Ядерная пора
| Ядерная пора | |
|---|---|
 Схема ядра клетки человека с ядерными порами. | |
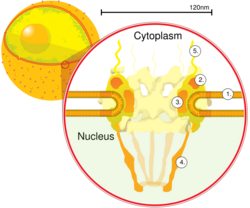 Схематическая диаграмма комплекса ядерных пор внутри ядерной оболочки (1) с внешним кольцом (2), спицами (3), корзиной (4) и нитями (5). | |
| Подробности | |
| Идентификаторы | |
| латинский | ядерная пора |
| МеШ | Д022022 |
| ТД | Х1.00.01.2.01005 |
| ФМА | 63148 |
| Анатомическая терминология | |
Ядерная пора — это канал, являющийся частью комплекса ядерных пор ( NPC ), большого белкового комплекса, обнаруженного в ядерной оболочке эукариотических клеток . Ядерная оболочка (NE) окружает ядро клетки , содержащее ДНК , и облегчает селективный мембранный транспорт различных молекул.
Комплекс ядерных пор преимущественно состоит из белков, известных как нуклеопорины (Nups). Каждый NPC человека содержит по меньшей мере 456 отдельных белковых молекул, включая 34 различных нуклеопорина . белка [ 1 ] в 2022 году было известно 90% структуры, [ 2 ] затем в 2024 году ядерная корзина была расшифрована. [ 3 ] Около половины нуклеопоринов включают в себя соленоидные белковые домены, такие как альфа-соленоиды или складки бета-пропеллера , а иногда и то и другое в виде отдельных структурных доменов . И наоборот, остальные нуклеопорины проявляют характеристики «нативно развернутых» или внутренне неупорядоченных белков , характеризующихся высокой гибкостью и отсутствием упорядоченной третичной структуры . Эти неупорядоченные белки, называемые FG нуклеопоринами (FG-Nups), содержат множественные фенилаланин - глициновые повторы (повторы FG) в своих аминокислотных последовательностях. [ 4 ] FG-Nups — один из трех основных типов нуклеопоринов , обнаруженных в NPC. Два других — это трансмембранные Nups и каркасные Nups. Трансмембранные Nups состоят из трансмембранных α-спиралей и играют жизненно важную роль в прикреплении NPC к ядерной оболочке . Каркасные Nups состоят из складок α-соленоида и β-пропеллера и создают структурный каркас NPC. [ 5 ]
Основная функция комплексов ядерных пор заключается в облегчении избирательного мембранного транспорта различных молекул через ядерную оболочку. Сюда входит транспортировка РНК и рибосомальных белков из ядра в цитоплазму , а также белков (таких как ДНК-полимераза и ламины ), углеводов , сигнальных молекул и липидов , движущихся в ядро. Примечательно, что комплекс ядерных пор (NPC) может активно опосредовать до 1000 транслокаций на комплекс в секунду. В то время как более мелкие молекулы могут пассивно диффундировать через поры, более крупные молекулы часто идентифицируются по специфическим сигнальным последовательностям, и нуклеопорины помогают им пересекать ядерную оболочку.
Эволюционно консервативные особенности последовательностей, кодирующих нуклеопорины, регулируют молекулярный транспорт через ядерную пору. [ 6 ] [ 7 ] Транспорт, опосредованный нуклеопорином, не влечет за собой прямых затрат энергии, а вместо этого зависит от градиентов концентрации, связанных с циклом RAN (Ras-связанный цикл ядерного белка).
Количество комплексов ядерных пор варьируется в зависимости от типа клеток и разных стадий жизненного цикла клетки: в клетках позвоночных обычно обнаруживается около 1000 NPC. [ 8 ] Комплекс ядерных пор человека (hNPC) представляет собой прочную структуру с молекулярной массой 120 мегадальтон (МДа). [ 9 ] Каждый NPC состоит из восьми белковых субъединиц, окружающих пору и образующих внешнее кольцо. Кроме того, эти субъединицы проецируют белок в форме спиц над каналом поры. Центральная область поры может иметь пробковую структуру; однако его точная природа остается неизвестной, и до сих пор не установлено, представляет ли он собой настоящую пробку или просто груз, временно пойманный в пути.
Ядерный поровый комплекс: размер и состав
[ редактировать ]Комплекс ядерных пор (NPC) представляет собой важнейшую клеточную структуру диаметром около 120 нанометров у позвоночных. Его канал у человека варьируется от 5,2 нанометра. [ 10 ] до 10,7 нм у лягушки Xenopus laevis с глубиной примерно 45 нм. [ 11 ] Кроме того, мРНК, будучи одноцепочечной, имеет толщину от 0,5 до 1 нм. NPC млекопитающих имеет молекулярную массу около 124 мегадальтон (МДа) и включает примерно 30 различных белковых компонентов, каждый из которых находится в нескольких копиях. NPC млекопитающих содержат около 800 нуклеопоринов каждый, которые организованы в отдельные субкомплексы NPC. [ 12 ] Напротив, дрожжи Saccharomyces cerevisiae обладают меньшей массой, оцениваемой всего в 66 МДа. [ 13 ]
Транспорт через комплекс ядерных пор
[ редактировать ]
Комплекс ядерных пор (NPC) служит строго регулируемыми воротами для транспорта молекул между ядром и цитоплазмой. Эта сложная система обеспечивает избирательное прохождение молекул, включая белки, РНК и сигнальные молекулы, обеспечивая правильную клеточную функцию и гомеостаз. Небольшие молекулы, такие как белки, вода и ионы, могут диффундировать через NPC, но грузы (> 40 кДа ), такие как РНК и белки, требуют участия растворимых транспортных рецепторов. [ 14 ]
Самым большим семейством ядерных транспортных рецепторов являются кариоферины, их также называют импортинами или экспортинами . Это суперсемейство ядерных транспортных рецепторов, которые облегчают транслокацию белков, РНК и рибонуклеарных частиц через NPC в процессе, зависимом от Ran GTP-гидролазы. [ 15 ] Это семейство далее подразделяется на подсемейства кариоферина -α и кариоферина -β. Другие рецепторы ядерного транспорта включают NTF2 и некоторые NTF2-подобные белки.
Для объяснения механизма транслокации были предложены три модели:
- Градиенты сродства вдоль центральной пробки
- Броуновское сродство
- Селективный этап
Импорт белков
[ редактировать ]Ядерные белки синтезируются в цитоплазме и должны быть импортированы через NPC в ядро. Импорт может быть направлен различными сигналами, из которых лучше всего характеризуются сигналы ядерной локализации (NLS). [ 16 ] Известно несколько последовательностей NLS, обычно содержащих консервативную последовательность с основными остатками, такими как PKKKRKV. Любой материал с NLS будет поглощен импортинами в ядро. [ нужна ссылка ]
Импорт начинается со связывания импортина-α с последовательностью NLS грузовых белков, образуя комплекс. Импортин-β затем присоединяется к импортину-α, облегчая транспорт к NPC. [ нужна ссылка ]
Когда комплекс достигает NPC, он диффундирует через пору без необходимости использования дополнительной энергии. При попадании в ядро RanGTP связывается с импортином-β и вытесняет его из комплекса. Затем белок восприимчивости к клеточному апоптозу (CAS), экспортин, который в ядре связан с RanGTP, вытесняет импортин-α из груза. Таким образом, NLS-белок находится в нуклеоплазме свободно. Комплекс импортинβ-RanGTP и импортинα-CAS-RanGTP диффундирует обратно в цитоплазму, где GTP гидролизуются до GDP, что приводит к высвобождению импортинаβ и импортина α, которые становятся доступными для нового раунда импорта NLS-белка. [ нужна ссылка ]
Хотя транслокация через NPC не зависит от энергии, общий цикл импорта требует гидролиза двух молекул GTP, что делает его активным транспортным процессом. Цикл импорта основан на нуклео-цитоплазматическом градиенте RanGTP. Этот градиент возникает из-за исключительной ядерной локализации RanGEFs, белков, которые обменивают GDP на GTP на молекулах Ran. Таким образом, в ядре наблюдается повышенная концентрация RanGTP по сравнению с цитоплазмой. [ нужна ссылка ]
Экспорт белков
[ редактировать ]Помимо ядерного импорта, некоторые молекулы и макромолекулярные комплексы, такие как субъединицы рибосом и информационные РНК , требуют экспорта из ядра в цитоплазму. Этот процесс экспорта повторяет механизм импорта по сложности и важности. [ нужна ссылка ]
В классическом сценарии экспорта белки с последовательностью ядерного экспорта (NES) образуют гетеротримерный комплекс с экспортином и RanGTP внутри ядра. Примером такого экспортина является CRM1. Этот комплекс впоследствии перемещается в цитоплазму , где происходит гидролиз GTP, высвобождая NES-содержащий белок. Образующийся комплекс CRM1-RanGDP возвращается в ядро, где RanGEF катализирует обмен ВВП на GTP на Ran, пополняя источник энергии системы. Весь этот процесс энергозависим и потребляет одну молекулу ГТФ. Примечательно, что экспортная активность, опосредованная CRM1, может ингибироваться такими соединениями, как лептомицин B.
Экспорт РНК
[ редактировать ]Различные пути экспорта через NPC для разных классов РНК. Экспорт РНК опосредован сигналами: сигналы ядерного экспорта (NES) присутствуют в РНК-связывающих белках, за исключением тРНК, у которой отсутствует адаптер. Примечательно, что все вирусные РНК и клеточные РНК ( тРНК , рРНК , U мяРНК , микроРНК ), за исключением мРНК, зависят от RanGTP. Консервативные факторы экспорта мРНК необходимы для ядерного экспорта мРНК. Факторами экспорта являются Mex67/Tap (большая субъединица) и Mtr2/p15 (малая субъединица). [ нужна ссылка ]
Считается, что у высших эукариот экспорт мРНК зависит от сплайсинга. Сплайсинг рекрутирует белковый комплекс TREX для сплайсинга сообщений, служащих адаптером для TAP, низкоаффинного РНК-связывающего белка. Однако существуют альтернативные пути экспорта мРНК, которые не полагаются на сплайсинг для специализированных сообщений, таких как гистоны. Недавние работы также предполагают взаимодействие между зависимым от сплайсинга экспортом и одним из этих альтернативных путей экспорта мРНК для секреторных и митохондриальных транскриптов. [ 17 ]
Сборка НПС
[ редактировать ]
Поскольку NPC регулирует доступ к геному, его присутствие в значительных количествах на стадиях клеточного цикла, характеризующихся высокой скоростью транскрипции, имеет решающее значение. Например, циклические клетки млекопитающих и дрожжей удваивают количество NPC в ядре между фазами G1 и G2. Сходным образом, ооциты накапливают большое количество NPC в ожидании быстрой митотической активности во время раннего развития. Более того, интерфазные клетки должны поддерживать генерацию NPC, чтобы поддерживать постоянный уровень NPC, поскольку некоторые из них могут быть повреждены. Более того, некоторые клетки могут даже увеличивать количество NPC из-за увеличения потребности в транскрипции. [ 18 ]
Теории сборки
[ редактировать ]Существует несколько теорий относительно того, как собираются NPC. Поскольку иммуноистощение некоторых белковых комплексов, таких как комплекс Nup 107–160, приводит к образованию беспористых ядер, вполне вероятно, что комплексы Nup участвуют в слиянии внешней мембраны ядерной оболочки с внутренней, а не что при срастании мембраны начинается образование поры. [ нужна ссылка ] Есть несколько способов, которыми это может привести к формированию полноценного NPC.
- Одна из возможностей состоит в том, что в виде белкового комплекса он связывается с хроматином . Затем он вставляется в двойную мембрану рядом с хроматином. Это, в свою очередь, приводит к слиянию этой мембраны. Вокруг этого белкового комплекса в конечном итоге связываются другие, образуя NPC. Этот метод возможен на каждой фазе митоза, поскольку двойная мембрана присутствует вокруг хроматина до того, как сможет встроиться комплекс слитых с мембраной белков. Постмитотические клетки могут сначала образовывать мембрану, а после образования в нее вставляются поры. [ нужна ссылка ]
- Другая модель формирования NPC — это образование препоры в качестве старта, а не одного белкового комплекса. Эта препора образуется, когда несколько комплексов Nup объединяются и связываются с хроматином. Во время митотической повторной сборки вокруг него будет образовываться двойная мембрана. Возможные предпоровые структуры наблюдались на хроматине перед образованием ядерной оболочки (NE) с помощью электронной микроскопии. [ 19 ] Во время интерфазы клеточного цикла образование препоры происходит внутри ядра, причем каждый компонент транспортируется через существующие NPC. Эти Nups будут связываться с импортином после образования, предотвращая сборку препоры в цитоплазме. После транспортировки в ядро Ran GTP связывается с импортином и заставляет его высвобождать груз. Этот Нуп сможет свободно формировать препору. По крайней мере, было показано, что связывание импортинов приводит к переносу нуклеопоринов Nup 107 и Nup 153 в ядро. [ 18 ] Сборка NPC — очень быстрый процесс, однако возникают определенные промежуточные состояния, что приводит к идее, что эта сборка происходит поэтапно. [ 20 ]
Разборка
[ редактировать ]Во время митоза NPC разбирается поэтапно, за исключением низших эукариот, таких как дрожжи, у которых разборка NPC не происходит во время митоза. [ 21 ] Периферические нуклеопорины , такие как Nup 153, Nup 98 и Nup 214, диссоциируют от NPC. Остальные белки, которые можно рассматривать как каркасные белки , остаются стабильными в виде цилиндрических кольцевых комплексов внутри ядерной оболочки. Считается, что эта разборка периферических групп NPC обусловлена фосфатами, поскольку некоторые из этих нуклеопоринов фосфорилируются на стадиях митоза. Однако фермент, участвующий в фосфорилировании, неизвестен in vivo. У многоклеточных животных (которые подвергаются открытому митозу) NE быстро деградирует после потери периферических Nups. Причиной этого может быть изменение архитектуры NPC. Это изменение может сделать NPC более проницаемым для ферментов, участвующих в деградации NE, таких как цитоплазматический тубулин, а также обеспечить проникновение ключевых белков-регуляторов митоза. В организмах, которые подвергаются полуоткрытому митозу, таких как нитчатый гриб Aspergillus nidulans , 14 из 30 нуклеопоринов отделяются от структуры основного каркаса, что обусловлено активацией киназ NIMA и Cdk1, которые фосфорилируют нуклеопорины и открывают ядерные поры. [ 22 ] [ 23 ] тем самым расширяя ядерную пору и обеспечивая проникновение митотических регуляторов. [ 24 ]
Сохранение целостности
[ редактировать ]У грибов, претерпевающих закрытый митоз , когда ядро остается интактным, изменения в барьере проницаемости ядерной оболочки (NE) объясняются изменениями внутри NPC. Эти изменения облегчают поступление митотических регуляторов в ядро. Исследования на Aspergillys nidulans показывают, что на состав NPC, по-видимому, влияет митотивная киназа NIMA. NIMA потенциально фосфорилирует нуклеопорины Nup98 и Gle2/Rae1, что приводит к ремоделированию NPC. [ 25 ] Это ремоделирование обеспечивает проникновение в ядро белкового комплекса cdc2/cyclinB и различных других белков, включая растворимый тубулин. Каркас NPC остается интактным на протяжении всего закрытого митоза. Кажется, это сохраняет целостность NE. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Лин, Д.Х., Стюве, Т., Шильбах, С., Рундлет, Э.Дж., Перричес, Т., Моббс, Г., ... Хельц, А. (2016). Архитектура сложного симметричного ядра ядерной поры. Наука, 352(6283), aaf1015. http://doi.org/10.1126/science.aaf1015
- ^ Мосалаганти С., Обарска-Косинска А., Сигель М., Танигучи Р., Туронева Б., Циммерли С.Э. и др. (10 июня 2022 г.). «Прогнозирование структуры на основе искусственного интеллекта расширяет возможности комплексного структурного анализа ядерных пор человека» . Наука . 376 (6598): eabm9506. дои : 10.1126/science.abm9506 . ISSN 0036-8075 . ПМИД 35679397 . Архивировано из оригинала 16 мая 2024 года . Проверено 16 мая 2024 г.
- ^ Сингх Д., Сони Н., Хатчингс Дж., Эчеверрия И., Шейх Ф., Дукетт М. и др. (9 августа 2024 г.). «Молекулярная архитектура ядерной корзины» . Клетка . дои : 10.1016/j.cell.2024.07.020 .
- ^ Field MC, Rout MP (3 апреля 2019 г.). «Время пор: эволюционное происхождение ядра и комплекса ядерных пор» . F1000Исследования . 8 : 369. дои : 10.12688/f1000research.16402.1 . ПМК 6449795 . ПМИД 31001417 .
- ^ Наг Н., Сасидхаран С., Уверский В.Н., Саудагар П., Трипати Т. (апрель 2022 г.). «Фазовое разделение ФГ-нуклеопоринов в комплексах ядерных пор» . Биохимия и биофизика Acta (BBA) - Исследования молекулярных клеток . 1869 (4):119205 doi : 10.1016/j.bbamcr.2021.119205 . ПМИД 34995711 .
- ^ Пейро М., Сохейлипур М., Ли Б.Л., Мофрад М.Р. (ноябрь 2015 г.). «Эволюционно консервативные особенности последовательности регулируют формирование сети FG в центре комплекса ядерных пор» . Научные отчеты . 5 : 15795. Бибкод : 2015NatSR...515795P . дои : 10.1038/srep15795 . ПМЦ 4635341 . ПМИД 26541386 .
- ^ Андо Д., Колвин М., Рексач М., Гопинатан А. (16 сентября 2013 г.). «Кластеризация физических мотивов внутри внутренне неупорядоченных последовательностей нуклеопоринов обнаруживает универсальные функциональные особенности» . ПЛОС ОДИН . 8 (9): е73831. Бибкод : 2013PLoSO...873831A . дои : 10.1371/journal.pone.0073831 . ПМЦ 3774778 . ПМИД 24066078 .
- ^ Адам С.А. (2001). «Комплекс ядерных пор» . Геномная биология . 2 (9): ОБЗОРЫ0007. doi : 10.1186/gb-2001-2-9-reviews0007 . ПМК 138961 . ПМИД 11574060 .
- ^ Ибарра А., Хетцер М.В. (февраль 2015 г.). «Белки ядерной поры и контроль функций генома» . Гены и развитие . 29 (4): 337–349. дои : 10.1101/gad.256495.114 . ПМЦ 4335290 . ПМИД 25691464 .
- ^ Мор Д., Фрей С., Фишер Т., Гюттлер Т., Герлих Д. (сентябрь 2009 г.). «Характеристика пассивного барьера проницаемости ядерных поровых комплексов» . Журнал ЭМБО . 28 (17): 2541–2553. дои : 10.1038/emboj.2009.200 . ПМЦ 2728435 . ПМИД 19680228 .
- ^ Маймон Т, Медалия О (2010). «Взгляд на комплекс ядерных пор многоклеточных животных» . Ядро . 1 (5): 383–386. дои : 10.4161/nucl.1.5.12332 . ISSN 1949-1034 . ПМК 3037531 . ПМИД 21326819 .
- ^ Кутай Ю, Юлен Р., Антонин В (1 декабря 2021 г.). «Митотическая разборка и сборка комплексов ядерных пор» . Тенденции в клеточной биологии . 31 (12): 1019–1033. дои : 10.1016/j.tcb.2021.06.011 . hdl : 20.500.11850/518955 . ISSN 0962-8924 . ПМИД 34294532 . Архивировано из оригинала 8 февраля 2024 года . Проверено 12 февраля 2024 г.
- ^ Тертон Х.Э., Дауэс И.В., Грант СМ (1997). «Saccharomyces cerevisiae демонстрирует yAP-1-опосредованную адаптивную реакцию на малоновой диальдегид» . Журнал бактериологии . 179 (4): 1096–1101. дои : 10.1128/jb.179.4.1096-1101.1997 . ISSN 0021-9193 . ПМК 178803 . ПМИД 9023189 .
- ^ «Ядерный поровый комплекс — обзор | Темы ScienceDirect» . www.sciencedirect.com . Архивировано из оригинала 15 февраля 2024 года . Проверено 15 февраля 2024 г.
- ^ «Кариоферин – обзор | Темы ScienceDirect» . www.sciencedirect.com . Архивировано из оригинала 15 февраля 2024 года . Проверено 15 февраля 2024 г.
- ^ Герлих Д. (1 июня 1997 г.). «Импорт ядерного белка» . Современное мнение в области клеточной биологии . 9 (3): 412–419. дои : 10.1016/S0955-0674(97)80015-4 . hdl : 11858/00-001M-0000-002D-1CC5-E . ISSN 0955-0674 . ПМИД 9159081 .
- ^ Ченик С., Чуа Х.Н., Чжан Х., Тарнавски С.П., Акеф А., Дерти А. и др. (апрель 2011 г.). «Анализ генома показывает взаимодействие между интронами 5'UTR и экспортом ядерной мРНК для секреторных и митохондриальных генов» . ПЛОС Генетика . 7 (4): e1001366. дои : 10.1371/journal.pgen.1001366 . ПМК 3077370 . ПМИД 21533221 .
- ^ Jump up to: а б Рабут Г., Ленарт П., Элленберг Дж. (июнь 2004 г.). «Динамика организации комплекса ядерных пор в клеточном цикле». Современное мнение в области клеточной биологии . 16 (3): 314–321. дои : 10.1016/j.ceb.2004.04.001 . ПМИД 15145357 .
- ^ Шиэн М.А., Миллс А.Д., Слиман А.М., Ласки Р.А., Блоу Дж.Дж. (январь 1988 г.). «Этапы сборки репликационно-компетентных ядер в бесклеточной системе из яиц Xenopus» . Журнал клеточной биологии . 106 (1): 1–12. дои : 10.1083/jcb.106.1.1 . ПМК 2114961 . ПМИД 3339085 .
- ^ Киселева Е., Резерфорд С., Коттер Л.М., Аллен Т.Д., Голдберг М.В. (октябрь 2001 г.). «Этапы разборки и повторной сборки комплекса ядерных пор во время митоза у ранних эмбрионов дрозофилы» . Журнал клеточной науки . 114 (Часть 20): 3607–3618. дои : 10.1242/jcs.114.20.3607 . ПМИД 11707513 . Архивировано из оригинала 13 сентября 2019 года . Проверено 4 ноября 2008 г.
- ^ Хампоэльц Б., Андрес-Понс А., Кастритис П., Бек М. (6 мая 2019 г.). «Структура и сборка ядерного порового комплекса» . Ежегодный обзор биофизики . 48 (1): 515–536. doi : 10.1146/annurev-biophys-052118-115308 . ISSN 1936-122Х . ПМИД 30943044 . Архивировано из оригинала 26 апреля 2021 года . Проверено 14 февраля 2024 г.
- ^ Маркосян С., Суреш С., Османи А.Х., Османи С.А. (февраль 2015 г.). «Nup2 требует сильно отличающегося партнера, NupA, для выполнения функций в комплексах ядерных пор и в области митотического хроматина» . Молекулярная биология клетки . 26 (4): 605–621. дои : 10.1091/mbc.E14-09-1359 . ПМЦ 4325833 . ПМИД 25540430 .
- ^ Де Соуза КП, Османи А.Х., Хашми С.Б., Османи С.А. (ноябрь 2004 г.). «Частичная разборка комплекса ядерных пор во время закрытого митоза у Aspergillus nidulans» . Современная биология . 14 (22): 1973–1984. Бибкод : 2004CBio...14.1973D . дои : 10.1016/j.cub.2004.10.050 . ПМИД 15556859 . S2CID 14782686 .
- ^ Де Соуза CP, Османи С.А. (сентябрь 2007 г.). «Митоз, а не только открытый или закрытый» . Эукариотическая клетка . 6 (9): 1521–1527. дои : 10.1128/EC.00178-07 . ПМК 2043359 . ПМИД 17660363 .
- ^ Лю Х.Л., Де Соуза КП, Османи А.Х., Османи С.А. (15 января 2009 г.). «Три белка грибкового трансмембранного комплекса ядерных пор Aspergillus nidulans необязательны в присутствии интактного комплекса An-Nup84-120» . Молекулярная биология клетки . 20 (2): 616–630. doi : 10.1091/mbc.E08-06-0628 . ISSN 1059-1524 . ПМЦ 2626566 . ПМИД 19019988 .
Внешние ссылки
[ редактировать ]- Гистологическое изображение: 20104loa - Система обучения гистологии в Бостонском университете.
- Nuclear+pore в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Анимация ядерного порового комплекса. Архивировано 7 февраля 2009 г. в Wayback Machine.
- Иллюстрации ядерного порового комплекса. Архивировано 7 февраля 2009 г. в Wayback Machine.
- 3D-структуры электронной микроскопии NPC и составляющих белков из банка данных EM (EMDB)
- NCDIR - Национальный центр динамического интерактома [ постоянная мертвая ссылка ]