Церебральный органоид

Нейронный напоминающую , или мозговой органоид , описывает искусственно выращенную in vitro ткань , части человеческого мозга . Нейронные органоиды создаются путем культивирования плюрипотентных стволовых клеток в трехмерную культуру, которую можно сохранять годами. [1] [2] Мозг представляет собой чрезвычайно сложную систему гетерогенных тканей и состоит из разнообразного набора нейронов и глиальных клеток . Эта сложность сделала изучение мозга и понимание того, как он работает, сложной задачей в нейробиологии, особенно когда речь идет о нейродегенеративных и нейродегенеративных заболеваниях. Целью создания неврологической модели in vitro является изучение этих заболеваний в более определенных условиях. Эта 3D-модель свободна от многих потенциальных ограничений in vivo . Различная физиология моделей человека и других млекопитающих ограничивает возможности исследований неврологических расстройств на животных. Нейронные органоиды содержат несколько типов нервных клеток и имеют анатомические особенности, повторяющие области нервной системы. [3] Некоторые нервные органоиды наиболее похожи на нейроны коры головного мозга . В некоторых случаях поражаются сетчатка , спинной мозг , таламус и гиппокамп . [1] Другие нервные органоиды неуправляемы и содержат множество нервных и ненервных клеток. Стволовые клетки обладают потенциалом прорастать во множество различных типов тканей, и их судьба зависит от многих факторов. Ниже изображение, показывающее некоторые химические факторы, которые могут привести к дифференцировке стволовых клеток в различные нервные ткани; была опубликована более подробная таблица определения специфичности органоидов. [3] Подобные методы используются со стволовыми клетками, используемыми для выращивания церебральных органоидов. [3]
Разработка модели
[ редактировать ]Использование плюрипотентных стволовых клеток человека для создания in vitro нервных органоидов позволяет исследователям анализировать текущие механизмы развития нервной ткани человека, а также изучать причины неврологических заболеваний человека. Нейронные органоиды — это исследовательский инструмент, используемый для понимания того, как работает патология заболевания. Эти органоиды можно использовать в экспериментах, для которых существующие методы in vitro слишком упрощены, но при этом они более применимы к людям, чем модели на грызунах или других млекопитающих. Исторически сложилось так, что крупные прорывы в работе мозга происходили в результате изучения травм или нарушений функций мозга человека. Модель человеческого мозга in vitro открывает новую волну в нашем понимании нервной системы человека. [1]
Методы культивирования
[ редактировать ]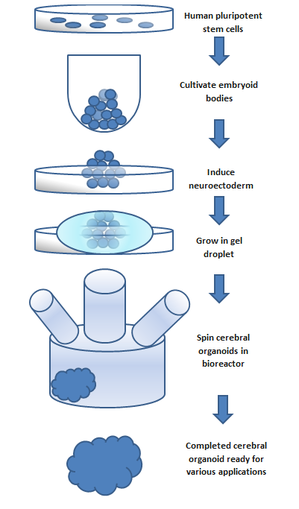
Эмбриоидное тело , выращенное из плюрипотентных стволовых клеток, используется для создания органоида . Эмбриоидные тела состоят из трех слоев: энтодермы , мезодермы и эктодермы , которые могут дифференцироваться в различные типы тканей.
Церебральный органоид может быть образован путем индукции дифференцировки клеток эктодермы в церебральные органоиды. [4] Общую процедуру можно разбить на 5 этапов. [1] [5] Впервые культивируются плюрипотентные стволовые клетки человека. Затем их культивируют в эмбриональное тело . Затем клеточную культуру индуцируют с образованием нейроэктодермы . Затем нейроэктодерму выращивают в капле матригеля . Матригель обеспечивает питательные вещества, и нейроэктодерма начинает пролиферировать и расти. Репликация определенных областей мозга в аналогах церебральных органоидов достигается за счет добавления внеклеточных сигналов к органоидной среде на разных стадиях развития; Было обнаружено, что эти сигналы вызывают изменения в моделях дифференцировки клеток, что приводит к перепросмотру желаемой области мозга. [3] Ингибирование SMAD можно использовать в обычных процессах культивирования церебральных органоидов для создания микроглии в церебральных органоидах. [6] Отсутствие сосудистой сети ограничивает размер органоида, который может расти. Это было основным ограничением в развитии органоидов. Использование вращающегося биореактора может улучшить доступность питательных веществ для клеток внутри органоида и улучшить развитие органоида. [7] Вращающиеся биореакторы все чаще используются в культурах клеток и выращивании тканей. Реактор способен обеспечить более быстрое удвоение клеток , увеличение размножения клеток и увеличение компонентов внеклеточного матрикса по сравнению со статически культивируемыми клетками. [8]
Компоненты
[ редактировать ]Дифференциация
[ редактировать ]Показано, что церебральные органоиды, выращенные методом 3D-культуры вращающегося биореактора, дифференцируются в различные типы нервной ткани, такие как глазной бокал, гиппокамп, вентральные отделы телеэнцефеля и дорсальная кора. [9] Кроме того, было показано, что органоиды человеческого мозга могут иметь встроенные светочувствительные оптические чашечки. [10]
Нейральные стволовые клетки/клетки-предшественники уникальны, поскольку они способны самообновляться и являются мультипотентными. Это означает, что они могут генерировать нейроны и глиальные клетки, которые являются двумя основными компонентами нервной системы. Судьба этих клеток контролируется несколькими факторами, влияющими на процесс дифференцировки. Пространственное расположение и временные атрибуты нервных клеток-предшественников могут влиять на то, образуют ли эти клетки нейроны или глиальные клетки. Дальнейшая дифференцировка затем контролируется внеклеточными условиями и передачей сигналов в клетках. [11] Точные условия и стимулы, необходимые для дифференцировки нервных клеток-предшественников в специфические нервные ткани, такие как ткань гиппокампа, зрительный нерв, кора головного мозга и т. д., неизвестны. Считается, что церебральные органоиды могут быть использованы для изучения механизмов развития этих процессов. [7]
Экспрессия генов
[ редактировать ]Чтобы проверить, дифференцируются ли нейрональные клетки-предшественники и стволовые клетки в определенные нервные ткани, можно протестировать несколько генных маркеров. Двумя маркерами, которые присутствуют на плюрипотентных стадиях, являются OCT4 и NANOG . Эти два маркера уменьшаются в ходе развития органоида. Маркеры нейронной идентичности, отмечающие успешную нервную индукцию, SOX1 и PAX6 , активируются во время развития органоидов. Эти изменения в экспрессии подтверждают предположение о самостоятельной дифференцировке церебральных органоидов. [1] Также можно протестировать маркеры переднего и заднего мозга. Маркеры переднего мозга FOXG1 и SIX3 высоко экспрессируются на протяжении всего развития органоидов. Однако маркеры заднего мозга EGR2 и ISL1 обнаруживают раннее присутствие, но уменьшаются на более поздних стадиях. Этот дисбаланс в развитии переднего мозга аналогичен расширению ткани переднего мозга при развитии мозга человека. [1] Чтобы проверить, развиваются ли органоиды еще дальше в региональную спецификацию, генные маркеры коры головного мозга и затылочной доли были протестированы . Многие регионы, которые имеют маркер FOXG1 переднего мозга , обозначающий их как регионы с морфологией коры головного мозга, также были положительными по маркеру EMX1, который указывает на идентичность дорсальной коры. Эти специфические области могут быть дополнительно уточнены с помощью маркеров AUTS2 , TSHZ2 и LMO4, первый из которых представляет кору головного мозга, а два — после затылочной доли. [1] Генетические маркеры гиппокампа, вентральной части переднего мозга и сосудистого сплетения также присутствуют в церебральных органоидах, однако общие структуры этих областей еще не сформированы.
Организация
[ редактировать ]Церебральные органоиды также обладают функциональными нейронами коры головного мозга. Эти нейроны должны формироваться на радиально организованной кортикальной пластинке. Маркер TBR1 присутствует в препластинке, предшественнике кортикальной пластинки, и присутствует вместе с MAP2 , нейрональным маркером, в 30-дневных церебральных органоидах. Эти маркеры указывают на наличие базального нейронного слоя, подобного препластине. Эти клетки также апикально прилегают к нейтральной зоне и являются рилин +позитивными, что указывает на наличие клеток Кахаля-Ретциуса. Клетки Кахаля-Ретциуса важны для формирования архитектуры кортикальных пластинок. [7] Кортикальная пластинка обычно образуется наизнанку, так что рождающиеся позже нейроны мигрируют в верхние поверхностные слои. Эта организация также присутствует в церебральных органоидах, согласно тестированию генетических маркеров. Нейроны, рожденные раньше срока, имеют маркер CTIP2 и расположены рядом с TBR1, обнаруживая препластинчатые клетки. Нейроны позднего рождения с маркерами SATB2 и BRN2 расположены в поверхностном слое, дальше от препластинки, чем нейроны раннего рождения, что позволяет предположить формирование слоя кортикальной пластинки. Кроме того, после 75 дней формирования церебральные органоиды обнаруживают рудиментарную маргинальную зону, область с низким содержанием клеток. Формирование многослойной кортикальной пластинки является очень простым в церебральных органоидах и предполагает, что у органоида отсутствуют сигналы и факторы, которые могли бы вызвать формирование организации слоев II-VI. [1] Однако нейроны церебральных органоидов могут образовывать аксоны, как показано окрашиванием GFP . Было показано, что аксоны, меченные GFP, имеют сложное ветвление и образование конусов роста. Кроме того, визуализация с красителем кальция показала, что церебральные органоиды содержат Ca. 2+ колебания и спонтанные скачки кальция в отдельных клетках. Передача сигналов кальция может быть усилена за счет глутамата и ингибирована за счет тетродотоксина . [1]
Взаимодействие с окружающей средой
[ редактировать ]В DishBrain выращенные клетки человеческого мозга были интегрированы в цифровые системы для игры в смоделированный понг посредством электрофизиологической стимуляции и записи. Ячейки «продемонстрировали значительно улучшенную производительность в понге », когда были воплощены в виртуальном игровом мире. [12] [13] [14]
- Взаимодействие с окружающими тканями
До конца не понятно, как отдельные локализованные ткани, образованные стволовыми клетками, способны координироваться с окружающими тканями и развиваться в целый орган. [15] Однако было показано, что большая часть дифференцировки тканей требует взаимодействия с окружающими тканями и зависит от диффузионных факторов индукции, которые либо ингибируют, либо стимулируют различную дифференцировку и физическую локализацию. [15] Дифференциация церебральных органоидов несколько локализована. Упомянутые ранее маркеры переднего и заднего мозга физически локализованы и появляются в кластерах. Это предполагает, что локальные стимулы высвобождаются, когда одна или несколько клеток дифференцируются в определенный тип, а не случайным путем по всей ткани. Маркеры субспецификации корковых долей, префронтальной коры и затылочной доли также физически локализованы. Однако гиппокамп и вентральные клетки переднего мозга физически не локализованы и расположены случайным образом в церебральном органоиде. [1] В церебральных органоидах отсутствуют кровеносные сосуды, и их размер ограничен поглощением питательных веществ самыми внутренними клетками. Вращающиеся биореакторы и передовые методы 3D-каркасов способны увеличить размер органоидов, хотя интеграция систем доставки питательных веществ in vitro, вероятно, спровоцирует следующий крупный скачок в развитии церебральных органоидов. [16]
Анализы
[ редактировать ]Церебральные органоиды могут служить моделью для изучения заболеваний и экспрессии генов. [17] Однако необходимы диагностические инструменты для оценки органоидной ткани головного мозга и создания органоидов, моделирующих рассматриваемое заболевание или состояние развития. [18] Транскриптомный анализ использовался в качестве анализа для изучения патологии церебральных органоидов, полученных от отдельных пациентов. [19] Кроме того, анализы TUNEL использовались в исследованиях в качестве оценочного маркера апоптоза в церебральных органоидах. [20] Другие анализы, используемые для анализа церебральных органоидов, включают следующее:
Генетические модификации
[ редактировать ]Церебральные органоиды можно использовать для изучения экспрессии генов посредством генетических модификаций. [17] Степень присутствия этих генетических модификаций во всем органоиде зависит от того, на какой стадии развития находится церебральный органоид, когда эти генетические модификации производятся; чем раньше будут сделаны эти модификации, например, когда церебральный органоид находится на стадии одноклеточной стадии, тем более вероятно, что эти модификации повлияют на большую часть клеток церебрального органоида. [17] Степень присутствия этих генетических модификаций в церебральном органоиде также зависит от процесса, посредством которого эти генетические модификации производятся. Если генетическая информация вводится в геном одной церебральной органоидной клетки с помощью механизма, то генетическая модификация останется в клетках в результате репликации. [17] Crispr/Cas 9 — это метод, с помощью которого можно осуществить эту долговременную генетическую модификацию. [17] Система, включающая использование транспозонов, также была предложена как средство создания долговременных генетических модификаций; однако степень, в которой транспозоны могут взаимодействовать с клеточным геномом, может различаться от клетки к клетке, что может создавать вариабельную экспрессивность между клетками церебральных органоидов. [17] Однако если генетическая модификация осуществляется посредством вставки «генетического груза» (например, с помощью аденоассоциированных вирусов / методов электропорации ), то было обнаружено, что генетическая модификация становится менее заметной с каждым раундом клеточного деления в церебральных органоидах. [17]
Вычислительные методы
[ редактировать ]Использование вычислительных методов было призвано помочь улучшить процесс культивирования церебральных органоидов; Также потребовалась разработка вычислительных методов для обеспечения необходимой детальной визуализации различных компонентов церебрального органоида (например, связности клеток), которую современные методы не могут обеспечить. [18] Программ, предназначенных для моделирования детальной морфологии церебральных органоидов, пока не существует. [18]
Приложения
[ редактировать ]Существует множество потенциальных применений использования церебральных органоидов, таких как потенциал клеточной судьбы , клеточно-заместительная терапия и анализы генома, специфичные для клеточного типа. [16] Церебральные органоиды также дают уникальную возможность понять сроки развития нервных тканей и могут использоваться в качестве инструмента для изучения различий между видами. [16] Другие потенциальные применения церебральных органоидов включают: [16]
Морфогенез тканей
[ редактировать ]Морфогенез тканей в отношении церебральных органоидов охватывает формирование нервных органов у позвоночных . Церебральные органоиды могут служить in vitro инструментами для изучения образования, его модуляции и дальнейшего понимания механизмов, контролирующих его. [16]
Миграционные анализы
[ редактировать ]Церебральные органоиды могут помочь в изучении миграции клеток . Нейронные глиальные клетки охватывают широкий спектр нервных клеток, некоторые из которых перемещаются вокруг нейронов. Факторы, управляющие их движениями, как и нейронами в целом, можно изучить с помощью церебральных органоидов. [4]
Отслеживание клональной линии
[ редактировать ]Отслеживание клональной линии является частью картирования судеб , при котором линия дифференцированных тканей прослеживается до плюрипотентных предшественников. Высвобождаемые локальные стимулы и механизм дифференцировки можно изучить, используя в качестве модели церебральные органоиды. [16] Генетические модификации церебральных органоидов могут служить средством отслеживания происхождения. [17]
Трансплантация
[ редактировать ]Церебральные органоиды можно использовать для выращивания определенных областей мозга и трансплантации их в области нейродегенерации в качестве терапевтического лечения. [21] [22] Они могут сливаться с сосудистой сетью хозяина и быть иммунологически молчащими. [23] В некоторых случаях геномы этих церебральных органоидов сначала придется редактировать. [19] Недавние исследования позволили добиться успешной трансплантации и интеграции церебральных органоидов в мозг мышей; После трансплантации также наблюдалось развитие клеточной дифференцировки и васкуляризации. [24] Церебральные органоиды могут служить основой для трансплантации и перестройки в мозге человека из-за сходства структуры. [24]
Тестирование на наркотики
[ редактировать ]Церебральные органоиды можно использовать в качестве простых моделей сложных тканей головного мозга для изучения действия лекарств и их проверки на первоначальную безопасность и эффективность. Тестирование новых лекарств от неврологических заболеваний также может стать результатом применения этого метода высокопроизводительного скрининга лекарств к церебральным органоидам. [19]
Биология развития
[ редактировать ]Органоиды можно использовать для изучения развития мозга , например, для выявления и исследования генетических переключателей, которые оказывают на него значительное влияние. [25] [26] [27] Его можно использовать для профилактики и лечения конкретных заболеваний. [28] (см. ниже), но также и для других целей, таких как понимание генетических факторов недавней эволюции мозга (или происхождения людей и эволюционных отличий от других обезьян), [29] [30] [31] улучшение человеческого потенциала и улучшение интеллекта , выявление вредных воздействий (и их защита) или улучшение продолжительности жизни мозга .
Исследование заболеваний
[ редактировать ]Органоиды можно использовать для изучения важнейших ранних стадий развития мозга, тестирования лекарств и, поскольку они могут быть изготовлены из живых клеток, для изучения отдельных пациентов. [32] Кроме того, разработка васкуляризированных церебральных органоидов может быть использована для изучения терапии инсульта в будущем. [33]
Вирус Зика
[ редактировать ]вирус Зика Было показано, что обладает тератогенным действием, вызывая дефекты неврологического развития плода. Церебральные органоиды использовались в исследованиях, чтобы понять процесс, посредством которого вирус Зика поражает мозг плода и в некоторых случаях вызывает микроцефалию. [19] [20] Было обнаружено, что церебральные органоиды, инфицированные вирусом Зика, меньше по размеру, чем их неинфицированные аналоги, что отражает микроцефалию плода. [19] [20] Повышенный апоптоз также был обнаружен в органоидах головного мозга, инфицированных вирусом Зика. [34] Другое исследование показало, что популяции нервных клеток-предшественников (NPC) в этих образцах значительно сократились. Двумя методами сокращения популяций NPC были увеличение гибели клеток и снижение пролиферации клеток. TLR3 В этих инфицированных органоидах была выявлена активация рецептора . Было показано, что ингибирование этого рецептора TLR3 частично останавливает некоторые эффекты, вызванные вирусом Зика. [35] Кроме того, было обнаружено, что размер просвета увеличен в органоидах, инфицированных вирусом Зика. [19] [20] Результаты, полученные при изучении церебральных органоидов, инфицированных вирусом Зика на разных стадиях созревания, позволяют предположить, что раннее воздействие вируса Зика на развивающийся плод может вызвать большую вероятность возникновения неврологических врожденных дефектов, связанных с вирусом Зика. [20]
Кокаин
[ редактировать ]Также было показано, что кокаин оказывает тератогенное воздействие на развитие плода. Церебральные органоиды использовались для изучения того, какие изоформы ферментов необходимы для неврологических дефектов плода, вызванных употреблением кокаина во время беременности. [19] Было установлено, что одним из этих ферментов является цитохрома P450 изоформа CYP3A5 . [19]
Микроцефалия
[ редактировать ]В одном случае церебральный органоид, выращенный у пациента с микроцефалией, продемонстрировал схожие симптомы и показал, что, по-видимому, причиной является слишком быстрое развитие, за которым следует более медленный рост мозга. Микроэнцефалия — это состояние развития, при котором мозг остается меньшего размера, что приводит к уменьшению размера головы и слабости. Микроцефалия не подходит для моделей на мышах, которые не повторяют это состояние. [32] Считается, что первичная форма заболевания вызвана гомозиготной мутацией гена микроцефалина . Заболевание трудно воспроизвести на моделях мышей, поскольку у мышей отсутствуют стадии развития увеличенной коры головного мозга , которые есть у людей. Естественно, болезнь, влияющую на это развитие, невозможно продемонстрировать в модели, в которой ее изначально нет. [36] Чтобы использовать церебральные органоиды для моделирования микроцефалии человека, одна группа исследователей взяла фибробласты кожи пациента и перепрограммировала их, используя четыре хорошо известных фактора перепрограммирования. К ним относятся OCT4 , SOX2 , MYC и KLF4 . Перепрограммированный образец удалось клонировать в индуцированные плюрипотентные стволовые клетки. Клетки культивировали в церебральный органоид в соответствии с процессом, описанным в разделе «Создание церебрального органоида» ниже. В результате образовавшийся органоид имел уменьшенное количество нервных клеток-предшественников и более мелкие ткани. Кроме того, в тканях, полученных от пациента, наблюдалось все меньше и реже нейроэпителиальных тканей, состоящих из предшественников, уменьшенное количество радиальных глиальных стволовых клеток и увеличенное количество нейронов. Эти результаты позволяют предположить, что основной механизм микроцефалии вызван преждевременной дифференцировкой клеток в нейроны, оставляющими дефицит радиальных глиальных клеток. [1]
болезнь Альцгеймера
[ редактировать ]Патология болезни Альцгеймера также моделировалась с использованием церебральных органоидов. [37] Плюрипотентные стволовые клетки пострадавшего человека использовались для создания органоидов мозга, а затем сравнивались с контрольными моделями, синтезированными у здоровых людей. Было обнаружено, что в пострадавших моделях наблюдались структуры, подобные структурам бляшек, вызванных бета-амилоидными белками , и нейрофибриллярными клубками , вызывающими симптомы заболевания. [38] Предыдущие попытки смоделировать это так точно не увенчались успехом: лекарства, разрабатываемые на основе эффективности в доклинических моделях на мышах, не продемонстрировали никакого эффекта в испытаниях на людях. [39]
Заболевания аутистического спектра
[ редактировать ]Церебральные органоиды также можно использовать для изучения расстройств аутистического спектра. [40] В одном исследовании церебральные органоиды были культивированы из клеток, полученных от пациентов с макроцефалией и РАС. [40] Было обнаружено, что эти церебральные органоиды отражают характеристики, типичные для фенотипа макроцефалии, связанного с РАС, обнаруженного у пациентов. [40] Культивируя церебральные органоиды пациентов с РАС и макроцефалией, можно установить связь между определенными генными мутациями и фенотипической экспрессией. [40] Аутизм также изучался путем сравнения здоровых и пораженных синтезированных органоидов мозга. [41] Наблюдение за двумя моделями показало сверхэкспрессию транскрипционного фактора FOXG1 , который продуцировал большее количество ГАМКергических ингибирующих нейронов в затронутых моделях. Значение такого использования органоидов головного мозга состоит в том, что оно обеспечивает большую поддержку гипотезы возбуждающего/тормозного дисбаланса. [42] если это окажется правдой, это может помочь определить цели для лекарств, чтобы можно было вылечить это заболевание.
Область эпигенетики и то, как метилирование ДНК может повлиять на развитие РАС, также вызывает интерес в последние годы. Традиционный метод изучения посмертных образцов нейронов людей с РАС ставит множество проблем, поэтому церебральные органоиды были предложены в качестве альтернативного метода изучения потенциального влияния, которое эпигенетические механизмы могут оказывать на развитие аутизма. Такое использование модели церебральных органоидов для изучения РАС и эпигенетических паттернов может дать представление о сроках эпигенетического развития. Однако важно отметить, что условия, в которых культивируются церебральные органоиды, могут повлиять на экспрессию генов и, как следствие, повлиять на наблюдения, сделанные с использованием этой модели. Кроме того, существует обеспокоенность по поводу изменчивости церебральных органоидов, культивированных из одного и того же образца. [43] Также необходимы дальнейшие исследования степени и точности, с которой церебральные органоиды повторяют эпигенетические паттерны, обнаруженные в первичных образцах. [43]
Преждевременная гипоксия/ишемия
[ редактировать ]Преждевременное гипоксическое повреждение по-прежнему трудно изучать из-за ограниченной доступности тканей головного мозга плода человека и неадекватных животных моделей для изучения кортикогенеза у человека. Церебральный органоид можно использовать для моделирования пренатальной патофизиологии и для сравнения чувствительности различных типов нервных клеток к гипоксии во время кортикогенеза. Промежуточные предшественники, по-видимому, особенно страдают из-за развернутого пути белкового ответа. [44] Также было замечено, что гипоксия приводила к апоптозу в церебральных органоидах, при этом особенно поражались внешняя радиальная глия и нейробласты/незрелые нейроны. [45]
Глиобластомы
[ редактировать ]Традиционные методы изучения глиобластом имеют ограничения. Одним из примеров таких ограничений может быть ограниченное количество образцов. Из-за этих проблем, связанных с использованием более традиционного подхода, церебральные органоиды использовались в качестве альтернативного средства для моделирования развития рака мозга. В одном исследовании с помощью CRISPR CAS-9 были смоделированы церебральные органоиды, отражающие опухолеподобные свойства. В этих генетически измененных моделях наблюдалось усиленное деление клеток. Церебральные органоиды также использовались на моделях мышей для изучения онкогенеза и инвазивности. В то же время на рост рака головного мозга влияют факторы окружающей среды, которые пока не воспроизводятся на моделях церебральных органоидов. Было показано, что церебральные органоиды позволяют понять нарушение регуляции генов, ответственных за развитие опухолей. [34]
Рассеянный склероз
[ редактировать ]Рассеянный склероз – аутоиммунное воспалительное заболевание, поражающее центральную нервную систему. Экологические и генетические факторы способствуют развитию рассеянного склероза, однако этиология этого состояния неизвестна. Индуцированные плюрипотентные стволовые клетки здоровых людей, а также пациентов с рассеянным склерозом были выращены в церебральные органоиды, создав инновационную человеческую модель этого заболевания. [46]
Ограничения
[ редактировать ]Церебральные органоиды предпочтительнее своих аналогов из трехмерных культур клеток, поскольку они могут лучше отражать структуру человеческого мозга и потому, что в определенной степени они могут отражать развитие неокортекса плода в течение длительного периода времени. Хотя церебральные органоиды обладают большим потенциалом, их культивирование и развитие имеет ограничения и области для улучшения. [34] Например, на создание одного церебрального органоида уходит несколько месяцев, и методы, используемые для их анализа, также требуют много времени. [24] Кроме того, церебральные органоиды не имеют структур, типичных для человеческого мозга, таких как гематоэнцефалический барьер. [34] Это ограничивает типы заболеваний, которые можно изучать. Другие ограничения включают в себя:
Некротические центры
[ редактировать ]До недавнего времени считалось, что центральная часть органоидов некротизирована из -за того, что кислород и питательные вещества не могут достичь этой самой внутренней области. [33] [18] Это накладывает ограничения на физиологическую применимость церебральных органоидов. [18] Из-за недостатка кислорода и питательных веществ рост нервных клеток-предшественников ограничен. [47] Однако недавние результаты показывают, что в процессе культивирования церебрального органоида можно избежать некротического центра, используя жидкостные устройства для увеличения воздействия на органоид среды. [18]
Надежность генерации
[ редактировать ]Было обнаружено, что структура церебральных органоидов в разных культурах варьируется; процедура стандартизации для обеспечения единообразия еще не стала обычной практикой. [33] Будущие шаги по пересмотру производства церебральных органоидов будут включать создание методов, обеспечивающих стандартизацию генерации церебральных органоидов. [33] Один из таких предлагаемых шагов включает регулирование состава и толщины геля, в котором культивируются церебральные органоиды; это может способствовать большей надежности производства церебральных органоидов. [18] Кроме того, вносится вариабельность в генерации церебральных органоидов из-за различий в используемых стволовых клетках. [19] Эти различия могут возникать из-за разных методов производства или различий в хозяевах. [19] Повышенный метаболический стресс также был обнаружен в органоидах. Было обнаружено, что этот метаболический стресс ограничивает специфичность органоидов. [6] Будущие шаги по оптимизации культивирования органоидов включают анализ более одного образца за раз. [24]
Зрелость
[ редактировать ]В настоящее время развитие зрелых синапсов в органоидах головного мозга ограничено из-за используемых сред. [33] Кроме того, хотя было показано, что некоторые электрофизиологические свойства развиваются в органоидах головного мозга, было показано, что культивирование отдельных и отдельных областей органоидов ограничивает созревание этих электрофизиологических свойств. Моделирование электрофизиологических процессов нейроразвития, типичных для развития на более поздних этапах нейроразвития, таких как синаптогенез , пока не предлагается в моделях церебральных органоидов. [6] Поскольку церебральные органоиды отражают то, что происходит во время развития нервной системы плода, существует обеспокоенность по поводу того, как в них проявляются поздние заболевания. Будущие улучшения включают разработку способа повторения нейродегенеративных заболеваний в органоидах головного мозга. [24]
Этика
[ редактировать ]Разумные органоиды
[ редактировать ]Этические проблемы были подняты в связи с использованием церебральных органоидов в качестве модели заболевания из-за того, что они могут испытывать такие ощущения, как боль, или иметь способность развивать сознание . [48] В настоящее время это маловероятно, учитывая простоту синтезируемых моделей по сравнению со сложностью человеческого мозга; однако было показано, что модели реагируют на световую стимуляцию, [49] поэтому современные модели действительно имеют некоторую возможность реагировать на некоторые стимулы.
Руководящие принципы и законодательство
[ редактировать ]Предпринимаются шаги по разрешению «серой зоны», такие как симпозиум 2018 года в Оксфордском университете, где эксперты в этой области, философы и юристы встретились, чтобы попытаться прояснить этические проблемы, связанные с новой технологией. [50] Аналогичным образом, такие проекты, как Brainstorm от Университета Кейс Вестерн, направлены на наблюдение за прогрессом в этой области путем мониторинга лабораторий, работающих с органоидами мозга, чтобы попытаться начать «построение философской основы», на основе которой могут быть построены будущие руководящие принципы и законодательство. [51]
Гуманизированные животные
[ редактировать ]Кроме того, «гуманизация» животных моделей была поднята как вызывающая озабоченность тема при трансплантации органоидов, полученных из стволовых клеток человека, другим животным моделям. [47] Например, потенциальные будущие проблемы такого типа были описаны, когда органоиды ткани головного мозга человека были трансплантированы детенышам крыс , которые оказались высокофункциональными, созревали и интегрировались с мозгом крысы. Такие модели можно использовать для моделирования развития человеческого мозга и, как было продемонстрировано, для исследования заболеваний (и их потенциальных методов лечения), но они могут быть спорными . [52] [53] [54]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к Ланкастер М.А., Реннер М., Мартин К.А., Венцель Д., Бикнелл Л.С., Херлз М.Э. и др. (сентябрь 2013 г.). «Церебральные органоиды моделируют развитие мозга человека и микроцефалию» . Природа . 501 (7467): 373–9. Бибкод : 2013Natur.501..373L . дои : 10.1038/nature12517 . ПМЦ 3817409 . ПМИД 23995685 .
- ^ Гордон А., Юн С.Дж., Тран СС, Макинсон К.Д., Пак Дж.Я., Андерсен Дж., Валенсия А.М., Хорват С., Сяо X, Угенард Дж.Р., Пашка С.П., Гешвинд Д.Х. (март 2021 г.). «Долгосрочное созревание корковых органоидов человека соответствует ключевым ранним постнатальным переходам» . Нат Нейроски . 24 (3): 331–342. дои : 10.1038/s41593-021-00802-y . ПМК 8109149 . ПМИД 33619405 .
- ^ Перейти обратно: а б с д Ди Лулло Э., Кригштейн А.Р. (октябрь 2017 г.). «Использование органоидов мозга для исследования развития нервной системы и заболеваний» . Обзоры природы. Нейронаука . 18 (10): 573–584. дои : 10.1038/nrn.2017.107 . ПМК 5667942 . ПМИД 28878372 .
Таблица 1: Протоколы генерации органоидов мозга
- ^ Перейти обратно: а б Первс Д., Августин Г.Дж., Фицпатрик Д., Холл У.К., ЛаМантия А.С., Уайт Л.Е., ред. (2007). Нейронаука (4-е изд.). Нью-Йорк: WH Freeman. ISBN 978-0-87893-697-7 .
- ^ Чёрч Г. «Будущее генетических кодов и кодов МОЗГА» . Ютуб . НИХвкаст . Проверено 10 февраля 2017 г.
- ^ Перейти обратно: а б с Чан В.К., Гриффитс Р., Прайс DJ, Мейсон Дж.О. (июль 2020 г.). «Церебральные органоиды как инструменты для выявления причин развития аутизма» . Молекулярный аутизм . 11 (1): 58. дои : 10.1186/s13229-020-00360-3 . ПМЦ 7359249 . ПМИД 32660622 .
- ^ Перейти обратно: а б с Фогель Г. (август 2013 г.). «Нейроразвитие. Лаборатория готовит мини-мозг». Наука . 341 (6149): 946–7. дои : 10.1126/science.341.6149.946 . ПМИД 23990534 .
- ^ Райхардт А., Полхов Б., Шакибаи М., Генрих В., Хетцер Р., Людерс С. (14 июня 2013 г.). «Крупномасштабное размножение клеток пуповины человека в биореакторе с вращающимся слоем для применения в инженерии сердечно-сосудистой ткани» . Открытый журнал биомедицинской инженерии . 7 (1): 50–61. дои : 10.2174/1874120701307010050 . ПМК 3706833 . ПМИД 23847691 .
- ^ Берштейн М., Кригштейн А.Р. (сентябрь 2013 г.). «Церебральные органоиды в блюде: прогресс и перспективы» . Клетка . 155 (1): 19–20. дои : 10.1016/j.cell.2013.09.010 . ПМК 5127703 . ПМИД 24074857 .
- ^ Габриэль, Эльке; Альбанна, Валид; Пасквини, Джованни; Рамани, Ананд; Йосипович, Наташа; Мариаппан, Арульджоти; Шинцель, Фридрих; Карч, Селеста М.; Бао, Гобин; Готтардо, Марко; Сурен, Ата Алп; Хешелер, Юрген; Нагель-Вольфрум, Керстин; Персико, Вероника; Риццоли, Сильвио О.; Альтмюллер, Джанин; Рипарбелли, Мария Джованна; Каллайни, Джулиано; Гуро, Оливье; Папантонис, Аргирис; Бускамп, Волкер; Шнайдер, Тони; Гопалакришнан, Джей (17 августа 2021 г.). «Органоиды человеческого мозга собирают функционально интегрированные двусторонние зрительные пузырьки» . Клеточная стволовая клетка . 28 (10): 1740–57.e8. дои : 10.1016/j.stem.2021.07.010 . ПМИД 34407456 . S2CID 237215870 .
- ^ Сакаёри Н., Киккава Т., Осуми Н. (октябрь 2012 г.). «Снижение пролиферации и избыточный астрогенез гетерозиготных нервных стволовых клеток/клеток-предшественников Pax6». Неврологические исследования . 74 (2): 116–21. doi : 10.1016/j.neures.2012.08.004 . ПМИД 22944581 . S2CID 19044103 .
- ^ Йирка, Боб. «Множество клеток человеческого мозга в чашке Петри научили играть в понг» . www.medicalxpress.com . Проверено 16 января 2022 г.
- ^ «Клетки человеческого мозга в тарелке учатся играть в понг быстрее, чем ИИ» . Новый учёный . Проверено 26 января 2022 г.
- ^ Каган Б.Дж., Китчен AC, Тран NT, Хабиболлахи Ф, Хаджехнеджад М, Паркер Б.Дж., Бхат А., Ролло Б., Рази А., Фристон К.Дж. (декабрь 2022 г.). «Нейроны in vitro обучаются и проявляют разумность, когда воплощаются в моделируемом игровом мире» . Нейрон . 110 (23): 3952–69.e8. дои : 10.1016/j.neuron.2022.09.001 . ПМЦ 9747182 . ПМИД 36228614 .
- ^ Перейти обратно: а б Эйраку М., Таката Н., Исибаши Х., Кавада М., Сакакура Э., Окуда С. и др. (апрель 2011 г.). «Самоорганизующийся морфогенез глазного бокала в трехмерной культуре». Природа . 472 (7341): 51–6. Бибкод : 2011Natur.472...51E . дои : 10.1038/nature09941 . ПМИД 21475194 . S2CID 4421136 .
- ^ Перейти обратно: а б с д и ж Чемберс С.М., Чиу Дж., Студер Л. (октябрь 2013 г.). «Развивай мозг» . Клеточная стволовая клетка . 13 (4): 377–8. дои : 10.1016/j.stem.2013.09.010 . ПМИД 24094317 .
- ^ Перейти обратно: а б с д и ж г час Фишер Дж., Хайде М., Хаттнер В.Б. (17 декабря 2019 г.). «Генетическая модификация органоидов мозга» . Границы клеточной нейронауки . 13 : 558. doi : 10.3389/fncel.2019.00558 . ПМК 6928125 . ПМИД 31920558 .
- ^ Перейти обратно: а б с д и ж г Поли Д., Мальяро С., Ахлувалиа А. (2019). «Экспериментальные и вычислительные методы исследования церебральных органоидов: обзор» . Границы в неврологии . 13 : 162. дои : 10.3389/fnins.2019.00162 . ПМК 6411764 . ПМИД 30890910 .
- ^ Перейти обратно: а б с д и ж г час я дж Ли К.Т., Бендрием Р.М., Ву В.В., Шен Р.Ф. (август 2017 г.). «3D-органоиды мозга, полученные из плюрипотентных стволовых клеток: многообещающие экспериментальные модели развития мозга и нейродегенеративных расстройств» . Журнал биомедицинской науки . 24 (1): 59. дои : 10.1186/s12929-017-0362-8 . ПМЦ 5563385 . ПМИД 28822354 .
- ^ Перейти обратно: а б с д и Сутарджоно Б (февраль 2019 г.). «Можем ли мы лучше понять, как Зика приводит к микроцефалии? Систематический обзор воздействия вируса Зика на органоиды человеческого мозга» . Журнал инфекционных болезней . 219 (5): 734–745. дои : 10.1093/infdis/jiy572 . ПМИД 30256965 .
- ^ Мансур А.А., Гонсалвес Х.Т., Блойд К.В., Ли Х., Фернандес С., Куанг Д. и др. (июнь 2018 г.). «In vivo модель функциональных и васкуляризированных органоидов головного мозга человека» . Природная биотехнология . 36 (5): 432–441. дои : 10.1038/nbt.4127 . ПМК 6331203 . ПМИД 29658944 .
- ^ Давио Н., Фридель Р.Х., Зу Х. (ноябрь 2018 г.). «Васкуляризация и приживление трансплантированных органоидов головного мозга человека в коре головного мозга мыши» . эНейро . 5 (6): ЭНЕВРО.0219–18.2018. дои : 10.1523/ENEURO.0219-18.2018 . ПМК 6243198 . ПМИД 30460331 .
- ^ Лелкес П.И., Ансуорт Б.Р. (2002). «Нейроэктодермальная клеточная культура: эндокринные клетки». В Атала А, Ланца Р. (ред.). Методы тканевой инженерии (1-е изд.). Сан-Диего, Калифорния: Academic Press. п. 381. ИСБН 978-0-12-436636-7 .
- ^ Перейти обратно: а б с д и Чен ХИ, Сун Х, Мин ГЛ (январь 2019 г.). «Применение органоидов человеческого мозга для решения клинических проблем» . Динамика развития . 248 (1): 53–64. дои : 10.1002/dvdy.24662 . ПМК 6312736 . ПМИД 30091290 .
- ^ Флек, Йонас Саймон; Янсен, Софи Мартина Йоханна; Уолни, Дамиан; Зенк, Фидес; Сеймия, Макико; Джайн, Аканкша; Окамото, Рёко; Сантел, Малгожата; Он, Чжисон; Кэмп, Дж. Грей; Тройтлейн, Барбара (5 октября 2022 г.). «Выявление и изменение регуломов клеточной судьбы в органоидах головного мозга человека» . Природа . 621 (7978): 365–372. дои : 10.1038/s41586-022-05279-8 . ПМЦ 10499607 . ПМИД 36198796 .
- Пресс-релиз университета: Рюгг, Питер. «Картирование развития человеческого мозга» . ETH Zürich через Medicalxpress.com . Проверено 20 ноября 2022 г.
- ^ Келли, Кевин В.; Пашка, Сергей П. (6 января 2022 г.). «Органогенез человеческого мозга: на пути к клеточному пониманию развития и болезней» . Клетка . 185 (1): 42–61. дои : 10.1016/j.cell.2021.10.003 . ПМИД 34774127 . S2CID 244038503 .
- ^ Кьярадиа, Илария; Ланкастер, Мэдлин А. (декабрь 2020 г.). «Мозговые органоиды для изучения нейробиологии человека на стыке in vitro и in vivo». Природная неврология . 23 (12): 1496–1508. дои : 10.1038/s41593-020-00730-3 . ПМИД 33139941 . S2CID 226242709 .
- ^ Цянь, Сюй; Сон, Хунцзюнь; Мин, Го-ли (15 апреля 2019 г.). «Мозговые органоиды: достижения, применение и проблемы» . Разработка . 146 (8): dev166074. дои : 10.1242/dev.166074 . ПМК 6503989 . ПМИД 30992274 .
- ^ Мостахо-Раджи, Мохаммед А.; Шмитц, Мэтью Т.; Монтойя, Себастьян Торрес; Пыльца, Алекс А. (февраль 2020 г.). «Обратное проектирование эволюции человеческого мозга с использованием органоидных моделей» . Исследования мозга . 1729 : 146582. doi : 10.1016/j.brainres.2019.146582 . ПМК 7058376 . ПМИД 31809699 . S2CID 208541541 .
- ^ Фернандес, Сара; Кляйн, Дэвис; Маркетто, Мария К. (7 октября 2021 г.). «Разгадка развития и эволюции человеческого мозга с использованием органоидных моделей» . Границы клеточной биологии и биологии развития . 9 : 737429. doi : 10.3389/fcell.2021.737429 . ПМЦ 8529117 . ПМИД 34692694 .
- ^ Муотри, Алиссон Р. (30 мая 2019 г.). «Мозговые органоиды и понимание эволюции человека» . F1000Исследования . 8 : 760. дои : 10.12688/f1000research.18495.1 . ПМК 6544132 . ПМИД 31275562 . S2CID 190868606 .
- ^ Перейти обратно: а б «Выращивание модельного мозга: эмбриональная идея» . Экономист . 31 августа 2013 г. Проверено 7 сентября 2013 г.
- ^ Перейти обратно: а б с д и Келава I, Ланкастер, Массачусетс (декабрь 2016 г.). «Выделение мини-мозгов: текущий прогресс и будущие перспективы в исследованиях органоидов мозга» . Биология развития . 420 (2): 199–209. дои : 10.1016/j.ydbio.2016.06.037 . ПМК 5161139 . ПМИД 27402594 .
- ^ Перейти обратно: а б с д Амин, Нил Д.; Пашка, Сергей П. (октябрь 2018 г.). «Построение моделей заболеваний головного мозга с помощью трехмерных органоидов» . Нейрон . 100 (2): 389–405. дои : 10.1016/j.neuron.2018.10.007 . ПМИД 30359604 .
- ^ Цянь, Сюй; Нгуен, Ха Нам; Джейкоб, Фади; Сон, Хунцзюнь; Мин, Го-ли (15 марта 2017 г.). «Использование органоидов мозга для понимания микроцефалии, вызванной вирусом Зика» . Разработка . 144 (6): 952–7. дои : 10.1242/dev.140707 . ПМЦ 5358105 . ПМИД 28292840 .
- ^ Опиц Дж. М., Холт MC (1990). «Микроцефалия: общие соображения и пособия по нозологии». Журнал черепно-лицевой генетики и биологии развития . 10 (2): 175–204. ПМИД 2211965 .
- ^ Гонсалес К., Армихо Э., Браво-Алегрия Х., Бесерра-Каликсто А., Мэйс К.Э., Сото К. (декабрь 2018 г.). «Моделирование патологии бета-амилоида и тау в органоидах головного мозга человека» . Молекулярная психиатрия . 23 (12): 2363–74. дои : 10.1038/s41380-018-0229-8 . ПМК 6594704 . ПМИД 30171212 .
- ^ Свердлов Р.Х. (сентябрь 2007 г.). «Патогенез болезни Альцгеймера» . Клинические вмешательства в старение . 2 (3): 347–59. ПМЦ 2685260 . ПМИД 18044185 .
- ^ Лауриссенс Б., Ожар Ф., Рахман А. (сентябрь 2013 г.). «Животные модели болезни Альцгеймера и разработка лекарств». Открытие лекарств сегодня: технологии . 10 (3): е319-27. дои : 10.1016/j.ddtec.2012.04.001 . ПМИД 24050129 .
- ^ Перейти обратно: а б с д Россетти, AC; Кох, П.; Ладевиг, Дж. (2019). «Открытие лекарств в психофармакологии: от 2D-моделей до церебральных органоидов» . Диалоги в клинической неврологии . 21 (2): 203–224. doi : 10.31887/dcns.2019.21.2/jladewig . ПМК 6787544 . ПМИД 31636494 . Проверено 04 октября 2020 г.
- ^ Ван Х (08.06.2018). «Моделирование неврологических заболеваний с помощью органоидов головного мозга человека» . Границы синаптической нейронауки . 10:15 . дои : 10.3389/fnsyn.2018.00015 . ПМК 6002496 . ПМИД 29937727 .
- ^ Рубинштейн Дж.Л. (апрель 2010 г.). «Три гипотезы дефектов развития, которые могут лежать в основе некоторых форм расстройств аутистического спектра». Современное мнение в неврологии . 23 (2): 118–23. doi : 10.1097/WCO.0b013e328336eb13 . ПМИД 20087182 . S2CID 14310856 .
- ^ Перейти обратно: а б Форсберг С.Л., Илиева М., Мария Мишель Т. (январь 2018 г.). «Эпигенетика и церебральные органоиды: перспективные направления в расстройствах аутистического спектра» . Трансляционная психиатрия . 8 (1): 14. дои : 10.1038/s41398-017-0062-x . ПМЦ 5802583 . ПМИД 29317608 .
- ^ Пашка А.М., Пак Дж.Ю., Шин Х.В., Ци Q, Рева О., Краснофф Р. и др. (май 2019 г.). «Человеческая 3D-клеточная модель гипоксической черепно-мозговой травмы недоношенных» . Природная медицина . 25 (5): 784–791. дои : 10.1038/s41591-019-0436-0 . ПМК 7020938 . ПМИД 31061540 .
- ^ Давио Н., Шевалье С., Фридель Р.Х., Зу Х. (2019). «Отличительная уязвимость и устойчивость подтипов нейропредшественников человека в церебральной органоидной модели пренатального гипоксического повреждения» . Границы клеточной нейронауки . 13 : 336. дои : 10.3389/fncel.2019.00336 . ПМК 6682705 . ПМИД 31417360 .
- ^ Давио, Николя; Чен, Эрик; Эдвардс, Тара; Садик, Сауд А. (15 марта 2023 г.). «Церебральные органоиды при первично-прогрессирующем рассеянном склерозе выявляют дефект дифференцировки стволовых клеток и олигодендроцитов» . Биология Открытая . 12 (3): био059845. дои : 10.1242/bio.059845 . ПМЦ 10040243 . ПМИД 36744877 .
- ^ Перейти обратно: а б Чен Х.И., Вольф Дж.А., Блю Р., Сонг ММ, Морено Дж.Д., Мин Г.Л., Сонг Х (октябрь 2019 г.). «Трансплантация органоидов человеческого мозга: новый взгляд на науку и этику мозговых химер» . Клеточная стволовая клетка . 25 (4): 462–472. дои : 10.1016/j.stem.2019.09.002 . ПМК 7180006 . ПМИД 31585092 .
- ^ Лавацца А., Массимини М. (сентябрь 2018 г.). «Церебральные органоиды: этические проблемы и оценка сознания» . Журнал медицинской этики . 44 (9): 606–610. doi : 10.1136/medethics-2017-104555 . ПМИД 29491041 .
- ^ Квадрато Г., Нгуен Т., Макоско Э.З., Шервуд Дж.Л., Мин Ян С., Бергер Д.Р. и др. (май 2017 г.). «Разнообразие клеток и сетевая динамика в светочувствительных органоидах мозга человека» . Природа . 545 (7652): 48–53. Бибкод : 2017Natur.545...48Q . дои : 10.1038/nature22047 . ПМЦ 5659341 . ПМИД 28445462 .
- ^ «Органоиды человеческого мозга: наука, этика» . Международное общество нейроэтики . Июнь 2018.
- ^ Гоголь А (октябрь 2018). «Модель человеческого мозга в чашке Петри?» . ЭврекАлерт! .
- ^ «Клетки человеческого мозга, трансплантированные в мозг крысят, растут и образуют связи» . Обзор технологий Массачусетского технологического института . Проверено 17 ноября 2022 г.
- ^ «Человеческие нейроны трансплантированы крысам для изучения заболеваний головного мозга» . Хранитель . 12 октября 2022 г. Проверено 17 ноября 2022 г.
- ^ Рева, Омер; Гор, Фелисити; Келли, Кевин В.; Андерсен, Химена; Сакаи, Нориаки; Чен, Сяоюй; Ли, Мин-Инь; Бирей, Фикри; Ян, Сяо; Пила, Нэй Л.; Бейкер, Сэмюэл В.; Амин, Нил Д.; Кулкарни, Шраванти; Мудипалли, Рачана; Цуй, Бяньсяо; Нишино, Сейджи; Грант, Джеральд А.; Ноулз, Джульетта К.; Шамлу, Мехрдад; Югенард, Джон Р.; Дейсерот, Карл; Пашка, Сергей П. (октябрь 2022 г.). «Созревание и интеграция трансплантированных корковых органоидов человека» . Природа . 610 (7931): 319–326. Бибкод : 2022Natur.610..319R . дои : 10.1038/s41586-022-05277-w . ПМЦ 9556304 . ПМИД 36224417 .