нейрогеномика
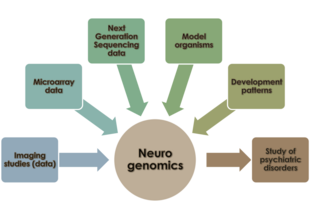
Нейрогеномика — это исследование того, как геном организма влияет на развитие и функцию его нервной системы. [ 1 ] Эта область призвана объединить функциональную геномику и нейробиологию , чтобы понять нервную систему в целом с геномной точки зрения.
Нервная система позвоночных состоит из двух основных типов клеток — нейроглиальных клеток и нейронов . У человека существуют сотни различных типов нейронов с разными функциями: некоторые из них обрабатывают внешние раздражители; другие вызывают реакцию на раздражители; другие организуются в централизованные структуры ( мозг , спинномозговые ганглии ), отвечающие за познание, восприятие и регуляцию двигательных функций. Нейроны в этих централизованных местах имеют тенденцию организовываться в гигантские сети и активно общаться друг с другом. До появления массивов экспрессии и методологий секвенирования ДНК исследователи стремились понять клеточное поведение нейронов (включая образование синапсов , развитие нейронов и регионализацию в нервной системе человека) с точки зрения лежащей в их основе молекулярной биологии и биохимии, без какого-либо понимания влияние генома нейрона на его развитие и поведение. По мере расширения нашего понимания генома роль сетей взаимодействий генов в поддержании функций и поведения нейронов вызвала интерес у исследователей. нейробиологическое исследовательское сообщество. Нейрогеномика позволяет ученым изучать нервную систему организмов в контексте лежащих в ее основе регуляторных и транскрипционных сетей. Этот подход отличается от нейрогенетики , которая подчеркивает роль отдельных генов без контекста сетевого взаимодействия при изучении нервной системы. [ 2 ]
Подходы
[ редактировать ]Появление высокопроизводительной биологии
[ редактировать ]В 1999 году Чирелли и Тонони [ 3 ] впервые сообщили о связи полногеномного профилирования экспрессии генов в мозге (с использованием микрочипов ) с поведенческим фенотипом у мышей. С тех пор данные об экспрессии генов в головном мозге, полученные с помощью микрочипов, были сопоставлены с различными локусами поведенческих количественных признаков (QTL) и опубликованы в нескольких публикациях. [ 4 ] [ 5 ] [ 6 ] Однако подходы, основанные на микрочипах, имеют свои собственные проблемы, которые затрудняют анализ: насыщение зондов может привести к очень небольшой измеримой вариативности экспрессии генов между генетически уникальными индивидуумами. [ 7 ] а наличие однонуклеотидных полиморфизмов (SNP) может привести к артефактам гибридизации. [ 8 ] [ 9 ] Кроме того, из-за своей природы на основе зондов микрочипы могут пропускать многие типы транскриптов ( нкРНК , микроРНК и мРНК изоформы ). Зонды также могут иметь видоспецифическое сродство связывания, что может затруднить сравнительный анализ.
Примечательно, что связь между поведенческими моделями и с высокой пенетрантностью локусами одиночных генов подпадает под сферу нейрогенетических исследований, в которых основное внимание уделяется выявлению простой причинной связи между одним геном с высокой пенетрантностью и наблюдаемой функцией/поведением. Однако было показано, что некоторые неврологические заболевания имеют тенденцию быть полигенными , поскольку на них влияют множество различных генов и регуляторных областей, а не один ген. Таким образом, произошел переход от подходов с одним геном к сетевым подходам для изучения неврологического развития и заболеваний, сдвиг, который в значительной степени стимулировался появлением методологий секвенирования следующего поколения .
Подходы к секвенированию нового поколения
[ редактировать ]Исследования близнецов показали, что шизофрения , [ 10 ] биполярное расстройство , [ 11 ] расстройство аутистического спектра (РАС), [ 12 ] [ 13 ] и синдром дефицита внимания с гиперактивностью [ 14 ] (СДВГ) – это наследственные, генетически сложные психические расстройства . Однако исследования сцепления в значительной степени не смогли выявить причинные варианты подобных психических расстройств, в первую очередь из-за их сложной генетической архитектуры. Множественные варианты риска низкой пенетрантности могут быть агрегированы у затронутых лиц и семей, а наборы причинных вариантов могут различаться в зависимости от семьи. Исследования в этом направлении определили полигенную основу ряда психических расстройств . [ 15 ] несколько независимо возникающих de novo мутаций у пациентов с болезнью Альцгеймера нарушают, например, общий набор функциональных путей, связанных с передачей сигналов нейронами. Было обнаружено, что [ 16 ] Таким образом, поиску понимания причинной биологии психических расстройств во многом помогает способность беспристрастно анализировать полные геномы больных и здоровых людей. [ 17 ]
Благодаря доступности массово параллельных методологий секвенирования нового поколения учёные получили возможность выйти за рамки захвата экспрессируемых генов с помощью зондов. RNA-seq Например, идентифицирует на 25–60% больше экспрессируемых генов, чем микрочипы. В будущей области нейрогеномики есть надежда, что, понимая геномные профили различных частей мозга, мы сможем улучшить наше понимание того, как взаимодействия между генами и путями влияют на клеточные функции и развитие. Ожидается, что этот подход сможет идентифицировать вторичные генные сети, которые нарушаются при неврологических расстройствах, что впоследствии поможет разработке лекарств от заболеваний головного мозга. [ 18 ] информацию о Например, инициатива BRAIN, запущенная в 2013 году, направлена на « разработке будущих методов лечения заболеваний головного мозга, включая болезнь Альцгеймера, эпилепсию и черепно-мозговые травмы ».
Исследования ассоциации редких вариантов (RVAS) подчеркнули роль de novo мутаций в некоторых врожденных расстройствах и расстройствах, возникающих в раннем детстве, таких как аутизм . [ 19 ] [ 20 ] Некоторые из этих мутаций, разрушающих белок, удалось идентифицировать только с помощью полногеномного секвенирования и подтвердить с помощью RNA-Seq . Кроме того, эти мутации статистически не обогащают отдельные гены, а скорее демонстрируют закономерности статистического обогащения групп генов, связанных с сетями, регулирующими неврологическое развитие и поддержание. Такое открытие было бы невозможно при использовании предшествующих геноцентрических подходов ( нейрогенетика , поведенческая нейробиология ). Нейрогеномика позволяет использовать высокопроизводительный системный подход для понимания полигенной основы нервно-психических расстройств. [ 17 ]
Визуализирующие исследования и оптическое картирование
[ редактировать ]Когда в 1980-х годах аутизм был идентифицирован как отдельное биологическое расстройство, исследователи обнаружили, что у аутичных людей наблюдается аномалия роста мозга в мозжечке в ранние годы развития. [ 21 ] Последующие исследования показали, что 90% детей с аутизмом имеют больший объем мозга, чем их сверстники в возрасте от 2 до 4 лет, и демонстрируют увеличение содержания белого и серого вещества в головном мозге . [ 22 ] Белое и серое вещество головного мозга связано с обучением и познанием соответственно, а образование амилоидных бляшек в белом веществе связано с болезнью Альцгеймера . Эти результаты подчеркнули влияние структурных различий в мозге на психические расстройства и побудили использовать технологии визуализации для картирования областей расхождения между здоровым и больным мозгом. Более того, хотя не всегда возможно получить биологические образцы из разных областей человеческого мозга, методы нейровизуализации предлагают неинвазивные средства для понимания биологической основы неврологических расстройств. Есть надежда, что понимание закономерностей локализации различных психических заболеваний, в свою очередь, может помочь в исследованиях сетевого анализа в нейрогеномике.
МРТ
[ редактировать ]Структурная магнитно-резонансная томография (МРТ) может использоваться для определения структурного состава мозга. В частности, в контексте нейрогеномики МРТ сыграла обширную роль в изучении болезни Альцгеймера за последние четыре десятилетия. Первоначально его использовали для исключения других причин деменции . [ 16 ] но недавние исследования показали наличие характерных изменений у пациентов с болезнью Альцгеймера. В результате МРТ в настоящее время используется в качестве инструмента нейровизуализации, помогающего определить временную и пространственную патофизиологию болезни Альцгеймера, такую как специфические церебральные изменения и визуализация амилоида . [ 16 ]
Простота и неинвазивность МРТ послужили стимулом для исследовательских проектов, которые отслеживают развитие и начало психических заболеваний в головном мозге. Болезнь Альцгеймера стала ключевым кандидатом в этом топографическом подходе к психиатрическим заболеваниям. Например, МРТ-сканирование в настоящее время используется для отслеживания функциональных профилей мозга в состоянии покоя и выполнения задач у детей с аутосомно-доминантной болезнью Альцгеймера. [ 23 ] Эти исследования обнаружили признаки ранних изменений головного мозга у людей из группы риска по болезни Альцгеймера. [ 16 ] Центр передового опыта в области аутизма Калифорнийского университета в Сан-Диего также проводит МРТ-исследования детей в возрасте от 12 до 42 месяцев в надежде охарактеризовать аномалии развития мозга у детей с поведенческими симптомами аутизма. [ 24 ]
Дополнительные исследования показали, что существуют специфические закономерности атрофии головного мозга (как следствие нейродегенерации ) при различных неврологических расстройствах и заболеваниях. Эти характерные для заболевания закономерности прогрессирования атрофии можно выявить с помощью МРТ и обеспечить клинический фенотипический контекст для нейрогеномных исследований. Временная информация о прогрессировании заболевания, предоставляемая этим подходом, также потенциально может помочь в интерпретации нарушений на уровне генной сети при психических заболеваниях. [ 16 ]
Оптическое картографирование
[ редактировать ]Одной из сдерживающих особенностей методологий секвенирования 2-го поколения является верхний предел геномного диапазона, доступного при спаривании партнеров. Оптическое картирование — это новая методология, используемая для охвата крупномасштабных вариантов, которые обычно невозможно обнаружить с помощью парного считывания концов. Этот подход был успешно применен для обнаружения вариантов олигодендроглиомы структурных , типа рака головного мозга. [ 25 ] Недавняя работа также подчеркнула универсальность оптических карт для улучшения существующих сборок генома. Хромосомные перестройки , микроделеции и крупномасштабные транслокации связаны с нарушением неврологических и когнитивных функций , например, при наследственной невропатии и нейрофиброматозе . Оптическое картирование может значительно улучшить обнаружение вариантов и информировать модели сети взаимодействия генов о болезненном состоянии при неврологических расстройствах.
Изучение других заболеваний головного мозга
[ редактировать ]Помимо неврологических расстройств, существуют дополнительные заболевания, которые проявляются в головном мозге и сформировали образцовые сценарии использования изображений мозга в сетевом анализе. Классическим примером визуализационно-геномного анализа стало исследование, проведенное в 2012 году. Оно сравнило результаты МРТ и профили экспрессии генов у 104 пациентов с глиомой, чтобы различить результаты лечения и выявить новые целевые геномные пути при мультиформной глиобластоме (ГБМ). Исследователи обнаружили две отдельные группы пациентов со значительно разной организацией белого вещества (инвазивная и неинвазивная). Последующий анализ данных по экспрессии генов показал, что митохондриальная дисфункция является основным каноническим путем агрессивного фенотипа GBM с низкой смертностью. [ 26 ]
Расширение подходов к визуализации мозга к другим заболеваниям может использоваться для исключения других заболеваний при диагностике психических расстройств, но не может использоваться для информирования о наличии или отсутствии психического расстройства.
Модели развития исследований
[ редактировать ]У людей
[ редактировать ]Современные подходы к сбору данных об экспрессии генов в человеческом мозге заключаются в использовании микрочипов или секвенирования РНК . В настоящее время редко удается собрать «живую» мозговую ткань – только когда лечение предполагает хирургическое вмешательство на головном мозге, есть шанс, что мозговая ткань будет собрана во время процедуры. Это касается эпилепсии.
В настоящее время данные об экспрессии генов обычно собираются на посмертном мозге, и это часто является препятствием для исследований нейрогеномики на людях. [ 27 ] [ 28 ] После смерти промежуток времени между смертью и моментом сбора данных посмертного мозга известен как посмертный интервал (PMI). Поскольку РНК деградирует после смерти, оптимальным вариантом будет свежий мозг, но он не всегда доступен. Это, в свою очередь, может повлиять на различные последующие анализы. следует учитывать следующие факторы При работе с данными омики, собранными из посмертного мозга, :
- В идеале человеческий мозг должен контролироваться на предмет PMI для данного исследования. [ 29 ] [ 30 ]
- Причина смерти также является важной переменной, которую следует учитывать при сборе образцов человеческого мозга для целей нейрогеномных исследований. Например, образцы мозга людей с клинической депрессией часто собираются после самоубийства. Определенные условия смерти, такие как передозировка наркотиков или огнестрельное ранение, причиненное самому себе, изменят экспрессию мозга.
- Еще одной проблемой изучения экспрессии генов в мозге является клеточная гетерогенность образцов ткани мозга. Массовые образцы мозга могут различаться по пропорциям конкретных популяций клеток от случая к случаю. Это может повлиять на характеристики экспрессии генов и существенно изменить анализ дифференциальной экспрессии.
- Одним из подходов к решению этой проблемы является использование секвенирования одноклеточной РНК . Это будет контролировать определенный тип клеток. Однако это решение применимо только в тех случаях, когда исследования не зависят от типа клеток. [ 31 ]
Дифференциальный диагноз также остается критическим преаналитическим фактором, мешающим общегрупповым исследованиям спектра неврологических расстройств. В частности, это было отмечено как проблема в исследованиях болезни Альцгеймера и расстройств аутистического спектра. Более того, по мере того, как наше понимание разнообразных симптомов и геномных основ различных нейрогеномных расстройств улучшается, сами диагностические критерии подвергаются перестановкам и пересмотру. [ 32 ]
Модели животных
[ редактировать ]Текущие геномные исследования неврологических расстройств, как правило, используют модели животных (и соответствующие гомологи генов ), чтобы понять сетевые взаимодействия, лежащие в основе конкретного расстройства, из-за этических проблем, связанных с получением биологических образцов из живого человеческого мозга. Здесь тоже не обошлось без препятствий.
Нейрогеномные исследования на модельном организме зависят от наличия полностью секвенированного и аннотированного эталонного генома. Кроме того, профили РНК ( миРНК , нкРНК , мРНК ) модельного организма должны быть хорошо каталогизированы, и любые выводы, применимые на их основе к человеку, должны иметь основу в функциональной гомологии /последовательности . [ 33 ]
данио
[ редактировать ]Развитие рыбок данио зависит от генных сетей, которые высоко консервативны среди всех позвоночных . [ 34 ] Кроме того, благодаря чрезвычайно хорошо аннотированному набору из 12 000 генов и 1 000 мутантов раннего развития, которые действительно видны в оптически прозрачных эмбрионах и личинках рыбок данио, рыбки данио предлагают сложную систему для мутагенеза и визуализации развивающихся патологий в реальном времени. Эта ранняя модель развития была использована для изучения нервной системы на клеточном уровне. [ 35 ] [ 36 ] Модельная система рыбок данио уже использовалась для изучения нейрорегенерации. [ 37 ] и тяжелые полигенные заболевания человека, такие как рак и болезни сердца. [ 38 ] Было выделено несколько мутантов рыбок данио с поведенческими вариациями в ответ на дозу кокаина и алкоголя, которые также могут стать основой для изучения патогенеза поведенческих расстройств. [ 39 ] [ 40 ]
Грызун
[ редактировать ]Модели на грызунах сыграли выдающуюся роль в изучении заболеваний человека. Эти модели были подробно аннотированы гомологами генов нескольких моногенных заболеваний у людей. Нокаутные исследования этих гомологов привели к расширению нашего понимания сетевых взаимодействий генов в тканях человека. Например, FMR1 связан с аутизмом. согласно результатам ряда сетевых исследований, ген [ 41 ] [ 42 ] Использование нокаута FMR 1 у мышей создает модель синдрома ломкой Х-хромосомы , одного из расстройств аутистического спектра . [ 43 ]
мышей Ксенотрансплантаты особенно полезны для открытия новых лекарств. [ 44 ] и сыграли чрезвычайно важную роль в открытии первых антипсихотических препаратов. Разработка моделей сложных психических заболеваний на животных также улучшилась за последние несколько лет. Модели на грызунах продемонстрировали изменения поведенческого фенотипа, напоминающие позитивное состояние шизофрении , либо после генетических манипуляций, либо после лечения препаратами, воздействующими на области мозга, предположительно влияющие на гиперактивность или нервное развитие. [ 45 ] Возник интерес к выявлению сетевых нарушений, вызванных этими лабораторными манипуляциями, а сбор геномных данных в результате исследований на грызунах внес значительный вклад в лучшее понимание геномики психиатрических заболеваний.
Первый мозга мыши транскриптом был создан в 2008 году. [ 46 ] С тех пор была проделана обширная работа по созданию моделей мышей, подвергающихся социальному стрессу, для изучения признаков экспрессии уровня путей различных психических заболеваний. В недавней статье были смоделированы особенности посттравматического стрессового расстройства (ПТСР) у мышей и профилирован весь транскриптом этих мышей. [ 47 ] Авторы обнаружили дифференциальную регуляцию во многих биологических путях, некоторые из которых были вовлечены в тревожные расстройства ( гиперактивность , реакция страха ), расстройства настроения и нарушения когнитивных функций. Эти результаты подкреплены обширным транскриптомным анализом тревожных расстройств, и считается, что изменения уровня экспрессии биологических путей, связанных с обучением страху и памятью, способствуют поведенческим проявлениям этих расстройств. [ 47 ] Считается, что функциональное обогащение генов, участвующих в долгосрочной синаптической потенциации, депрессии и пластичности, играет важную роль в приобретении, консолидации и поддержании травматических воспоминаний, лежащих в основе тревожных расстройств. [ 47 ] [ 48 ]
Экспериментальные мышиные модели психических расстройств
[ редактировать ]Распространенный подход к использованию модели на мышах заключается в применении экспериментального лечения к беременной мыши, чтобы воздействовать на весь помет. Однако ключевым вопросом в этой области является обработка пометов в статистическом анализе. В большинстве исследований учитывается общее количество произведенных потомков, поскольку это может привести к увеличению статистической мощности. Однако правильный способ — подсчитывать количество пометов и нормализовать размер помета. Было обнаружено, что несколько исследований аутизма неправильно проводили статистический анализ, основанный на общем количестве потомков, а не на количестве пометов. [ 49 ]
Некоторые тревожные расстройства, такие как посттравматическое стрессовое расстройство (ПТСР), включают гетерогенные изменения в нескольких различных областях мозга, таких как гиппокамп , миндалевидное тело и прилежащее ядро . Было показано, что клеточное кодирование травматических событий и поведенческих реакций, вызванных такими событиями, лежит в первую очередь в изменениях в сигнальных молекулах, связанных с синаптической передачей .
Глобальное профилирование экспрессии генов различных областей генов, участвующих в обработке страха и тревоги, с использованием моделей на мышах привело к идентификации временно и пространственно различных наборов дифференциально экспрессируемых генов. Анализ путей этих генов указал на возможную роль в нейрогенезе и поведенческих реакциях, связанных с тревогой, наряду с другими функциональными и фенотипическими наблюдениями. [ 47 ]
Мышиные модели для исследования мозга внесли значительный вклад в разработку лекарств и расширили наше понимание геномных основ некоторых неврологических заболеваний последнего поколения. Хлорпромазин , первый антипсихотический препарат (открытый в 1951 году), был признан жизнеспособным вариантом лечения после того, как в ходе поведенческого скрининга было показано, что он подавляет реакцию на аверсивные стимулы у крыс.
Проблемы
[ редактировать ]Моделирование и оценка скрытых симптомов (мыслей, вербального обучения, социальных взаимодействий, когнитивного поведения) остается проблемой при использовании модельных организмов для изучения психических расстройств со сложной генетической патологией . Например, данный генотип+фенотип в мышиной модели должен имитировать геномные основы фенотипа, наблюдаемого у человека.
Это особенно важный момент, который следует учитывать при расстройствах спектра, таких как аутизм . Аутизм — это расстройство, симптомы которого можно разделить на две категории: (i) дефицит социального взаимодействия и (ii) повторяющееся поведение и ограничение интересов. Поскольку мыши, как правило, являются более социальными существами среди всех представителей отряда Rodentia, которые в настоящее время используются в качестве модельных организмов, мышей обычно используют для максимально точного моделирования психических расстройств человека. В частности, в отношении аутизма в настоящее время существуют следующие обходные пути для имитации поведенческих симптомов человека:
- Для первой диагностической категории нарушения социального поведения мышей подвергают социальному тесту, предназначенному для выявления типичных аутичных социальных дефицитов. Нормальное социальное поведение мышей включает обнюхивание, преследование, физический контакт и аллогруминг . Также можно использовать голосовое общение.
- Есть несколько способов обнаружить вторую диагностическую категорию у мышей. Примеры повторяющегося поведения могут включать чрезмерное кружение, уход за собой и чрезмерное рытье. Обычно такое поведение осуществляется последовательно в течение длительного периода времени (например, уход за собой в течение 10 минут). [ 50 ]
- Хотя повторяющееся поведение легко наблюдать, трудно охарактеризовать фактические ограниченные интересы мышей. Одним из аспектов ограниченных интересов аутичных людей является «настойчивое требование одинаковости» — концепция, согласно которой аутичные люди требуют, чтобы их окружение оставалось последовательным. Если эта среда изменится, человек будет испытывать стресс и тревогу. Сообщалось об успешном подтверждении мышиной модели аутизма путем изменения среды обитания мыши. [ 51 ]
В любом из этих экспериментов у «аутичных» мышей был «нормальный» партнер по общению, а ученые, наблюдавшие за мышами, не знали («слепы») о генотипах мышей.
Экспрессия генов в мозге
[ редактировать ]Профиль экспрессии генов центральной нервной системы (ЦНС) уникален. Восемьдесят процентов всех человеческих генов экспрессируются в мозге; 5000 из этих генов экспрессируются исключительно в ЦНС. Человеческий мозг имеет самый высокий уровень экспрессии генов среди всех изученных мозгов млекопитающих. Для сравнения, ткани за пределами мозга будут иметь более схожие уровни экспрессии по сравнению с их аналогами млекопитающих. Одним из источников повышенного уровня экспрессии в человеческом мозге является некодирующая белок область генома. Многочисленные исследования показали, что человеческий мозг имеет более высокий уровень экспрессии регуляторных областей по сравнению с мозгом других млекопитающих. Также наблюдается заметное обогащение событий альтернативного сплайсинга в человеческом мозге. [ 2 ]
Пространственные различия
[ редактировать ]Профили экспрессии генов также различаются в конкретных областях мозга. Исследование на микрочипах показало, что профиль транскриптома ЦНС группируется в зависимости от региона. Другое исследование охарактеризовало регуляцию экспрессии генов в 10 различных регионах на основе сигналов eQTL . [ 52 ] Причина различных профилей экспрессии связана с функцией, миграцией нейронов и клеточной гетерогенностью региона. Даже три слоя коры головного мозга имеют разные профили экспрессии. [ 53 ]
Исследование, завершенное в Гарвардской медицинской школе в 2014 году, позволило выявить линии развития, возникающие в результате мутаций одного основания нейронов. Исследователи секвенировали 36 нейронов коры головного мозга трех нормальных людей и обнаружили, что высокоэкспрессируемые гены и гены, связанные с нейронами, были значительно обогащены однонейронными SNV . Было обнаружено, что эти SNV, в свою очередь, коррелируют с хроматиновыми маркерами транскрипции из мозга плода. [ 54 ]
Закономерности развития у человека
[ редактировать ]Экспрессия генов мозга меняется на разных этапах жизни. Наиболее значительные уровни экспрессии обнаруживаются на ранних этапах развития, при этом скорость экспрессии генов является самой высокой во время развития плода. Это является результатом быстрого роста нейронов эмбриона. Нейроны на этой стадии претерпевают нейрональную дифференцировку , клеточную пролиферацию , миграцию, а также дендритное и синаптическое развитие . [ 55 ] Паттерны экспрессии генов смещаются ближе к специализированным функциональным профилям во время эмбрионального развития, однако определенные этапы развития все еще продолжаются во время родов. Следовательно, профили экспрессии генов в двух полушариях мозга при рождении кажутся асимметричными. При рождении профили экспрессии генов кажутся асимметричными между полушариями мозга . По мере продолжения развития профили экспрессии генов становятся схожими в разных полушариях. У здорового взрослого человека профили экспрессии остаются относительно постоянными с конца двадцатых до конца сороковых годов. Начиная с пятидесятых годов, наблюдается значительное снижение экспрессии генов, важных для нормального функционирования. Несмотря на это, наблюдается увеличение разнообразия генов, экспрессируемых в мозге. Это возрастное изменение экспрессии может коррелировать с содержанием GC . На более поздних стадиях жизни наблюдается усиление индукции основных генов с низким содержанием GC, а также усиление репрессии основных генов с высоким содержанием GC. [ 53 ] Другой причиной изменения разнообразия генов является накопление мутаций и повреждений ДНК. Исследования экспрессии генов показывают, что гены, вызывающие эти возрастные мутации, одинаковы у людей в стареющей популяции. Гены, которые высоко экспрессируются на этапе развития, значительно уменьшаются на поздних стадиях жизни, тогда как гены, которые сильно репрессируются на этапе развития, значительно увеличиваются на поздних стадиях. [ 54 ]
Эволюция мозга млекопитающих
[ редактировать ]Эволюция Homo sapiens с момента отделения от общего предка приматов показала заметное увеличение размеров и сложности мозга, особенно коры головного мозга . [ 56 ] [ 57 ] [ 58 ] [ 59 ] По сравнению с приматами человека кора головного мозга имеет большую площадь поверхности, но незначительно отличается по толщине. Многие крупномасштабные исследования, направленные на понимание отличий человеческого мозга от мозга других видов, показали, что расширение семейств генов и изменения в альтернативном сплайсинге ответственны за последующее увеличение когнитивных способностей и кооперативного поведения у людей. [ 60 ] [ 61 ] Однако нам еще предстоит определить точные фенотипические последствия всех этих изменений. Одна из трудностей заключается в том, что только приматы развили подразделения в коре головного мозга, что затрудняет моделирование специфических неврологических проблем человека на грызунах . [ 58 ] [ 62 ] [ 63 ]
Данные о последовательностях используются для понимания эволюционных генетических изменений, которые привели к развитию ЦНС человека. Тогда мы сможем понять, как неврологические фенотипы различаются у разных видов. Сравнительная геномика предполагает сравнение данных о последовательностях филогении , чтобы точно определить генотипические изменения, которые происходят в определенных линиях, и понять, как эти изменения могли возникнуть. Увеличение количества высококачественных эталонных последовательностей млекопитающих обычно улучшает сравнительный анализ , поскольку увеличивает статистическую мощность . Однако увеличение числа видов в филогении сопряжено с риском добавления ненужного шума, поскольку качество выравнивания ортологичных последовательностей обычно снижается. Более того, разные классы видов будут иметь существенные различия в своих фенотипах. [ 64 ]
Несмотря на это, сравнительная геномика позволила нам связать генетические изменения, обнаруженные в филогении, с конкретными путями. Чтобы определить это, линии проверяются на предмет функциональных изменений, которые происходят с течением времени. Это часто измеряется как отношение несинонимичных замен к синонимичным заменам или отношение dN/dS (иногда сокращенно обозначаемое как ω). Когда соотношение dN/dS больше 1, это указывает на положительный выбор . Отношение dN/dS, равное 1, свидетельствует об отсутствии селективного давления. Отношение dN/dS меньше 1 указывает на отрицательный выбор . Например, консервативные области генома обычно имеют соотношение dN/dS менее 1, поскольку любые изменения в этих положениях, вероятно, будут вредными. [ 65 ] По оценкам, из генов, экспрессируемых в человеческом мозге, 342 из них имеют соотношение dN/dS более 1 в человеческой линии по сравнению с другими линиями приматов. [ 64 ] Это указывает на положительный отбор в человеческой линии по фенотипам мозга. Понимание значимости положительного отбора обычно является следующим шагом. Например, ASPM , CDK5RAP2 и NIN — это гены, которые положительно отобраны в человеческой линии и напрямую коррелируют с размером мозга. Это открытие может помочь объяснить, почему человеческий мозг больше, чем мозг других млекопитающих. [ 65 ]
Различия в экспрессии сетевого уровня между видами
[ редактировать ]Считается, что изменения экспрессии генов, являющиеся конечной реакцией на любые генетические изменения, являются хорошим показателем для понимания фенотипических различий в биологических образцах. Сравнительные исследования выявили ряд различий в контроле транскрипции между приматами и грызунами . Например, ген CNTNAP2 специально обогащен префронтальной корой . Мышиный гомолог CNTNAP2 не экспрессируется в мозге мыши. CNTNAP2 вовлечен в когнитивные функции речи, а также в расстройства нервного развития, такие как расстройство аутистического спектра. Это говорит о том, что контроль экспрессии играет значительную роль в развитии уникальных когнитивных функций человека. Как следствие, в ряде исследований были изучены специфичные для мозга усилители. факторы транскрипции , такие как SOX5, Было обнаружено, что положительно отбираются в человеческой линии. Исследования экспрессии генов у людей, шимпанзе и макак-резус выявили специфичные для человека сети совместной экспрессии и повышение экспрессии генов в коре головного мозга человека по сравнению с приматами. [ 66 ]
расстройства
[ редактировать ]Нейрогеномные расстройства проявляются как неврологические расстройства со сложной генетической архитектурой и неменделевским типом наследования. [ 18 ] Некоторые примеры этих расстройств включают биполярное расстройство и шизофрению . [ 15 ] В проявлении заболевания могут быть задействованы несколько генов, а мутации при таких заболеваниях, как правило, редки и возникают de novo. Следовательно, становится крайне маловероятным наблюдать один и тот же (потенциально причинный) вариант у двух неродственных людей, страдающих одним и тем же нейрогеномным расстройством. [ 15 ] выявили несколько de novo экзонных и структурных вариаций при расстройствах аутистического спектра (РАС). Продолжающиеся исследования , например, [ 15 ] Таким образом, аллельный спектр редких и распространенных вариантов нейрогеномных нарушений требует проведения крупных когортных исследований, чтобы эффективно исключить варианты с низким эффектом и выявить общие пути, часто мутирующие при различных заболеваниях, а не конкретные гены и специфические с высокой пенетрантностью мутации .
Полногеномное секвенирование (WGS) и полноэкзомное секвенирование (WES) использовалось в исследованиях широкогеномных ассоциаций (GWAS) для характеристики генетических вариантов, связанных с нейрогеномными расстройствами. Однако влияние этих вариантов не всегда может быть проверено из-за неменделевских закономерностей наследования, наблюдаемых при некоторых из этих расстройств. [ 15 ] Еще одной сдерживающей особенностью сетевого анализа является отсутствие крупномасштабных наборов данных по многим психиатрическим (нейрогеномным) заболеваниям. Поскольку некоторые заболевания с нейрогеномной основой, как правило, имеют полигенную основу, несколько неспецифических, редких и частично пенетрантных мутаций de novo у разных пациентов могут способствовать одному и тому же наблюдаемому диапазону фенотипов, как в случае с расстройством аутистического спектра и шизофренией. [ 67 ] Обширные исследования алкогольной зависимости также подчеркнули необходимость высококачественного геномного профилирования больших наборов образцов. [ 68 ] [ 69 ] при изучении полигенных , спектральных расстройств .
Проект «1000 геномов» стал успешной демонстрацией того, как согласованные усилия по получению репрезентативных геномных данных широкого спектра людей могут привести к выявлению действенных биологических идей для различных заболеваний. [ 70 ] Однако такой масштабной инициативы, особенно в области нейрогеномных расстройств, пока нет.
Моделирование психических расстройств в исследованиях нейрогеномики – проблемы
[ редактировать ]Одно крупное исследование GWAS выявило 13 новых локусов риска шизофрении . [ 71 ] Изучение влияния этих кандидатов в идеале могло бы продемонстрировать фенотип шизофрении на животных моделях, который обычно трудно наблюдать из-за его проявления в виде латентной личности. Этот подход способен определить молекулярное влияние гена-кандидата . В идеале гены-кандидаты должны оказывать неврологическое воздействие, что, в свою очередь, предполагает, что они играют роль в неврологическом расстройстве. Например, в вышеупомянутом исследовании GWAS по шизофрении Рипке и его коллеги [ 71 ] определили, что все эти гены-кандидаты участвуют в передаче сигналов кальция. Альтернативно, можно изучить эти варианты на модельных организмах в контексте нарушенной неврологической функции. Важно отметить, что с высокой пенетрантностью, варианты этих нарушений как правило, представляют собой мутации de novo .
Еще одной сложностью изучения нейрогеномных расстройств является гетерогенная природа расстройства. При многих из этих расстройств мутации, наблюдаемые от случая к случаю, не остаются постоянными. При аутизме у больного человека может наблюдаться большое количество вредных мутаций в гене X. У другого больного человека может не быть каких-либо существенных мутаций в гене X, но имеется большое количество мутаций в гене Y. Альтернативой является определение того, является ли ген X и ген Y влияют на один и тот же биохимический путь, который влияет на неврологические функции. Сетевой анализ биоинформатики является одним из подходов к этой проблеме. Методологии сетевого анализа предоставляют обобщенный системный обзор молекулярного пути.
Последнее осложнение, которое следует учитывать, — это коморбидность нейрогеномных генов. Некоторые расстройства, особенно на более тяжелых концах спектра, имеют тенденцию сочетаться друг с другом. Например, более тяжелые случаи РАС , как правило, связаны с умственной отсталостью (ИН). Это поднимает вопрос о том, существуют ли истинные, уникальные гены РАС и уникальные гены ID, или есть только гены, связанные только с неврологическими функциями, которые могут мутировать в аномальный фенотип. Одним из мешающих факторов может быть фактическая диагностическая категория и методы расстройств спектра, поскольку симптомы тяжелых расстройств могут быть схожими. В одном исследовании изучались коморбидные симптомы между группами с РАС и РАС, и не было обнаружено существенных различий между симптомами детей с РАС, детей с РАС с РАС и детей с РАС без РАС. Будущие исследования могут помочь установить более строгую генетическую основу для диагностики этих расстройств.
Сетевой анализ
[ редактировать ]
Основная цель сетевого анализа в нейрогеномике — выявление статистически значимых неслучайных связей между генами, содержащими варианты риска. [ 15 ] Хотя уже существует несколько реализаций алгоритма этого подхода, [ 72 ] [ 73 ] общие шаги сетевого анализа остаются прежними.
- Аналитический процесс начинается с идентификации биологической сети на основе экспериментальной проверки. Это может быть сеть совместной экспрессии генов или сеть белок-белкового взаимодействия (PPI). Узлы сети будут кластеризованы.
- Впоследствии создается конкретный список генов с известной ассоциацией с конкретным интересующим фенотипом. Этот список мог быть определен экспериментальными данными, не связанными с генетическими исследованиями психических расстройств. [ 15 ] Это называется «списком совпадений».
- Гены, входящие в список совпадений, а также биологическая сеть, выбранная на первом этапе, помечаются как таковые.
- За этим следует этап определения вины по ассоциации (GBA). Это означает, что кластеры в биологической сети, которые имеют значительное количество генов из списка совпадений, исследуются дополнительно с использованием инструментов функционального обогащения и запроса базы данных о путях, в которых участвуют эти гены кластера с высокой оценкой. [ 74 ]
- Таким образом, исследуются биологические ассоциации высокопоставленных, экспериментально вовлеченных членов кластера, расширяя область поиска за пределами первоначального списка совпадений и включая гены-члены дополнительных путей, которые могут иметь значительную ассоциацию с рассматриваемой исходной биологической сетью. В результате образуется набор генов-кандидатов. [ 15 ]
Основной принцип этого подхода заключается в том, что гены, сгруппированные вместе, также будут совместно влиять на один и тот же молекулярный путь. Опять же, в идеале они должны быть частью неврологической функции. Гены-кандидаты затем можно использовать для определения приоритета вариантов для валидации в влажной лаборатории.
Нейрофармакология
[ редактировать ]Исторически сложилось так, что из-за поведенческой стимуляции, проявляющейся как симптом при некоторых нейрогеномных расстройствах, терапия в основном опиралась на антипсихотики или антидепрессанты. Эти классы лекарств подавляют общие симптомы расстройств, но с сомнительной эффективностью. Самым большим препятствием для нейрофармакогеномных исследований был размер когорты. Учитывая новые доступные данные по секвенированию больших когорт, в последнее время появился толчок к расширению терапевтических возможностей. Гетерогенная природа неврологических заболеваний является ключевой мотивацией для персонализированных подходов медицины к их лечению. При неврологических заболеваниях редко можно встретить единичные гены, вызывающие высокую пенетрантность. Понятно, что геномные профили различаются в зависимости от случая, и, по логике вещей, методы лечения должны различаться в зависимости от случая. Еще больше усложняет проблему то, что многие из этих расстройств относятся к расстройствам спектра. Их генетическая этиология будет варьироваться в пределах этого спектра. Например, тяжелый РАС связан с мутациями de novo с высокой пенетрантностью. Более легкие формы РАС обычно связаны со смесью распространенных вариантов.
Таким образом, ключевым вопросом является преобразование этих недавно выявленных генетических вариантов (в результате исследований вариантов числа копий , секвенирования генов-кандидатов и технологий высокопроизводительного секвенирования) в меры вмешательства для пациентов с нейрогеномными расстройствами. Одним из аспектов будет то, является ли неврологическое расстройство действенным с медицинской точки зрения (т.е. существует ли простой метаболический путь, на который может быть нацелена терапия). Например, определенные случаи РАС были связаны с микроделециями гена TMLHE . Этот ген кодирует фермент биосинтеза карнитина . Добавки, повышающие уровень карнитина, по-видимому, облегчали некоторые симптомы РАС, но исследование было затруднено многими влияющими факторами. Как упоминалось ранее, использование подхода генной сети поможет выявить соответствующие представляющие интерес пути. Многие нейрофармакогеномные подходы сосредоточены на воздействии на последующие продукты этих путей. [ 75 ] [ 76 ]
Гематоэнцефалический барьер
[ редактировать ]Исследования на животных моделях нескольких заболеваний головного мозга показали, что гематоэнцефалический барьер (ГЭБ) претерпевает модификации на многих уровнях; например, состав поверхностных гликопротеинов может влиять на типы штаммов ВИЧ-1, переносимых ГЭБ. Было обнаружено, что ГЭБ играет ключевую роль в возникновении болезни Альцгеймера . [ 77 ] Однако изучить это на людях чрезвычайно сложно из-за очевидных ограничений доступа к мозгу и получения биологических образцов для секвенирования или морфологического анализа. Мышиные модели ГЭБ и модели болезненных состояний хорошо послужили для концептуализации ГЭБ как регуляторного интерфейса между болезнью и хорошим здоровьем мозга.
Персонализированная нейробиология
[ редактировать ]Гетерогенная природа неврологических заболеваний является ключевой мотивацией для персонализированных подходов медицины к их лечению. [ 75 ] Геномные образцы отдельных пациентов можно использовать для выявления прогностических факторов или для лучшего понимания конкретного прогноза нейрогеномного заболевания и использования этой информации для определения вариантов лечения. [ 78 ] Несмотря на очевидную клиническую пользу этого подхода, адаптация этого подхода до сих пор не существует.
Существуют различные проблемы, запрещающие применение персонализированной геномики для оценки, диагностики и лечения психических расстройств.
- Во-первых, причинно-сетевая биология некоторых расстройств нейрогеномного спектра еще не полностью изучена, несмотря на обширные исследования, проведенные с такими расстройствами, как аутизм. [ 12 ] [ 42 ] и шизофрения . [ 10 ] Таким образом, аналитическая обоснованность существующих гипотез относительно этиологии нейрогеномных нарушений до сих пор полностью не установлена и является предметом дискуссий и противоречий.
- Клиническая достоверность генетических вариантов, которые, как было показано, тесно коррелируют со специфическими нейрогеномными нарушениями, часто является серьезной причиной беспокойства. [ 78 ] Интерпретация результатов этих тестов и последующее принятие решений являются сложной задачей, учитывая полигенную природу многих из этих расстройств. Ситуация еще больше усложняется тем, что было показано, что превентивное вмешательство при серьезных психических расстройствах не всегда снижает риск развития этого расстройства. [ 79 ] Такое вмешательство может быть недоступно даже для потомков пострадавших взрослых, находящихся в группе риска, что ограничивает «медицинскую применимость» данных. [ 78 ]
- Также были подняты этические проблемы в отношении защиты личной геномной информации и того, как лучше всего подойти к бремени случайных находок и оценке семейного риска.
- Родство и инбридинг могут привести к избирательному обогащению редких генетических мутаций с низкой пенетрантностью, приписываемых различным симптомам нейрогеномных нарушений. Таким образом, интерпретация семейно-специфичных генетических мутаций и/или нарушений на сетевом уровне при возникновении редкого психического расстройства требует тщательного рассмотрения мотивации участников, включенных в исследование. [ 78 ]
- Тем не менее, эти проблемы можно решить путем эффективного обучения и консультирования, и сбор геномных данных от пациентов с психическими расстройствами не должен быть дисквалифицирован только на этом основании. Сами по себе данные служат динамичным ресурсом здравоохранения и могут значительно улучшить наше понимание геномной основы некоторых психических расстройств.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Богуски, Марк С.; Джонс, Аллан Р. (1 мая 2004 г.). «Нейрогеномика: на стыке нейробиологии и геномных наук». Природная неврология . 7 (5): 429–433. дои : 10.1038/nn1232 . ISSN 1097-6256 . ПМИД 15114353 . S2CID 14310435 .
- ^ Перейти обратно: а б Джайн, Кевал К. (01 января 2013 г.). «Нейрогенетика и нейрогеномика». Применение биотехнологии в неврологии . Хумана Пресс. стр. 7–16. дои : 10.1007/978-1-62703-272-8_2 . ISBN 9781627032711 .
- ^ Чирелли, Кьяра; Тонони, Джулио (1999). «Различия в экспрессии генов во время сна и бодрствования» . Анналы медицины . 31 (2): 117–124. дои : 10.3109/07853899908998787 . ПМИД 10344584 .
- ^ Мэтьюз, Дуглас Б.; Бхаве, Санджив В.; Белкнап, Джон К.; Бриттингем, Синтия; Чеслер, Элисса Дж.; Хитцеманн, Роберт Дж.; Хоффманн, Паула Л.; Лу, Лу; МакВини, Шеннон (1 сентября 2005 г.). «Комплексная генетика взаимодействия алкоголя и функций и поведения ЦНС». Алкоголизм: клинические и экспериментальные исследования . 29 (9): 1706–1719. doi : 10.1097/01.alc.0000179209.44407.df . ISSN 0145-6008 . ПМИД 16205371 .
- ^ Хоффман, Паула Л.; Майлз, Майкл; Эденберг, Ховард Дж.; Зоммер, Вольфганг; Табаков, Борис; Венер, Жанна М.; Леволь, Джоанна (1 февраля 2003 г.). «Экспрессия генов в мозге: взгляд на зависимость от этанола, нейроадаптацию и предпочтения» . Алкоголизм: клинические и экспериментальные исследования . 27 (2): 155–168. дои : 10.1097/01.ALC.0000060101.89334.11 . ISSN 0145-6008 . ПМИД 12605065 .
- ^ Фаррис, Шон П.; Майлз, Майкл Ф. (1 января 2012 г.). «Модуляция генных сетей этанолом: последствия алкоголизма» . Нейробиология болезней . 45 (1): 115–121. дои : 10.1016/j.nbd.2011.04.013 . ISSN 1095-953X . ПМК 3158275 . ПМИД 21536129 .
- ^ Пожитков Алексей Евгеньевич; Бубе, Идрисса; Брауэр, Мариус Х.; Ноубл, Питер А. (01 марта 2010 г.). «За пределами массивов Affymetrix: расширение набора известных изотерм гибридизации и наблюдение за интенсивностью сигнала перед промывкой» . Исследования нуклеиновых кислот . 38 (5): е28. дои : 10.1093/нар/gkp1122 . ISSN 0305-1048 . ПМЦ 2836560 . ПМИД 19969547 .
- ^ Уолтер, Николь А.Р.; МакВини, Шеннон К.; Питерс, Сандра Т.; Белкнап, Джон К.; Хитцеманн, Роберт; Бак, Кари Дж. (1 сентября 2007 г.). «SNP имеют значение: влияние на обнаружение дифференциальной экспрессии» . Природные методы . 4 (9): 679–680. дои : 10.1038/nmeth0907-679 . ISSN 1548-7091 . ПМК 3410665 . ПМИД 17762873 .
- ^ Уолтер, Николь А.Р.; Внизу, Дэниел; Ладерас, Тед; Муни, Майкл А.; Даракджян, Присцилла; Сирлз, Роберт П.; Харрингтон, Кристина А.; МакВини, Шеннон К.; Хитцеманн, Роберт (1 января 2009 г.). «Высокопроизводительное секвенирование на мышах: сравнение платформ выявляет преобладание загадочных SNP» . БМК Геномика . 10 : 379. дои : 10.1186/1471-2164-10-379 . ISSN 1471-2164 . ПМЦ 2743714 . ПМИД 19686600 .
- ^ Перейти обратно: а б Салливан П.Ф.; Кендлер КС; Нил MC (01 декабря 2003 г.). «Шизофрения как сложная черта: данные метаанализа исследований близнецов» . Архив общей психиатрии . 60 (12): 1187–1192. дои : 10.1001/archpsyc.60.12.1187 . ISSN 0003-990X . ПМИД 14662550 .
- ^ Смоллер, Джордан В.; Финн, Кристин Т. (15 ноября 2003 г.). «Семейные, близнецовые и усыновительные исследования биполярного расстройства». Американский журнал медицинской генетики, часть C. 123С (1): 48–58. CiteSeerX 10.1.1.456.6790 . дои : 10.1002/ajmg.c.20013 . ISSN 1552-4868 . ПМИД 14601036 . S2CID 29453951 .
- ^ Перейти обратно: а б Розенберг, Ребекка Э.; Ло, Дж. Кили; Енокян, Гаяне; МакГриди, Джон; Кауфманн, Уолтер Э.; Закон, Пол А. (01 октября 2009 г.). «Характеристики и соответствие расстройств аутистического спектра среди 277 пар близнецов» . Архив педиатрии и подростковой медицины . 163 (10): 907–914. doi : 10.1001/archpediatrics.2009.98 . ISSN 1538-3628 . ПМИД 19805709 .
- ^ Фрейзер, Томас В.; Томпсон, Ли; Янгстрем, Эрик А.; Закон, Пол; Хардан, Антонио Ю.; Энг, Чарис; Моррис, Натан (1 августа 2014 г.). «Двойное исследование наследственного и общего вклада окружающей среды в развитие аутизма» . Журнал аутизма и нарушений развития . 44 (8): 2013–2025. дои : 10.1007/s10803-014-2081-2 . ISSN 1573-3432 . ПМК 4104233 . ПМИД 24604525 .
- ^ Бумсма, Доррет; Бушьян, Андреас; Пелтонен, Лина (1 ноября 2002 г.). «Классические исследования близнецов и не только» (PDF) . Обзоры природы Генетика . 3 (11): 872–882. дои : 10.1038/nrg932 . ISSN 1471-0056 . ПМИД 12415317 . S2CID 9318812 .
- ^ Перейти обратно: а б с д и ж г час Салливан, Патрик Ф.; Дейли, Марк Дж.; О'Донован, Майкл (1 августа 2012 г.). «Генетическая архитектура психических расстройств: новая картина и ее последствия» . Обзоры природы Генетика . 13 (8): 537–551. дои : 10.1038/nrg3240 . ISSN 1471-0056 . ПМЦ 4110909 . ПМИД 22777127 .
- ^ Перейти обратно: а б с д и Джонсон, Кейт А.; Фокс, Ник С.; Сперлинг, Рейса А.; Кланк, Уильям Э. (1 апреля 2012 г.). «Визуализация мозга при болезни Альцгеймера» . Перспективы Колд-Спринг-Харбора в медицине . 2 (4): а006213. doi : 10.1101/cshperspect.a006213 . ISSN 2157-1422 . ПМЦ 3312396 . ПМИД 22474610 .
- ^ Перейти обратно: а б МакКэрролл, Стивен А.; Фэн, Гопин; Хайман, Стивен Э. (01 июня 2014 г.). «Геномная нейрогенетика: методология и значение» . Природная неврология . 17 (6): 756–763. дои : 10.1038/nn.3716 . ISSN 1546-1726 . ПМЦ 4912829 . ПМИД 24866041 .
- ^ Перейти обратно: а б «Мнение: настоящее и будущее нейрогеномики | Журнал Scientist Magazine®» . Ученый . Проверено 23 февраля 2016 г.
- ^ Малхотра, Дирадж; Себат, Джонатан (16 марта 2012 г.). «CNV: предвестники редкой вариантной революции в психиатрической генетике» . Клетка . 148 (6): 1223–1241. дои : 10.1016/j.cell.2012.02.039 . ISSN 1097-4172 . ПМЦ 3351385 . ПМИД 22424231 .
- ^ Макклеллан, Джон; Кинг, Мэри-Клэр (23 июня 2010 г.). «Геномный анализ психических заболеваний: меняющийся ландшафт». ДЖАМА . 303 (24): 2523–2524. дои : 10.1001/jama.2010.869 . ISSN 1538-3598 . ПМИД 20571020 .
- ^ Куршен, Э.; Юнг-Куршен, Р.; Пресс, Джорджия; Хесселинк, младший; Джерниган, ТЛ (26 мая 1988 г.). «Гипоплазия VI и VII долек мозжечка при аутизме» . Медицинский журнал Новой Англии . 318 (21): 1349–1354. дои : 10.1056/NEJM198805263182102 . ISSN 0028-4793 . ПМИД 3367935 .
- ^ Куршен, Э.; Карнс, CM; Дэвис, HR; Зиккарди, Р.; Карпер, РА; Тиг, ЗД; Чисум, HJ; Моисей, П.; Пирс, К. (24 июля 2001 г.). «Необычные модели роста мозга в раннем возрасте у пациентов с аутистическим расстройством: исследование МРТ». Неврология . 57 (2): 245–254. дои : 10.1212/wnl.57.2.245 . ISSN 0028-3878 . ПМИД 11468308 . S2CID 11234938 .
- ^ Кироз, Якил Т.; Шульц, Аарон П.; Чен, Кевэй; Протас, Хиллари Д.; Брикхаус, Майкл; Флейшер, Адам С.; Лангбаум, Джессика Б.; Тийягура, Прадип; Фэган, Энн М. (1 августа 2015 г.). «Визуализация мозга и нарушения биомаркеров крови у детей с аутосомно-доминантной болезнью Альцгеймера: перекрестное исследование» . JAMA Неврология . 72 (8): 912–919. дои : 10.1001/jamaneurol.2015.1099 . ISSN 2168-6157 . ПМЦ 4625544 . ПМИД 26121081 .
- ^ «Центр передового опыта по аутизму Калифорнийского университета в Сан-Диего» . autism-center.ucsd.edu . Проверено 24 февраля 2016 г.
- ^ Рэй, Мохана; Гольдштейн, Стив; Чжоу, Шиго; Потамусис, Константинос; Саркар, Дипаян; Ньютон, Майкл А; Эстерберг, Элизабет; Кендзиорски, Кристина ; Боглер, Оливер (26 июля 2013 г.). «Обнаружение структурных изменений в солидной опухоли олигодендроглиомы с помощью анализа одиночных молекул» . БМК Геномика . 14 (1): 505. дои : 10.1186/1471-2164-14-505 . ПМЦ 3727977 . ПМИД 23885787 .
- ^ Колен, Ривка Р.; Вангель, Марк; Ван, Цзисинь; Гутман, Дэвид А.; Хван, Скотт Н.; Винтермарк, Макс; Джайн, Раджан; Джилван-Николас, Манал; Чен, Джеймс Ю. (1 января 2014 г.). «Визуализация геномного картирования инвазивного фенотипа МРТ предсказывает исход пациента и метаболическую дисфункцию: проект исследовательской группы по фенотипу глиомы TCGA» . BMC Медицинская Геномика . 7:30 . дои : 10.1186/1755-8794-7-30 . ISSN 1755-8794 . ПМК 4057583 . ПМИД 24889866 .
- ^ Липска, Барбара К.; Дип-Собослай, Эми; Вайкерт, Синтия Шеннон; Хайд, Томас М.; Мартин, Кэтрин Э.; Герман, Мэри М.; Кляйнман, Джоэл Э. (15 сентября 2006 г.). «Критические факторы экспрессии генов в посмертном мозге человека: фокус на исследованиях шизофрении» . Биологическая психиатрия . 60 (6): 650–658. doi : 10.1016/j.biopsych.2006.06.019 . ПМИД 16997002 . S2CID 39379510 .
- ^ Стэн, Ана Д.; Гхош, Суброто; Гао, Сюэ-Мин; Робертс, Розалинда К.; Льюис-Амескуа, Келли; Хатанпаа, Киммо Дж.; Тамминга, Кэрол А. (6 декабря 2006 г.). «Человеческая посмертная ткань: какие маркеры качества имеют значение?» . Исследования мозга . 1123 (1): 1–11. дои : 10.1016/j.brainres.2006.09.025 . ЧВК 1995236 . ПМИД 17045977 .
- ^ Дурик, Ваня; Банаср, Мунира; Штокмайер, Крейг А.; Симен, Артур А.; Ньютон, Сэмюэл С.; Оверхолсер, Джеймс С.; Джурджус, Джордж Дж.; Дитер, Леза; Думан, Рональд С. (1 февраля 2013 г.). «Измененная экспрессия генов, связанных с синапсом и глутаматом, в посмертном гиппокампе субъектов с депрессией» . Международный журнал нейропсихофармакологии . 16 (1): 69–82. дои : 10.1017/S1461145712000016 . ISSN 1461-1457 . ПМЦ 3414647 . ПМИД 22339950 .
- ^ Надь, Корина; Маэ, Марисса; Лопес, Хуан Пабло; Вайанкур, Кэтрин; Кручану, Кристиана; Гросс, Джеффри А.; Арновиц, Митчелл; Мечавар, Нагиб; Турецкий, Густаво (01 мая 2015 г.). «Влияние посмертного интервала на целостность биомолекул в мозге» . Журнал невропатологии и экспериментальной неврологии . 74 (5): 459–469. doi : 10.1097/NEN.0000000000000190 . ISSN 0022-3069 . ПМИД 25868148 .
- ^ Дарманис, Спирос; Слоан, Стивен А.; Чжан, Е; Энге, Мартин; Канеда, Кристина; Шуер, Лоуренс М.; Гепхарт, Мелани Г. Хайден; Баррес, Бен А.; Землетрясение, Стивен Р. (9 июня 2015 г.). «Обзор разнообразия транскриптомов человеческого мозга на уровне отдельных клеток» . Труды Национальной академии наук . 112 (23): 7285–7290. Бибкод : 2015PNAS..112.7285D . дои : 10.1073/pnas.1507125112 . ISSN 0027-8424 . ПМК 4466750 . ПМИД 26060301 .
- ^ Чиконьола, Клаудия; Кьяссерини, Давиде; Парнетти, Лусилла (29 июня 2015 г.). «Преаналитические мешающие факторы при анализе биомаркеров спинномозговой жидкости при болезни Альцгеймера: проблема суточных вариаций» . Границы в неврологии . 6 : 143. doi : 10.3389/fneur.2015.00143 . ISSN 1664-2295 . ПМЦ 4483516 . ПМИД 26175714 .
- ^ Ринквитц, Силке; Муррен, Филипп; Беккер, Томас С. (1 февраля 2011 г.). «Рыбки данио: интегративная система нейрогеномики и нейробиологии». Прогресс нейробиологии . 93 (2): 231–243. дои : 10.1016/j.pneurobio.2010.11.003 . ISSN 1873-5118 . ПМИД 21130139 . S2CID 34169168 .
- ^ Каньестро, Кристиан; Постлтуэйт, Джон Х. (15 мая 2007 г.). «Развитие передне-задней оси хордовых без классической передачи сигналов ретиноевой кислоты» . Биология развития . 305 (2): 522–538. дои : 10.1016/j.ydbio.2007.02.032 . ISSN 0012-1606 . ПМИД 17397819 .
- ^ Таллафус, Александра; Трепман, Алисса; Эйзен, Джудит С. (1 декабря 2009 г.). «МРНК DeltaA и распределение белка в нервной системе рыбок данио» . Динамика развития . 238 (12): 3226–3236. дои : 10.1002/dvdy.22136 . ISSN 1097-0177 . ПМЦ 2882441 . ПМИД 19924821 .
- ^ Руссек-Блюм, Нива; Гутник, Амос; Набель-Розен, Хелит; Блехман, Жанна; Штаудт, Николь; Дорский, Ричард И.; Уарт, Коринн; Левковиц, Гил (01 октября 2008 г.). «Размер кластера дофаминергических нейронов определяется на ранних стадиях формирования паттерна переднего мозга» . Разработка . 135 (20): 3401–3413. дои : 10.1242/dev.024232 . ISSN 0950-1991 . ПМК 2692842 . ПМИД 18799544 .
- ^ Реймер, Мичелл М.; Соренсен, Инга; Куща, Вероника; Фрэнк, Ребекка Э.; Лю, Чонг; Беккер, Катерина Г.; Беккер, Томас (20 августа 2008 г.). «Регенерация двигательных нейронов у взрослых рыбок данио» . Журнал неврологии . 28 (34): 8510–8516. doi : 10.1523/JNEUROSCI.1189-08.2008 . ISSN 1529-2401 . ПМК 6671064 . ПМИД 18716209 .
- ^ Уайт, Ричард; Роуз, Кристин; Зон, Леонард (01 сентября 2013 г.). «Рак данио: современное состояние и путь вперед» . Обзоры природы Рак . 13 (9): 624–636. дои : 10.1038/nrc3589 . ISSN 1474-175Х . ПМК 6040891 . ПМИД 23969693 .
- ^ Дарланд, Т.; Даулинг, Дж. Э. (2001). «Поведенческий скрининг чувствительности к кокаину у мутагенизированных рыбок данио» . Учеб. Натл. акад. наук. США . 98 (20): 11691–11696. Бибкод : 2001PNAS...9811691D . дои : 10.1073/pnas.191380698 . ПМК 58791 . ПМИД 11553778 .
- ^ ; Локвуд Б., Бьерке С., Кобаяши К. и Го С. «Острое воздействие алкоголя на личинки рыбок данио: генетическая система для крупномасштабного скрининга» Pharmacol. Биохим. Поведение 2004; 77, 647–654
- ^ Бургерон, Томас (01 сентября 2015 г.). «От генетической архитектуры к синаптической пластичности при расстройствах аутистического спектра». Обзоры природы Неврология . 16 (9): 551–563. дои : 10.1038/nrn3992 . ISSN 1471-003X . ПМИД 26289574 . S2CID 12742356 .
- ^ Перейти обратно: а б Просто Марсель Адам; Черкасский Владимир Леонидович; Келлер, Тимоти А.; Кана, Раджеш К.; Миншью, Нэнси Дж. (1 апреля 2007 г.). «Функциональная и анатомическая корковая недостаточность при аутизме: данные фМРТ-исследования задачи исполнительной функции и морфометрии мозолистого тела» . Кора головного мозга . 17 (4): 951–961. дои : 10.1093/cercor/bhl006 . ISSN 1047-3211 . ПМК 4500121 . ПМИД 16772313 .
- ^ Одди, Д.; Крузио, МЫ ; Д'Амато, Франция; Пьетропаоло, С. (15 августа 2013 г.). «Моногенные мышиные модели социальной дисфункции: последствия для аутизма». Поведенческие исследования мозга . СИ: Нейробиология аутизма. 251 : 75–84. дои : 10.1016/j.bbr.2013.01.002 . ПМИД 23327738 . S2CID 10384899 .
- ^ Гулд, Стивен Э.; Хунттила, Мелисса Р.; де Соваж, Фредерик Дж. (01 мая 2015 г.). «Трансляционная ценность мышиных моделей при разработке онкологических лекарств». Природная медицина . 21 (5): 431–439. дои : 10.1038/нм.3853 . ISSN 1078-8956 . ПМИД 25951530 . S2CID 5789096 .
- ^ Джонс, Калифорния; Уотсон, DJG; Фоне, KCF (01 октября 2011 г.). «Животные модели шизофрении» . Британский журнал фармакологии . 164 (4): 1162–1194. дои : 10.1111/j.1476-5381.2011.01386.x . ISSN 0007-1188 . ПМЦ 3229756 . ПМИД 21449915 .
- ^ Мортазави, Али; Уильямс, Брайан А.; МакКью, Кеннет; Шеффер, Лориан; Уолд, Барбара (1 июля 2008 г.). «Картирование и количественная оценка транскриптомов млекопитающих с помощью RNA-Seq». Природные методы . 5 (7): 621–628. дои : 10.1038/nmeth.1226 . ISSN 1548-7105 . ПМИД 18516045 . S2CID 205418589 .
- ^ Перейти обратно: а б с д Мухиэ, Сеид; Гаутам, Аарти; Мейерхофф, Джеймс; Чакраборти, Набарун; Хаммамия, Раша; Джетт, Марти (28 февраля 2015 г.). «Профили транскриптома мозга на мышиной модели, имитирующей особенности посттравматического стрессового расстройства» . Молекулярный мозг . 8 (1): 14. дои : 10.1186/s13041-015-0104-3 . ПМЦ 4359441 . ПМИД 25888136 .
- ^ Натт, Дэвид Дж.; Малиция, Андреа Л. (1 января 2004 г.). «Структурные и функциональные изменения мозга при посттравматическом стрессовом расстройстве». Журнал клинической психиатрии . 65 (Приложение 1): 11–17. ISSN 0160-6689 . ПМИД 14728092 .
- ^ Лазич, Стэнли Э; Эссиу, Лоран (22 марта 2013 г.). «Улучшение фундаментальной и трансляционной науки путем учета различий в моделях животных от помета к помету» . BMC Нейронаука . 14:37 . дои : 10.1186/1471-2202-14-37 . ISSN 1471-2202 . ПМК 3661356 . ПМИД 23522086 .
- ^ Кроули, Жаклин Н. (1 сентября 2012 г.). «Трансляционные животные модели аутизма и нарушений нервного развития» . Диалоги в клинической неврологии . 14 (3): 293–305. doi : 10.31887/DCNS.2012.14.3/jcrawley . ISSN 1294-8322 . ПМЦ 3513683 . ПМИД 23226954 .
- ^ Готэм, Кэтрин; Бишоп, Сомер Л.; Гус, Ванесса; Уэрта, Марисела; Лунд, Сабата; Буя, Андреас; Кригер, Абба; Лорд, Кэтрин (01 февраля 2013 г.). «Изучение связи между тревогой и настойчивым стремлением к сходству при расстройствах аутистического спектра» . Исследования аутизма . 6 (1): 33–41. дои : 10.1002/аур.1263 . ISSN 1939-3806 . ПМЦ 4373663 . ПМИД 23258569 .
- ^ Рамасами, Адайкалаван; Трабзуни, Дания; Гуэльфи, Себастьян; Варгезе, Вибин; Смит, Колин; Уокер, Роберт; Де, Тишам; Британский консорциум по экспрессии мозга; Североамериканский консорциум экспрессии мозга (01 октября 2014 г.). «Генетическая изменчивость регуляции экспрессии генов в десяти областях мозга человека» . Природная неврология . 17 (10): 1418–1428. дои : 10.1038/nn.3801 . ISSN 1097-6256 . ПМЦ 4208299 . ПМИД 25174004 .
- ^ Перейти обратно: а б Наумова Оксана Ю.; Ли, Мария; Рычков Сергей Ю.; Власова Наталья Владимировна; Григоренко, Елена Л. (01.01.2013). «Экспрессия генов в человеческом мозге: современное состояние изучения специфичности и пространственно-временной динамики» . Развитие ребенка . 84 (1): 76–88. дои : 10.1111/cdev.12014 . ISSN 1467-8624 . ПМЦ 3557706 . ПМИД 23145569 .
- ^ Перейти обратно: а б Лодато, Майкл А.; Вудворт, Молли Б.; Ли, Семин; Эврони, Гилад Д.; Мехта, Бхавен К.; Каргер, Амир; Ли, Сухён; Читтенден, Томас В.; Д'Гама, Алисса М. (2 октября 2015 г.). «Соматическая мутация в отдельных нейронах человека отслеживает историю развития и транскрипции» . Наука . 350 (6256): 94–98. Бибкод : 2015Sci...350...94L . дои : 10.1126/science.aab1785 . ISSN 1095-9203 . ПМЦ 4664477 . ПМИД 26430121 .
- ^ Миллер, Джереми А.; Дин, Сун-Лин; Санкин, Сьюзен М.; Смит, Кимберли А.; Нг, Лидия; Сафер, Аарон; Эбберт, Аманда; Райли, Закери Л.; Ройалл, Джошуа Дж. (10 апреля 2014 г.). «Транскрипционный ландшафт пренатального человеческого мозга» . Природа . 508 (7495): 199–206. Бибкод : 2014Natur.508..199M . дои : 10.1038/nature13185 . ISSN 0028-0836 . ПМК 4105188 . ПМИД 24695229 .
- ^ Кэрролл, Шон Б. (апрель 2003 г.). «Генетика и создание Homo Sapiens» . Природа . 422 (6934): 849–857. дои : 10.1038/nature01495 . ПМИД 12712196 . S2CID 4333307 .
- ^ Хилл, Роберт Шон; Уолш, Кристофер А. (1 сентября 2005 г.). «Молекулярное понимание эволюции человеческого мозга». Природа . 437 (7055): 64–67. Бибкод : 2005Natur.437...64H . дои : 10.1038/nature04103 . ISSN 1476-4687 . ПМИД 16136130 . S2CID 4406401 .
- ^ Перейти обратно: а б Ракич, Пасько (01 октября 2009 г.). «Эволюция неокортекса: взгляд из биологии развития» . Обзоры природы Неврология . 10 (10): 724–735. дои : 10.1038/nrn2719 . ISSN 1471-003X . ПМЦ 2913577 . ПМИД 19763105 .
- ^ Гешвинд, Дэниел Х.; Ракич, Пасько (30 октября 2013 г.). «Корковая эволюция: судите о мозге по его оболочке» . Нейрон . 80 (3): 633–647. дои : 10.1016/j.neuron.2013.10.045 . ISSN 1097-4199 . ПМЦ 3922239 . ПМИД 24183016 .
- ^ Каларко, Джон А.; Син, И; Касерес, Марио; Каларко, Джозеф П.; Сяо, Синьшу; Пан, Цюнь; Ли, Кристофер; Пройсс, Тодд М.; Бленкоу, Бенджамин Дж. (15 ноября 2007 г.). «Глобальный анализ альтернативных различий в сплайсинге между людьми и шимпанзе» . Гены и развитие . 21 (22): 2963–2975. дои : 10.1101/gad.1606907 . ISSN 0890-9369 . ПМК 2049197 . ПМИД 17978102 .
- ^ Чжан, Сяо-Оу; Инь, Цин-Фей; Ван, Хай-Бин; Чжан, Ян; Чен, Тянь; Чжэн, Пин; Лу, Сюйхуа; Чен, Лин-Лин; Ян, Ли (01 января 2014 г.). «Видоспецифичный альтернативный сплайсинг приводит к уникальной экспрессии sno-lncRNAs» . БМК Геномика . 15 : 287. дои : 10.1186/1471-2164-15-287 . ISSN 1471-2164 . ПМЦ 4234469 . ПМИД 24734784 .
- ^ Сомель, Мехмет; Лю, Силин; Хаитович, Филипп (01 февраля 2013 г.). «Эволюция человеческого мозга: транскрипты, метаболиты и их регуляторы». Обзоры природы Неврология . 14 (2): 112–127. дои : 10.1038/nrn3372 . ISSN 1471-003X . ПМИД 23324662 . S2CID 12572416 .
- ^ Куреши, Ирфан А.; Мелер, Марк Ф. (1 августа 2012 г.). «Новая роль некодирующих РНК в эволюции, развитии, пластичности и заболеваниях мозга» . Обзоры природы Неврология . 13 (8): 528–541. дои : 10.1038/nrn3234 . ISSN 1471-003X . ПМК 3478095 . ПМИД 22814587 .
- ^ Перейти обратно: а б Гешвинд, Дэниел Х.; Ракич, Пасько (30 октября 2013 г.). «Корковая эволюция: судите о мозге по его обложке» . Нейрон . 80 (3): 633–647. дои : 10.1016/j.neuron.2013.10.045 . ISSN 0896-6273 . ПМЦ 3922239 . ПМИД 24183016 .
- ^ Перейти обратно: а б Энард, Вольфганг (1 января 2014 г.). «Сравнительная геномика эволюции размеров мозга» . Границы человеческой неврологии . 8 : 345. дои : 10.3389/fnhum.2014.00345 . ПМК 4033227 . ПМИД 24904382 .
- ^ Ван, Гуан-Чжун; Конопка, Женевьева (01 июня 2013 г.). «Расшифровка сигнатур экспрессии генов человека в мозге» . Транскрипция . 4 (3): 102–108. дои : 10.4161/trns.24885 . ISSN 2154-1272 . ПМЦ 4042582 . ПМИД 23665540 .
- ^ Киров Г.; Поклингтон, Эй Джей; Холманс, П.; Иванов Д.; Икеда, М.; Рудерфер, Д.; Моран, Дж.; Чембер, К.; Тончева, Д. (01 февраля 2012 г.). «Анализ CNV de novo указывает на специфические нарушения постсинаптических сигнальных комплексов в патогенезе шизофрении» . Молекулярная психиатрия . 17 (2): 142–153. дои : 10.1038/mp.2011.154 . ISSN 1476-5578 . ПМЦ 3603134 . ПМИД 22083728 .
- ^ Берут, Лаура Дж.; Агравал, Арпана; Бухольц, Кэтлин К.; Доэни, Кимберли Ф.; Лори, Кэти; Пью, Элизабет; Фишер, Шерри; Фокс, Луи; Хауэллс, Уильям (16 марта 2010 г.). «Полногеномное исследование ассоциации алкогольной зависимости» . Труды Национальной академии наук . 107 (11): 5082–5087. Бибкод : 2010PNAS..107.5082B . дои : 10.1073/pnas.0911109107 . ISSN 0027-8424 . ПМК 2841942 . ПМИД 20202923 .
- ^ Джураева, Дилафруз; Трейтлейн, Йенс; Шольц, Хенрике; Франк, Йозеф; Дегенхардт, Франциска; Сихон, Свен; Райдингер, Моника; Маттайзен, Мануэль; Витт, Стефани Х. (01 января 2015 г.). «XRCC5 как ген риска алкогольной зависимости: данные полногеномного анализа набора генов и последующих исследований на дрозофиле и людях» . Нейропсихофармакология . 40 (2): 361–371. дои : 10.1038/нпп.2014.178 . ISSN 1740-634X . ПМЦ 4443948 . ПМИД 25035082 .
- ^ Консорциум проекта «1000 геномов» (1 октября 2015 г.). «Глобальный справочник по генетическим вариациям человека» . Природа . 526 (7571): 68–74. Бибкод : 2015Natur.526...68T . дои : 10.1038/nature15393 . ISSN 0028-0836 . ПМК 4750478 . ПМИД 26432245 .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Перейти обратно: а б Рипке, Стефан; О'Душлейн, Колм; Чембер, Кимберли; Моран, Дженнифер Л.; Келер, Анна К.; Актерин, Сюзанна; Берген, Сара Э.; Коллинз, Энн Л.; Кроули, Джеймс Дж. (1 октября 2013 г.). «Общегеномный анализ ассоциаций выявил 13 новых локусов риска шизофрении» . Природная генетика . 45 (10): 1150–1159. дои : 10.1038/ng.2742 . ISSN 1546-1718 . ПМЦ 3827979 . ПМИД 23974872 .
- ^ Ли, Фил Х.; О'Душлейн, Колм; Томас, Бретт; Перселл, Шон М. (1 июля 2012 г.). «INRICH: интервальный анализ обогащения для полногеномных исследований ассоциаций» . Биоинформатика . 28 (13): 1797–1799. doi : 10.1093/биоинформатика/bts191 . ISSN 1367-4811 . ПМК 3381960 . ПМИД 22513993 .
- ^ Моррис, Эндрю П; Войт, Бенджамин Ф; Теслович, Таня М; Феррейра, Тереза; Сегре, Айелле V; Штайнторсдоттир, Валгердур; Стробридж, Рона Дж; Хан, Хасан; Граллерт, Харальд (1 сентября 2012 г.). «Крупномасштабный ассоциативный анализ дает представление о генетической архитектуре и патофизиологии диабета 2 типа» . Природная генетика . 44 (9): 981–990. дои : 10.1038/ng.2383 . ISSN 1061-4036 . ПМЦ 3442244 . ПМИД 22885922 .
- ^ Гиллис, Джесси; Павлидис, Пол (2012). « Вина по ассоциации» — скорее исключение, чем правило в генных сетях» . PLOS Вычислительная биология . 8 (3): e1002444. Бибкод : 2012PLSCB...8E2444G . дои : 10.1371/journal.pcbi.1002444 . ПМЦ 3315453 . ПМИД 22479173 .
- ^ Перейти обратно: а б МакМахон, Фрэнсис Дж.; Инсел, Томас Р. (7 июня 2012 г.). «Фармакогеномика и персонализированная медицина в нейропсихиатрии» . Нейрон . 74 (5): 773–776. дои : 10.1016/j.neuron.2012.05.004 . ПМК 3407812 . ПМИД 22681682 .
- ^ Брандлер, Уильям М.; Себат, Джонатан (1 января 2015 г.). «От мутаций De Novo к персонализированным терапевтическим вмешательствам при аутизме». Ежегодный обзор медицины . 66 (1): 487–507. doi : 10.1146/annurev-med-091113-024550 . ПМИД 25587659 .
- ^ Бэнкс, Уильям А. (01 октября 2010 г.). «Мышиные модели неврологических расстройств: взгляд со стороны гематоэнцефалического барьера» . Biochimica et Biophysica Acta (BBA) - Молекулярные основы болезней . 1802 (10): 881–888. дои : 10.1016/j.bbadis.2009.10.011 . ISSN 0006-3002 . ПМЦ 2891624 . ПМИД 19879356 .
- ^ Перейти обратно: а б с д Бизекер, Барбара Боулз; Пей, Холли Ландрам (1 августа 2013 г.). «Геномное секвенирование психических расстройств: обещания и вызовы» . Международный журнал нейропсихофармакологии . 16 (7): 1667–1672. дои : 10.1017/S146114571300014X . ISSN 1461-1457 . ПМЦ 3703499 . ПМИД 23575420 .
- ^ Бунник, Элин М; Шермер, Маартье Х.Н.; Янссенс, Сесиль JW (19 января 2012 г.). «Роль характеристик заболевания в этических дебатах о тестировании личного генома» . BMC Медицинская Геномика . 5 (1): 4. дои : 10.1186/1755-8794-5-4 . ПМК 3293088 . ПМИД 22260407 .
