Старение мозга
Старение мозга . — это процесс трансформации мозга в пожилом возрасте , включающий изменения в опыте всех людей и в результате болезней (включая нераспознанные болезни) Обычно это относится к людям.
Поскольку продление жизни актуально только в том случае, если оно сопровождается увеличением продолжительности жизни и, что более важно, сохранением здоровья мозга и когнитивных функций, поиск омолаживающих подходов, которые действуют одновременно на периферические ткани и на функции мозга, является ключевой стратегией развития омолаживающих технологий. [1]
Старение является основным фактором риска большинства распространенных нейродегенеративных заболеваний , включая легкие когнитивные нарушения , деменцию, включая болезнь Альцгеймера , цереброваскулярные заболевания , болезнь Паркинсона и болезнь Лу Герига . [2] [3] Хотя многие исследования сосредоточены на заболеваниях старения , имеется мало информативных исследований по молекулярной биологии стареющего мозга (обычно пишется «стареющий мозг» в британском английском языке ) при отсутствии нейродегенеративных заболеваний или нейропсихологического профиля здоровых пожилых людей. Однако исследования показывают, что процесс старения связан с рядом структурных, химических и функциональных изменений в мозге, а также с множеством нейрокогнитивных изменений. Недавние исследования модельных организмов предполагают, что с возрастом организмов происходят отчетливые изменения в экспрессии генов на уровне отдельных нейронов . [4] На этой странице представлен обзор изменений, связанных со старением мозга человека , в том числе старением без сопутствующих заболеваний .
Структурные изменения
[ редактировать ]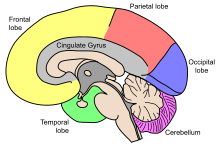
Старение влечет за собой множество физических, биологических, химических и психологических изменений, и мозг не является исключением из этого явления. Эти различные изменения попытались отобразить с помощью концептуальных моделей , таких как Теория старения и познания (STAC) в 2009 году. Модель STAC рассматривает такие факторы, как нейронные изменения в белом веществе , истощение дофамина , сокращение и истончение коры . [5] КТ показало, что желудочки головного мозга расширяются в зависимости от возраста. Более поздние исследования МРТ сообщили о возрастном региональном уменьшении объема головного мозга. [6] [7] Региональное сокращение объема не является равномерным; некоторые области мозга сокращаются со скоростью до 1% в год, тогда как другие остаются относительно стабильными до конца жизни. [8] Мозг очень сложен и состоит из множества различных областей и типов тканей или материи. Различные функции разных тканей головного мозга могут быть более или менее восприимчивы к возрастным изменениям. [6] Вещество головного мозга можно разделить на серое и белое вещество. Серое вещество состоит из тел клеток и коры подкорковых ядер . Белое вещество состоит из плотно упакованных миелинизированных аксонов, соединяющих нейроны друг с другом и с периферией. [6]
Потеря нейронных цепей и пластичности мозга
[ редактировать ]Пластичность мозга означает способность мозга изменять структуру и функции. [9] [10] Это связано с распространенной фразой «если вы это не используете, вы это теряете», что является другим способом сказать: если вы не используете это, ваш мозг будет выделять для этого меньше соматотопического пространства . Один из предполагаемых механизмов наблюдаемого возрастного дефицита пластичности у животных является результатом возрастных изменений регуляции кальция . [11] Изменения в способности организма усваивать кальций в конечном итоге повлияют на возбуждение нейронов и способность распространять потенциалы действия , что, в свою очередь, повлияет на способность мозга изменять свою структуру или функцию (т.е. его пластическую природу). Из-за сложности мозга со всеми его структурами и функциями логично предположить, что некоторые области будут более уязвимы к старению, чем другие. Здесь следует упомянуть две цепи — гиппокамп и неокортикальную цепь. [12] Было высказано предположение, что возрастное снижение когнитивных функций частично связано не с гибелью нейронов, а с синаптическими изменениями. Данные, подтверждающие эту идею, полученные при работе с животными, также позволяют предположить, что этот когнитивный дефицит обусловлен функциональными и биохимическими факторами, такими как изменения ферментативной активности, химических мессенджеров или экспрессии генов в корковых цепях. [12]
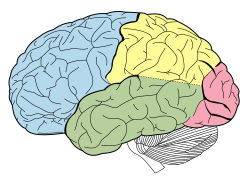
Истончение коры
[ редактировать ]| Доли человеческого мозга |
|---|
Достижения в технологии МРТ предоставили возможность увидеть структуру мозга в мельчайших деталях простым и неинвазивным способом in vivo . Барцокис и др. отметил, что наблюдается уменьшение объема серого вещества в период между взрослением и старостью , тогда как было обнаружено, что объем белого вещества увеличивается с 19–40 лет и снижается после этого возраста. [13] Исследования с использованием морфометрии на основе вокселей выявили такие области, как островковая доля и верхняя теменная извилина, как особенно уязвимые к возрастным потерям серого вещества у пожилых людей. [13] Соуэлл и др. сообщили, что первые 6 десятилетий жизни человека коррелировали с наиболее быстрым снижением плотности серого вещества, и это происходило в дорсальных , лобных и теменных долях как на межполушарных , так и на латеральных поверхностях мозга. Также стоит отметить, что такие области, как поясная извилина и затылочная кора , окружающая пяточную борозду , по-видимому, не подвержены этому уменьшению плотности серого вещества с течением времени. [13] Влияние возраста на плотность серого вещества в задней височной коре проявляется преимущественно в левом, а не в правом полушарии и ограничивается задней языковой корой. Было обнаружено, что некоторые языковые функции, такие как поиск и производство слов, локализуются в более передних отделах языковой коры и ухудшаются с возрастом. Соуэлл и др. также сообщили, что эти передние речевые коры созревают и угасают раньше, чем более задние речевые коры. [13] Также было обнаружено, что ширина борозды не только увеличивается с возрастом, но и увеличивается. [14] но также и со снижением когнитивных функций у пожилых людей. [15]
Морфология и микроструктура
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( март 2023 г. ) |
внесло возрастное уменьшение объема серого вещества Наибольший вклад в изменение объема мозга . Более того, снижается плотность нейронов, изменяется микроструктура белого вещества и энергетический обмен в мозжечке . изменяется [16] Общая кортикальная атрофия возникает с возрастом, и, например, объем хвостатого ядра уменьшается. [17] [ нужны дальнейшие объяснения ]
Возрастная морфология нейронов
[ редактировать ]со всего мира приходят к единому мнению Когнитивные нейробиологи , что возрастные когнитивные нарушения могут быть не следствием потери нейронов или гибели клеток, а, скорее, результатом небольших специфичных для региона изменений в морфологии нейронов. [11] Исследования Дуана и др. показали, что дендритные ветви и дендритные отростки кортикальных . пирамидных нейронов уменьшаются в размере и/или количестве в определенных областях и слоях коры головного мозга человека и приматов, не являющихся человеком, с возрастом (Duan et al , 2003 г.; Сообщалось об уменьшении количества и плотности позвоночника на 46% у людей старше 50 лет по сравнению с более молодыми людьми. [12] Электронно -микроскопическое исследование на обезьянах показало 50% потерю шипов на апикальных дендритных пучках пирамидных клеток в префронтальной коре старых животных (27–32 года) по сравнению с молодыми (6–9 лет). [12]
Нейрофибриллярные клубки
[ редактировать ]
Возрастные невропатологии, такие как болезнь Альцгеймера , болезнь Паркинсона , диабет , гипертония и атеросклероз, затрудняют определение нормальных закономерностей старения. [18] [19] Одним из важных различий между нормальным старением и патологическим старением является расположение нейрофибриллярных клубков. Нейрофибриллярные клубки состоят из парных спиральных нитей (ПГФ). [20] При нормальном старении без деменции количество клубков в теле каждой пораженной клетки относительно невелико. [20] и ограничивается обонятельным ядром , парагиппокампальной извилиной , миндалевидным телом и энторинальной корой . [21] По мере старения человека, не страдающего деменцией, плотность клубков в целом увеличивается, но существенной разницы в том, где они обнаруживаются, нет. [21]
Другим основным нейродегенеративным фактором, обычно обнаруживаемым в головном мозге пациентов с БА, являются амилоидные бляшки . Однако, в отличие от клубков, бляшки не являются постоянным признаком нормального старения. [21]
Роль окислительного стресса
[ редактировать ]Когнитивные нарушения связывают с окислительным стрессом, воспалительными реакциями и изменениями в микроциркуляторном русле головного мозга. [22] Точное влияние каждого из этих механизмов на когнитивное старение неизвестно. Окислительный стресс является наиболее контролируемым фактором риска и наиболее изученным. В онлайн-медицинском словаре Мерриам-Вебстера окислительный стресс определяется как «физиологический стресс для организма, вызванный кумулятивным ущербом, нанесенным свободными радикалами, неадекватно нейтрализуемыми антиоксидантами , и который считается связанным со старением». [23] Следовательно, окислительный стресс – это повреждение, наносимое клеткам свободными радикалами, высвободившимися в процессе окисления.
По сравнению с другими тканями организма мозг считается необычайно чувствительным к окислительному повреждению. [24] Повышенное окислительное повреждение связано с нейродегенеративными заболеваниями, легкими когнитивными нарушениями и индивидуальными различиями в когнитивных способностях у здоровых пожилых людей. При «нормальном старении» мозг подвергается окислительному стрессу множеством способов. Основной вклад вносят окисление белков, перекисное окисление липидов и окислительные модификации ядерной и митохондриальной ДНК. [24] Окислительный стресс может повредить репликацию ДНК и замедлить восстановление посредством многих сложных процессов, включая укорочение теломер в компонентах ДНК. [25] Каждый раз, когда соматическая клетка реплицируется, теломерный компонент ДНК укорачивается. Поскольку длина теломер частично наследуется, [25] существуют индивидуальные различия в возрасте начала когнитивного снижения.
повреждение ДНК
[ редактировать ]По крайней мере 25 исследований показали, что повреждения ДНК накапливаются с возрастом в мозге млекопитающих. Это повреждение ДНК включает окисленный нуклеозид 8-гидроксидезоксигуанозин (8-OHdG), одно- и двухцепочечные разрывы, поперечные связи ДНК-белок и малонового диальдегида аддукты (обзор у Bernstein et al. [26] ). Сообщалось об увеличении повреждения ДНК с возрастом в мозге мышей, крыс, песчанок, кроликов, собак и человека. У молодых 4-дневных крыс на нейрон приходится около 3000 однонитевых разрывов и 156 двухцепочечных разрывов, тогда как у крыс старше 2 лет уровень повреждения увеличивается примерно до 7400 однонитевых разрывов и 600 двухцепочечных разрывов на нейрон. . [27]
Лу и др. [28] изучили транскрипционные человека профили лобной коры у людей в возрасте от 26 до 106 лет. Это привело к идентификации набора генов, экспрессия которых изменилась после 40 лет. Кроме того, они обнаружили, что промоторные последовательности этих конкретных генов с возрастом накапливают окислительные повреждения ДНК, включая 8-OHdG (см. Теорию старения повреждений ДНК ). Они пришли к выводу, что повреждение ДНК может снизить экспрессию избирательно уязвимых генов, участвующих в обучении, памяти и выживании нейронов, запуская процесс старения мозга, который начинается в раннем возрасте.
Иммунная система и жидкости
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( март 2023 г. ) |
Проницаемость гематоэнцефалического барьера , нейровоспаление и нейродегенерация , а также микробиотой кишечника, вызванное системное хроническое воспаление, по-видимому, связаны и взаимодействуют со старением, например, поскольку гомеостаз микробиоты кишечника может нарушаться с возрастом. [29] Согласно обзору, нейровоспалительные изменения, «включая активацию микроглии и выработку воспалительных цитокинов », происходят при нормальном старении. [30] [ нужны дальнейшие объяснения ]
Жидкости
[ редактировать ]мозговой кровоток снижается на 0,3-0,5% в год в здоровом старении. Было показано, что [31] Эффективно функционирующая глимфатическая система , участвующая в выведении отходов, может быть важна для поддержания здоровья мозга, и эффективность ее транспортировки, по-видимому, снижается с возрастом. [32] Было доказано, что факторы кровообращения модулируют старение и омолаживают мозг. [33] [ нужны дальнейшие объяснения ]
Химические изменения
[ редактировать ]
В рамках пути вознаграждения дофамин вырабатывается в телах нервных клеток, расположенных в VTA, и высвобождается в прилежащем ядре и префронтальной коре . Двигательные функции дофамина связаны с отдельным путем, с телами клеток черной субстанции , которые производят и высвобождают дофамин в полосатое тело .

Помимо структурных изменений, которые мозг претерпевает с возрастом, процесс старения также влечет за собой широкий спектр биохимических изменений. Точнее, нейроны общаются друг с другом через специализированные химические посланники, называемые нейротрансмиттерами . Несколько исследований выявили ряд этих нейротрансмиттеров, а также их рецепторов , которые демонстрируют заметные изменения в различных областях мозга как часть нормального процесса старения.
Дофамин
[ редактировать ]Подавляющее число исследований сообщили о возрастных изменениях в синтезе дофамина , местах связывания и количестве рецепторов . Исследования с использованием позитронно-эмиссионной томографии (ПЭТ) на живых людях показали значительное возрастное снижение синтеза дофамина. [34] особенно в полосатом теле и экстрастриарных областях (за исключением среднего мозга ). [35] возрастном снижении дофаминовых рецепторов , Также D2 и значительном D3 . D1 широко сообщалось о [36] [37] [38] [39] [40] общее снижение рецепторов D1 и D2 , Показано [38] и, более конкретно, снижение связывания рецепторов D1 и D2 в хвостатом ядре и скорлупе . [37] [40] общее снижение плотности рецепторов D1 происходит Также было показано, что с возрастом. Значительное возрастное снижение дофаминовых рецепторов D2 и D3 было обнаружено в передней поясной извилине , лобной коре , латеральной височной коре , гиппокампе , медиальной височной коре, миндалевидном теле , медиальном таламусе и латеральном таламусе. [36] Одно исследование также показало значительную обратную корреляцию между связыванием дофамина в затылочной коре и возрастом. [37] Посмертные исследования также показывают, что количество рецепторов D 1 и D 2 снижается с возрастом как в хвостатом ядре , так и в скорлупе , хотя соотношение этих рецепторов не показывает возрастных изменений. [39] Считается, что потеря дофамина с возрастом является причиной многих неврологических симптомов, частота которых увеличивается с возрастом, таких как уменьшение размахивания руками и повышенная ригидность . [41] Изменения уровня дофамина также могут вызывать возрастные изменения когнитивной гибкости . [41]
Серотонин
[ редактировать ]снижение уровней различных рецепторов серотонина и переносчика серотонина Также было показано, что с возрастом происходит (5-HTT). Исследования, проведенные с использованием методов ПЭТ на людях in vivo, показывают, что уровни 5-НТ 2 рецептора в хвостатом ядре , скорлупе и лобной коре головного мозга снижаются с возрастом. [40] Также было обнаружено снижение связывающей способности 5-НТ2 - рецептора во лобной коре. [38] а также снижение связывающей способности переносчика серотонина (5-HHT) в таламусе и среднем мозге . [42] Посмертные исследования на людях показали снижение связывающей способности серотонина и уменьшение количества рецепторов S 1 в лобной коре и гиппокампе , а также снижение сродства в скорлупе . [43]
Глутамат
[ редактировать ]
Глутамат — еще один нейромедиатор , уровень которого имеет тенденцию уменьшаться с возрастом. [44] [45] [46] Исследования показали, что у пожилых людей концентрация глутамата в моторной коре ниже , чем у более молодых. [46] значительное возрастное снижение, особенно в теменном сером веществе, базальных ганглиях и, в меньшей степени, лобном белом веществе. Также было отмечено [44] [45] Хотя эти уровни были изучены в нормальном человеческом мозге, области теменных и базальных ганглиев часто поражаются при дегенеративных заболеваниях головного мозга, связанных со старением, и поэтому было высказано предположение, что глутамат мозга может быть полезен в качестве маркера заболеваний головного мозга, на которые влияет старение. . [44]
Нейропсихологические изменения
[ редактировать ]Изменения ориентации
[ редактировать ]Ориентация определяется как осознание себя по отношению к своему окружению. [47] Часто ориентацию проверяют, определяя, есть ли у человека чувство времени, места и личности. Нарушение ориентации является одним из наиболее распространенных симптомов заболеваний головного мозга, поэтому тесты на ориентацию включены почти во все медицинские и нейропсихологические обследования. [48] Хотя исследования в основном были сосредоточены на уровнях ориентации среди клинических групп населения, в небольшом количестве исследований изучалось, наблюдается ли нормальное снижение ориентации среди здоровых стареющих взрослых. Результаты были несколько неубедительными. Некоторые исследования показывают, что ориентация не снижается на протяжении всей жизни. [49] [50] Например, в одном исследовании 92% нормальных пожилых людей (65–84 лет) имели идеальную или почти идеальную ориентацию. [51] Однако некоторые данные свидетельствуют о том, что легкие изменения в ориентации могут быть нормальной частью старения. [52] [53] Например, Свит и его коллеги пришли к выводу, что «пожилые люди с нормальной, здоровой памятью могут иметь легкие трудности с ориентацией. Напротив, молодые люди с нормальной памятью практически не имеют проблем с ориентацией». [53] (с. 505). Таким образом, хотя текущие исследования показывают, что нормальное старение обычно не связано со значительным снижением ориентации, легкие трудности могут быть частью нормального старения и не обязательно признаком определенной патологии.
Изменения внимания
[ редактировать ]Многие пожилые люди замечают снижение своих способностей к вниманию. [54] Внимание — это широкая конструкция, которая относится к «когнитивным способностям, которые позволяют нам справляться с присущими человеческому мозгу ограничениями обработки путем выбора информации для дальнейшей обработки». [55] Поскольку ресурсы человеческого мозга ограничены, люди используют свое внимание, чтобы сосредоточиться на определенных стимулах и блокировать другие.
Если у пожилых людей меньше ресурсов внимания, чем у молодых людей, мы могли бы ожидать, что, когда необходимо выполнять две задачи одновременно, производительность пожилых людей снизится больше, чем у молодых людей. Однако большой обзор исследований когнитивных функций и старения показывает, что эта гипотеза не получила полной поддержки. [56] Хотя некоторые исследования показали, что пожилым людям труднее кодировать и извлекать информацию, когда их внимание разделено, другие исследования не обнаружили значимых различий с более молодыми людьми. Точно так же можно было бы ожидать, что пожилые люди будут плохо справляться с задачами, требующими устойчивого внимания, которые измеряют способность обращать внимание на раздражители и реагировать на них в течение длительного периода времени. Однако исследования показывают, что устойчивое внимание не снижается с возрастом. Результаты показывают, что устойчивое внимание усиливается в раннем взрослом возрасте, а затем остается относительно стабильным, по крайней мере, до середины восьмого десятилетия жизни. [57] Необходимы дополнительные исследования того, как нормальное старение влияет на внимание после восьмидесяти лет.
Стоит отметить, что существуют и другие факторы, помимо истинной способности к концентрации внимания, которые могут быть связаны с трудностями в концентрации внимания. Например, возможно, что сенсорный дефицит влияет на способность внимания пожилых людей. Другими словами, нарушение слуха или зрения может затруднить пожилым людям задачу успешного выполнения задач визуального и вербального внимания. [54]
Изменения в памяти
[ редактировать ]У человека идентифицировано множество различных типов памяти, таких как декларативная память (включая эпизодическую память и семантическую память ), рабочая память , пространственная память и процедурная память . [6] Проведенные исследования показали, что функции памяти, особенно те, которые связаны с медиальной височной долей , особенно уязвимы к возрастному ухудшению. [12] Ряд исследований с использованием различных методов, таких как гистологическая , структурная визуализация, функциональная визуализация и связывание рецепторов , предоставили сходные доказательства того, что лобные доли и лобно-стриарные дофаминергические пути особенно подвержены возрастным процессам, приводящим к изменениям памяти. [6]
Изменения в языке
[ редактировать ]Изменения в выполнении вербальных задач, а также расположение, степень и интенсивность ЖИРНЫХ изменений сигнала, измеренных с помощью функциональной МРТ , изменяются по предсказуемым закономерностям с возрастом. Например, поведенческие изменения, связанные с возрастом, включают снижение производительности при выполнении задач, связанных с поиском слов, пониманием предложений с высокими требованиями к синтаксической и/или рабочей памяти и составлением таких предложений. [58]
Паттерны активации мозга
[ редактировать ]Левое нижнее лобное соединение и левое переднее клинье / предклинье были единственными областями в более широком наборе областей, связанных с управляющими функциями , которые постоянно демонстрировали возрастные различия в активности мозга. [59]
Изменения в обучении и поведенческой гибкости
[ редактировать ]Обучение часто более эффективно у детей и с возрастом занимает больше времени или становится более трудным. Исследование с использованием нейровизуализации выявило быстрое усиление нейромедиатора ГАМК в качестве основного потенциального компонента объяснения того, почему это происходит. [60] [61]
Поведенческая гибкость может относиться к эффективной и надлежащей адаптации к различным ситуациям и изменяющимся требованиям окружающей среды, включая скорость адаптации, а также к способности находить решения новых проблем или новые решения старых проблем. [62] [63] Исследования указывают на позднюю стадию старения и/или деменцию в позднем возрасте. [62] снижает поведенческую гибкость и мешает обдумыванию дальнейших действий. [64] [65]
Генетические изменения
[ редактировать ]Различия в последствиях старения среди людей можно объяснить как генетическими факторами, факторами здоровья и окружающей среды . Как и во многих других научных дисциплинах, дебаты о природе и воспитании являются постоянным конфликтом в области когнитивной нейробиологии . [19] [20] Поиск генетических факторов всегда был важным аспектом в попытках понять нейропатологические процессы. Исследования, направленные на обнаружение генетического компонента развития аутосомно-доминантного заболевания (АД), также внесли большой вклад в понимание генетики, лежащей в основе нормального или «непатологического» старения. [20]
- Аутосомно-доминантный (АД) – Аутосомно-доминантный тип наследования, характерный для некоторых генетических нарушений. « Аутосомный » означает, что рассматриваемый ген расположен на одной из пронумерованных, или неполовых, хромосом. « Доминантный » означает, что одной копии мутировавшего гена (от одного родителя) достаточно, чтобы вызвать заболевание.
Человеческий мозг демонстрирует снижение функций и изменение экспрессии генов . Эта модуляция экспрессии генов может быть связана с окислительным повреждением ДНК в промоторных областях генома. [28] Гены, активность которых снижается после 40 лет, включают:
- GluR1 рецептора AMPA Субъединица
- Субъединица рецептора NMDA R2A (участвует в обучении )
- Субъединицы рецептора ГАМК-А
- Гены, участвующие в долговременной потенциации, например кальмодулин 1 и CaM-киназа II альфа.
- передачи сигналов кальция Гены
- синаптической пластичности Гены
- синаптических пузырьков Гены высвобождения и рециркуляции
Гены, которые активируются, включают:
- Гены, связанные с реакцией на стресс и восстановлением ДНК
- Антиоксидантная защита
Измерение
[ редактировать ]Эпигенетический возрастной анализ областей мозга
[ редактировать ]Мозжечок является самой молодой областью мозга (и, вероятно, частью тела) у долгожителей согласно эпигенетическому биомаркеру тканевого возраста, известному как эпигенетические часы : он примерно на 15 лет моложе, чем ожидалось у долгожителей. [66] Напротив, у субъектов моложе 80 лет все области мозга и клетки мозга имеют примерно одинаковый эпигенетический возраст. [66] [67] Эти данные свидетельствуют о том, что мозжечок лучше защищен от эффектов старения, что, в свою очередь, может объяснить, почему в мозжечке наблюдается меньше нейропатологических признаков возрастной деменции по сравнению с другими областями мозга.
Другой
[ редактировать ]Идут исследования и разработки биомаркеров старения , систем обнаружения и программного обеспечения для измерения биологического возраста мозга. Например, программное обеспечение глубокого обучения , использующее анатомические магнитно-резонансные изображения, оценивало возраст мозга с относительно высокой точностью, включая обнаружение ранних признаков болезни Альцгеймера и различных нейроанатомических моделей неврологического старения. [68]
Замедление последствий старения
[ редактировать ]Современное состояние биомедицинских технологий не позволяет остановить и повернуть вспять старение. Тем не менее, потенциально можно отсрочить последствия и тяжесть симптомов.Несмотря на отсутствие единого мнения об эффективности, сообщается, что следующие факторы замедляют снижение когнитивных функций:
- Высокий уровень образования [20] [69]
- Физические упражнения [70] [71] [72]
- Оставаться интеллектуально занятым, то есть чтением и умственной деятельностью (например, разгадыванием кроссвордов) [73] [71]
- Поддержание социальных и дружеских сетей [74] [71]
- Поддержание здорового питания , включая жирные кислоты омега-3 , [75] [76] [77] защитные антиоксиданты [19] и, например, флавонолы продукты, содержащие [78] а также потенциально антоцианы и флаваноны содержащие [79] [80] как, в более общем плане, средиземноморская диета [81] [82]
- Ограничение стресса, достаточный сон, устранение сенсорных нарушений , отказ от курения, ограничение употребления алкоголя, защита мозга, лечение сердечно-сосудистых заболеваний. факторов риска [71]
- Отказ от антихолинергических препаратов [71]
- Ряд фармакологические стратегии находятся в стадии изучения, включая никотинамидрибозид [72] [83]
- Ограничение калорий и периодическое голодание [72] [ необходимы дополнительные ссылки ]
- Микробиом . также играет роль Ученые показали, что трансплантация фекальной микробиоты от молодых мышей-доноров старым мышам-реципиентам существенно омолаживает мозга биомаркеры последних. [84] дополняя аналогичные результаты исследования 2020 года. [85] Диета и другие факторы влияют на микробиом. Пробиотики, такие как L. plantarum, также могут иметь соответствующие эффекты. [86]
Когнитивный резерв
[ редактировать ]Способность человека не демонстрировать никаких когнитивных признаков старения, несмотря на старение мозга, называется когнитивным резервом. [22] [69] Эта гипотеза предполагает, что у двух пациентов может быть одна и та же патология головного мозга: у одного наблюдаются заметные клинические симптомы, а другой продолжает функционировать относительно нормально. Исследования когнитивного резерва изучают конкретные биологические, генетические и экологические различия, которые делают некоторых людей более устойчивыми к снижению когнитивных функций, чем другие.
Исследовать
[ редактировать ]"Супер Эйджерс"
[ редактировать ]В ходе продольных исследований недавно был проведен анализ долгожителей генетический и их потомков с целью выявления защитных факторов от негативных последствий старения. В частности, ген CETP связан с предотвращением снижения когнитивных функций и болезни Альцгеймера. [87] В частности, по валину CETP у гомозигот , но не у гетерозигот, наблюдалось относительное снижение памяти на 51% меньше по сравнению с контрольной группой после поправки на демографические факторы и статус APOE . [87]
Монахиня исследование
[ редактировать ]Исследование, финансируемое Национальным институтом старения (NIA), началось в 1986 году и охватило группу из 678 сестер-католиков и зафиксировало последствия старения. Исследователи использовали автобиографические очерки, собранные, когда монахини присоединились к своему сестричеству. Результаты показывают, что ранняя плотность идей, определяемая количеством высказанных идей и использованием сложных предлогов в этих эссе, была важным предиктором более низкого риска развития болезни Альцгеймера в пожилом возрасте. Было обнаружено, что более низкая плотность идей в значительной степени связана с меньшим весом мозга, более высокой церебральной атрофией и большим количеством нейрофибриллярных клубков . [88]
В 1994 году изучение религиозных орденов началось . Его первоначальное финансирование также было предоставлено NIA.
Воспаление гипоталамуса и ГнРГ
[ редактировать ]В исследовании 2013 года было высказано предположение, что воспаление гипоталамуса может быть связано с общим старением нашего тела. Они сосредоточились на активации белкового комплекса NF-κB у мышей-испытуемых, которая показала повышенную активацию по мере старения мышей-испытуемых в исследовании. Эта активация не только влияет на старение, но и влияет на гормон, известный как GnRH , который проявляет новые антивозрастные свойства при введении мышам вне гипоталамуса, вызывая при этом противоположный эффект при введении в гипоталамус. Пройдет некоторое время, прежде чем это можно будет осмысленно применить к людям, поскольку необходимы дополнительные исследования этого пути, чтобы понять механику антивозрастных свойств ГнРГ. [89]
Воспаление
[ редактировать ]Исследование показало, что миелоидные клетки являются движущей силой неадаптивного воспаления, мозга вызывающего старение у мышей, и что это можно обратить вспять или предотвратить путем ингибирования передачи сигналов EP2. [90] [91]
Цереброспинальная жидкость
[ редактировать ]
Исследование показало, что введение питательной спинномозговой жидкости из клеток головного мозга молодых мышей в старый мозг омолаживает отдельные части мозга, доказывая, что она играет роль в старении мозга, и, среди прочего, идентифицируя белок FGF17 как ключевую мишень для потенциальных терапевтических средств, в том числе для борьбы со старением . [92]
Субарахноидальная лимфатическая мембрана , об открытии которой сообщалось около 2023 года, вероятно, играет роль в функциях спинномозговой жидкости и, будучи одновременно защитным барьером и множеством иммунных клеток, которые контролируют мозг на наличие инфекций и воспалений , по-видимому, существенно участвует в основные заболевания головного мозга и старение мозга. Это «хозяин большой популяции миелоидных клеток ». ], количество которых увеличивается в ответ на воспаление и старение». [93]
Возрастные различия
[ редактировать ]Для определенных демографических групп последствия нормального когнитивного старения особенно выражены. Различия в когнитивном старении могут быть связаны с отсутствием или ограниченным доступом к медицинской помощи и, как следствие, непропорционально тяжелыми последствиями для здоровья. По мере того, как население мира растет, диверсифицируется и стареет, растет потребность в понимании этого неравенства. [ нужна ссылка ]
Раса
[ редактировать ]Афроамериканцы
[ редактировать ]
В Соединенных Штатах чернокожие и афроамериканцы непропорционально часто страдают от метаболических нарушений с возрастом. Это имеет множество последствий, но наиболее заметным из них является ущерб для здоровья сердечно-сосудистой системы . Метаболитные профили индекса здорового старения — показателя, который оценивает нейрокогнитивную функцию, среди других показателей здоровья на протяжении многих лет, — связаны с сердечно-сосудистыми заболеваниями. [95] Здоровая сердечно-сосудистая функция имеет решающее значение для поддержания нейрокогнитивной эффективности в пожилом возрасте. Внимание , вербальное обучение и когнитивные способности связаны с диастолическим артериальным давлением , уровнем триглицеридов и уровнем холестерина ЛПВП соответственно. [96]
латиноамериканцы
[ редактировать ]В США у латиноамериканцев чаще всего развивается метаболический синдром – сочетание высокого кровяного давления , высокого уровня сахара в крови , повышенного уровня триглицеридов и абдоминального ожирения – который не только увеличивает риск сердечных заболеваний и диабета 2 типа , но и связано со снижением нейрокогнитивной функции в среднем возрасте. [97] Это происходит даже несмотря на то, что продолжительность жизни латиноамериканцев в США выше, чем у белых и черных. [98] [99]
Среди различных латиноамериканцев частота предрасполагающего к деменции аллеля ε4 гена apoE4 была самой высокой у латиноамериканцев Карибского бассейна ( кубинцы , доминиканцы , пуэрториканцы , 12,6–17,5%) и самой низкой среди латиноамериканцев с материка ( мексиканцы , выходцы из Центральной Америки и Южной Америки , 11,0% ). –11,2 %). В то же время частота нейропротекторного аллеля ε2 также была самой высокой у выходцев из Карибского бассейна (5,2–8,6 %) и самой низкой у выходцев с материка (2,9–3,9 %). Среди латиноамериканцев материкового региона наиболее распространенным является «средний» аллель ε3: 85,2–86,2% по сравнению с 73,9–81,5% среди латиноамериканцев Карибского бассейна. [100]
Коренные народы
[ редактировать ]Коренные народы часто недостаточно изучаются в исследованиях. Обзоры современной литературы по изучению коренных жителей Австралии, Бразилии, Канады и США среди участников в возрасте от 45 до 94 лет показывают различные уровни распространенности когнитивных нарушений, не связанных с деменцией, от 4,4% до 17,7%. [101] Эти результаты можно интерпретировать в контексте нейрокогнитивных тестов, предвзятых в зависимости от культуры, существующих заболеваний, плохого доступа к здравоохранению, низкого уровня образования и/или старости. [102]
Секс
[ редактировать ]
По сравнению с их коллегами-мужчинами, баллы женщин по мини-экзамену психического состояния (MMSE) имеют тенденцию снижаться с возрастом несколько более быстрыми темпами. [103] Мужчины с легкими когнитивными нарушениями, как правило, демонстрируют больше микроструктурных повреждений, чем женщины с MCI, но, по-видимому, имеют больший когнитивный резерв из-за большего абсолютного размера мозга и плотности нейронов. В результате у женщин, как правило, симптомы снижения когнитивных функций проявляются при более низких порогах, чем у мужчин. [104] Этот эффект, по-видимому, смягчается уровнем образования : высшее образование связано с более поздней диагностикой легких когнитивных нарушений по мере увеличения нейропатологической нагрузки. [105] В настоящее время нет известных исследований, позволяющих выявить характерную закономерность снижения когнитивных функций с возрастом у трансгендеров .
Социально-экономические факторы
[ редактировать ]Социально-экономический статус – это взаимодействие социальных и экономических факторов. Было продемонстрировано, что социально-демографические факторы могут в некоторой степени использоваться для прогнозирования когнитивных профилей пожилых людей. [106] Это может быть связано с тем, что семьи с более высоким социально-экономическим статусом (СЭС) готовы предоставить своим детям ресурсы на раннем этапе, способствующие когнитивному развитию. Для детей в семьях с низким СЭС относительно небольшие изменения в доходе родителей были связаны с большими изменениями площади поверхности мозга; эти потери наблюдались в областях, связанных с языком, чтением, исполнительными функциями и пространственными навыками. Между тем, для детей в семьях с высоким СЭП небольшие изменения в доходе родителей были связаны с небольшими изменениями площади поверхности внутри этих регионов. [107] Что касается глобальной толщины коры, у детей с низким SES наблюдалось криволинейное уменьшение толщины с возрастом, тогда как у детей с высоким SES наблюдалось более крутое линейное снижение, что позволяет предположить, что синаптическая обрезка более эффективна в последней группе. Эта тенденция была особенно очевидна в левой веретенообразной и левой верхней височной извилине — критических областях, поддерживающих речь и грамотность. [108]
Исследование показало, что у пользователей диетической программы SNAP в возрасте 50+ «было примерно на 2 года меньше когнитивного старения за 10-летний период по сравнению с теми, кто не пользовался ею», несмотря на то, что в ней практически не было условий для устойчивости и здоровья приобретенных пищевых продуктов. с купонами (или купонами-кредитами). [109] [110]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Гаспар-Сильва, Филипа; Триго, Диого; Магальяйнс, Жоана (24 июня 2023 г.). «Старение мозга: механизмы и стратегии омоложения» . Клеточные и молекулярные науки о жизни . 80 (7): 190. дои : 10.1007/s00018-023-04832-6 . ПМЦ 10290611 . ПМИД 37354261 .
- ^ Каммингс, Джеффри Л. (8 мая 2002 г.). «Болезнь Альцгеймера» . ДЖАМА . 287 (18): 2335–2338. дои : 10.1001/jama.287.18.2335 . ISSN 0098-7484 . ПМИД 11988038 .
- ^ Уиндер, Ник Р.; Рив, Эмили Х.; Уокер, Эшли Э. (01 января 2021 г.). «Жесткость крупных артерий и здоровье мозга: данные моделей на животных» . Американский журнал физиологии. Физиология сердца и кровообращения . 320 (1): H424–H431. doi : 10.1152/ajpheart.00696.2020 . ISSN 0363-6135 . ПМЦ 7847068 . ПМИД 33164578 .
- ^ Кадаккужа, Бина М; Ахмедов, Комолитдин (14 декабря 2013 г.). «Возрастная двунаправленная модуляция экспрессии генов в одном идентифицированном нейроне R15 аплизии» . БМК Геномика . 14 (1): 880. дои : 10.1186/1471-2164-14-880 . ПМЦ 3909179 . ПМИД 24330282 .
- ^ Рейтер-Лоренц, Патрисия А.; Парк, Дениз К. (1 сентября 2014 г.). «Как это происходит? Возвращаясь к теории старения и познания» . Обзор нейропсихологии . 24 (3): 355–370. дои : 10.1007/s11065-014-9270-9 . ISSN 1573-6660 . ПМК 4150993 . ПМИД 25143069 .
- ^ Jump up to: а б с д и Крейк, Ф.; Солтхаус, Т. (2000). Справочник по старению и познанию (2-е изд.). Махва, Нью-Джерси: Лоуренс Эрлбаум. ISBN 0-8058-2966-0 . OCLC 44957002 .
- ^ Раз, Нафтали; и др. (2005). «Региональные изменения мозга у стареющих здоровых взрослых: общие тенденции, индивидуальные различия и модификаторы» . Кора головного мозга . 15 (11): 1676–1689. дои : 10.1093/cercor/bhi044 . hdl : 11858/00-001M-0000-0025-8479-B . ПМИД 15703252 .
- ^ Раз, Нафтали; Родриг, Карен М. (2006). «Дифференциальное старение мозга: закономерности, когнитивные корреляты и модификаторы» (PDF) . Неврологические и биоповеденческие обзоры . 30 (6): 730–748. doi : 10.1016/j.neubiorev.2006.07.001 . ПМК 6601348 . ПМИД 16919333 . Архивировано из оригинала (PDF) 23 июля 2011 года . Проверено 28 января 2010 г.
- ^ Колб, Брайан; Уишоу, Ян К. (1998). «Пластичность мозга и поведение» (PDF) . Ежегодный обзор психологии . 49 (1): 43–64. дои : 10.1146/annurev.psych.49.1.43 . hdl : 2027.42/74427 . ПМИД 9496621 .
- ^ Колб, Брайан; Гибб, Роббин; Робинсон, Терри Э. (2003). «Пластичность мозга и поведение» (PDF) . Современные направления психологической науки . 12 (1): 1–5. дои : 10.1111/1467-8721.01210 . hdl : 2027.42/74427 . ISSN 0963-7214 . S2CID 204347081 .
- ^ Jump up to: а б Барнс, К.; Берк, С. (2006). «Нейральная пластичность в стареющем мозге». Обзоры природы Неврология . 7 (1): 30–40. дои : 10.1038/nrn1809 . ПМИД 16371948 . S2CID 1784238 .
- ^ Jump up to: а б с д и Хоф PR, Моррисон Дж. Х. (октябрь 2004 г.). «Стареющий мозг: морфомолекулярное старение корковых цепей». Тенденции в нейронауках . 27 (10): 607–13. дои : 10.1016/j.tins.2004.07.013 . ПМИД 15374672 . S2CID 31680049 .
- ^ Jump up to: а б с д Соуэлл Э.Р., Петерсон Б.С., Томпсон П.М., Добро пожаловать С.Е., Хенкениус А.Л., Тога А.В. (март 2003 г.). «Картирование корковых изменений на протяжении всей жизни человека». Природная неврология . 6 (3): 309–15. дои : 10.1038/nn1008 . ПМИД 12548289 . S2CID 23799692 .
- ^ Тао Лю; Вэй Вэнь; Ваньлинь Чжу; Джулиан Троллор; Симона Реппермунд; Джон Кроуфорд; Джесси С. Джин; Сухуай Ло; Генри Бродати; Перминдер Сачдев (2010). «Влияние возраста и пола на корковые борозды у пожилых людей». НейроИмидж . 51 (1): 19–27. doi : 10.1016/j.neuroimage.2010.02.016 . ПМИД 20156569 . S2CID 8158316 .
- ^ Тао Лю; Вэй Вэнь; Ваньлинь Чжу; Николь А. Кочан; Джулиан Н. Троллор; Симона Реппермунд; Джесси С. Джин; Сухуай Ло; Генри Бродати; Перминдер С. Сачдев (2011). «Взаимосвязь между изменчивостью кортикальной борозды и когнитивными способностями у пожилых людей». НейроИмидж . 56 (3): 865–873. doi : 10.1016/j.neuroimage.2011.03.015 . ПМИД 21397704 . S2CID 7489380 .
- ^ Дин, Сяо-Ци; Модсли, Эндрю А.; Сабати, Мохаммед; Шериф Сулейман; Шмитц, Бирте; Шютце, Мартин; Бронзлик, Пол; Каль, Кай Г.; Ланферманн, Генрих (15 августа 2016 г.). «Физиологическое снижение нейронов в мозге здорового стареющего человека — исследование in vivo с использованием МРТ и короткой эхо-спектроскопической визуализации всего мозга 1H» . НейроИмидж . 137 : 45–51. doi : 10.1016/j.neuroimage.2016.05.014 . ISSN 1053-8119 . ПМЦ 4914466 . ПМИД 27164326 .
- ^ Пини, Лоренцо; Пиевани, Микела; Боккетта, Мартина; Альтомаре, Даниэле; Боско, Паоло; Каведо, Энрика; Галлуцци, Саманта; Мариццони, Мойра; Фризони, Джованни Б. (1 сентября 2016 г.). «Атрофия мозга при болезни Альцгеймера и старении». Обзоры исследований старения . 30 :25–48. дои : 10.1016/J.arr.2016.01.002 . ISSN 1568-1637 . ПМИД 26827786 . S2CID 42793845 .
- ^ Хабес М., Яновиц Д., Эрус Г., Толедо Дж.Б., Резник С.М., Доши Дж., Ван дер Аувера С., Виттфельд К., Хегеншайд К., Хостен Н., Биффар Р., Хомут Г., Вёльцке Х., Грабе Х.Дж., Хоффманн В., Давацикос К. ( 2016). «Прогрессирующее старение мозга: связь с эпидемиологическими и генетическими факторами риска, а также совпадение с моделями атрофии болезни Альцгеймера» . Трансляционная психиатрия . 6 (4): е775. дои : 10.1038/tp.2016.39 . ПМЦ 4872397 . ПМИД 27045845 .
- ^ Jump up to: а б с Габриэли, Дж.; Хедден, Т. (2004). «Взгляд на стареющий разум: взгляд когнитивной нейробиологии». Обзоры природы Неврология . 5 (2): 87–96. дои : 10.1038/nrn1323 . ПМИД 14735112 . S2CID 9398942 .
- ^ Jump up to: а б с д и Андертон Б.Х. (апрель 2002 г.). «Старение мозга». Механизмы старения и развития . 123 (7): 811–7. дои : 10.1016/S0047-6374(01)00426-2 . ПМИД 11869738 . S2CID 43097130 .
- ^ Jump up to: а б с Дэвис, П.; Моррис, Дж.; и др. (1991). «Распределение клубков, бляшек и связанных с ними иммуногистохимических маркеров при здоровом старении и болезни Альцгеймера». Нейробиология старения . 12 (4): 295–312. дои : 10.1016/0197-4580(91)90006-6 . ПМИД 1961359 . S2CID 4060446 .
- ^ Jump up to: а б Уолли Л.Дж., Дири И.Дж., Эпплтон К.Л., Старр Дж.М. (ноябрь 2004 г.). «Когнитивный резерв и нейробиология когнитивного старения». Обзоры исследований старения . 3 (4): 369–82. doi : 10.1016/J.arr.2004.05.001 . ПМИД 15541707 . S2CID 6629858 .
- ^ «Окислительный стресс» . Медицинский словарь Мерриам-Вебстера . Проверено 24 июня 2023 г.
- ^ Jump up to: а б Келлер Дж.Н., Шмитт Ф.А., Шефф С.В. и др. (апрель 2005 г.). «Доказательства увеличения окислительного повреждения у субъектов с легкими когнитивными нарушениями» (PDF) . Неврология . 64 (7): 1152–6. дои : 10.1212/01.WNL.0000156156.13641.BA . ПМИД 15824339 . S2CID 398262 .
- ^ Jump up to: а б Харрис С.Э., Дири И.Дж., Макинтайр А. и др. (октябрь 2006 г.). «Связь между длиной теломер, физическим здоровьем, когнитивным старением и смертностью у пожилых людей без слабоумия». Письма по неврологии . 406 (3): 260–4. дои : 10.1016/j.neulet.2006.07.055 . ПМИД 16919874 . S2CID 24592571 .
- ^ Бернштейн Х., Пейн С.М., Бернштейн С., Гаревал Х., Дворжак К. (2008)Рак и старение как последствия невосстановленного повреждения ДНК. В: Новое исследование повреждения ДНК (редакторы: Хонока Кимура и Аой Судзуки) Nova Science Publishers, Inc. , Нью-Йорк, глава 1, стр. 1–47. см. стр. 18. ISBN 978-1-60456-581-2
- ^ Мандавилли Б.С., Рао КС (1996). «Накопление повреждений ДНК в стареющих нейронах происходит по механизму, отличному от апоптоза». Дж. Нейрохем . 67 (4): 1559–65. дои : 10.1046/j.1471-4159.1996.67041559.x . ПМИД 8858940 . S2CID 42442582 .
- ^ Jump up to: а б Лу Т., Пан Ю., Као С.Ю., Ли С., Кохане И., Чан Дж., Янкнер Б.А. (2004). «Регуляция генов и повреждение ДНК в стареющем человеческом мозге». Природа . 429 (6994): 883–891. Бибкод : 2004Natur.429..883L . дои : 10.1038/nature02661 . ПМИД 15190254 . S2CID 1867993 .
- ^ Моу, Йи; Ду, Ю; Чжоу, Лисинг; Юэ, Джижун; Ху, Сяньлян; Лю, Исинь; Чен, Сао; Линь, Сюфан; Чжан, Гунчанг; Сяо, Хэнъи; Донг, Биронг (2022). «Микробиота кишечника взаимодействует с мозгом посредством системного хронического воспаления: влияние на нейровоспаление, нейродегенерацию и старение» . Границы в иммунологии . 13 : 796288. дои : 10.3389/fimmu.2022.796288 . ISSN 1664-3224 . ПМК 9021448 . PMID 35464431 .
- ^ Инь, Фэй; Санчети, Харш; Патил, Ишан; Каденас, Энрике (1 ноября 2016 г.). «Энергетический обмен и воспаление при старении мозга и болезни Альцгеймера» . Свободнорадикальная биология и медицина . 100 : 108–122. doi : 10.1016/j.freeradbiomed.2016.04.200 . ISSN 0891-5849 . ПМК 5094909 . ПМИД 27154981 .
- ^ Графф, Барнаби Дж.; Харрисон, Стефани Л.; Пейн, Стивен Дж.; Эль-Бури, Вахби К. (2023). «Региональные изменения мозгового кровотока при здоровом старении и болезни Альцгеймера: обзор повествования» . Цереброваскулярные заболевания . 52 (1): 11–20. дои : 10.1159/000524797 . ISSN 1015-9770 . ПМИД 35640565 . S2CID 249236311 .
- ^ Бенвенист, Элен; Лю, Сяодань; Кундал, Сунил; Санггаард, Саймон; Ли, Хедок; Уордлоу, Джоанна (2019). «Глимфатическая система и очистка отходов при старении мозга: обзор» . Геронтология . 65 (2): 106–119. дои : 10.1159/000490349 . ISSN 0304-324X . ПМК 6329683 . ПМИД 29996134 .
- ^ Висс-Корей, Тони (ноябрь 2016 г.). «Старение, нейродегенерация и омоложение мозга» . Природа . 539 (7628): 180–186. Бибкод : 2016Natur.539..180W . дои : 10.1038/nature20411 . ISSN 1476-4687 . ПМК 5172605 . ПМИД 27830812 .
- ^ Моббс, Чарльз В.; Хоф, Патрик Р. (2009). Справочник по нейробиологии старения . Амстердам: Elsevier/Academic Press. ISBN 978-0-12-374898-0 . OCLC 299710911 .
- ^ Ота, М.; Ясуно, Ф.; Ито, Х.; Секи, К.; Козаки, С.; Асада, Т.; Сухара, Т. (2006). «Возрастное снижение синтеза дофамина в мозге живого человека, измеренное с помощью позитронно-эмиссионной томографии с L-[β- 11 C]DOPA». Life Sciences . 79 (8): 730–736. doi : 10.1016/j.lfs.2006.02.017 . PMID 16580023 .
- ^ Jump up to: а б Каасинен, В.; Вилкман, Х.; Хиетала, Дж.; Ногрен, К.; Хелениус, Х.; Олссон, Х.; Фарде, Л.; Ринне, ДЖО (2000). «Возрастная потеря дофаминовых рецепторов D2/D3 в экстрастриарных областях человеческого мозга». Нейробиология старения . 21 (5): 683–688. дои : 10.1016/S0197-4580(00)00149-4 . ПМИД 11016537 . S2CID 40871554 .
- ^ Jump up to: а б с Ван Ю, Чан Г.Л., Холден Дж.Э. и др. (сентябрь 1998 г.). «Возрастное снижение дофаминовых рецепторов D1 в мозге человека: исследование ПЭТ». Синапс . 30 (1): 56–61. doi : 10.1002/(SICI)1098-2396(199809)30:1<56::AID-SYN7>3.0.CO;2-J . ПМИД 9704881 . S2CID 31445572 .
- ^ Jump up to: а б с Айо, М.; Ямасаки, Т. (1993). «Обнаружение возрастного снижения рецепторов дофамина, D1, D2 и серотонина 5-HT2 в мозге живого человека». Прогресс нейропсихофармакологии и биологической психиатрии . 17 (3): 415–421. дои : 10.1016/0278-5846(93)90075-4 . ПМИД 8475323 . S2CID 20933930 .
- ^ Jump up to: а б Ринне, Юха О.; Лоннберг, Пиркко; Марьямайки, Паиви (1989). «Возрастное снижение дофаминовых рецепторов D1 и D2 в мозге человека». Исследования мозга . 508 (2): 349–352. дои : 10.1016/0006-8993(90)90423-9 . ПМИД 2407314 . S2CID 39023717 .
- ^ Jump up to: а б с Вонг, Д.Ф.; и др. (1984). «Влияние возраста на рецепторы дофамина и серотонина, измеренное с помощью позитронной томографии в мозгу живого человека». Наука . 226 (4681): 1393–1396. Бибкод : 1984Sci...226.1393W . дои : 10.1126/science.6334363 . ПМИД 6334363 . S2CID 24278577 .
- ^ Jump up to: а б Ван, Э.; Снайдер, С.Д. (1998). Справочник стареющего мозга . Сан-Диего, Калифорния: Academic Press. ISBN 0-12-734610-4 . OCLC 636693117 .
- ^ Ямамото, М.; Сухара, Т.; Окубо, Ю.; Ичимия, Т.; Судо, Ю.; Иноуэ, Ю.; Такано, А.; Ясуно, Ф.; Ёсикава, К.; Танада, С. (2001). «Возрастное снижение количества переносчиков серотонина в мозге живого человека здоровых мужчин». Науки о жизни . 71 (7): 751–757. дои : 10.1016/S0024-3205(02)01745-9 . ПМИД 12074934 .
- ^ Маркуссон, Дж.; Орланд, Л.; Винблад, Б. (1984). «Влияние возраста на участки связывания серотонина (S-1) головного мозга человека». Журнал нейрохимии . 43 (6): 1699–1705. дои : 10.1111/j.1471-4159.1984.tb06098.x . ПМИД 6491674 . S2CID 36750403 .
- ^ Jump up to: а б с Чанг Л., Цзян К.С., Эрнст Т. (январь 2009 г.). «Влияние возраста и пола на глутамат мозга и другие метаболиты» . Магнитно-резонансная томография . 27 (1): 142–5. дои : 10.1016/j.mri.2008.06.002 . ПМК 3164853 . ПМИД 18687554 .
- ^ Jump up to: а б Сайласута Н., Эрнст Т., Чанг Л. (июнь 2008 г.). «Региональные различия и влияние возраста и пола на концентрацию глютамата в человеческом мозге» . Магнитно-резонансная томография . 26 (5): 667–75. дои : 10.1016/j.mri.2007.06.007 . ПМК 2712610 . ПМИД 17692491 .
- ^ Jump up to: а б Кайзер Л.Г., Шуфф Н., Кэшдоллар Н., Вайнер М.В. (май 2005 г.). «Возрастные изменения концентрации глутамата и глутамина в мозге нормального человека: исследование 1H-МР-спектроскопии при 4 Т» . Нейробиология старения . 26 (5): 665–72. doi : 10.1016/j.neurobiolaging.2004.07.001 . ПМЦ 2443746 . ПМИД 15708441 .
- ^ Лезак, доктор медицины; Ховисон, Д.Б.; Лоринг, Д.В. (2004). Нейропсихологическая оценка (4-е изд.). Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-511121-7 .
- ^ Альверзо Дж.П. (2006). «Обзор литературы по ориентации как показателю уровня сознания». Журнал стипендий медсестер . 38 (2): 159–164. дои : 10.1111/j.1547-5069.2006.00094.x . ПМИД 16773920 .
- ^ Брочи, Дж.; Бреннан, Дж.; Уайк, М. (1985). «Временная ориентация в пресеннем и старческом возрасте». Британский журнал психиатрии . 147 (6): 692–695. дои : 10.1192/bjp.147.6.692 . ПМИД 3830331 . S2CID 28550165 .
- ^ Хопп, Джорджия; Диксон, РА; Грут, М.; Бачекман, Л. (1997). «Продольные и психометрические профили двух тестов когнитивного статуса у очень пожилых людей». Журнал клинической психологии . 53 (7): 673–686. doi : 10.1002/(sici)1097-4679(199711)53:7<673::aid-jclp5>3.0.co;2-j . ПМИД 9356897 .
- ^ Бентон, Алабама; Эслингер, П.; Дамасио, А. (1981). «Нормативные наблюдения за показателями нейропсихологических тестов в пожилом возрасте». Журнал клинической нейропсихологии . 3 (1): 33–42. дои : 10.1080/01688638108403111 . ПМИД 7276195 .
- ^ Ишизаки, Дж.; Мэгуро, К.; Амбо, Х.; Шимада, М.; Ямагучи, С.; Харасака, К.; и др. (1998). «Нормативное общинное исследование мини-психического состояния пожилых людей: влияние возраста и уровня образования» . Журналы геронтологии: серия B. 53 (6): 359–363. дои : 10.1093/geronb/53b.6.p359 . ПМИД 9826967 .
- ^ Jump up to: а б Мило, Джей-Джей; Такой, Ю.; Лихи, Б.; Абрамовиц, К.; Новински, CJ (1999). «Нормативные клинические связи между ориентацией и памятью: возраст как важная переменная-модератор». Клинический нейропсихолог . 13 (4): 495–508. doi : 10.1076/1385-4046(199911)13:04;1-y;ft495 . ПМИД 10806463 .
- ^ Jump up to: а б Кенсинджер, Э.А. (2009). Познание при старении и возрастных заболеваниях. В PR Hof & CV Mobbs (ред.), Справочник по нейробиологии старения (249-256) . Лондон: Эльзевир Пресс.
- ^ Банич, Монтана; Комптон, Р.Дж. (2011). Когнитивная нейробиология . Бельмонт, Калифорния: Уодсворт. п. 334.
- ^ Лайт, LL (1991). «Память и старение: четыре гипотезы в поисках данных». Ежегодный обзор психологии . 42 : 333–376. дои : 10.1146/annurev.ps.42.020191.002001 . ПМИД 2018397 .
- ^ Перевозчик, JSA; Чейн, А.; Солман, GJF; Смилек, Д. (2010). «Возрастные тенденции нарушений устойчивого внимания». Психология и старение . 25 (3): 569–574. дои : 10.1037/a0019363 . ПМИД 20677878 .
- ^ Кроссон Б., Гарсия А., Макгрегор К. и Виренга CE (2013). Влияние старения на нейронные системы языка. В MFG Сандра Коффлер, Джоэл Морган, Ида Сью Бэрон (ред.), Нейропсихология, Том 1 (стр. 149–187). Издательство Оксфордского университета. ISBN 9780199794317
- ^ Хекнер, Мариса К.; Чеслик, Эдна С.; Эйкхофф, Саймон Б.; Камиллери, Джулия А.; Хоффстедтер, Феликс; Лангнер, Роберт (1 августа 2021 г.). «Возвращение к старению мозга и исполнительным функциям: последствия метааналитических данных и данных о функциональной связности» . Журнал когнитивной нейронауки . 33 (9): 1716–1752. bioRxiv 10.1101/2020.15.07.204941 . дои : 10.1162/jocn_a_01616 . ПМЦ 8630425 . ПМИД 32762523 .
- ^ «Сканирование мозга проливает свет на то, почему дети учатся быстрее, чем взрослые» . УПИ . Проверено 17 декабря 2022 г.
- ^ Франк, Себастьян М.; Беккер, Маркус; Ци, Андреа; Гейгер, Патрисия; Франк, Ульрика И.; Роуздал, Люк А.; Маллони, Вильгельм М.; Сасаки, Юка; Гринли, Марк В.; Ватанабэ, Такео (5 декабря 2022 г.). «Эффективное обучение детей с быстрым повышением ГАМК во время и после тренировки» . Современная биология . 32 (23): 5022–5030.e7. bioRxiv 10.1101/2022.01.02.474022 . дои : 10.1016/j.cub.2022.10.021 . ISSN 0960-9822 . ПМИД 36384138 . S2CID 253571891 .
- ^ Jump up to: а б Уддин, Люсина К. (март 2021 г.). «Когнитивная и поведенческая гибкость: нейронные механизмы и клинические соображения» . Обзоры природы Неврология . 22 (3): 167–179. дои : 10.1038/s41583-021-00428-w . ISSN 1471-0048 . ПМЦ 7856857 . ПМИД 33536614 .
- ^ Оде, Жан-Николя; Лефевр, Луи (1 августа 2017 г.). «Что гибкого в поведенческой гибкости?» . Поведенческая экология . 28 (4): 943–947. дои : 10.1093/beheco/arx007 .
- ^ Бретон, Янник-Андре; Силанд, Келси Д.; Редиш, А. Дэвид (2015). «Старение ухудшает обдуманность и поведенческую гибкость при межвременном выборе» . Границы стареющей неврологии . 7:41 . дои : 10.3389/fnagi.2015.00041 . ISSN 1663-4365 . ПМЦ 4375985 . ПМИД 25870560 .
- ^ Ян, Вэньчжун; Чжоу, Сюэянь; Ма, Тао (2019). «Снижение памяти и поведенческая негибкость у пожилых мышей коррелируют с нарушением регуляции способности синтеза белка» . Границы стареющей неврологии . 11 :246. дои : 10.3389/fnagi.2019.00246 . ISSN 1663-4365 . ПМК 6737270 . ПМИД 31551760 .
- ^ Jump up to: а б Хорват С., Мах В., Лу А.Т., Ву Дж.С., Чой О.В., Ясинска А.Дж., Рианчо Дж.А., Тунг С., Коулз Н.С., Браун Дж., Винтерс Х.В., Коулз Л.С. (2015). «Мозжечок стареет медленно в соответствии с эпигенетическими часами» . Старение . 7 (5): 294–306. дои : 10.18632/aging.100742 . ПМЦ 4468311 . ПМИД 26000617 .
- ^ Хорват С (2013). «Возраст метилирования ДНК тканей и типов клеток человека» . Геномная биология . 14 (10): 115 р. дои : 10.1186/gb-2013-14-10-r115 . ПМК 4015143 . ПМИД 24138928 . (Ошибка: два : 10.1186/s13059-015-0649-6 , PMID 25968125 , Часы втягивания )
- ^ Инь, Чэньчжун; Иммс, Фиби; Ченг, Минси; и др. (10 января 2023 г.). «Анатомически интерпретируемое глубокое изучение возраста мозга фиксирует когнитивные нарушения, специфичные для конкретной области» . Труды Национальной академии наук . 120 (2): e2214634120. Бибкод : 2023PNAS..12014634Y . дои : 10.1073/pnas.2214634120 . ISSN 0027-8424 . ПМЦ 9926270 . ПМИД 36595679 .
- Пресс-релиз университета: «Сколько на самом деле лет вашему мозгу? Анализ с помощью искусственного интеллекта точно отражает риск снижения когнитивных функций и болезни Альцгеймера» . Университет Южной Калифорнии (medicalxpress.com) . Архивировано из оригинала 17 февраля 2023 года . Проверено 17 февраля 2023 г.
- Новостная статья об исследовании: «ИИ может определить истинный возраст мозга» . Deutschlandfunk Nova (на немецком языке). Архивировано из оригинала 17 февраля 2023 года . Проверено 17 февраля 2023 г.
- ^ Jump up to: а б Скармиас, Н.; Стерн, Ю. (2003). «Когнитивный резерв и образ жизни» . Журнал клинической и экспериментальной нейропсихологии . 25 (5): 625–633. дои : 10.1076/jcen.25.5.625.14576 . ПМК 3024591 . ПМИД 12815500 .
- ^ Бейкер, Л.Д.; Фрэнк, LL; Фостер-Шуберт, К.; Грин, PS; Уилинсон, CW; Мактирнан, А.; и др. (2010). «Влияние аэробных упражнений на когнитивные нарушения: контролируемое исследование» . Архив неврологии . 67 (1): 71–79. дои : 10.1001/archneurol.2009.307 . ПМК 3056436 . ПМИД 20065132 .
- ^ Jump up to: а б с д и Криванек, Тейлор Дж.; Гейл, Сет А.; Макфили, Бриттани М.; Никастри, Кейси М.; Даффнер, Кирк Р. (1 января 2021 г.). «Содействие успешному когнитивному старению: десятилетний обзор» . Журнал болезни Альцгеймера . 81 (3): 871–920. дои : 10.3233/JAD-201462 . ISSN 1387-2877 . ПМЦ 8293659 . ПМИД 33935078 .
- ^ Jump up to: а б с Мэттсон, Марк П.; Арумугам, Тирума В. (5 июня 2018 г.). «Признаки старения мозга: адаптивные и патологические модификации метаболических состояний» . Клеточный метаболизм . 27 (6): 1176–1199. дои : 10.1016/j.cmet.2018.05.011 . ISSN 1550-4131 . ПМК 6039826 . ПМИД 29874566 .
- ^ Холл, CB; Липтон, РБ; Сливински, М.; Кац, MJ; Дерби, Калифорния; Вергезе, Дж. (2009). «Когнитивная деятельность задерживает наступление ухудшения памяти у людей, у которых развивается деменция» . Неврология . 73 (5): 356–361. дои : 10.1212/wnl.0b013e3181b04ae3 . ПМК 2725932 . ПМИД 19652139 .
- ^ Барнс, LL; Мендес де Леон, CF; Уилсон, Р.С.; Биениас, JL ; Эванс, Д.А. (2004). «Социальные ресурсы и снижение когнитивных функций среди пожилых афроамериканцев и белых». Неврология . 63 (12): 2322–2326. дои : 10.1212/01.wnl.0000147473.04043.b3 . ПМИД 15623694 . S2CID 30469207 .
- ^ Чаппус-МакКенди, Хиллари; Шевалье, Лори; Роберж, Клод; Плурд, Мелани (30 августа 2019 г.). «Метаболизм ПНЖК омега-3 и изменения мозга при старении». Прогресс нейропсихофармакологии и биологической психиатрии . 94 : 109662. дои : 10.1016/j.pnpbp.2019.109662 . hdl : 11143/15833 . ISSN 0278-5846 . ПМИД 31152862 . S2CID 169031411 .
- ^ Дьялл, Саймон К. (2015). «Длинноцепочечные жирные кислоты омега-3 и мозг: обзор независимых и общих эффектов EPA, DPA и DHA» . Границы стареющей неврологии . 7:52 . дои : 10.3389/fnagi.2015.00052 . ISSN 1663-4365 . ПМК 4404917 . ПМИД 25954194 .
- ^ Денис, Изабель; Потье, Бриджит; Хеберден, Кристина; Ванкассель, Сильви (март 2015 г.). «Полиненасыщенные жирные кислоты омега-3 и старение мозга». Текущее мнение о клиническом питании и метаболической помощи . 18 (2): 139–146. дои : 10.1097/MCO.0000000000000141 . ISSN 1363-1950 . ПМИД 25501348 . S2CID 205780791 .
- ^ Холланд, Томас Монро; Агарвал, Пуджа; Ван, Ямин; Дхана, Клодиан; Леурганс, Сью Э.; Ши, Кайла; Бут, Сара Л.; Раджан, Кумар; Шнайдер, Джули А.; Барнс, Лиза Л. (22 ноября 2022 г.). «Связь потребления флавонолов с пищей с изменениями в глобальном познании и некоторых когнитивных способностях» (PDF) . Неврология . 100 (7): e694–e702. дои : 10.1212/WNL.0000000000201541 . ISSN 0028-3878 . ПМЦ 9969915 . ПМИД 36414424 . S2CID 253800625 .
- ^ Гарденер, Саманта Л.; Рейни-Смит, Стефани Р.; Вайнборн, Майкл; Бондонно, Кэтрин П.; Мартинс, Ральф Н. (3 сентября 2021 г.). «Потребление продуктов, содержащих антоцианы, флаванолы и флаваноны, и когнитивная функция: описательный обзор» . Границы стареющей неврологии . 13 : 640381. дои : 10.3389/fnagi.2021.640381 . ПМЦ 8446387 . ПМИД 34539375 .
- ^ Кент, К.; Чарльтон, Кентукки; Нетцель, М.; Фаннинг, К. (июнь 2017 г.). «Потребление антоцианов с пищей и когнитивные результаты в клинических исследованиях на людях: систематический обзор». Журнал человеческого питания и диетологии . 30 (3): 260–274. дои : 10.1111/jhn.12431 . ПМИД 27730693 . S2CID 4344504 .
- ^ Ди Джозия, Паоло; Стамерра, Козимо Андреа; Джорджини, Паоло; Джамиалахамди, Танназ; Батлер, Александра Э.; Сахебкар, Амирхоссейн (май 2022 г.). «Роль питания в воспалении». Обзоры исследований старения . 77 : 101596. doi : 10.1016/j.arr.2022.101596 . ПМИД 35219904 . S2CID 247087388 .
- ^ Мур, Кэти; Хьюз, Кэтрин Ф.; Уорд, Мэри; Хоуи, Лин; МакНалти, Хелен (май 2018 г.). «Диета, питание и старение мозга: современные данные и новые направления» . Труды Общества питания . 77 (2): 152–163. дои : 10.1017/S0029665117004177 . ПМИД 29316987 . S2CID 46282736 .
- ^ Брейди, Нэди; Лю, Юэ (ноябрь 2020 г.). «Может ли никотинамирибозид защитить от когнитивных нарушений?». Текущее мнение о клиническом питании и метаболической помощи . 23 (6): 413–420. дои : 10.1097/MCO.0000000000000691 . ISSN 1363-1950 . ПМИД 32925178 . S2CID 221724061 .
- ^ Беме, Маркус; Гуззетта, Кэтрин Э.; Бастианссен, Томас Ф.С.; ван де Вау, Марсель; Молони, Джерард М.; Гуаль-Грау, Эндрю; Спичак, Симон; Олаваррия-Рамирес, Лорето; Фицджеральд, Патрик; Морильяс, Энрике; Ритц, Натаниэль Л.; Джаггар, Минал; Коуэн, Кейтлин С.М.; Криспи, Фиона; Доносо, Франциско; Халицки, Эвелин; Нето, Марта Дж.; Сикетти, Марсия; Голубева Анна Владимировна; Фицджеральд, Рэйчел С.; Классон, Маркус Дж.; Коттер, Пол Д.; О'Лири, Оливия Ф.; Динан, Тимоти Г.; Крайан, Джон Ф. (август 2021 г.). «Микробиота молодых мышей противодействует избирательным возрастным поведенческим нарушениям» . Природное старение . 1 (8): 666–676. дои : 10.1038/s43587-021-00093-9 . ISSN 2662-8465 . ПМИД 37117767 .
- Новостная статья об исследовании: «Кишечные бактерии молодых мышей обращают вспять признаки старения мозга у старых мышей» . Новый Атлас . 10 августа 2021 г. Проверено 21 сентября 2021 г.
- ^ Ли, Джунёнг; Венна, Венугопал Р.; Дурган, Дэвид Дж.; Ши, Хуанань; Худобенко, Яков; Путлури, Нагиредди; Петрозино, Джозеф; Маккалоу, Луиза Д.; Брайан, Роберт М. (9 ноября 2020 г.). «Трансплантация микробиоты молодых и пожилых мышей без микробов: увеличение количества короткоцепочечных жирных кислот и улучшение когнитивных функций» . Кишечные микробы . 12 (1): 1814107. дои : 10.1080/19490976.2020.1814107 . ISSN 1949-0976 . ПМЦ 7757789 . ПМИД 32897773 .
- ^ Хатчинсон, Эшли Н.; Тингё, Лина; Брюммер, Роберт Ян (август 2020 г.). «Потенциальное воздействие пробиотиков и жирных кислот ω-3 на хроническое вялотекущее воспаление» . Питательные вещества . 12 (8): 2402. дои : 10.3390/nu12082402 . ISSN 2072-6643 . ПМЦ 7468753 . ПМИД 32796608 .
- ^ Jump up to: а б Сандерс, Эми; Ван, Цуйлин; Кац, Минди; Дерби, Кэрол; Барзилай, Нир (2011). «Связь функционального полиморфизма в гене белка-переносчика эфиров холестерина (CETP) со снижением памяти и заболеваемостью деменцией» . Журнал Американской медицинской ассоциации . 303 (2): 150–158. дои : 10.1001/jama.2009.1988 . ПМК 3047443 . ПМИД 20068209 .
- ^ Райли КП, Сноудон Д.А., Дерозье М.Ф., Маркесбери В.Р. (2005). «Языковые способности в раннем возрасте, когнитивные функции в позднем возрасте и невропатология: результаты исследования монахини». Нейробиология старения . 26 (3): 341–7. doi : 10.1016/j.neurobiolaging.2004.06.019 . ПМИД 15639312 . S2CID 41770951 .
- ^ Чжан Го, Го; Ли, Джусюэ; Пуркайастха, Пуркайастха; Тан, Ичжэ; Чжан, Хай; Инь, Йе; Ли, Бо; и др. (2013). «Гипоталамическое программирование системного старения с участием IKK-[bgr], NF-[kgr]B и GnRH» . Природа . 497 (7448): 211–216. дои : 10.1038/nature12143 . ПМЦ 3756938 . ПМИД 23636330 .
- ^ «Исследование выявило иммунный фактор старения мозга» . www.medicalxpress.com . Проверено 13 февраля 2021 г.
- ^ Минхас, Парас С.; Латиф-Эрнандес, Амира; Макрейнольдс, Мелани Р.; Дурайрадж, Ааруран С.; Ван, Цянь; Рубин, Аманда; Джоши, Амит У.; Он, Джой К.; Гауба, Эша; Лю, Линг; Ван, Конгконг; Линде, Майлз; Сугиура, Юки; Мун, Питер К.; Маджети, Рави; Суэмацу, Макото; Мохлы-Розен, Дарья; Вайсман, Ирвинг Л.; Лонго, Фрэнк М.; Рабиновиц, Джошуа Д.; Андреассон, Катрин И. (февраль 2021 г.). «Восстановление метаболизма миелоидных клеток обращает вспять снижение когнитивных функций при старении» . Природа . 590 (7844): 122–128. Бибкод : 2021Natur.590..122M . дои : 10.1038/s41586-020-03160-0 . ISSN 1476-4687 . ПМЦ 8274816 . ПМИД 33473210 .
- ^ Ирам, Таль; Керн, Фабиан; Каур, Ачинт; Минени, Сакет; Морнингстар, Эллисон Р.; Шин, Хизер; Гарсия, Мигель А.; Йерра, Лакшми; Паловичс, Роберт; Ян, Эндрю С.; Хан, Оливер; Лу, Наннан; Шукен, Стивен Р.; Хейни, Майкл С.; Леаллер, Бенуа; Айер, Манаси; Ло, Цзянь; Зеттерберг, Хенрик; Келлер, Андреас; Зучеро, Дж. Брэдли; Висс-Корей, Тони (май 2022 г.). «Молодой CSF восстанавливает олигодендрогенез и память у старых мышей посредством Fgf17» . Природа . 605 (7910): 509–515. Бибкод : 2022Natur.605..509I . дои : 10.1038/s41586-022-04722-0 . ISSN 1476-4687 . ПМЦ 9377328 . ПМИД 35545674 . S2CID 248741220 .
- Новостная статья об исследовании: Йирка, Боб. «Передача старой мыши спинномозговой жидкости от молодой мыши улучшает ее память» . www.medicalxpress.com . Проверено 22 июня 2022 г.
- Экспертные отзывы об исследовании: «Омоложение памяти у древних мышей» . Научный медиа-центр Германии . Проверено 22 июня 2022 г.
- ^ Мёллгорд, Кьельд; Бейнлих, Феликс Р.М.; Куск, Питер; Миякоши, Лео М.; Делле, Кристина; Пла, Вирджиния; Хаугланд, Натали Л.; Эсмаил, Тина; Расмуссен, Мартин К.; Гомолка, Рышард С.; Мори, Юки; Недергаард, Майкен (2023). «Мезотелий делит субарахноидальное пространство на функциональные отсеки» . Наука . 379 (6627): 84–88. Бибкод : 2023Sci...379...84M . doi : 10.1126/science.adc8810 . ПМИД 36603070 . S2CID 255440992 .
- Пресс-релиз университета: «Недавно открытая анатомия защищает и контролирует мозг» . Медицинский центр Университета Рочестера (medicalxpress.com) . Архивировано из оригинала 7 января 2023 года . Проверено 15 февраля 2023 г.
- Новостная статья об исследовании: Чаручандра, Суканья (30 января 2023 г.). «Ученые обнаружили новый защитный слой в мозге» . Новости передовой науки . Архивировано из оригинала 30 января 2023 года . Проверено 15 февраля 2023 г.
- ^ Jump up to: а б Ариас, Элизабет; Сюй, Цзяцюань; Доктор медицинских наук, М. (8 августа 2022 г.). «Таблица продолжительности жизни в США, 2020 г.» (PDF) . Национальные отчеты по статистике естественного движения населения . 71 (1). Центры по контролю и профилактике заболеваний : 51. — Таблица 19.
- ^ Ери, Ашиш; Мерфи, Рэйчел А; Маррон, Меган М; Клиш, Клэри; Харрис, Тамара Б; Льюис, Грегори Д; Ньюман, Энн Б; Мурти, Венкатеш Л; Шах, Рави V (14 декабря 2017 г.). «Профили метаболитов индекса здорового старения связаны с сердечно-сосудистыми заболеваниями у афроамериканцев: исследование здоровья, старения и состава тела» . Журналы геронтологии: серия А. 74 (1): 68–72. дои : 10.1093/gerona/glx232 . ISSN 1079-5006 . ПМК 6298181 . ПМИД 29253112 .
- ^ Симс, Регина; Мадхере, Серж; Каллендер, Клайв; Кэмпбелл, Альфонсо (2008). «Модель взаимосвязи между факторами риска сердечно-сосудистых заболеваний и нейрокогнитивной функцией у афроамериканцев» . Этническая принадлежность и болезни . 18 (4): 471–476. ISSN 1049-510X . ПМК 3804014 . ПМИД 19157252 .
- ^ Гонсалес, Гектор М.; Тарраф, Вассим; Васкес, Присцилла; Сандерлин, Эшли Х.; Розенберг, Наталья И.; Дэвис, Соня; Родригес, Карлос Х.; Галло, Линда С.; Тьягараджан, Бхарат; Давиглус, Марта; Хамбаты, Тасним (июль 2018 г.). «Метаболический синдром и нейрокогниция среди разнообразных латиноамериканцев/латиноамериканцев среднего и старшего возраста: результаты HCHS/SOL» . Уход при диабете . 41 (7): 1501–1509. дои : 10.2337/dc17-1896 . ISSN 1935-5548 . ПМК 6014545 . ПМИД 29716895 .
- ^ Ариас, Элизабет; Сюй, Цзяцюань (8 августа 2022 г.). «Национальные отчеты по статистике естественного движения населения: таблицы смертности в США, 2020 г.» (PDF) . Центры по контролю и профилактике заболеваний .
- ^ Хилл, Латойя; Артига, Саманта (23 мая 2023 г.). «Что способствует увеличению расового неравенства в продолжительности жизни?» . kff.org .
- ^ Гонсалес, Гектор М.; Тарраф, Вассим; Цзянь, Сюэцю; Васкес, Присцилла М.; Каплан, Роберт; Тьягараджан, Бхарат; Давиглус, Марта; Ламар, Мелисса; Галло, Линда С.; Цзэн, Дунлин; Форнаж, Мириам (декабрь 2018 г.). «Генотипы аполипопротеина E среди различных латиноамериканцев среднего и старшего возраста: исследование латиноамериканцев - исследование результатов нейрокогнитивного старения (HCHS/SOL)» . Научные отчеты . 8 (1): 17578. Бибкод : 2018NatSR...817578G . дои : 10.1038/s41598-018-35573-3 . ISSN 2045-2322 . ПМК 6292877 . ПМИД 30546063 .
- ^ де Соуза-Таларико, Джулиана Н.; де Карвальо, Анна П.; Бруки, Соня, доктор медицинских наук; Нитрини, Рикардо; Ферретти-Ребустини, Рената Э.де.Л. (2016). «Распространенность деменции и когнитивных нарушений и связанные с ними факторы среди коренного населения: систематический обзор» . Болезнь Альцгеймера и связанные с ней расстройства . 30 (3): 281–287. doi : 10.1097/WAD.0000000000000140 . ISSN 0893-0341 . ПМИД 26840546 . S2CID 24144093 .
- ^ Рэдфорд, Кайли; Лавренчич, Луиза М.; Дельбар, Ким; Дрейпер, Брайан; Камминг, Роберт; Дневной свет, Гейл; Мак, Холли А.; Чокли, Саймон; Беннетт, Хейли; Гарви, Гейл; Хилл, Тхи Йен (13 августа 2019 г.). Ансти, Каарин; Питерс, Рут (ред.). «Факторы, связанные с высокой распространенностью деменции среди пожилых австралийских аборигенов» . Журнал болезни Альцгеймера . 70 (с1): С75–С85. дои : 10.3233/JAD-180573 . ПМК 6700619 . ПМИД 30507573 .
- ^ Липницки, Даррен М.; Кроуфорд, Джон Д.; Дутта, Раджиб; Таламуту, Анбупалам; Кочан, Николь А.; Эндрюс, Гэвин; Лима-Коста, М. Фернанда; Кастро-Коста, Эрико; Брэйн, Кэрол; Мэтьюз, Фиона Э.; Стефан, Блоссом CM (21 марта 2017 г.). Миллер, Брюс Л. (ред.). «Возрастное снижение когнитивных функций и связь с полом, образованием и генотипом аполипопротеина Е в этнокультурных группах и географических регионах: совместное когортное исследование» . ПЛОС Медицина . 14 (3): e1002261. дои : 10.1371/journal.pmed.1002261 . ISSN 1549-1676 . ПМК 5360220 . ПМИД 28323832 .
- ^ О'Дуайер, Лоуренс; Ламбертон, Франк; Бокде, Арун Л.В.; Эверс, Майкл; Фалуйи, Йетунде О.; Таннер, Колби; Мазойер, Бернар; О'Нил, Десмонд; Бартли, Майреад; Коллинз, Ронан; Кофлан, Тара (2 июля 2012 г.). «Половой диморфизм при здоровом старении и легких когнитивных нарушениях: исследование DTI» . ПЛОС ОДИН . 7 (7): e37021. Бибкод : 2012PLoSO...737021O . дои : 10.1371/journal.pone.0037021 . ISSN 1932-6203 . ПМЦ 3388101 . ПМИД 22768288 .
- ^ Рэпп, Стивен Р.; Эспеланд, Марк А.; Мэнсон, Джоан Э.; Резник, Сьюзен М.; Брайан, Ник Р.; Смоллер, Сильвия; Кокер, Лаура Х.; Филлипс, Лоуренс С.; Стефаник, Марсия Л.; Сарто, Глория Э. (август 2013 г.). «Уровень образования, изменения на МРТ и когнитивные функции у пожилых женщин в постменопаузе по данным исследования памяти, проведенного в рамках инициативы Women's Health Initiative» . Международный журнал психиатрии в медицине . 46 (2): 121–143. дои : 10.2190/pm.46.2.a . ISSN 0091-2174 . ПМЦ 4544866 . ПМИД 24552037 .
- ^ Сантос, Надин Коррейя; Морейра, Педро Силва; Кастаньо, Тереза Коста; Соуза, Нуно; Коста, Патрисио Соарес (12 января 2016 г.). «Дискриминантная сила социально-демографических характеристик и настроения в различении кластеров когнитивных функций у пожилых людей: перекрестный анализ» . Старение и психическое здоровье . 21 (5): 537–542. дои : 10.1080/13607863.2015.1128879 . hdl : 1822/46259 . ISSN 1360-7863 . ПМИД 26756965 . S2CID 25603962 .
- ^ Пикколо, Лусиана Р.; Мерц, Эмили С.; Он, Сяофу; Соуэлл, Элизабет Р.; Ноубл, Кимберли Г. (19 сентября 2016 г.). Цзо, Си-Нянь (ред.). «Возрастные различия в толщине коры зависят от социально-экономического статуса» . ПЛОС ОДИН . 11 (9): e0162511. Бибкод : 2016PLoSO..1162511P . дои : 10.1371/journal.pone.0162511 . ISSN 1932-6203 . ПМК 5028041 . ПМИД 27644039 .
- ^ Ноубл, Кимберли Дж; Хьюстон, Сюзанна М; Брито, Натали Х; Барч, Хауке; Кан, Эрик; Куперман, Джошуа М; Акшумофф, Наташа; Амарал, Дэвид Дж; Блосс, Корица С; Либигер, Ондрей; Шорк, Николас Дж. (май 2015 г.). «Семейный доход, образование родителей и строение мозга детей и подростков» . Природная неврология . 18 (5): 773–778. дои : 10.1038/nn.3983 . ISSN 1097-6256 . ПМЦ 4414816 . ПМИД 25821911 .
- ^ «Использование SNAP связано с более медленным ухудшением памяти у пожилых людей» . Консультант по неврологии . 14 ноября 2022 г. Проверено 17 декабря 2022 г.
- ^ Лу, Пейи; Кезиос, Катрина; Ли, Чонсон; Калонико, Себастьян; Вимер, Кристофер; Хаззури, Адина Зеки Аль (9 ноября 2022 г.). «Связь между использованием программы дополнительного питания и ухудшением памяти: результаты исследования здоровья и выхода на пенсию» . Неврология . 100 (6): e595–e602. дои : 10.1212/WNL.0000000000201499 . ISSN 0028-3878 . ПМЦ 9946186 . ПМИД 36351816 . S2CID 253445156 .
- Пресс-релиз университета: «Использование льгот SNAP может замедлить ухудшение памяти у пожилых людей» . Школа общественного здравоохранения Мейлмана Колумбийского университета (Medicalxpress.com) . Проверено 17 декабря 2022 г.
Внешние ссылки
[ редактировать ]- Национальный институт старения: инструменты для выявления когнитивных нарушений у пожилых людей .