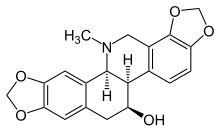
Хелидонин
| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
Хелидонин [ 1 ]
| |
| Систематическое название ИЮПАК
(5b R ,6 S ,12b S )-13-Метил-5b,6,7,12b,13,14-гексагидро-2 H ,10 H -[1,3]бензодиоксоло[5,6- c ][1 ,3]диоксоло[4,5- i ]фенантридин-6-ол | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.006.823 |
| КЕГГ | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 20 Н 19 Н О 5 | |
| Молярная масса | 353.374 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Хелидонин представляет собой изолят Papaveraceae , обладающий ингибирующей активностью в отношении ацетилхолинэстеразы и бутирилхолинэстеразы . [ 2 ]
Введение
[ редактировать ]Хелидонин является основным алкалоидным компонентом Chelidonium majus . Хелидониум большой L. — единственный вид трибы Chelidonieae семейства Papaveraceae . Papaveraceae богат специфическими алкалоидами. C. majus содержит различные изохинолиновые алкалоиды со протопина , протоберберина и бензофенантридина. структурами [ 3 ] Этот алкалоид бензофенантридина может вызывать апоптоз в некоторых трансформированных или злокачественных клеточных линиях. [ 4 ]
D-хелидонин, основной алкалоид Chelidonium majus , был впервые выделен в 1839 году. [ 5 ] В предполагаемые целебные свойства чистотела большого ( Chelidonium majus ) верили по всей Европе и Азии в период Римской Империи (Плиний 1966), а аборигенные культуры Нового Света использовали растения, содержащие BIA, используя сок или экстракты корней для лечения небольших порезов и инфекций. . [ 6 ]
Синтез
[ редактировать ]Амид (N-(бицикло[4.2.0]окта-1,3,5-триен-7-ил)-2-этенилбензамид) нагревали в кипящем бромбензоле с образованием перелитого соединения. Напротив, термолиз более гибкого уретана (метилбицикло[4.2.0]окта-1,3,5-триен-7-ил[(2-этенилфенил)метил]карбамата) дал желаемый цисконденсированный продукт. Строительными блоками, необходимыми для синтеза хелидонина, являются уретан и бромистый бензил. Уретан получали сначала с использованием нитрила (5,6-дигидро-2Н-циклобута[f][1,3]бензодиоксол-5-карбонитрила), в результате гидролиза получали карбоновую кислоту. Карбоновая кислота, которая при разложении по Курциусу дала сырой изоцианат (N=C=O). Реакция сырого изоцианата с бензиловым спиртом привела к образованию уретана с боковой группой NHCOOC7H7. Бензилбромид получали конверсией 2,3-метилендиоксибензальдегида в 1,2,3,4-тетрагидро-7,8-метилендиоксиизохинол последовательными деградациями Гофмана и фон Брауна. [ 5 ]
Конденсация уретана и бромистого бензила привела к образованию маслянистого стирола. Из этой структуры образовался жидкий ацетилен. кристаллический тетрагидробенз[ c Далее образовался ]фенантридин. гидроборирование и окисление дают спирт. Окисление Джонса привело к образованию кетона. А путем переработки кетона искомый цис , цис образовался -спирт. После гидрогенолиза бензилоксикарбонильной группы был синтезирован dl-норхелидонин. [ 5 ]
Доступные формы
[ редактировать ]Хелидонин имеет несколько форм, которые синтезируются аналогичным образом и имеют сходную структуру, в том числе: (+)-гомохелидонин, (+)-хеламин и (-)-норхелидонин представляют собой третичные бензо[ c ]фенантридиновые алкалоиды с частично гидрированными B и Кольца С. Они встречаются у ряда видов растений семейства Papaveraceae. Первые два были выделены из корней Chelidonium majus L. как минорные алкалоиды. Энантиомерный (+)-норхелидонин недавно был обнаружен у C. majus . [ 7 ]
Метаболизм
[ редактировать ]Хелидонин является основным биологически активным изохинолиновым алкалоидным ингредиентом Chelidonium majus. Бензилизохинолиновые алкалоиды (БИА) представляют собой структурно разнообразную группу специализированных метаболитов растений с долгой историей исследований. Ограниченное число семейств ферментов участвует в метаболизме BIA. В то время как некоторые ферменты обладают относительно широким диапазоном субстратов, другие обладают высокой субстратоспецифичностью.
Небольшое количество видов растений, в том числе опийный мак ( Papaver somniferum ) и другие представители семейства Ranunculales , стали модельными системами для изучения метаболизма BIA. В последнее время появление транскриптомики , протеомики и метаболомики ускорило открытие новых генов биосинтеза BIA.
В целом, метилтрансферазы метаболизма BIA принимают широкий спектр алкалоидных субстратов с разнообразной структурой основной цепи, причем некоторые из них демонстрируют большую гибкость, чем другие, в отношении диапазона субстратов. [ 6 ]
Показания
[ редактировать ]Хелидонин представляет собой изолят Papaveraceae , обладающий ингибирующей активностью в отношении ацетилхолинэстеразы и бутирилхолинэстеразы (неспецифической холинэстеразы). [ 2 ] Ингибиторы АХЭ ( ацетилхолинэстеразы ) или антихолинэстеразы препятствуют расщеплению АХ ферментом холинэстеразы, увеличивая как уровень, так и продолжительность действия нейромедиатора. По механизму действия ингибиторы АХЭ можно разделить на две группы: необратимые и обратимые.
Обратимые ингибиторы, конкурентные или неконкурентные, в основном имеют терапевтическое применение, тогда как токсические эффекты связаны с необратимыми модуляторами активности АХЭ. Обратимые ингибиторы АХЭ играют важную роль в фармакологическом манипулировании активностью фермента. Эти ингибиторы включают соединения с различными функциональными группами ( карбамат , группа четвертичного или третичного аммония) и применяются для диагностики и/или лечения различных заболеваний, таких как: миастения, АД, послеоперационная кишечная непроходимость, вздутие мочевого пузыря, глаукома , а также противоядие при передозировке антихолинергических препаратов. [ 8 ]
Токсичность
[ редактировать ]Хелидонин изучался на многих организмах, но главным образом на крысах и мышах. У этих организмов сублетальные дозы хелидонина вызывали птозный тремор, седативный эффект и снижение температуры тела. ЛД50 хелидонина при внутрибрюшинном введении составляет у мышей 1,3 г/кг и у крыс 2 г/кг. [ 9 ] Исследований токсичности хелидонина у человека не так много.
Ссылки
[ редактировать ]- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество . п. 1517. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Jump up to: а б «NCATS Inxight: Препараты — ХЕЛИДОНИН, (+/-)-» . Drugs.ncats.io . Проверено 22 января 2020 г.
- ^ КОЛОМБО, М; Бозисио, Э. (1996). «Фармакологическая активность Chelidonium Majusl. (Papaveraceae)». Фармакологические исследования . 33 (2). Эльзевир Б.В.: 127–134. дои : 10.1006/phrs.1996.0019 . ISSN 1043-6618 . ПМИД 8870028 .
- ^ Кемени-Беке, Адам; Аради, Янош; Дамьянович, Юдит; Бек, Золтан; Фацко, Андреа; Берта, Андраш; Боднар, Андреа (2006). «Апоптотический ответ клеток увеальной меланомы на лечение хелидонином, сангвинарином и хелеритрином». Письма о раке . 237 (1). Эльзевир Б.В.: 67–75. дои : 10.1016/j.canlet.2005.05.037 . ISSN 0304-3835 . ПМИД 16019128 .
- ^ Jump up to: а б с Оппольцер, В.; Келлер, К. (1971). «Полный синтез dl-хелидонина». Журнал Американского химического общества . 93 (15): 3836–3837. дои : 10.1021/ja00744a085 . ISSN 0002-7863 .
- ^ Jump up to: а б Хейгел, Джиллиан М.; Факкини, Питер Дж. (2013). «Метаболизм бензилизохинолиновых алкалоидов: век открытий и дивный новый мир». Физиология растений и клеток . 54 (5): 647–672. дои : 10.1093/pcp/pct020 . ISSN 1471-9053 . ПМИД 23385146 .
- ^ Нечас, Марек; Досталь, Иржи; Кейновска, Ива; Ворличкова, Микаэла; Славик, Иржи (2005). «Молекулярные и кристаллические структуры (+)-гомохелидонина, (+)-хеламина и (-)-норхелидонина». Журнал молекулярной структуры . 734 (1–3). Эльзевир Б.В.: 1–6. Бибкод : 2005JMoSt.734....1N . doi : 10.1016/j.molstruc.2004.08.006 . ISSN 0022-2860 .
- ^ Чолович, Мирьяна Б.; Крстич, Даниела З.; Лазаревич-Пасти, Тамара Д.; Бонджич, Александра М.; Васич, Весна М. (2013). «Ингибиторы ацетилхолинэстеразы: фармакология и токсикология» . Современная нейрофармакология . 11 (3): 315–335. дои : 10.2174/1570159X11311030006 . ISSN 1570-159X . ПМЦ 3648782 . ПМИД 24179466 .
- ^ Гарднер, З. (2013). Справочник по ботанической безопасности Американской ассоциации растительных продуктов (2-е изд.). Нью-Йорк, Америка: CRC Press.
- Каликова, Люси; Оплетал, Любомир; Курфюрст, Милан; Мацакова, Катерина; Кулханкова, Андреа; Хосталкова, Анна (2010). «Соединения, ингибирующие ацетилхолинэстеразу и бутирилхолинэстеразу, из Chelidonium majus (Papaveraceae)». Коммуникации о натуральных продуктах . 5 (11): 1751–1754. ISSN 1934-578X . ПМИД 21213973 .