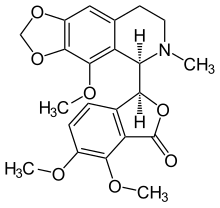
Носкапин
 | |
 | |
| Клинические данные | |
|---|---|
| Другие имена | Наркотин |
| AHFS / Drugs.com | Международные названия лекарств |
| Беременность категория |
|
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | ~30% |
| Период полувыведения | От 1,5 до 4 часов (в среднем 2,5) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.004.455 |
| Химические и физические данные | |
| Формула | C22H23NOC22H23NO7 |
| Молярная масса | 413.426 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Носкапин (также известный как Наркотин , Нектодон , Носпен , Анаркотин и (архаичный) Опиан ) представляет собой бензилизохинолиновый алкалоид структурной подгруппы фталидеизохинолина, который был выделен из многочисленных видов семейства Papaveraceae (семейство маковых). Ему не хватает значительного снотворного, эйфорического или обезболивающего эффекта, что обусловливает очень низкий потенциал привыкания. [1] Этот агент в основном используется из-за его противокашлевого (подавляющего кашель) действия.
Медицинское использование
[ редактировать ]Носкапин часто используется как противокашлевое средство. [2] Однако голландские рекомендации 2012 года не рекомендуют его использовать при остром кашле . [3]
Побочные эффекты
[ редактировать ]- Тошнота
- Рвота
- Потеря координации
- Галлюцинации (слуховые и зрительные)
- Потеря сексуального влечения
- Отек простаты
- Потеря аппетита
- Расширенные зрачки
- Увеличение частоты сердечных сокращений
- Дрожь и мышечные спазмы
- Боли в груди
- Повышенная бдительность
- Потеря сонливости
- Потеря стереоскопического зрения.
Взаимодействия
[ редактировать ]Носкапин может усиливать действие веществ центрального седативного действия, таких как алкоголь и снотворные средства . [4]
Препарат не следует принимать вместе с ИМАО (ингибиторами моноаминоксидазы), поскольку могут возникнуть неизвестные и потенциально фатальные эффекты. [ нужна ссылка ]
Носкапин не следует принимать одновременно с варфарином, поскольку антикоагулянтное действие варфарина может усиливаться. [5]
Биосинтез
[ редактировать ]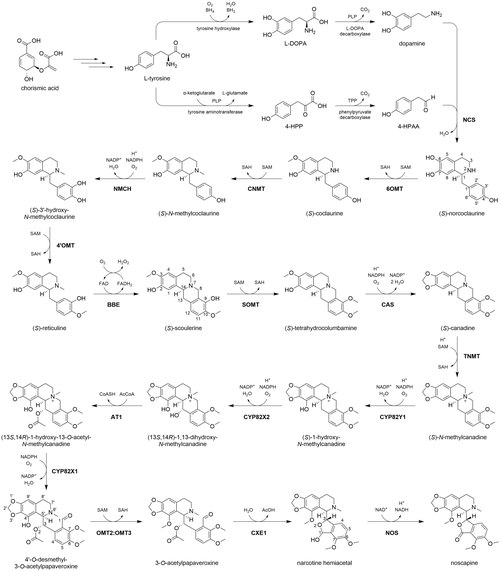
Биосинтез носкапина у P. somniferum начинается с хоризмовой кислоты , которая синтезируется по шикиматному пути из эритрозо-4-фосфата и фосфоенолпирувата . Хоризминовая кислота является предшественником аминокислоты тирозина , источника азота в бензилизохинолиновых алкалоидах . Тирозин может подвергаться трансаминированию, опосредованному PLP , с образованием 4-гидроксифенилпировиноградной кислоты (4-HPP), с последующим декарбоксилированием, опосредованным TPP , с образованием 4-гидроксифенилацетальдегида (4-HPAA). Тирозин также может быть гидроксилирован с образованием 3,4-дигидроксифенилаланина (ДОФА) с последующим декарбоксилированием, опосредованным PLP, с образованием дофамина . Норкоклауринсинтаза (NCS) катализирует реакцию Пикте-Шпенглера между 4-ГПАА и дофамином с образованием ( S ) -норкоклаурина , образуя характерный бензилизохинолиновый каркас. ( S )-Норкоклаурин последовательно 6- O -метилируется (6OMT), N -метилируется (CNMT), 3-гидроксилируется (NMCH) и 4'- O -метилируется (4'OMT) с использованием кофакторов S- аденозилметионин (SAM) и НАДФ + для метилирования и гидроксилирования соответственно. В результате этих реакций образуется ( S ) -ретикулин , ключевой промежуточный продукт в биосинтезе бензилизохинолиновых алкалоидов. [6]
Остальная часть пути биосинтеза носкапина в значительной степени регулируется одним биосинтетическим кластером из 10 генов. [7] Гены, входящие в этот кластер, кодируют ферменты, ответственные за девять из одиннадцати оставшихся химических превращений. Во-первых, фермент берберинового мостика (BBE), фермент, не кодируемый кластером, образует слитую четырехкольцевую структуру в ( S ) -скулерине . BBE использует O 2 в качестве окислителя и ему помогает кофактор флавинадениндинуклеотид (FAD). Затем О -метилтрансфераза (SOMT) метилирует 9-гидроксильную группу. Канадинсинтаза (CAS) катализирует образование уникального метилендиокси-мостика C2-C3 в ( S )-канадине. [8] Далее следуют N - метилирование (TNMT) и два гидроксилирования (CYP82Y1, CYP82X2), которым способствуют SAM и O 2 /NADPH соответственно. Затем спирт C13 ацетилируется ацетилтрансферазой (АТ1) с использованием ацетил-КоА . Другой фермент цитохрома P450 (CYP82X1) катализирует гидроксилирование C8, и вновь образованный полуаминаль спонтанно расщепляется, образуя третичный амин и альдегид. Гетеродимер метилтрансферазы (OMT2:OMT3) катализирует SAM-опосредованное O- метилирование на C4'. [9] Затем O - ацетильная группа расщепляется карбоксилэстеразой (CXE1), образуя спирт, который немедленно реагирует с соседним альдегидом C1 с образованием полуацеталя в новом пятичленном кольце. Очевидная противодействность между AT1 и CXE1 предполагает, что ацетилирование в этом контексте используется в качестве защитной группы, предотвращая образование полуацеталя до тех пор, пока сложный эфир не будет расщеплен ферментативно. [10] Наконец, НАД + -зависимая короткоцепочечная дегидрогеназа (NOS) окисляет полуацеталь до лактона, завершая биосинтез носкапина. [6]
Механизм действия
[ редактировать ]Противокашлевые эффекты носкапина, по-видимому, в первую очередь опосредованы его агонистической активностью в отношении σ-рецепторов . Доказательства этого механизма подтверждены экспериментальными данными на крысах. Предварительное лечение римказолом , σ-специфическим антагонистом , вызывает дозозависимое снижение противокашлевой активности носкапина. [11] Известно, что носкапин и его синтетические производные, называемые носкапиноидами, взаимодействуют с микротрубочками и ингибируют пролиферацию раковых клеток. [12]
Структурный анализ
[ редактировать ]Лактонное . кольцо нестабильно и раскрывается в основных средах Противоположная реакция наблюдается в кислых средах. Связь (C1-C3'), соединяющая два оптически активных атома углерода, также нестабильна. В водном растворе серной кислоты и при нагревании диссоциирует на котарнин (4-метокси-6-метил-5,6,7,8-тетрагидро-[1,3]диоксоло[4,5- г ]изохинолин) и оповую кислоту ( 6-формил-2,3-диметоксибензойная кислота). При восстановлении носкапина цинком / HCl связь C1-C3' насыщается и молекула диссоциирует на гидрокотарнин (2-гидроксикотарнин) и меконин (6,7-диметоксиизобензофуран-1(3H ) -он).
История
[ редактировать ]Носкапин был впервые выделен и охарактеризован по химическому распаду и свойствам в 1803 году под названием «Наркотин». [13] [14] Жан-Франсуа Дерон, французский химик из Парижа. Затем Пьер-Жан Робике , другой французский химик, в 1831 году доказал, что наркотик и морфин являются отдельными алкалоидами. [15] Наконец, Пьер-Жан Робике провел в течение 20 лет, между 1815 и 1835 годами, серию исследований по совершенствованию методов выделения морфина , а также выделил в 1832 году еще один очень важный компонент опиума-сырца, который он назвал кодеином , в настоящее время широко полученное из опиума использовал соединение, .
Общество и культура
[ редактировать ]Рекреационное использование
[ редактировать ]Имеются отдельные сообщения о рекреационном использовании безрецептурных наркотиков в нескольких странах. [16] легкодоступен в местных аптеках без рецепта. Эффекты, начинающиеся примерно через 45–120 минут после употребления, аналогичны отравлению декстрометорфаном и алкоголем . В отличие от декстрометорфана носкапин не является антагонистом NMDA-рецепторов . [17]
Носкапин в героине
[ редактировать ]Носкапин может выжить в процессе производства героина , и его можно найти в уличном героине. Это полезно для правоохранительных органов, так как по количеству загрязняющих веществ можно определить источник изъятых наркотиков. В 2005 году в Льеже , Бельгия , средняя концентрация носкапина составляла около 8%. [18]
Носкапин также использовался для выявления потребителей наркотиков, которые принимают уличный героин одновременно с прописанным диаморфином . [19] Поскольку диаморфин в уличном героине аналогичен фармацевтическому диаморфину, исследование примесей является единственным способом проверить, употреблялся ли уличный героин. Другие загрязнители, используемые в мочи образцах вместе с носкапином, включают папаверин и ацетилкодеин . Носкапин метаболизируется в организме и сам редко обнаруживается в моче, вместо этого он присутствует в виде основных метаболитов — котарнина и меконина . Обнаружение осуществляется с помощью газовой хроматографии-масс-спектрометрии или жидкостной хроматографии-масс-спектрометрии (ЖХМС), но также можно использовать ряд других аналитических методов.
Исследовать
[ редактировать ]Клинические испытания
[ редактировать ]эффективность носкапина при лечении некоторых гематологических злокачественных новообразований. В клинике изучалась [20] [21] Индукция полиплоидии носкапином наблюдалась in vitro в лимфоцитах человека при высоких дозах (>30 мкМ); однако системное воздействие низкого уровня, например, при приеме лекарств от кашля, по-видимому, не представляет генотоксической опасности. Предполагается, что механизм индукции полиплоидии носкапином включает либо повреждение аппарата веретена хромосом , либо слияние клеток. [22] [23]
Восстановление биосинтеза носкапина
[ редактировать ]Многие ферменты пути биосинтеза носкапина были выяснены благодаря открытию «опероноподобного кластера» из 10 генов, названного HN1. [7] В 2016 году путь биосинтеза носкапина был восстановлен в дрожжевых клетках. [24] позволяющий синтезировать препарат без необходимости сбора и очистки от растительного сырья. В 2018 году весь путь носкапина был воссоздан и произведен в дрожжах из простых молекул. Кроме того, у дрожжей была оптимизирована экспрессия белка, что позволило увеличить выработку носкапина в 18 000 раз. [25] Есть надежда, что эту технологию можно будет использовать для производства фармацевтических алкалоидов, таких как носкапин, которые в настоящее время экспрессируются в растениях с слишком низким выходом , чтобы их можно было производить массово, что позволит им стать рыночными терапевтическими лекарствами. [26]
Противораковые производные
[ редактировать ]Носкапин сам по себе является антимитотическим средством , поэтому его аналоги имеют большой потенциал в качестве новых противораковых препаратов. [27] аналоги, обладающие значительным цитотоксическим действием за счет модифицированного 1,3-бензодиоксолового фрагмента. Разработаны [28] Аналогичным образом были разработаны N-алкиламино, 1,3-диинил, 9-винилфенил и 9-арилиминопроизводные носкапина. [29] [30] [31] [32] Механизм их действия заключается в ингибировании тубулина . [33]
Противовоспалительный эффект
[ редактировать ]Интересно, что различные исследования показали, что носкапин оказывает противовоспалительное действие и значительно снижает уровни провоспалительных факторов, таких как интерлейкин 1β (IL-1β), IFN-c и IL-6. В связи с этим в другом исследовании Khakpour et al. исследовали влияние носкапина на воспаление, вызванное каррагинаном, у крыс. Они обнаружили, что носкапин в дозе 5 мг/кг массы тела через три часа после инъекции оказывает наибольшее противовоспалительное действие. Более того, они показали, что степень уменьшения воспаления при этой дозе носкапина примерно равна индометацину как известному и стандартному противовоспалительному препарату. Более того, Шири и др. пришли к выводу, что носкапин предотвращает прогрессирование вызванного брадикинином воспаления в стопе крысы путем антагонизма рецепторов брадикинина. Кроме того, Зугайер и др. оценили противовоспалительное действие бромированного носкапина. Было показано, что бромированная форма носкапина ингибирует секрецию цитокина TNF-α и хемокина IP-10/CXCL10 макрофагами, тем самым уменьшая воспаление, не влияя на выживаемость макрофагов. Кроме того, бромированное производное носкапина оказывает в 5–40 раз более сильное действие, чем носкапин. Опять же, это бромированное производное также ингибирует toll-подобный рецептор (TLR), фактор некроза опухоли α (TNF-α) и NO в макрофагах человека и мыши, не вызывая токсичности. Кроме того, бромированный носкапин обладает мощной противовоспалительной активностью на моделях септического воспаления, дозозависимо ингибирует факторы воспаления и предотвращает высвобождение TNF-α и NO в макрофагах человека и мыши. Другое исследование воспалительного заболевания кишечника (язвенного колита) и рака толстой кишки показало, что носкапин обладает отличным противовоспалительным действием, которое может значительно снизить уровни провоспалительных факторов, таких как IL-1β, IFN-c и IL-6, по сравнению с контрольная группа. Кроме того, обнаружено, что хитозан наночастицы, содержащие бромированные производные носкапина, могут снижать уровень провоспалительных цитокинов, таких как IL-1β, IFN-c и IL-6, и воспаление в ткани слизистой оболочки толстой кишки. [34]
См. также
[ редактировать ]- Сироп от кашля
- Кодеин ; Фолкодин
- Декстрометорфан ; Димеморфан
- рацеморфан ; Декстрорфан ; Леворфанол
- Бутамират
- Пентоксиверин
- Типепидин
- Клоперастин
- Левоклоперастин
- Нарцеин , родственный алкалоид опия.
Ссылки
[ редактировать ]- ^ Алтыноз М.А., Топчу Г., Хачимуфтуоглу А, Озпинар А, Озпинар А, Хакер Е, Эльмаджи И (август 2019 г.). «Носкапин, опиоид, не вызывающий привыкания, и ингибитор микротрубочек в потенциальном лечении глиобластомы». Нейрохимические исследования . 44 (8): 1796–1806. дои : 10.1007/s11064-019-02837-x . ПМИД 31292803 . S2CID 195873326 .
- ^ Сингх Х., Сингх П., Кумари К., Чандра А., Дасс С.К., Чандра Р. (март 2013 г.). «Обзор носкапина и его влияние на метаболизм гема». Современный метаболизм лекарств . 14 (3): 351–360. дои : 10.2174/1389200211314030010 . ПМИД 22935070 .
- ^ Верли Л., Верхей Т.Дж., Хопстакен Р.М., Принс Дж.М., Саломе П.Л., Бинделс П.Дж. (2012). «[Краткое содержание практического руководства NHG «Острый кашель»]». Голландский медицинский журнал . 156 : А4188. ПМИД 22917039 .
- ^ Ясек, В., изд. Австрийский кодекс (на немецком языке) (изд. 2007/2008 г.). Вена: Издательство австрийского фармацевта. ISBN 978-3-85200-181-4 .
- ^ Олссон С., Холм Л., Мирберг О., Сундстрем А., Юэ Ч.Ю. (февраль 2008 г.). «Носкапин может усиливать эффект варфарина» . Британский журнал клинической фармакологии . 65 (2): 277–278. дои : 10.1111/j.1365-2125.2007.03018.x . ПМК 2291222 . ПМИД 17875192 .
- ^ Jump up to: а б Сингх А., Менендес-Пердомо И.М., Факкини П.Дж. (2019). «Биосинтез алкалоида бензилизохинолина в опийном маке: обновленная информация». Обзоры фитохимии . 18 (6): 1457–1482. Бибкод : 2019ПЧРв..18.1457С . дои : 10.1007/s11101-019-09644-w . S2CID 208301912 .
- ^ Jump up to: а б Винцер Т., Газда В., Хе З., Камински Ф., Керн М., Ларсон Т.Р. и др. (июнь 2012 г.). «Кластер из 10 генов Papaver somniferum для синтеза противоракового алкалоида носкапина» . Наука . 336 (6089): 1704–1708. Бибкод : 2012Sci...336.1704W . дои : 10.1126/science.1220757 . ПМИД 22653730 . S2CID 41420733 .
- ^ Данг Т.Т., Факкини П.Дж. (январь 2014 г.). «Клонирование и характеристика канадинсинтазы, участвующей в биосинтезе носкапина в опийном маке». Письма ФЭБС . 588 (1): 198–204. дои : 10.1016/j.febslet.2013.11.037 . ПМИД 24316226 . S2CID 26504234 .
- ^ Пак М.Р., Чен X, Ланг Д.Э., Нг К.К., Факкини П.Дж. (июль 2018 г.). «Гетеродимерные О-метилтрансферазы, участвующие в биосинтезе носкапина в опийном маке» . Заводской журнал . 95 (2): 252–267. дои : 10.1111/tpj.13947 . ПМИД 29723437 . S2CID 19237801 .
- ^ Данг Т.Т., Чен X, Факкини П.Дж. (февраль 2015 г.). «Ацетилирование служит защитной группой при биосинтезе носкапина в опийном маке». Химическая биология природы . 11 (2): 104–106. дои : 10.1038/nchembio.1717 . ПМИД 25485687 .
- ^ Камей Дж (1996). «Роль опиоидергических и серотонинергических механизмов при кашле и противокашлевых средствах». Легочная фармакология . 9 (5–6): 349–356. дои : 10.1006/pulp.1996.0046 . ПМИД 9232674 .
- ^ Лопус М., Наик ПК (февраль 2015 г.). «Нацеленность на динамическую цель: носкапиноиды как средства лечения рака, нацеленные на микротрубочки». Фармакологические отчеты . 67 (1): 56–62. дои : 10.1016/j.pharep.2014.09.003 . ПМИД 25560576 . S2CID 19622488 .
- ^ Деросне Дж. Ф. (1803 г.). «Память под опиумом» . Анналы химии . 11 : 257–285.
- ^ Дробник Ю., Дробник Э. (декабрь 2016 г.). «Хронология и библиография ранних выделений растительных метаболитов (1770-1820) и их влияние на фармацию: критическое исследование». Фитотерапия . 115 : 155–164. дои : 10.1016/j.fitote.2016.10.009 . ПМИД 27984164 .
- ^ Вишняк Дж. (март 2013 г.). «Пьер-Жан Робике» . Химическое образование . 24 (Приложение 1): 139–149. дои : 10.1016/S0187-893X(13)72507-2 .
- ^ Бхатия М., Вайд Л. (август 2004 г.). «Вид наркотической зависимости у больных психогенным кашлем» . Журнал ларингологии и отологии . 118 (8): 659–660. дои : 10.1258/0022215041917844 . ПМИД 15453951 .
- ^ Черч Дж., Джонс М.Г., Дэвис С.Н., Ложа D (июнь 1989 г.). «Противокашлевые средства как антагонисты N-метиласпартата: дальнейшие исследования». Канадский журнал физиологии и фармакологии . 67 (6): 561–567. дои : 10.1139/y89-090 . ПМИД 2673498 .
- ^ Денуз Р., Дюбуа Н., Шарлье С. (сентябрь 2005 г.). «[Анализ изъятий героина за два года в районе Льежа]». Revue Médicale de Liège (на французском языке). 60 (9): 724–728. ПМИД 16265967 .
- ^ Патерсон С., Линцерис Н., Митчелл Т.Б., Кордеро Р., Нестор Л., Стрэнг Дж. (декабрь 2005 г.). «Валидация методов выявления незаконного употребления героина у пациентов, которым прописан фармацевтический героин для лечения опиоидной зависимости» . Зависимость . 100 (12): 1832–1839. дои : 10.1111/j.1360-0443.2005.01225.x . ПМИД 16367984 .
- ^ «Исследование носкапина у пациентов с неходжкинской лимфомой низкой степени злокачественности или хроническим лимфоцитарным лейкозом, резистентным к химиотерапии» . ClinicalTrials.gov . 22 мая 2014 г.
- ^ «Исследование носкапина HCl (CB3304) у пациентов с рецидивирующей или рефрактерной множественной миеломой» . ClinicalTrials.gov . 7 октября 2016 г.
- ^ Митчелл И.Д., Карлтон Дж.Б., Чан М.Ю., Робинсон А., Сандерленд Дж. (ноябрь 1991 г.). «Носкапин-индуцированная полиплоидия in vitro». Мутагенез . 6 (6): 479–486. дои : 10.1093/mutage/6.6.479 . ПМИД 1800895 .
- ^ Шулер М., Мюльбауэр П., Гуззи П., Истмонд Д.А. (январь 1999 г.). «Носкапина гидрохлорид разрушает митотическое веретено в клетках млекопитающих и индуцирует анеуплоидию, а также полиплоидию в культивируемых лимфоцитах человека» . Мутагенез . 14 (1): 51–56. дои : 10.1093/mutage/14.1.51 . ПМИД 10474821 .
- ^ Ли Ю, Smolke CD (июль 2016 г.). «Инженерный биосинтез противоракового алкалоида носкапина в дрожжах» . Природные коммуникации . 7 : 12137. Бибкод : 2016NatCo...712137L . дои : 10.1038/ncomms12137 . ПМЦ 4935968 . ПМИД 27378283 .
- ^ Ли Ю, Ли С, Тоди К., Тренчард И, Крейвенс А., Смолке CD (апрель 2018 г.). «Полный биосинтез носкапина и галогенированных алкалоидов в дрожжах» . Труды Национальной академии наук Соединенных Штатов Америки . 115 (17): E3922–E3931. Бибкод : 2018PNAS..115E3922L . дои : 10.1073/pnas.1721469115 . ПМЦ 5924921 . ПМИД 29610307 .
- ^ Крис Х., О'Коннор С.Э. (апрель 2016 г.). «Биокатализаторы из растений-производителей алкалоидов» . Современное мнение в области химической биологии . 31 : 22–30. дои : 10.1016/j.cbpa.2015.12.006 . hdl : 21.11116/0000-0002-B92F-A . ПМИД 26773811 .
- ^ Махмудян М., Рахими-Могаддам П. (январь 2009 г.). «Противораковая активность носкапина: обзор». Недавние патенты на открытие противораковых препаратов . 4 (1): 92–97. дои : 10.2174/157489209787002524 . ПМИД 19149691 .
- ^ Йонг С., Дивайн С.М., Абель А.С., Томлинс С.Д., Мутиа Д., Гао X и др. (сентябрь 2021 г.). «Аналоги носкапина, модифицированные 1,3-бензодиоксолом: синтез, антипролиферативная активность и структура, связанная с тубулином». ХимМедХим . 16 (18): 2882–2894. дои : 10.1002/cmdc.202100363 . ПМИД 34159741 . S2CID 235610355 .
- ^ Даш С.Г., Сури С., Нагиредди П.К., Кантевари С., Найк П.К. (сентябрь 2021 г.). «Рациональный дизайн 9-винилфенил носкапина как мощного противоракового средства, связывающего тубулин, и оценка воздействия его комбинации на доцетаксел» . Журнал биомолекулярной структуры и динамики . 39 (14): 5276–5289. дои : 10.1080/07391102.2020.1785945 . ПМИД 32608323 . S2CID 220283865 .
- ^ Мехер Р.К., Прагьяндипта П., Педапати Р.К., Нагиредди П.К., Кантевари С., Найек А.К., Наик П.К. (сентябрь 2021 г.). «Рациональный дизайн новых аналогов N-алкиламина носкапина, их химический синтез и клеточная активность как мощных противораковых средств». Химическая биология и дизайн лекарств . 98 (3): 445–465. дои : 10.1111/cbdd.13901 . ПМИД 34051055 . S2CID 235243148 .
- ^ Патель А.К., Мехер Р.К., Редди П.К., Педапати Р.К., Прагьяндипта П., Кантевари С. и др. (июль 2021 г.). «Рациональный дизайн, химический синтез и клеточная оценка новых 1,3-дииниловых производных носкапина как мощных противораковых средств, связывающих тубулин». Журнал молекулярной графики и моделирования . 106 : 107933. doi : 10.1016/j.jmgm.2021.107933 . ПМИД 33991960 . S2CID 234683080 .
- ^ Патель А.К., Мехер Р.К., Нагиредди П.К., Прагьяндипта П., Педапати Р.К., Кантевари С., Наик П.К. (апрель 2021 г.). «9-Арилиминоноскапиноиды как мощный противораковый агент, связывающий тубулин: химический синтез и клеточная оценка против клеток опухоли молочной железы» . SAR и QSAR в экологических исследованиях . 32 (4): 269–291. дои : 10.1080/1062936X.2021.1891567 . ПМИД 33687299 . S2CID 232161419 .
- ^ Мандави С., Верма С.К., Банджаре Л., Дубей А., Бхатт Р., Тареджа С., Джайн А.К. (2021). «Понимание целевого связывания и пространственных отпечатков аналогов носкапиноидов как ингибиторов тубулина». Медицинская химия . 17 (6): 611–622. дои : 10.2174/1573406416666200117120348 . ПМИД 31951171 . S2CID 210701250 .
- ^ Рахманян-Девин П., Барадаран Рахими В., Джаафари М.Р., Голмохаммадзаде С., Саней-Фар З., Аскари В.Р. (30 ноября 2021 г.). «Носкапин, новое лекарство от различных заболеваний: механистический обзор» . Доказательная дополнительная и альтернативная медицина . 2021 : 8402517. doi : 10.1155/2021/8402517 . ПМЦ 8648453 . ПМИД 34880922 .