Ингибитор митоза

Ингибитор митоза , ингибитор микротрубочек или ингибитор тубулина — это препарат, который ингибирует митоз или деление клеток и используется при лечении рака , подагры и грибка ногтей . Эти препараты разрушают микротрубочки — структуры, которые разрывают хромосомы при делении клетки. Ингибиторы митоза используются при лечении рака , поскольку раковые клетки способны расти посредством непрерывного деления , которое в конечном итоге распространяется по организму ( метастазирует ). Таким образом, раковые клетки более чувствительны к ингибированию митоза, чем нормальные клетки. Ингибиторы митоза также используются в цитогенетике (исследовании хромосом), где они останавливают деление клеток на стадии, когда хромосомы можно легко исследовать. [ 1 ]
Ингибиторы митоза получают из природных веществ, таких как растительные алкалоиды , и предотвращают митоз клеток, нарушая полимеризацию микротрубочек, предотвращая тем самым рост рака. Микротрубочки — это длинные, похожие на веревки белки, которые проходят через клетку и перемещают клеточные компоненты. Микротрубочки представляют собой длинные полимеры , состоящие из более мелких единиц ( мономеров ) белка тубулина . Микротрубочки создаются во время нормального функционирования клеток путем сборки (полимеризации) компонентов тубулина и разбираются, когда они больше не нужны. Одной из важных функций микротрубочек является перемещение и разделение хромосом и других компонентов клетки для клеточного деления ( митоза ). Ингибиторы митоза мешают сборке и разборке тубулина на полимеры микротрубочек. Это прерывает деление клеток, обычно во время фазы митоза (М) клеточного цикла , когда два набора полностью сформированных хромосом должны разделиться на дочерние клетки. [ 2 ] [ 3 ] Молекулы, связывающие тубулин, вызвали значительный интерес после внедрения таксанов в клиническую онкологию и широкого использования алкалоидов барвинка .
Примеры митотических ингибиторов, часто используемых при лечении рака, включают паклитаксел , доцетаксел , винбластин , винкристин и винорелбин . [ 1 ] Колхицин и гризеофульвин являются ингибиторами митоза, используемыми при лечении подагры и грибка ногтей соответственно.
Микротрубочки
[ редактировать ]
Микротрубочки являются ключевыми компонентами цитоскелета эукариотических клеток и играют важную роль в различных клеточных функциях, таких как внутриклеточная миграция и транспорт, поддержание формы клеток, полярность, передача сигналов клеткам и митоз. [ 4 ] Они играют решающую роль в делении клеток , участвуя в движении и прикреплении хромосом на различных стадиях митоза. Таким образом, динамика микротрубочек является важной целью для разработки противораковых препаратов . [ 5 ]
Структура
[ редактировать ]Микротрубочки состоят из двух субъединиц глобулярного белка : α- и β-тубулина. Эти две субъединицы объединяются, образуя α,β- гетеродимер , который затем собирается в нитевидную трубчатую структуру. Гетеродимеры тубулина располагаются «голова к хвосту», при этом α-субъединица одного димера контактирует с β-субъединицей другого. Такое расположение приводит к образованию длинных белковых волокон, называемых протофиламентами.
Эти протофиламенты образуют основу полой цилиндрической микротрубочки диаметром около 25 нанометров и длиной от 200 нанометров до 25 микрометров. Около 12–13 протофиламентов располагаются параллельно, образуя С-образный белковый лист, который затем скручивается, образуя трубчатую структуру, называемую микротрубочкой. Расположение гетеродимеров «голова к хвосту» придает полярность образующейся микротрубочке, которая имеет α-субъединицу на одном конце и β-субъединицу на другом конце. Конец α-тубулина имеет отрицательный (–) заряд, тогда как конец β-тубулина имеет положительный (+) заряд. [ 4 ] Микротрубочки растут из отдельных мест сборки в клетках, называемых центрами организации микротрубочек (MTOC), которые представляют собой сеть белков, связанных с микротрубочками (MAP). [ 6 ] [ 7 ]
Две молекулы богатого энергией гуанозинтрифосфата (GTP) также являются важными компонентами структуры микротрубочек. Одна молекула ГТФ прочно связана с α-тубулином и не подлежит обмену, тогда как другая молекула ГТФ связана с β-тубулином и может быть легко заменена гуанозиндифосфатом (ГДФ). Стабильность микротрубочки будет зависеть от того, занят ли β-конец GTP или GDP. Микротрубочка, имеющая молекулу GTP на β-конце, будет стабильной и продолжит расти, тогда как микротрубочка, имеющая молекулу GDP на β-конце, будет нестабильной и будет быстро деполимеризоваться. [ 6 ] [ 7 ]
Динамика микротрубочек
[ редактировать ]Микротрубочки не статичны , но представляют собой высокодинамичные полимеры и демонстрируют два типа динамического поведения: « динамическую нестабильность » и « беговую дорожку ». Динамическая нестабильность — это процесс, при котором концы микротрубочек переключаются между периодами роста и укорочения. Эти два конца не равны: конец α-тубулина с кольцом (-) менее динамичен, в то время как более динамичный конец β-тубулина с кольцом (+) растет и укорачивается быстрее. Микротрубочка претерпевает длительные периоды медленного удлинения, короткие периоды быстрого укорочения, а также паузу, во время которой не происходит ни роста, ни укорочения. [ 4 ] [ 7 ] [ 8 ] Динамическая нестабильность характеризуется четырьмя переменными: скоростью роста микротрубочек; скорость сокращения; частота перехода от состояния роста или паузы к укорочению (называемая « катастрофой ») и частота перехода от сокращения к росту или паузе (называемая « спасением »).
Другое динамическое поведение, называемое беговой дорожкой, представляет собой чистый рост микротрубочек на одном конце и чистое укорочение на другом конце. Он включает в себя внутренний поток субъединиц тубулина от плюсового конца к минусовому концу. Оба динамических поведения важны, и конкретная микротрубочка может проявлять преимущественно динамическую нестабильность, беговую дорожку или смесь того и другого. [ 8 ] [ 9 ]
Механизм действия
[ редактировать ]Агенты, действующие как ингибиторы тубулина, также действуют как ингибиторы деления клеток. Микротрубочка существует в непрерывном динамическом состоянии роста и укорочения за счет обратимой ассоциации и диссоциации гетеродимеров α/β-тубулина на обоих концах. Такое динамическое поведение и, как следствие, контроль над длиной микротрубочек жизненно важны для правильного функционирования митотического веретена при митозе, т.е. клеточном делении.
Микротрубочки участвуют в разных стадиях клеточного цикла . Во время первой стадии, или профазы , микротрубочки, необходимые для деления клеток, начинают формироваться и расти по направлению к вновь образовавшимся хромосомам, образуя пучок микротрубочек, называемый митотическим веретеном . Во время прометафазы и метафазы это веретено прикрепляется к хромосомам в определенной точке, называемой кинетохорой , и претерпевает несколько периодов роста и сокращения, настраиваясь на возвратно-поступательные колебания хромосом. В анафазе микротрубочки, прикрепленные к хромосомам, также поддерживают тщательно регулируемый процесс укорочения и удлинения. Таким образом, присутствия препарата, который может подавлять динамику микротрубочек, достаточно, чтобы блокировать клеточный цикл и привести к гибели клеток в результате апоптоза . [ 5 ] [ 10 ] [ 11 ]
Ингибиторы тубулина, таким образом, действуют, вмешиваясь в динамику микротрубочек, т.е. на их рост ( полимеризация ) и укорочение (деполимеризация). Один класс ингибиторов действует путем ингибирования полимеризации тубулина с образованием микротрубочек и называется ингибиторами полимеризации, подобно аналогам колхицина и алкалоидам барвинка . Они уменьшают массу полимера микротрубочек в клетках при высоких концентрациях и действуют как агенты, дестабилизирующие микротрубочки. Другой класс ингибиторов действует путем ингибирования деполимеризации полимеризованного тубулина и увеличения массы полимера микротрубочек в клетках. Они действуют как агенты, стабилизирующие микротрубочки, и называются ингибиторами деполимеризации, подобно аналогам паклитаксела . [ 4 ] Эти три класса лекарств, по-видимому, действуют по несколько разному механизму .

Аналоги колхицина блокируют деление клеток, разрушая микротрубочки. Сообщалось, что β-субъединица тубулина участвует в связывании колхицина. Он связывается с растворимым тубулином, образуя комплекс колхицин-тубулин. Этот комплекс вместе с нормальными тубулинами затем подвергается полимеризации с образованием микротрубочек. Однако присутствие этого комплекса ТС предотвращает дальнейшую полимеризацию микротрубочек. Этот комплекс вызывает конформационные изменения , которые блокируют дальнейшее присоединение димеров тубулина и тем самым предотвращают рост микротрубочек. Поскольку комплекс ТС замедляет добавление новых димеров, микротрубочки разбираются из-за структурного дисбаланса или нестабильности во время метафазы митоза. [ 13 ]
Алкалоиды барвинка связываются с β-субъединицей димеров тубулина в отдельной области, называемой связывающим домен барвинка. Они быстро связываются с тубулином, причем это связывание обратимо и не зависит от температуры (от 0 °C до 37 °C). В отличие от колхицина, алкалоиды барвинка напрямую связываются с микротрубочками. Они не образуют сначала комплекс с растворимым тубулином и не сополимеризуются с образованием микротрубочек, однако способны вызывать конформационные изменения тубулина в связи с самоассоциацией тубулина. [ 8 ] Алкалоиды барвинка связываются с тубулином с высоким сродством на концах микротрубочек, но с низким сродством к участкам тубулина, расположенным по бокам цилиндра микротрубочек. Связывание этих препаратов с сайтами с высоким сродством приводит к сильному кинетическому подавлению обмена тубулина даже при низкой концентрации лекарства, в то время как их связывание с сайтами с низким сродством при относительно высокой концентрации лекарства деполимеризует микротрубочки. [ 5 ]
В отличие от колхицина и алкалоидов барвинка, паклитаксел усиливает полимеризацию микротрубочек, способствуя как фазам нуклеации , так и элонгации реакции полимеризации , а также снижает критическую концентрацию субъединицы тубулина (т. е. концентрацию растворимого тубулина в равновесном состоянии). Микротрубочки, полимеризованные в присутствии паклитаксела, чрезвычайно стабильны. [ 5 ] Механизм связывания паклитаксела имитирует механизм связывания нуклеотида GTP, но имеет некоторые важные различия. GTP связывается на одном конце димера тубулина, поддерживая контакт со следующим димером вдоль каждого протофиламента, в то время как паклитаксел связывается с одной стороной β-тубулина, поддерживая контакт со следующим протофиламентом. GTP связывается с несобранными димерами тубулина, тогда как сайты связывания паклитаксела расположены только в собранном тубулине. Гидролиз GTP позволяет разбирать и регулировать систему микротрубочек; однако активация тубулина паклитакселом приводит к постоянной стабилизации микротрубочек. Таким образом, было описано, что подавление динамики микротрубочек является основной причиной ингибирования деления клеток и гибели опухолевых клеток в клетках, обработанных паклитакселом. [ 14 ]
Отношения структура-активность (SAR)
[ редактировать ]
Колхицин является одним из старейших известных антимитотических препаратов, и в последние годы [ когда? ] было проведено много исследований с целью выделения или разработки соединений, имеющих аналогичную структуру, но высокую активность и меньшую токсичность . Это привело к открытию ряда аналогов колхицина. Структура колхицина состоит из трех колец: триметоксибензольного кольца (кольцо А), метокситропонового кольца (кольцо С) и семичленного кольца (кольцо В) с ацетамидной группой, расположенной в положении С-7. Триметоксифенильная группа колхицина не только помогает стабилизировать комплекс тубулин-колхицин, но также важна для антитубулиновой активности в сочетании с кольцом C. 3-метоксигруппа увеличивает способность связывания, тогда как 1-метоксигруппа помогает достичь правильного конформация молекулы. Стабильность тропонового кольца и положение метокси- и карбонильной группы имеют решающее значение для связывающей способности соединения. 10-метоксигруппу можно заменить галогеном, алкилом, алкокси или аминогруппами, не влияя на сродство связывания тубулина, тогда как объемные заместители снижают активность. Кольцо B при расширении показало пониженную активность, однако считается, что кольцо и его боковая цепь C-7 влияют на конформацию аналогов колхицина, а не на их способность связывать тубулин. Замена в положении С-5 приводила к потере активности, тогда как присоединение кольцевидного гетероциклические кольцевые системы с кольцом B привели к образованию очень сильнодействующего соединения. [ 13 ]

Паклитаксел добился больших успехов в качестве противоракового препарата, однако предпринимаются постоянные усилия по повышению его эффективности и разработке более активных аналогов, обладающих большей биодоступностью и специфичностью . Важность С-13-замещенной боковой цепи фенилизосерина для биологической активности паклитаксела известна уже давно. Было протестировано несколько замен при замене C-3'. Замена С-3'-фенильной группы на алкильную или алкинильную группы значительно усиливала активность, а наличие в этом положении группы CF 3 в сочетании с модификацией 10-Ас другими ацильными группами повышало активность в несколько раз. Другая модификация C-3' с циклопропановыми и эпоксидными фрагментами также оказалась эффективной. Было обнаружено, что большинство аналогов без кольца А гораздо менее активны, чем сам паклитаксел. Аналоги с амидной боковой цепью при С-13 менее активны, чем их сложноэфирные аналоги. Также дезоксигенация в положении 1 показала снижение активности. Получение 10-α-спироэпоксида и его эфира 7-МОМ дало соединения, имеющие сравнимые цитотоксичность и активность сборки тубулина такие же, как у паклитаксела. Замена на C-6-α-OH и C-6-β-OH давала аналоги, которые были эквивалентны паклитакселу в анализе сборки тубулина. Наконец, оксетановое кольцо играет важную роль во взаимодействии с тубулином. обнаружено, что [ 15 ]
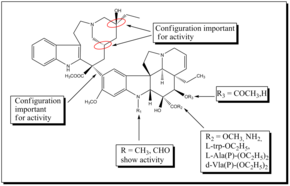
Винбластин — очень сильнодействующий препарат, который также имеет серьезные побочные эффекты, особенно на нервную систему. Поэтому были разработаны новые синтетические аналоги с целью получения более эффективных и менее токсичных препаратов. Стереохимические при C-20', C-16' и C-14 ' конфигурации в части велбанамина имеют решающее значение, и инверсия приводит к потере активности. Карбоксиметильная группа C-16' важна для активности, поскольку декарбоксилированный димер неактивен. Структурные вариации C-15'-C-20' в велбанаминовом кольце хорошо переносятся. Верхнескелетная модификация винбластина дала винорелбин, который проявляет активность , сравнимую с активностью винбластина. Другим полученным аналогом было дифторпроизводное винорелбина, которое показало улучшенную противоопухолевую активность in vivo. Было обнаружено, что фторирование винорелбина в положении С-19 резко увеличивает его активность in vivo . Большинство исследований SAR касаются виндолиновой части бис-индольных алкалоидов , поскольку модификация по C-16 и C-17 открывает хорошие возможности для разработки новых аналогов. Замена сложноэфирной группы амидной группой у С-16 привела к созданию виндезина. Аналогично замена ацетильной группы у C-16 на L-trp-OC. 2 H 5 , d-Ala(P)-(OC 2 H 5 ) 2 , L-Ala(P)-(OC 2 H 5 ) 2 и I-Vla(P)-(OC 2 H 5 ) 2 дали начало к новым аналогам, обладающим антитубулиновой активностью. Также было обнаружено, что индольная метильная группа виндолина представляет собой полезную позицию для потенциальной функционализации и разработки новых, мощных производных винбластина. Новая серия полусинтетических С-16-спирооксазолидин-1,3-дионов, полученных из 17-деацетилвинбластина, проявила хорошую антитубулиновую активность и меньшую цитотоксичность. Винглицинат, глицинатное пролекарство, полученное из группы винбластина C-17-OH, проявлял аналогичную противоопухолевую активность и токсичность, что и винбластин. [ 16 ]
Использование в цитогенетике
[ редактировать ]Цитогенетика , изучение хромосомного материала путем анализа G-полосных хромосом, широко использует митотические ингибиторы. Чтобы подготовить препарат для цитогенетического исследования, к исследуемым клеткам добавляют ингибитор митоза. Это останавливает клетки во время митоза, в то время как хромосомы все еще видны. Когда клетки центрифугируют и помещают в гипотонический раствор , они набухают, распространяя хромосомы. После подготовки хромосомы клеток можно просмотреть под микроскопом, чтобы изучить структуру полос хромосом. Этот эксперимент имеет решающее значение для многих форм исследований рака.
Тубулинсвязывающие препараты
[ редактировать ]Молекулы, связывающие тубулин, отличаются от других противораковых препаратов по механизму действия, поскольку они нацелены на митотическое веретено, а не на ДНК. Тубулинсвязывающие препараты классифицируются по механизму действия и месту связывания. [ 6 ] [ 17 ] [ 18 ] как:
I. Ингибиторы деполимеризации тубулина
[ редактировать ]а) Лиганды сайта паклитаксела , включая паклитаксел, эпотилон, доцетаксел, дискодермолид и т. д.
II. Ингибиторы полимеризации тубулина
[ редактировать ]а) Сайт связывания колхицина, включает колхицин, комбрестатин, 2-метоксиэстрадиол, метоксибензолсульфонамиды (Е7010) и т. д.
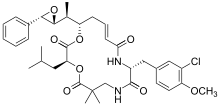
б) сайт связывания алкалоидов барвинка, [ 19 ] включает винбластин, винкристин, винорелбин, винфлунин, доластатин, галихондрины, гемиастерлины, криптофизин 52 и др.
- Место связывания различных лекарств на тубулине
-
Таксол связан с тубулином.
-
Винбластин связан с тубулином.
-
Колхицин связан с тубулином.
| Классы ингибиторов тубулина | Привязка домена | Родственные препараты или аналоги | Терапевтическое использование | Стадия клинической разработки |
|---|---|---|---|---|
| Ингибиторы полимеризации | Домен Винча | Винбластин | Болезнь Ходжкина , герминогенный рак яичек | в клиническом использовании; В стадии разработки 22 комбинированных исследования |
| Винкристин | Лейкемия , лимфомы | В клиническом использовании; В стадии разработки 108 комбинированных исследований. | ||
| Винорелбин | Солидные опухоли, лимфомы, рак легких | В клиническом использовании; В стадии разработки находятся 29 фазы I –III клинических исследований (одиночные и комбинированные). | ||
| Винфлунин | Мочевой пузырь , немелкоклеточный рак легкого , рак молочной железы | Фаза III | ||
| Критофицин 52 | Солидные опухоли | Третий этап завершен | ||
| Галихондрины | – | Фаза I | ||
| Доластатины | Потенциальный агент, воздействующий на сосуды | Фаза I; этап II завершен | ||
| Гемиастерлины | – | Фаза I | ||
| Колхициновый домен | Колхицин | Неопухолевые подагра заболевания ( семейная , средиземноморская лихорадка ) | Одобрено в 2009 году FDA в рамках Инициативы по неутвержденным лекарствам. [ нужна ссылка ] | |
| Комбретастатины | Потенциальный агент, воздействующий на сосуды | Фаза I | ||
| 2-метоксиэстрадиол | – | Фаза I | ||
| Е7010 | Солидные опухоли | Фаза I, II | ||
| Ингибиторы деполимеризации | Таксановый сайт | Паклитаксел (Таксол) | яичников опухоли , молочной железы и легких, саркома Капоши ; исследования с многочисленными другими опухолями | В клиническом использовании; 207 исследований фазы I–III в США; TL00139 находится на стадии I испытаний. |
| Доцетаксел (Таксотер) | Опухоли простаты , головного мозга и легких | 8 исследований в США (фазы I–III) | ||
| Эпотилон | Опухоли, устойчивые к паклитакселу | Фазы I–III | ||
| Дискодермолид | – | Фаза I |
| Ингибиторы тубулина | |||
|---|---|---|---|
| Домен Винча |  |
 |
|
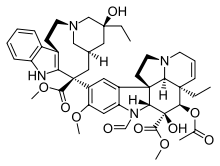
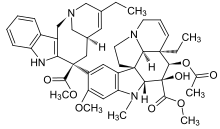
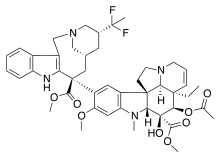
| Винбластин | Винкристин | Винорелбин | |
 |
 |

| |
| Винфлунин | Криптофицин 52 | Галихондрин Б | |
 |
 |

| |
| Доластатин 10 | Доластатин 15 | Гемиастерлин А | |

| |||
| Гемиастерлин Б | |||
| Колхициновый домен |  |
 |

|
| Колхицин | Комбретастатин | Е7010 | |
| |||
| 2-метоксиэстрадиол | |||
| САЙТ ТАКСАНА | 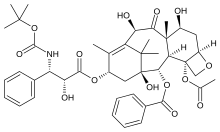 |
 |

|
| Доцетаксел | Паклитаксел | Эпотилон А | |
 |

| ||
| Эпотилон Б | Дискодермолид | ||
Конкретные агенты
[ редактировать ]Таксаны
[ редактировать ]Таксаны – это сложные терпены, вырабатываемые растениями рода Taxus (тис). Первоначально полученные из тихоокеанского тиса , теперь они синтезируются искусственно. клетки Их основным механизмом является нарушение функции микротрубочек за счет стабилизации образования микротрубочек. Микротрубочки необходимы для митотического размножения , поэтому, инактивируя функцию микротрубочек клетки, таксаны ингибируют деление клетки.
- Паклитаксел — используется для лечения рака легких , рака яичников , рака молочной железы и запущенных форм саркомы Капоши . [ 21 ]
- Доцетаксел — используется для лечения рака молочной железы, яичников и немелкоклеточного рака легких . [ 22 ] [ 23 ]
Алкалоиды барвинка
[ редактировать ]
Алкалоиды барвинка — это амины , вырабатываемые галлюциногенным растением Catharanthus roseus (мадагаскарский барвинок). Алкалоиды барвинка ингибируют микротрубочек полимеризацию .
- Винбластин — используется для лечения лейкемии , лимфомы Ходжкина , немелкоклеточного рака легких, рака молочной железы и рака яичек . Он также является компонентом большого количества схем химиотерапии . Винбластин и винкристин были выделены из мадагаскарского барвинка Catharanthus roseus . На Мадагаскаре барвинок розовый традиционно использовался для лечения диабета. Фактически, на протяжении веков его использовали во всем мире для лечения всех видов заболеваний: от укусов ос в Индии до глазных инфекций в странах Карибского бассейна. В 1950-х годах исследователи начали анализировать растение и обнаружили, что оно содержит более 70 алкалоидов. Было обнаружено, что некоторые из них снижают уровень сахара в крови, а другие действуют как кровоостанавливающие средства . Самым интересным было то, что винбластин и винкристин снижали количество лейкоцитов в крови. Высокое количество лейкоцитов в крови указывает на лейкемию, поэтому был открыт новый противораковый препарат. Эти два алкалоида связываются с тубулином, не позволяя клетке создавать веретена, необходимые для деления. Это отличается от действия таксола, который препятствует делению клеток, предотвращая разрушение веретена. Винбластин в основном полезен для лечения Лимфома Ходжкина , прогрессирующий рак яичек и прогрессирующий рак молочной железы. Винкристин в основном используется для лечения острого лейкоза и других лимфом.
- Винкристин — используется для лечения лимфомы , рака молочной железы, рака легких и острого лимфобластного лейкоза . [ 24 ]
- Виндезин — используется для лечения лейкемии, лимфомы, меланомы , рака молочной железы и рака легких. [ 24 ]
- Винорелбин — используется для лечения рака молочной железы и немелкоклеточного рака легких. [ 24 ] Он был разработан под руководством французского фармацевта Пьера Пуатера, который в 1989 году получил первоначальную лицензию на производство препарата под торговой маркой Навельбин. Винорелбин также известен как винорелбина тартрат, препарат представляет собой полусинтетический аналог другого противоракового препарата – винбластина. Винорелбин включен в класс фармацевтических препаратов, известных как алкалоиды барвинка, и многие из его характеристик имитируют химический состав и биологические механизмы цитотоксических препаратов винкристина и винбластина. Винорелбин продемонстрировал многообещающую активность против рака молочной железы и проходит клинические испытания для лечения других типов опухолей.
- Винфлунин — новый фторированный алкалоид барвинка, который в настоящее время проходит II фазу клинических испытаний и в доклинических исследованиях продемонстрировал превосходящую противоопухолевую активность по сравнению с винорелбином и винбластином. Винфлунин блокирует митоз при переходе метафаза/анафаза, что приводит к апоптозу. [ 25 ] Винфлунин — химиотерапевтический препарат, используемый для лечения прогрессирующего рака мочевого пузыря и уротелиального тракта. Его еще называют Джавлор. Он лицензирован для людей, которые уже прошли химиотерапию цисплатином или карбоплатином.
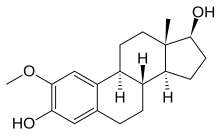
Колхицин
[ редактировать ]Колхицин — алкалоид, полученный из безвременника осеннего ( Colchicum Autumnale ). Он ингибирует митоз путем ингибирования полимеризации микротрубочек. Хотя колхицин не используется для лечения рака у людей, его обычно используют для лечения острых приступов подагры . [ 26 ]
Колхицин — противовоспалительный препарат, который постоянно используется уже более 3000 лет. Колхицин — это пероральный препарат, который, как известно, используется для лечения острой подагры и предотвращения острых приступов семейной средиземноморской лихорадки (СЛС). Однако использование колхицина ограничено его высокой токсичностью в других методах лечения. Известно, что колхицин ингибирует деление и пролиферацию клеток. Ранние исследования показали, что колхицин разрушает митотическое веретено. Впоследствии было показано, что растворение микротрубочек ответственно за влияние колхицина на митотическое веретено и клеточную пролиферацию. [ 27 ]
Подофиллотоксин
[ редактировать ]Подофиллотоксин, полученный из растения майской яблони , используется для лечения вирусных инфекций кожи, а синтетические аналоги этой молекулы используются для лечения некоторых типов рака.
Гризеофульвин
[ редактировать ]Гризеофульвин , полученный из вида Penicillium, является ингибитором митоза, который используется в качестве противогрибкового препарата. Ингибирует сборку грибковых микротрубочек.
Другие
[ редактировать ]- Глазиовианин А обычно выделяют из листьев бразильского дерева Ateleia glazioviana Baill. [ 28 ]
- Криптофицин 52 выделен из сине-зеленой водоросли Nostoc sp. GSV 224. Криптофицины представляют собой семейство родственных депсипептидов, проявляющих высокую цитотоксическую активность. Криптофицин 52 изначально разрабатывался как фунгицид, но был слишком токсичен для клинического использования. Позже исследования были сосредоточены на рассмотрении криптофицина как яда микротрубочек, предотвращающего образование митотического веретена. [ 12 ] Криптофицин 52 продемонстрировал высокую мощную антимитотическую активность, противодействуя динамике микротрубочек веретена. [ 6 ] Кроме того, интерес к этому препарату еще больше возрос после открытия того, что криптофицин демонстрирует пониженную чувствительность к насосу множественной лекарственной устойчивости и не демонстрирует снижения активности в ряде устойчивых к лекарственным средствам клеточных линий .
- Галихондрин B был впервые выделен из Halichondria okadai , а позже из неродственных губок Axinella carteri и Phankella carteri . Галихондрин Б представляет собой сложный полиэфир макролид, который синтезируется и останавливает рост клеток в субнаномолярных концентрациях. [ 6 ] Галихондрин B является неконкурентным ингибитором связывания винкристина и винбластина с тубулином, что позволяет предположить, что препараты связываются с сайтом связывания барвинка или близлежащим сайтом. Выделение галихондрина B из двух неродственных родов губок привело к предположению, что галихондрин B на самом деле является микробом, а не метаболитом губки, поскольку губки поддерживают широкий спектр микробов. Если это так, технологии ферментации могут обеспечить полезный запас галихондрина Б.
- Доластатины были выделены из морского зайца Dolabella auricleria , небольшого морского моллюска , и считаются источником яда, использованного при убийстве сына императора Клавдия римского в 55 году нашей эры. Доластатины 10 и 15 представляют собой новые пентапептиды и обладают мощными антимитотическими свойствами. Они цитотоксичны для ряда клеточных линий в субнаномолярных концентрациях. Пептиды доластатинов 10 и 15 неконкурентно ингибируют связывание винкристина с тубулином. Доластатин 10 в 9 раз более эффективен, чем доластатин 15, и оба они более эффективны, чем винбластин. [ 6 ] Доластатины также усиливают и стабилизируют связывание колхицина с тубулином.
- Гемиастерлины были выделены из морской губки Cymbastela sp . Гемиастерлины представляют собой семейство сильнодействующих цитотоксических пептидов. Гемиастерлин А и гемиастерлин В проявляют сильную активность против линии клеток P388 и ингибируют деление клеток путем связывания с сайтом алкалоида барвинка на тубулине. Гемиастерлин А и В проявляют более сильную антипролиферативную активность, чем алкалоиды барвинка и паклитаксел.
- Комбретастатины выделяют из ивы южноафриканской Combretum afrum . Комбретастатин является одним из наиболее простых соединений, проявляющих антимитотические эффекты за счет взаимодействия с местом связывания колхицина тубулина, а также одним из наиболее мощных ингибиторов связывания колхицина. [ 6 ] Комбретастатин не распознается насосом множественной лекарственной устойчивости (MDR), клеточным насосом, который быстро выбрасывает чужеродные молекулы из клетки. [ 10 ] Сообщается также, что комбретастатин способен ингибировать ангиогенез, процесс, необходимый для роста опухоли. Помимо этих факторов, одним из недостатков комбретастатина является низкая растворимость в воде.
- E7010 является наиболее активным из сульфонамидных антимитотических агентов, который, как было показано, ингибирует образование микротрубочек путем связывания в месте колхицина. [ 6 ] [ 10 ] Он хорошо растворим в воде в виде кислой соли. Метоксибензолсульфонамид показал хорошие результаты против широкого спектра опухолевых клеток, включая солидные опухоли, устойчивые к алкалоиду барвинка. Результаты исследований на животных показали активность в отношении тканей колоректального рака, рака молочной железы и легких.
- 2-Метоксиэстрадиол является естественным метаболитом гормона эстрадиола млекопитающих и образуется в результате окисления в печени. 2-метоксиэстрадиол цитотоксичен для нескольких линий опухолевых клеток , связывается с колхициновым участком тубулина, индуцируя образование аномальных микротрубочек. 2-Метоксиэстрадиол проявляет сильную апоптотическую активность против быстро растущих опухолевых клеток. Он также обладает антиангиогенной активностью за счет прямого апоптотического воздействия на эндотелиальные клетки. [ 29 ]
- Доцетаксел – полусинтетический аналог паклитаксела, имеющий торговое название Таксотер. Доцетаксел имеет минимальные структурные модификации боковой цепи C13, а замена C10 показала большую растворимость в воде и большую эффективность, чем паклитаксел. Клинические исследования показали, что пациенты, у которых развивается гиперчувствительность к паклитакселу, могут получать доцетаксел без аллергической реакции. [ 6 ]
- Паклитаксел был выделен из коры тихоокеанского тиса Taxus brevifolia Nutt. (Таксовые). Позже его также выделили из деревьев фундука (листья, ветки и орехи) и грибов, живущих на этих деревьях, но концентрация составляет лишь около 10% от концентрации в тисовых деревьях. Паклитаксел также известен как таксол и онксол и является противораковым препаратом. Препарат является препаратом первой линии лечения рака яичников, молочной железы, легких и толстой кишки и второй линией лечения саркомы Капоши, связанной со СПИДом . (Саркома Капоши – это рак кожи и слизистых оболочек, который обычно встречается у пациентов с синдромом приобретенного иммунодефицита, СПИДом). Он настолько эффективен, что некоторые онкологи называют период до 1994 года «эрой до таксола» в лечении рака молочной железы. [ 30 ]
- Эпотилоны получают из ферментирующих почвенных бактерий Sorangium cellulosum , и оказалось, что они слишком токсичны для использования в качестве противогрибкового средства. Эпотилоны представляют собой агенты, стабилизирующие микротрубочки, с механизмом действия, аналогичным таксанам, включая подавление динамики микротрубочек, стабилизацию микротрубочек, стимулирование полимеризации тубулина и увеличение массы полимера в высоких концентрациях. Они вызывают остановку митоза в фазе G2-M клеточного цикла, что приводит к апоптозу. [ 5 ] Эпотилон А и эпотилон В обладают как противогрибковыми, так и цитотоксическими свойствами. Эти эпотилоны являются конкурентными ингибиторами связывания паклитаксела с тубулином, проявляя активность в аналогичных концентрациях. Это открытие позволяет предположить, что эпотилоны и паклитаксел принимают сходные конформации in vivo. Однако эпотилоны примерно в 30 раз более водорастворимы, чем паклитаксел, и более доступны, их легко получить путем ферментации родительской миксобактерии, и их можно получить путем полного синтеза. Эпотилоны также не распознаются механизмами множественной лекарственной устойчивости, поэтому они обладают гораздо более высокой эффективностью, чем паклитаксел, в клеточных линиях с множественной лекарственной устойчивостью. [ 10 ]
- Первоначально было обнаружено, что дискодермолид обладает иммуносупрессивной и противогрибковой активностью. Дискодермолид представляет собой полигидроксилированный морской продукт алкететраен-лактона, выделенный из багамской глубоководной губки Discodermia dissoluta , ингибирующий митоз клеток и индуцирующий образование стабильного полимера тубулина in vitro и считающийся более эффективным, чем паклитаксел, со ЕС 50 значением 3,0 мкМ против 23. мкМ. [ 6 ] Препарат, макролид (полигидроксилированный лактон), является членом структурно разнообразного класса соединений, называемых поликетидами, с заметным химическим механизмом действия. Он стабилизирует микротрубочки клеток-мишеней, по существу останавливая их на определенной стадии клеточного цикла и останавливая деление клеток. Это многообещающий кандидат морского происхождения для лечения некоторых видов рака.
Ограничения
[ редактировать ]Побочные эффекты
[ редактировать ]- периферическая невропатия, вызванная химиотерапией , прогрессирующее, стойкое, часто необратимое покалывание, онемение, сильная боль и гиперчувствительность к холоду, начиная с кистей и стоп, а иногда и с поражением рук и ног. [ 31 ]
- стоматит (изъязвления губ, языка, полости рта)
- тошнота, рвота, диарея, запор, паралитическая непроходимость кишечника, задержка мочи
- подавление костного мозга
- реакции гиперчувствительности – приливы крови, локализованные кожные реакции, сыпь (с или без) зуд, стеснение в груди, боль в спине, одышка, лекарственная лихорадка или озноб.
- скелетно-мышечные эффекты – артралгия и/или миалгия
- сильная слабость
- гипотония
- алопеция
- нейротоксичность [ 32 ]
Человеческий фактор
[ редактировать ]Ограничения в противораковой терапии возникают главным образом по двум причинам; из-за особенностей организма пациента или из-за специфических генетических изменений в опухолевых клетках. Со стороны пациента терапия ограничена плохой абсорбцией препарата, что может привести к низкой концентрации активного вещества в крови и доставке небольшого его количества к опухоли. Низкий уровень препарата в сыворотке крови также может быть вызван быстрым метаболизмом и выведением, связанным со сродством к кишечному и/или печеночному цитохрому Р450 . Другая причина – нестабильность и деградация препаратов в желудочно-кишечной среде. Серьезной проблемой является также вариабельность между пациентами, что обусловливает различную биодоступность после введения одинаковой дозы препарата и различную толерантность к действию химиотерапевтических средств. Вторая проблема особенно важна при лечении людей пожилого возраста. Их организм более слаб, и им необходимо применять более низкие дозы, часто ниже терапевтического уровня. Другой проблемой противораковых средств является их ограниченная растворимость в воде, что существенно снижает абсорбцию лекарства. Проблемы с доставкой препаратов к опухоли возникают также тогда, когда активное вещество имеет высокую молекулярную массу, что ограничивает проникновение в ткани, или когда опухоль имеет большой объем, препятствующий проникновению. [ 4 ] [ 33 ]
Лекарственная устойчивость
[ редактировать ]Множественная лекарственная устойчивость является наиболее важным ограничением в противораковой терапии. Он может развиваться во многих химически различных соединениях. На данный момент известно несколько механизмов развития резистентности. Наиболее распространенным является производство так называемых «вытяжных насосов». Насосы удаляют лекарства из опухолевых клеток, что приводит к снижению концентрации лекарства в мишени ниже терапевтического уровня. Отток вызывается P-гликопротеином, также называемым переносчиком многих лекарств. Этот белок является продуктом гена множественной лекарственной устойчивости MDR1 и членом семейства АТФ-зависимых транспортеров ( АТФ-связывающая кассета ). Р-гликопротеин встречается в каждом организме и служит для защиты организма от ксенобиотиков , участвует в перемещении питательных веществ и других биологически важных соединений внутри одной клетки или между клетками. P-гликопротеин обнаруживает субстраты, когда они проникают в плазматическую мембрану и связываются с ними, что вызывает активацию одного из АТФ-связывающих доменов. Следующим этапом является гидролиз АТФ, что приводит к изменению формы P-gp и открывает канал, по которому лекарство выкачивается из клетки. Гидролиз второй молекулы АТФ приводит к закрытию канала и цикл повторяется. P-гликопротеин имеет сродство к гидрофобным лекарствам с положительным зарядом или электрически нейтральным и часто сверхэкспрессируется при многих раковых заболеваниях человека. Некоторые опухоли, например, рак легких, не сверхэкспрессируют этот транспортер, но также способны развивать резистентность. Было обнаружено, что другой транспортер MRP1 также работает как откачивающий насос, но в этом случае субстратами являются отрицательно заряженные природные соединения или лекарства, модифицированные глутатионом, конъюгацией, гликозилированием, сульфатированием и глюкуронилированием. Лекарства могут проникать в клетку несколькими способами. Основными путями являются: диффузия через плазматическую мембрану, через рецептор или транспортер или через процесс эндоцитоза . Рак может развить устойчивость в результате мутаций своих клеток, которые приводят к изменениям на поверхности клеток или нарушению эндоцитоза. Мутация может устранить или изменить транспортеры или рецепторы, которые позволяют лекарствам проникать в опухолевую клетку. Другой причиной лекарственной устойчивости является мутация β-тубулина, которая вызывает изменения в сайтах связывания, и данное лекарство не может быть связано со своей мишенью. Опухоли также меняют экспрессирующие изоформы тубулина на те, которые не являются мишенью для антимитотических препаратов, например, сверхэкспрессируют βIII-тубулин. Кроме того, опухолевые клетки экспрессируют другие виды белков и изменяют динамику микротрубочек, чтобы противодействовать действию противораковых препаратов. Лекарственная устойчивость может развиться и из-за перерыва в терапии. [ 4 ] [ 7 ] [ 8 ] [ 33 ]
Другие
[ редактировать ]- Незначительная клиническая эффективность – часто соединения проявляют активность in vitro , но не обладают противоопухолевой активностью в клинике. [ 34 ]
- Плохая растворимость в воде лекарств, которые необходимо растворять в полиоксиэтилированном касторовом масле или полисорбате, что вызывает реакции гиперчувствительности. Было высказано предположение, что эти растворители также могут уменьшить доставку лекарств к клеткам-мишеням. [ 12 ] [ 35 ]
- Биодоступность [ 36 ]
- Предел дозы – более высокие дозы вызывают высокую токсичность, а длительное применение приводит к кумулятивной нейротоксичности и гематопоэтической токсичности. [ 12 ]
- Нейропатия, являющаяся значительным побочным эффектом, может развиться в любой момент терапии и потребовать прерывания лечения. После исчезновения симптомов терапию можно начать снова, но перерыв позволяет опухоли развить резистентность. [ 20 ]
- Плохое проникновение через гематоэнцефалический барьер . [ 20 ]
Открытие и развитие
[ редактировать ]Первым известным соединением, которое связывается с тубулином, был колхицин, он был выделен из безвременника осеннего , Colchicum Autumnale , но не использовался для лечения рака. Первыми противораковыми препаратами, одобренными для клинического применения, были алкалоиды барвинка, винбластин и винкристин в 1960-х годах.
Они были выделены из экстрактов листьев растения Catharanthus Roseus ( Vinca Rosea ) в Университете Западного Онтарио в 1958 году. [ 5 ] Первыми препаратами являются таксаны и паклитаксел , обнаруженные в экстрактах коры тиса Taxus brevifolia в 1967 году Монро Уолл и Мансухом Вани, но его активность по ингибированию тубулина не была известна до 1979 года.
Тисы являются плохим источником активных веществ, что ограничивало разработку таксанов более 20 лет, пока не был открыт путь синтеза. [ 5 ] В декабре 1992 года паклитаксел был одобрен для использования в химиотерапии. [ 37 ]
Будущая разработка лекарств
[ редактировать ]Из-за многочисленных побочных эффектов и ограничений в применении необходимы новые препараты с лучшими свойствами. Особенно желательны улучшения противоопухолевой активности, профиля токсичности, состава лекарственного средства и фармакологии. [ 35 ] В настоящее время предложено несколько подходов к разработке новых терапевтических средств с лучшими свойствами.
- Открытие агентов, которые не являются субстратом для эффлюксного насоса, или модификация лекарств в сторону более низкого сродства к транспортирующим белкам. Следующим подходом является открытие ингибиторов P-гликопротеина с более высоким сродством к транспортеру, чем у лекарств. Для улучшения пероральной биодоступности предлагается одновременный прием P-gp и ингибиторов цитохрома с противоопухолевыми препаратами. [ 20 ] [ 35 ]
- Разработка ингибиторов, сайт связывания которых находится в α-тубулине. Эта часть димера тубулина остается неиспользованной, поскольку все используемые в настоящее время лекарства связываются с β-тубулином. Исследования в этой области могут открыть новые возможности в лечении и предоставить новый класс ингибиторов.
- Одной из мишеней противораковых препаратов может быть сосудистая сеть опухоли. Преимуществом в этом случае является относительно легкий доступ терапевтических средств к мишени. Известно, что некоторые соединения могут ингибировать образование новых кровеносных сосудов (тормозить процесс ангиогенеза ) или закрывать существующие. Опухолевые клетки умирают очень быстро после прекращения подачи кислорода, что позволяет предположить, что эти агенты особенно интересны. Более того, кажется, что агенты действуют только на сосуды опухоли и не взаимодействуют с нормальными тканями. Механизмы неизвестны, но предполагается, что причиной являются различия между молодой тканью опухоли и зрелой тканью нормальной сосудистой сети. Противососудистые агенты аналогичны колхицину и связываются с сайтом связывания колхицина на β-тубулине, поэтому разработка новых агентов, действующих с сайтом связывания колхицина (который не используется ни одним из одобренных в настоящее время препаратов), кажется многообещающим подходом. [ 5 ]
- Терапия с комбинацией двух или более препаратов, которые имеют разные сайты связывания и/или разные механизмы действия, но имеют неперекрывающиеся побочные эффекты. Это позволит использовать препараты в низких концентрациях, что уменьшит выраженность побочных эффектов, связанных с высокими дозами противораковых препаратов. Повышение эффективности может быть также результатом поддержания низких концентраций лекарств в течение длительного периода времени вместо резкого изменения количества вводимого лекарства. [ 8 ] [ 12 ]
- Липосомы и лекарства, связанные с полимерами, представляют собой многообещающие улучшения в системе доставки. Липосомы позволяют доставлять к опухоли значительные количества препарата без токсического эффекта в нормальных тканях и медленно высвобождать лекарственные препараты, что приводит к пролонгированию фармацевтического действия. Аналогичными свойствами обладают лекарства, связанные с полимером. Кроме того, использование водорастворимых полимеров позволяет гидрофильным противораковым агентам стать растворимыми. Характер связи полимер-лекарство может быть таким, чтобы быть стабильным в нормальных тканях и разрушаться в опухолевой среде, которая более кислая. Такой подход позволяет высвободить активный агент точно в цель. [ 36 ]
- Откройте для себя новые соединения, активные против лекарственно-устойчивых видов рака, механизм действия которых отличается от уже известных лекарств.
- Выяснение всех механизмов резистентности и разработка препаратов, позволяющих ее избежать. [ 12 ]
Этот раздел необходимо обновить . ( декабрь 2016 г. ) |
См. также
[ редактировать ]- Лекарственные формы
- Тубулин
- Микротрубочка
- Рак
- Химиотерапия
- Дизайн лекарств
- Винбластин
- Винкристин
- Винорелбин
- Винфлунин
- Криптофицин
- Галихондрин Б
- Колхицин
- Комбретастатины
- 2-метоксиэстрадиол
- Доцетаксел
- Паклитаксел
- Эпотилоны
- Дискодермолид
- Эрибулин , новый агент
Ссылки
[ редактировать ]- ^ Перейти обратно: а б «Каковы различные типы химиотерапевтических препаратов?» . Американское онкологическое общество. Архивировано из оригинала 17 июля 2007 года . Проверено 5 августа 2007 г.
- ^ «Определение митотического ингибитора» . Национальный институт рака. Архивировано из оригинала 13 августа 2024 года . Проверено 5 августа 2007 г.
- ^ «Варианты лечения: ингибиторы митоза» . Дайджест наркотиков. Архивировано из оригинала 16 февраля 2007 года . Проверено 5 августа 2007 г.
- ^ Перейти обратно: а б с д и ж Перес, Э.А. (2009). «Ингибиторы микротрубочек: дифференциация агентов, ингибирующих тубулин, на основе механизмов действия, клинической активности и резистентности» . Молекулярная терапия рака . 8 (8): 2086–95. дои : 10.1158/1535-7163.MCT-09-0366 . ПМИД 19671735 .
- ^ Перейти обратно: а б с д и ж г час Джордан, М. (2012). «Механизм действия противоопухолевых препаратов, взаимодействующих с микротрубочками и тубулином». Современная медицинская химия. Противораковые агенты . 2 (1): 1–17. дои : 10.2174/1568011023354290 . ПМИД 12678749 .
- ^ Перейти обратно: а б с д и ж г час я дж Ислам, Мохаммед; Искандер, Магди (2004). «Сайты связывания микротубулина как мишень для разработки противораковых агентов». Мини-обзоры по медицинской химии . 4 (10): 1077–104. дои : 10.2174/1389557043402946 . ПМИД 15579115 .
- ^ Перейти обратно: а б с д Пеллегрини, Федерико; Будман, Дэниел Р. (2005). «Обзор: функция тубулина, действие антитубулиновых препаратов и разработка новых лекарств». Исследование рака . 23 (3): 264–73. doi : 10.1081/CNV-200055970 . ПМИД 15948296 . S2CID 45866448 .
- ^ Перейти обратно: а б с д и ж Джордан, Мэри Энн; Уилсон, Лесли (2004). «Микротрубочки как мишень для противораковых препаратов». Обзоры природы Рак . 4 (4): 253–65. дои : 10.1038/nrc1317 . ПМИД 15057285 . S2CID 10228718 .
- ^ ТитоФохо, Роль микротрубочек в клеточной биологии, нейробиологии и онкологии, Humana Press. [ нужна страница ]
- ^ Перейти обратно: а б с д Джордан, Аллан; Хэдфилд, Джон А.; Лоуренс, Николас Дж.; Макгоун, Алан Т. (1998). «Тубулин как мишень для противораковых препаратов: агенты, взаимодействующие с митотическим веретеном». Обзоры медицинских исследований . 18 (4): 259–96. doi : 10.1002/(SICI)1098-1128(199807)18:4<259::AID-MED3>3.0.CO;2-U . ПМИД 9664292 . S2CID 32194348 .
- ^ Бхалла, Капил Н. (2003). «Противораковые агенты, нацеленные на микротрубочки, и апоптоз» . Онкоген . 22 (56): 9075–86. дои : 10.1038/sj.onc.1207233 . ПМИД 14663486 .
- ^ Перейти обратно: а б с д и ж Моррис, П.Г.; Форнье, Миннесота (2008). «Активные агенты микротрубочек: за пределами границ таксанов» . Клинические исследования рака . 14 (22): 7167–72. дои : 10.1158/1078-0432.CCR-08-0169 . ПМИД 19010832 .
- ^ Перейти обратно: а б Чен, Цзин; Лю, Тао; Донг, Сяову; Ху, Юнчжоу (2009). «Недавние разработки и анализ SAR ингибиторов сайта связывания колхицина». Мини-обзоры по медицинской химии . 9 (10): 1174–90. дои : 10.2174/138955709789055234 . ПМИД 19817710 .
- ^ Абал, М.; Андреу, Дж.; Барасоайн, И. (2003). «Таксаны: мишени для микротрубочек и центросом и механизмы действия, зависящие от клеточного цикла». Текущие цели в области лекарств от рака . 3 (3): 193–203. дои : 10.2174/1568009033481967 . ПМИД 12769688 .
- ^ Фанг, В.-; Лян, X.- (2005). «Последние достижения в области взаимосвязи структура-активность и механистических исследований аналогов таксола». Мини-обзоры по медицинской химии . 5 (1): 1–12. дои : 10.2174/1389557053402837 . ПМИД 15638787 .
- ^ Ликсин Чжан, Арнольд Л. Демейн (2005), Натуральные продукты: открытие лекарств и терапевтическая медицина. Натуральные продукты: открытие лекарств и терапевтическая медицина. Архивировано 30 октября 2023 года в Wayback Machine. [ нужна страница ]
- ^ Хамель, Эрнест (1996). «Антимитотические натуральные продукты и их взаимодействие с тубулином» . Обзоры медицинских исследований . 16 (2): 207–31. doi : 10.1002/(SICI)1098-1128(199603)16:2<207::AID-MED4>3.0.CO;2-4 . ПМИД 8656780 . S2CID 647015 . Архивировано из оригинала 22 августа 2020 года . Проверено 21 января 2024 г.
- ^ Кингстон, Дэвид Джи (2009). «Тубулин-интерактивные натуральные продукты как противораковые агенты (1)» . Журнал натуральных продуктов . 72 (3): 507–15. дои : 10.1021/np800568j . ПМК 2765517 . ПМИД 19125622 .
- ^ Крэгг, Гордон М.; Ньюман, Дэвид Дж. (2004). «Повесть о двух мишенях опухоли: топоизомераза I и тубулин. Вклад Стены и Вани в химиотерапию рака †». Журнал натуральных продуктов . 67 (2): 232–44. дои : 10.1021/np030420c . ПМИД 14987065 .
- ^ Перейти обратно: а б с д Куппенс, Иса (2006). «Современное состояние новых ингибиторов тубулина в клинике». Современная клиническая фармакология . 1 (1): 57–70. дои : 10.2174/157488406775268200 . ПМИД 18666378 .
- ^ Сэвилл, Миссури; Литцау, Дж.; Плуда, Дж. М.; Уилсон, Вашингтон; Хамфри, RW; Фейгель, Э.; Стейнберг, С.М.; Бродер, С.; Ярчоан, Р.; Одом, Дж.; Фейерштейн, И. (1995). «Лечение ВИЧ-ассоциированной саркомы Капоши паклитакселом» . Ланцет . 346 (8966): 26–28. дои : 10.1016/S0140-6736(95)92654-2 . ПМИД 7603142 . Архивировано из оригинала 26 июня 2019 года . Проверено 5 июля 2019 г.
- ^ Люсенг-Уильямсон, Калифорния; Фентон, К. (2005). «Доцетаксел: обзор его использования при метастатическом раке молочной железы». Наркотики . 65 (17): 2513–2531. дои : 10.2165/00003495-200565170-00007 . ПМИД 16296875 .
- ^ Кларк, С.Дж.; Ривори, LP (1999). «Клиническая фармакокинетика доцетаксела». Клиническая фармакокинетика . 36 (2): 99–114. дои : 10.2165/00003088-199936020-00002 . ПМИД 10092957 .
- ^ Перейти обратно: а б с «Винкристин (Онковин)» . Архивировано из оригинала 29 июня 2007 года . Проверено 5 августа 2007 г.
- ^ Окунева Татьяна; Хилл, Бриджит Т.; Уилсон, Лесли; Джордан, Мэри Энн (2003). «Влияние винфлунина, винорелбина и винбластина на динамику центромер» . Молекулярная терапия рака . 2 (5): 427–36. ПМИД 12748304 . Архивировано из оригинала 13 августа 2024 года . Проверено 21 января 2024 г.
- ^ Лу Ю, Чен Дж, Сяо М, Ли В, Миллер Д.Д. (ноябрь 2012 г.). «Обзор ингибиторов тубулина, которые взаимодействуют с местом связывания колхицина» . Фарм Рес . 29 (11): 2943–71. дои : 10.1007/s11095-012-0828-z . ПМК 3667160 . ПМИД 22814904 .
- ^ Молад, Яир (2002). «Обновленная информация о колхицине и его механизме действия». Текущие отчеты по ревматологии . 4 (3): 252–6. дои : 10.1007/s11926-002-0073-2 . ПМИД 12010611 . S2CID 4507579 .
- ^ Писатель, сотрудник GEN (29 июня 2016 г.). «Борьба с раком с помощью щепотки петрушки и укропа» . GEN – Новости генной инженерии и биотехнологии . Проверено 26 октября 2023 г.
- ^ Лакхани, Нехал Дж.; Саркар, Мохамади А.; Вениц, Юрген; Фигг, Уильям Д. (2003). «2-метоксиэстрадиол, многообещающее противораковое средство» . Фармакотерапия . 23 (2): 165–72. дои : 10.1592/phco.23.2.165.32088 . ПМИД 12587805 . S2CID 1541302 . Архивировано из оригинала 25 июня 2023 года . Проверено 21 января 2024 г.
- ^ http://www.paclitaxel.org/ [ нужна полная цитата ]
- ^ дель Пино Б.М. (23 февраля 2010 г.). «Периферическая невропатия, вызванная химиотерапией» . Бюллетень рака NCI . п. 6. Архивировано из оригинала 11 декабря 2011 года.
- ^ Банк данных об опасных веществах (HSDB) http://toxnet.nlm.nih.gov. Архивировано 11 июня 2019 г. в Wayback Machine. [ нужна полная цитата ]
- ^ Перейти обратно: а б Готтесман, Майкл М. (2002). «Механизмы лекарственной устойчивости рака» . Ежегодный обзор медицины . 53 : 615–27. дои : 10.1146/annurev.med.53.082901.103929 . ПМИД 11818492 . Архивировано из оригинала 13 августа 2024 года . Проверено 21 января 2024 г.
- ^ Иващенко, Александр; Киселёв, Алекс; Ткаченко Сергей; Иваненков, Ян; Балакин, Константин (2007). «Новые митотические мишени и их низкомолекулярные ингибиторы». Текущие цели в области лекарств от рака . 7 (8): 766–84. дои : 10.2174/156800907783220499 . ПМИД 18220536 .
- ^ Перейти обратно: а б с Аттард, Герхардт; Грейсток, Аластер; Кэй, Стэн; Де Боно, Иоганн (2006). «Обновленная информация о тубулинсвязывающих агентах». Патология биологии . 54 (2): 72–84. дои : 10.1016/j.patbio.2005.03.003 . ПМИД 16545633 .
- ^ Перейти обратно: а б Тервогт, Йецке М.Меерум; Шелленс, Ян Х.М.; Хуйнинк, Вим В.тен Боккель; Бейнен, Джос Х. (1999). «Клиническая фармакология противораковых препаратов в отношении форм и путей введения». Обзоры лечения рака . 25 (2): 83–101. дои : 10.1053/ctrv.1998.0107 . ПМИД 10395834 .
- ^ Гордализа, М. (2008). «Натуральные продукты как источники противораковых лекарств». Клиническая и трансляционная онкология . 9 (12): 767–76. дои : 10.1007/s12094-007-0138-9 . ПМИД 18158980 . S2CID 19282719 .


