ДНК хлоропластов

ДНК хлоропластов ( хпДНК ) — это ДНК, расположенная в хлоропластах, фотосинтетических органеллах, расположенных внутри клеток некоторых эукариотических организмов. Хлоропласты, как и другие типы пластид , содержат геном, отдельный от генома клетки в ядре . Существование ДНК хлоропластов было обнаружено биохимически в 1959 году. [1] и подтверждено электронной микроскопией в 1962 году. [2] Открытие того, что хлоропласты содержат рибосомы [3] и осуществляет синтез белка [4] обнаружили, что хлоропласты генетически полуавтономны. Первые полные последовательности генома хлоропластов были опубликованы в 1986 году: Nicotiana tabacum (табак) Сугиурой и его коллегами и Marchantia полиморфа (печеночник) Озеки и др. [5] [6] С тех пор большое количество ДНК хлоропластов было секвенировано различных видов .
Молекулярная структура
[ редактировать ]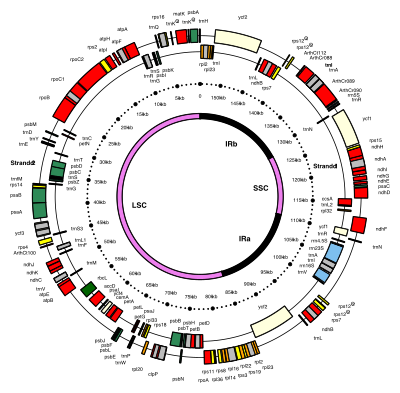
ДНК хлоропластов имеют круглую форму и обычно имеют длину 120 000–170 000 пар оснований . [7] [8] [9] Они могут иметь длину контура около 30–60 микрометров и массу около 80–130 миллионов дальтон . [10]
У большинства хлоропластов весь хлоропластный геном объединен в одно большое кольцо, хотя геном динофитовых водорослей является заметным исключением: их геном разбит примерно на сорок небольших плазмид , каждая из которых имеет длину 2 000–10 000 пар оснований . [11] Каждое миникольцо содержит от одного до трех генов. [11] пустые плазмиды без кодирующей ДНК но были также обнаружены .
Долгое время считалось, что ДНК хлоропластов имеет кольцевую структуру, но некоторые данные свидетельствуют о том, что ДНК хлоропластов чаще принимает линейную форму. [12] Было обнаружено, что более 95% хлоропластной ДНК в хлоропластах кукурузы имеют разветвленную линейную форму, а не отдельные круги. [11]
Инвертированные повторы
[ редактировать ]ДНК многих хлоропластов содержат два инвертированных повтора , которые отделяют длинный однокопийный участок (LSC) от короткого однокопийного участка (SSC). [9]
Инвертированные повторы сильно различаются по длине: от 4000 до 25 000 пар оснований каждый. [11] Инвертированные повторы у растений, как правило, находятся в верхней части этого диапазона, каждый из которых имеет длину 20 000–25 000 пар оснований. [9] [13] Области инвертированных повторов обычно содержат три гена рибосомальной РНК и два гена тРНК , но они могут быть расширены или уменьшены , чтобы содержать от четырех до более 150 генов. [11] Хотя данная пара инвертированных повторов редко бывает полностью идентична, они всегда очень похожи друг на друга, что, по-видимому, является результатом согласованной эволюции . [11]
Области инвертированных повторов высококонсервативны среди наземных растений и накапливают мало мутаций. [9] [13] Подобные инвертированные повторы существуют в геномах цианобактерий и двух других линий хлоропластов ( glaucophyta и rhodophyceæ ), что позволяет предположить, что они предшествовали хлоропластам. [11] хотя некоторые ДНК хлоропластов, например ДНК гороха и некоторых красных водорослей, [11] с тех пор потеряли инвертированные повторы. [13] [14] Другие, например красная водоросль Порфира, перевернули один из своих инвертированных повторов (сделав их прямыми повторами). [11] Вполне возможно, что инвертированные повторы помогают стабилизировать остальную часть генома хлоропластов, поскольку ДНК хлоропластов, потерявшие некоторые сегменты инвертированных повторов, имеют тенденцию к большей перестройке. [14]
Нуклеоиды
[ редактировать ]Каждый хлоропласт содержит около 100 копий своей ДНК в молодых листьях, а в старых листьях их количество снижается до 15–20 копий. [15] Обычно они упакованы в нуклеоиды , которые могут содержать несколько одинаковых колец ДНК хлоропластов. В каждом хлоропласте можно обнаружить множество нуклеоидов. [10]
Хотя ДНК хлоропластов не связана с истинными гистонами , [16] у красных водорослей гистоноподобный белок хлоропластов (HC), кодируемый ДНК хлоропластов, который плотно упаковывает каждое кольцо ДНК хлоропласта в нуклеоид . был обнаружен [17]
У примитивных красных водорослей нуклеоиды ДНК хлоропластов сгруппированы в центре хлоропласта, тогда как у зеленых растений и зеленых водорослей нуклеоиды рассеяны по всей строме . [17]
Содержание генов и экспрессия пластидных генов
[ редактировать ]более 5000 геномов хлоропластов Было секвенировано , и они доступны через базу данных геномов органелл NCBI. [18] Первые геномы хлоропластов были секвенированы в 1986 году из табака ( Nicotiana tabacum ). [19] и печеночник ( Marchantia полиморфа ). [20] Сравнение последовательностей генов цианобактерий Synechocystis с последовательностями хлоропластов Arabidopsis подтвердило эндосимбиотическое происхождение хлоропластов. [21] [22] Это также продемонстрировало значительную степень переноса генов от цианобактериального предка к ядерному геному.
У большинства видов растений геном хлоропластов кодирует около 120 генов. [23] [24] Гены в первую очередь кодируют основные компоненты фотосинтетического аппарата и факторы, участвующие в их экспрессии и сборке. [25] У видов наземных растений набор генов, кодируемых геномом хлоропластов, достаточно консервативен. Сюда входят четыре рибосомальные РНК , примерно 30 тРНК , 21 рибосомальный белок и 4 субъединицы пластид-кодируемого комплекса РНК-полимеразы , которые участвуют в экспрессии пластидных генов. [25] Большая субъединица Рубиско и 28 фотосинтетических белков тилакоидов закодированы в геноме хлоропластов. [25]
Редукция генома хлоропластов и перенос генов
[ редактировать ]Со временем многие части генома хлоропласта были перенесены в ядерный геном хозяина, [7] [8] [26] процесс, называемый эндосимбиотическим переносом генов . В результате геном хлоропластов сильно редуцирован по сравнению с геномом свободноживущих цианобактерий. Хлоропласты могут содержать 60–100 генов, тогда как цианобактерии часто имеют в своем геноме более 1500 генов. [27] Паразитические пилостили даже утратили свои пластидные гены тРНК . [28] Напротив, известно лишь несколько случаев, когда гены были перенесены в хлоропласт от различных доноров, включая бактерии. [29] [30] [31]
Эндосимбиотический перенос генов — это то, как мы узнаем об утраченных хлоропластах во многих хромальвеолатов линиях . Даже если хлоропласт в конечном итоге теряется, гены, которые он пожертвовал ядру бывшего хозяина, сохраняются, что доказывает существование утраченного хлоропласта. Например, хотя диатомовые водоросли ( гетероконтофит ) теперь имеют хлоропласт, полученный из красных водорослей , присутствие многих генов зеленых водорослей в ядре диатомовых водорослей свидетельствует о том, что предок диатомовых водорослей (вероятно, также предок всех хромальвеолатов) имел хлоропласт, полученный из зеленых водорослей . некоторая точка, которая впоследствии была заменена красным хлоропластом. [32]
У наземных растений около 11–14% ДНК в их ядрах можно отнести к хлоропластам. [33] до 18% у Arabidopsis , что соответствует примерно 4500 генам, кодирующим белок. [34] В последнее время произошло несколько переносов генов из ДНК хлоропластов в ядерный геном наземных растений. [8]
Белки, кодируемые хлоропластами
[ редактировать ]Из примерно трех тысяч белков, обнаруженных в хлоропластах, около 95% кодируются ядерными генами. Многие белковые комплексы хлоропластов состоят из субъединиц как генома хлоропласта, так и ядерного генома хозяина. В результате синтез белка должен быть скоординирован между хлоропластом и ядром. Хлоропласты в основном находятся под ядерным контролем, хотя хлоропласты также могут выдавать сигналы, регулирующие экспрессию генов в ядре, так называемые ретроградные сигналы . [35]
Синтез белка
[ редактировать ]Синтез белка в хлоропластах основан на РНК-полимеразе, кодируемой собственным геномом хлоропласта, которая родственна РНК-полимеразам, обнаруженным у бактерий. Хлоропласты также содержат загадочную вторую РНК-полимеразу, которая кодируется ядерным геномом растения. Две РНК-полимеразы могут распознавать и связываться с различными типами промоторов в геноме хлоропластов. [36] Рибосомы . в хлоропластах аналогичны бактериальным рибосомам [37]
Этот раздел нуждается в дополнении: различия в размерах генома между водорослями и наземными растениями, вещество хлоропластов, кодируемое ядром, репликация ДНК, окислительно-восстановительный потенциал НАДФН, специальные тРНК-синтетазы и т. д. Вы можете помочь, добавив в него . ( январь 2013 г. ) |
Редактирование РНК в пластидах
[ редактировать ]Редактирование РНК — это вставка, удаление и замена нуклеотидов в транскрипте мРНК перед трансляцией в белок. Высокоокислительная среда внутри хлоропластов увеличивает скорость мутаций, поэтому для сохранения функциональных последовательностей необходима посттранскрипционная репарация. Эдитосома хлоропласта заменяет C -> U и U -> C в очень специфических местах транскрипта. Это может изменить кодон аминокислоты или восстановить нефункциональный псевдоген путем добавления стартового кодона AUG или удаления преждевременного стоп-кодона UAA. [38]
Эдитосома распознает и связывается с цис-последовательностью, расположенной выше сайта редактирования. Расстояние между сайтом связывания и сайтом редактирования зависит от гена и белков, участвующих в эдитосоме. Сотни различных белков PPR ядерного генома участвуют в процессе редактирования РНК. Эти белки состоят из 35-мерных повторяющихся аминокислот, последовательность которых определяет цис-связывающий сайт редактируемого транскрипта. [38]
Базальные наземные растения, такие как печеночники, мхи и папоротники, имеют сотни различных мест редактирования, тогда как у цветковых растений их обычно от тридцати до сорока. У паразитических растений, таких как Epifagus Virginiana, наблюдается потеря редактирования РНК, что приводит к потере функции генов фотосинтеза. [39]
репликация ДНК
[ редактировать ]Ведущая модель репликации хпДНК
[ редактировать ]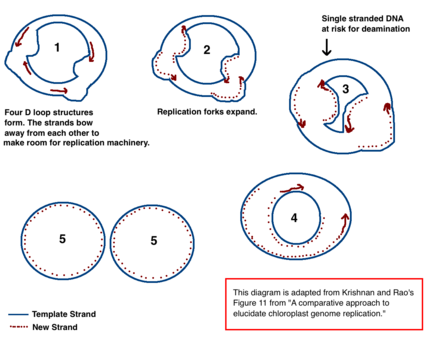
Механизм репликации ДНК хлоропластов (хпДНК) окончательно не определен, но были предложены две основные модели. Ученые пытались наблюдать репликацию хлоропластов с помощью электронной микроскопии с 1970-х годов. [40] [41] Результаты микроскопических экспериментов привели к идее, что ДНК хлоропластов реплицируется с использованием петли двойного смещения (D-петли). Когда D-петля движется по кольцевой ДНК, она принимает промежуточную тета-форму, также известную как промежуточный продукт репликации Кэрнса, и завершает репликацию с помощью механизма катящегося круга. [40] [12] Репликация начинается в определенных точках происхождения. Множественные репликационные вилки открываются, позволяя механизму репликации реплицировать ДНК. По мере продолжения репликации вилки растут и в конечном итоге сходятся. Новые структуры хпДНК разделяются, образуя дочерние хромосомы хпДНК.
В дополнение к ранним экспериментам по микроскопии, эта модель также подтверждается количеством дезаминирования, наблюдаемым в хпДНК. [40] Дезаминирование происходит при аминогруппы потере и представляет собой мутацию , которая часто приводит к изменению оснований. При дезаминировании аденина он превращается в гипоксантин (H). Гипоксантин может связываться с цитозином , и когда пара оснований HC реплицируется, он становится GC (таким образом, происходит замена оснований A → G). [42]

В хпДНК существует несколько градиентов дезаминирования A → G. ДНК становится восприимчивой к событиям дезаминирования, когда она одноцепочечная. Когда образуются репликационные вилки, некопируемая цепь является одноцепочечной и, следовательно, подвергается риску дезаминирования A → G. Следовательно, градиенты дезаминирования указывают на то, что репликационные вилки, скорее всего, присутствовали, а также на направление, в котором они первоначально открывались (самый высокий градиент, скорее всего, находится ближе всего к стартовому сайту, поскольку он был одноцепочечным в течение самого длительного периода времени). [40] Этот механизм до сих пор остается ведущей теорией; однако вторая теория предполагает, что большая часть хпДНК на самом деле линейна и реплицируется посредством гомологичной рекомбинации. Далее утверждается, что лишь незначительная часть генетического материала хранится в кольцевых хромосомах, тогда как остальная часть находится в разветвленных, линейных или других сложных структурах. [40] [12]
Альтернативная модель репликации
[ редактировать ]Одна из основных конкурирующих моделей хпДНК утверждает, что большая часть хпДНК является линейной и участвует в структурах гомологичной рекомбинации и репликации, подобных бактериофагу Т4 . [12] Было установлено, что некоторые растения имеют линейную хпДНК, например кукуруза, а другие еще содержат сложные структуры, которые ученые еще не понимают; [12] однако сегодня преобладает мнение, что большая часть хпДНК имеет кольцевую форму. Когда были проведены оригинальные эксперименты с хпДНК, ученые заметили линейные структуры; однако они приписывали эти линейные формы разорванным кругам. [12] Если разветвленные и сложные структуры, наблюдаемые в экспериментах с хпДНК, реальны, а не являются артефактами сцепленной кольцевой ДНК или разорванных кругов, то механизма репликации D-петли недостаточно, чтобы объяснить, как эти структуры будут реплицироваться. [12] В то же время гомологичная рекомбинация не объясняет множественные градиенты A → G, наблюдаемые в пластомах. [40] Этот недостаток является одним из самых больших для теории линейной структуры.
Таргетинг и импорт белка
[ редактировать ]Перемещение такого большого количества генов хлоропластов в ядро означает, что многие белки хлоропластов , которые должны были транслироваться в хлоропластах, теперь синтезируются в цитоплазме. Это означает, что эти белки должны быть направлены обратно в хлоропласт и импортированы как минимум через две мембраны хлоропласта. [43]
Любопытно, что около половины белковых продуктов перенесенных генов даже не доставляются обратно в хлоропласты. Многие из них стали экзаптациями , взяв на себя новые функции, такие как участие в делении клеток , маршрутизации белков и даже устойчивости к болезням . Несколько генов хлоропластов нашли новый дом в митохондриальном геноме — большинство из них стали нефункциональными псевдогенами , хотя несколько генов тРНК все еще работают в митохондриях . [27] Некоторые перенесенные белковые продукты ДНК хлоропластов направляются по секреторному пути. [27] (хотя многие вторичные пластиды ограничены внешней мембраной, полученной из клеточной мембраны хозяина , и, следовательно, топологически находятся вне клетки, поскольку, чтобы добраться до хлоропласта из цитозоля , вам нужно пересечь клеточную мембрану , как если бы вы направлялись в во внеклеточное пространство . В этих случаях белки, нацеленные на хлоропласты, первоначально перемещаются по секреторному пути). [44]
Поскольку клетка, приобретающая хлоропласт, уже имела митохондрии (и пероксисомы , а также клеточную мембрану для секреции), новый хозяин-хлоропласт должен был разработать уникальную систему нацеливания на белки , чтобы избежать отправки белков хлоропласта в неправильную органеллу . [43]
Цитоплазматическая трансляция и N-концевые транзитные последовательности
[ редактировать ]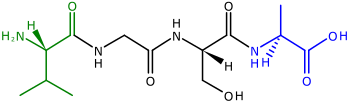
Полипептиды , предшественники белков , представляют собой цепочки аминокислот . Два конца полипептида называются N-концом , или амино-концом , и С-концом , или карбоксильным концом . [45] Для многих (но не всех) [46] белки хлоропластов, кодируемые ядерными генами, к N-концам полипептидов добавляются расщепляемые транзитные пептиды , которые используются для направления полипептида в хлоропласт для импорта. [43] [47] (N-концевые транзитные пептиды также используются для направления полипептидов в митохондрии растений ). [48] N-концевые транзитные последовательности также называются препоследовательностями. [43] поскольку они расположены на «переднем» конце полипептида — рибосомы синтезируют полипептиды от N-конца к С-концу. [45]
Транзитные пептиды хлоропластов демонстрируют огромные различия по длине и аминокислотной последовательности . [47] Они могут иметь длину от 20 до 150 аминокислот. [43] — необычно большая длина, что позволяет предположить, что транзитные пептиды на самом деле представляют собой наборы доменов с разными функциями. [47] Транзитные пептиды обычно имеют положительный заряд . [43] богаты гидроксилированными аминокислотами, такими как серин , треонин и пролин , и бедны кислыми аминокислотами, такими как аспарагиновая кислота и глутаминовая кислота . [47] В водном растворе транзитная последовательность образует случайный клубок. [43]
Однако не все белки хлоропластов содержат N-концевой расщепляемый транзитный пептид. [43] Некоторые включают транзитную последовательность в функциональную часть самого белка. [43] У некоторых вместо этого к С-концу присоединяется транзитная последовательность . [49] Большинство полипептидов, у которых отсутствуют N-концевые направляющие последовательности, направляются на внешнюю мембрану хлоропласта , плюс по крайней мере один направляется на внутреннюю мембрану хлоропласта . [43]
Фосфорилирование, шапероны и транспорт
[ редактировать ]хлоропласта После того, как полипептид синтезируется на рибосоме в цитозоле , АТФ энергия может быть использована для фосфорилирования или добавления фосфатной группы ко многим (но не всем) из них в их транзитных последовательностях. [43] Серин и треонин (оба очень распространены в транзитных последовательностях хлоропластов и составляют 20–30% последовательности) [50] часто являются аминокислотами , которые принимают фосфатную группу . [48] [50] Фермент , осуществляющий фосфорилирование, специфичен для полипептидов хлоропластов и игнорирует те, которые предназначены для митохондрий или пероксисом . [50]
Фосфорилирование изменяет форму полипептида. [50] облегчая прикрепление белков 14-3-3 к полипептиду. [43] [51] У растений белки 14-3-3 связываются только с пребелками хлоропластов. [48] Он также связан с белком Hsp70 шока , предотвращает пищевого который полипептида преждевременное сворачивание . [43] Это важно, поскольку предотвращает принятие хлоропластными белками активной формы и выполнение своих хлоропластных функций не в том месте — цитозоле . [48] [51] В то же время они должны сохранять форму, достаточную для того, чтобы их можно было распознать и импортировать в хлоропласт. [48]
Белок теплового шока и белки 14-3-3 вместе образуют цитозольный направляющий комплекс, который облегчает импорт полипептида хлоропласта в хлоропласт. [43]
Альтернативно, если транзитный пептид пребелка хлоропласта не фосфорилирован, пребелок хлоропласта все равно может присоединяться к белку теплового шока или Toc159 . Эти комплексы могут связываться с комплексом ТОС на внешней мембране хлоропласта, используя энергию ГТФ . [43]
Транслокон на внешней мембране хлоропласта (ТОС).
[ редактировать ]Комплекс ТОС , или транслокон представляет на внешней хлоропласта , мембране хлоропласта собой совокупность белков, которые импортируют пребелки через внешнюю оболочку . пять субъединиц Идентифицированы комплекса TOC — два GTP -связывающих белка Toc34 и Toc159 , туннель импорта белка Toc75 , а также белки Toc64. [43] и Ток12 . [46]
Первые три белка образуют основной комплекс, состоящий из одного Toc159, четырех-пяти Toc34 и четырех Toc75, которые образуют четыре отверстия в диске диаметром 13 нанометров . Весь основной комплекс весит около 500 килодальтон . Два других белка, Toc64 и Toc12, связаны с основным комплексом, но не являются его частью. [46]
Ток34 и 33
[ редактировать ]![Toc34 из растения гороха. Toc34 имеет три почти идентичные молекулы (показаны слегка разными оттенками зеленого), каждая из которых образует димер с одной из соседних молекул. Часть сайта связывания молекулы GDP выделена розовым цветом.[52]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e4/TOC34.png/350px-TOC34.png)
Toc34 — это интегральный белок внешней мембраны хлоропласта, закрепленный в ней гидрофобными [53] С-концевой хвост. [43] [51] Однако большая часть белка, включая его большой связывающий гуанозинтрифосфат (GTP), домен, выходит в строму. [51]
Задача Toc34 — поймать некоторые пребелки хлоропластов в цитозоле и передать их остальной части комплекса TOC. [43] Когда GTP , энергетическая молекула, подобная АТФ, присоединяется к Toc34, белок становится гораздо более способным связываться со многими пребелками хлоропластов в цитозоле . [43] Присутствие пребелка хлоропласта заставляет Toc34 расщеплять GTP на гуанозиндифосфат (GDP) и неорганический фосфат . Эта потеря GTP заставляет белок Toc34 высвобождать пребелок хлоропласта, передавая его следующему белку TOC. [43] Затем Toc34 высвобождает обедненную молекулу ВВП, вероятно, с помощью неизвестного фактора обмена ВВП . Домен обмена , Toc159 может быть фактором выполняющим удаление ВВП. Затем белок Toc34 может поглотить другую молекулу GTP и начать цикл заново. [43]
Toc34 можно отключить посредством фосфорилирования . Протеинкиназа , дрейфующая по внешней мембране хлоропласта, может использовать АТФ для добавления фосфатной группы к белку Toc34, не позволяя ему получить другую молекулу GTP , ингибируя активность белка. Это может дать возможность регулировать импорт белка в хлоропласты. [43] [51]
Arabidopsis thaliana имеет два гомологичных белка: и AtToc34 ( AT означает Arabidopsis t AtToc33 haliana ) , [43] [51] каждый из которых примерно на 60% идентичен по аминокислотной последовательности Toc34 гороха (так называемый ps Toc34). [51] AtToc33 является наиболее распространенным у арабидопсиса . [51] и это функциональный аналог Toc34, поскольку его можно отключить фосфорилированием. С другой стороны, AtToc34 не может фосфорилироваться. [43] [51]
Ток159
[ редактировать ]Toc159 — это еще одна GTP TOC, связывающая субъединица , такая же, как Toc34 . Toc159 имеет три домена . На N-конце находится А-домен, богатый кислыми аминокислотами и занимающий около половины длины белка. [43] [53] A-домен часто отщепляется , оставляя фрагмент массой 86 килодальтон , называемый Toc86 . [53] В середине находится его GTP- связывающий домен, который очень похож на гомологичный GTP-связывающий домен в Toc34. [43] [53] На С-конце находится гидрофильный М-домен, [43] который закрепляет белок на внешней мембране хлоропласта. [53]
Toc159, вероятно, работает во многом аналогично Toc34, распознавая белки в цитозоле с помощью GTP . Его можно регулировать посредством фосфорилирования , но с помощью другой протеинкиназы, отличной от той, которая фосфорилирует Toc34. [46] Его М-домен образует часть туннеля, по которому проходят пребелки хлоропластов, и, по-видимому, обеспечивает силу, которая проталкивает пребелки, используя энергию ГТФ . [43]
Toc159 не всегда обнаруживается как часть комплекса TOC — его также обнаруживают в растворенном виде в цитозоле . Это предполагает, что он может действовать как челнок, который находит пребелки хлоропластов в цитозоле и переносит их обратно в комплекс ТОС. Однако прямых доказательств такого поведения не так много. [43]
Семейство белков Toc159: Toc159 , Toc132 , Toc120 и Toc90 было обнаружено у Arabidopsis thaliana . Они различаются по длине A-доменов, которых в Toc90 полностью нет. Toc132, Toc120 и Toc90, похоже, имеют специализированные функции по импорту таких веществ, как нефотосинтетические препротеины, и не могут заменить Toc159. [43]
Ток75
[ редактировать ]
Toc75 является наиболее распространенным белком на внешней оболочке хлоропласта. Это трансмембранная трубка, которая образует большую часть самой поры ТОС. Toc75 представляет собой β-цилиндрический канал, выстланный 16 β-складчатыми пластинками . [43] Отверстие, которое оно образует, имеет ширину около 2,5 нанометра на концах и сужается до 1,4–1,6 нанометра в диаметре в самом узком месте — достаточно широкой, чтобы позволить частично свернутым пребелкам хлоропластов пройти через него. [43]
Toc75 также может связываться с пребелками хлоропластов, но делает это намного хуже, чем Toc34 или Toc159. [43]
Arabidopsis thaliana имеет несколько изоформ Toc75 , названия которых соответствуют хромосомным положениям генов кодирующих их . AtToc75 III является наиболее распространенным из них. [43]
Транслокон на внутренней мембране хлоропласта (TIC).
[ редактировать ]Транслокон TIC , или транслокон на внутренней транслокон , мембране хлоропласта . [43] Это еще один белковый комплекс, который импортирует белки через внутреннюю оболочку хлоропласта . Полипептидные цепи хлоропластов, вероятно, часто проходят через два комплекса одновременно, но комплекс TIC также может восстанавливать пребелки, потерянные в межмембранном пространстве . [43]
Как и транслокон TOC , транслокон TIC имеет большой сердцевинный комплекс, окруженный некоторыми слабо связанными периферическими белками, такими как Tic110 , Tic40 и Tic21 . [54] Ядро комплекса весит около миллиона дальтон и содержит Tic214 , Tic100 , Tic56 и Tic20I , возможно, по три каждого. [54]
Тик20
[ редактировать ]Tic20 представляет собой интегральный белок, имеющий четыре трансмембранные α-спирали . [43] Он обнаружен в комплексе TIC массой 1 миллион дальтон . [54] Потому что он похож на бактериальные переносчики аминокислот и митохондриальный импортный белок Tim17. [43] ( транслоказа на внутренней митохондриальной мембране ) , [55] было предложено стать частью канала импорта TIC. [43] нет . in vitro Однако доказательств этого [43] У Arabidopsis thaliana известно, что примерно на каждые пять белков Toc75 во внешней мембране хлоропластов приходится два белка Tic20 I (основная форма Tic20 у Arabidopsis ) во внутренней мембране хлоропласта. [54]
В отличие от Tic214 , Tic100 или Tic56 , Tic20 имеет гомологичных родственников среди цианобактерий и почти всех линий хлоропластов, что позволяет предположить, что он развился до первого эндосимбиоза хлоропластов. Tic214 , Tic100 и Tic56 уникальны для хлоропластов хлоропластидана , что позволяет предположить, что они развились позже. [54]
Тик214
[ редактировать ]Tic214 — это еще один белок ядра комплекса TIC, названный так потому, что он весит чуть менее 214 килодальтон . Его длина составляет 1786 аминокислот , и считается, что конце имеется шесть трансмембранных доменов на его N- . Tic214 примечателен тем, что кодируется ДНК хлоропластов, точнее первой открытой рамкой считывания ycf1 . Tic214 и Tic20 вместе, вероятно, составляют часть комплекса TIC размером в один миллион дальтон , который охватывает всю мембрану . Tic20 скрыт внутри комплекса, тогда как Tic214 открыт по обе стороны внутренней мембраны хлоропласта . [54]
Тик100
[ редактировать ]Tic100 — это белок, кодируемый ядром , длиной 871 аминокислота . Все 871 аминокислота в совокупности весят чуть меньше 100 тысяч дальтон , и поскольку зрелый белок, вероятно, не теряет ни одной аминокислоты при импорте в хлоропласт (у него нет расщепляемого транзитного пептида ), он получил название Tic100. Tic100 находится по краям комплекса массой 1 миллион дальтон на стороне, обращенной к межмембранному пространству хлоропластов . [54]
Тик56
[ редактировать ]Tic56 также является белком, кодируемым ядром . Препротеин , кодируемый его геном, имеет длину 527 аминокислот и весит около 62 тысяч дальтон ; зрелая форма, вероятно, подвергается обработке, которая уменьшает ее вес до 56 тысяч дальтон, когда она импортируется в хлоропласт. Tic56 в значительной степени встроен в комплекс массой 1 миллион дальтон. [54]
Tic56 и Tic100 высоко консервативны среди наземных растений, но они не похожи ни на один белок, функция которого известна. Ни один из них не имеет трансмембранных доменов . [54]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Стокинг, Ч.Р. и Гиффорд, Э.М. (1959). «Включение тимидина в хлоропласты спирогиры». Связь с биохимическими и биофизическими исследованиями . 1 (3): 159–164. дои : 10.1016/0006-291X(59)90010-5 .
- ^ Рис, Х. и Плаут, В. (1962). «Ультраструктура ДНК-содержащих участков хлоропласта хламидомонады» . Дж. Клеточная Биол . 13 (3): 383–91. дои : 10.1083/jcb.13.3.383 . ПМК 2106071 . ПМИД 14492436 .
- ^ Литтлтон, JW (1962). «Выделение рибосом из хлоропластов шпината». Эксп. Сотовый Res . 26 (1): 312–317. дои : 10.1016/0014-4827(62)90183-0 . ПМИД 14467684 .
- ^ Хибер, У. (1962). «Синтез белка в хлоропластах при фотосинтезе». Природа . 195 (1): 91–92. Бибкод : 1962Natur.195...91H . дои : 10.1038/195091a0 . ПМИД 13905812 . S2CID 4265095 .
- ^ Шинозаки, К.; Оме, М.; Танака, М.; Вакасуги, Т.; Хаясида, Н.; Мацубаяси, Т.; Заита, Н.; Чунвонгсе, Дж.; Обоката, Дж.; Ямагучи-Синозаки, К.; Ото, К. (1986). «Полная нуклеотидная последовательность генома хлоропластов табака: организация и экспрессия его генов» . Журнал ЭМБО . 5 (9): 2043–2049. дои : 10.1002/j.1460-2075.1986.tb04464.x . ISSN 0261-4189 . ПМК 1167080 . ПМИД 16453699 .
- ^ Кадзухико; Такеучи, Масаюки; Чжэнь, Хлоропласт. Охяма, Хидэя, Шираи, Хиромаса; Сано, Организация гена выведена из полной последовательности ДНК хлоропласта Marchantia polymorpha печеночника» . Nature . 322 (6079): 572–574. Bibcode : 1986Natur.322..572O . doi : 10.1038/322572a0 . ISSN 1476-4687 . S2CID 431195 2 .
- ^ Jump up to: а б Данн Л. (2002). Объяснение биологических наук (PDF) . Зеленая ДНК: ОБЪЯСНЕНИЕ БИОЗУКИ.
- ^ Jump up to: а б с Клегг М.Т., Гаут Б.С., Жир Г.Х., Мортон Б.Р. (июль 1994 г.). «Скорость и закономерности эволюции ДНК хлоропластов» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (15): 6795–801. Бибкод : 1994PNAS...91.6795C . дои : 10.1073/pnas.91.15.6795 . ПМЦ 44285 . ПМИД 8041699 .
- ^ Jump up to: а б с д Шоу Дж., Лики Э.Б., Шиллинг Э.Э., Смолл Р.Л. (март 2007 г.). «Сравнение последовательностей всего генома хлоропластов для выбора некодирующих областей для филогенетических исследований у покрытосеменных растений: черепахи и зайца III». Американский журнал ботаники . 94 (3): 275–88. дои : 10.3732/ajb.94.3.275 . ПМИД 21636401 . S2CID 30501148 .
- ^ Jump up to: а б Берджесс Дж (1989). Введение в развитие растительной клетки . Кембридж: Издательство Кембриджского университета. п. 62. ИСБН 978-0-521-31611-8 .
- ^ Jump up to: а б с д и ж г час я Санделиус А.С. (2009). Хлоропласт: взаимодействие с окружающей средой . Спрингер. п. 18. ISBN 978-3-540-68696-5 .
- ^ Jump up to: а б с д и ж г Бендич А.Дж. (июль 2004 г.). «Круглые хромосомы хлоропластов: великая иллюзия» . Растительная клетка . 16 (7): 1661–6. дои : 10.1105/tpc.160771 . ПМК 514151 . ПМИД 15235123 .
- ^ Jump up to: а б с Колоднер Р., Тевари К.К. (январь 1979 г.). «Инвертированные повторы в ДНК хлоропластов высших растений» . Труды Национальной академии наук Соединенных Штатов Америки . 76 (1): 41–5. Бибкод : 1979ПНАС...76...41К . дои : 10.1073/pnas.76.1.41 . ПМЦ 382872 . ПМИД 16592612 .
- ^ Jump up to: а б Палмер Дж. Д., Томпсон В. Ф. (июнь 1982 г.). «Перестройки ДНК хлоропластов происходят чаще, когда теряется большая инвертированная повторяющаяся последовательность». Клетка . 29 (2): 537–50. дои : 10.1016/0092-8674(82)90170-2 . ПМИД 6288261 . S2CID 11571695 .
- ^ Биохимия растений (3-е изд.). Академическая пресса. 2005. с. 517 . ISBN 9780120883912 .
количество копий цДНК на хлоропласт.
- ^ Биология, 8-е издание Кэмпбелл и Рис . Бенджамин Каммингс (Пирсон). 2009. с. 516.
- ^ Jump up to: а б Кобаяши Т., Такахара М., Миягишима С.Ю., Куроива Х., Сасаки Н., Ота Н., Мацузаки М., Куроива Т. (июль 2002 г.). «Обнаружение и локализация кодируемого хлоропластами HU-подобного белка, который организует нуклеоиды хлоропластов» . Растительная клетка . 14 (7): 1579–89. дои : 10.1105/tpc.002717 . ПМК 150708 . ПМИД 12119376 .
- ^ «Ресурсы генома органелл NCBI» . Национальный институт здоровья . Проверено 18 августа 2021 г.
- ^ Шинозаки, К.; Оме, М.; Танака, М.; Вакасуги, Т.; Хаясида, Н.; Мацубаяси, Т.; Заита, Н.; Чунвонгсе, Дж.; Обоката Дж. и Ямагути-Синозаки К. (1986). «Полная нуклеотидная последовательность генома хлоропластов табака: организация и экспрессия его генов» . ЭМБО Дж . 5 (9): 2043–2049. дои : 10.1002/j.1460-2075.1986.tb04464.x . ПМК 1167080 . ПМИД 16453699 .
- ^ Охяма, К.; Фукузава, Х.; Кохчи, Т.; Шираи, Х.; Сано, Т.; Сано, С.; Умесоно, К.; Сики, Ю.; Такеучи, М.; Чанг З. и Аота С. (1986). «Организация гена хлоропластов выведена из полной последовательности ДНК хлоропластов печеночника Marchantia polymorpha». Природа . 322 (6079): 572–574. Бибкод : 1986Natur.322..572O . дои : 10.1038/322572a0 . S2CID 4311952 .
- ^ Канеко Т. и Табата С. (1997). «Полная структура генома одноклеточной цианобактерии Synechocystis sp. PCC6803» . Физиол растительной клетки . 38 (11): 1171–1176. doi : 10.1093/oxfordjournals.pcp.a029103 . ПМИД 9435137 .
- ^ Сато, С.; Накамура, Ю.; Канеко, Т.; Асамидзу Э. и Табата С. (1999). «Полная структура генома хлоропластов Arabidopsis thaliana» . ДНК Рез . 6 (5): 283–290. дои : 10.1093/dnares/6.5.283 . ПМИД 10574454 .
- ^ Дэниел, Х.; Лин, К.; Ю, М. и Чанг, В. (2016). «Геномы хлоропластов: разнообразие, эволюция и применение в генной инженерии» . Геном Биол . 17 (1): 134. дои : 10.1186/s13059-016-1004-2 . ПМЦ 4918201 . ПМИД 27339192 .
- ^ Клегг, Монтана; Гаут, Б.С.; Узнайте, GH & Morton, BR (1994). «Скорость и закономерности эволюции ДНК хлоропластов» . ПНАС . 91 (15): 6795–6801. Бибкод : 1994PNAS...91.6795C . дои : 10.1073/pnas.91.15.6795 . ПМЦ 44285 . ПМИД 8041699 .
- ^ Jump up to: а б с Берри, Джо; Йеррамсетти, П.; Зелински, AM и Муре, CM (2013). «Экспрессия фотосинтетических генов у высших растений». Фотосинт. Рез . 117 (1): 91–120. Бибкод : 2013PhoRe.117...91B . дои : 10.1007/s11120-013-9880-8 . ПМИД 23839301 . S2CID 16536768 .
- ^ Хуанг С.И., Эйлифф М.А., Тиммис Дж.Н. (март 2003 г.). «Прямое измерение скорости переноса ДНК хлоропластов в ядро». Природа . 422 (6927): 72–6. Бибкод : 2003Natur.422...72H . дои : 10.1038/nature01435 . ПМИД 12594458 . S2CID 4319507 .
- ^ Jump up to: а б с Мартин В., Рухан Т., Ричли Э., Хансен А., Корнельсен С., Линс Т., Лейстер Д., Стобе Б., Хасегава М., Пенни Д. (сентябрь 2002 г.). «Эволюционный анализ геномов арабидопсиса, цианобактерий и хлоропластов выявил пластидную филогению и тысячи цианобактериальных генов в ядре» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (19): 12246–51. Бибкод : 2002PNAS...9912246M . дои : 10.1073/pnas.182432999 . ПМК 129430 . ПМИД 12218172 .
- ^ Белло, Сидони; Реннер, Сюзанна С. (2016). «Каждый из пластомов двух видов эндопаразитов рода Pilostyles (Apodanthaceae) сохраняет всего пять или шесть возможно функциональных генов» . Геномная биология и эволюция . 8 (1): 189–201. дои : 10.1093/gbe/evv251 . ПМЦ 4758247 . ПМИД 26660355 .
- ^ Мацкевич П., Бодил А., Мощинский К. (июль 2013 г.). «Случай горизонтального переноса генов от бактерий в своеобразный геном пластиды динофлагеллят» . Мобильные генетические элементы . 3 (4): e25845. дои : 10.4161/mge.25845 . ПМЦ 3812789 . ПМИД 24195014 .
- ^ Лелиарт Ф., Лопес-Баутиста Х.М. (март 2015 г.). «Геномы хлоропластов Bryopsis Plumosa и Tydemania Expeditions (Bryopsidales, Chlorophyta): компактные геномы и гены бактериального происхождения» . БМК Геномика . 16 (1): 204. дои : 10.1186/s12864-015-1418-3 . ПМЦ 4487195 . ПМИД 25879186 .
- ^ Робисон Т.А., Груш А.Л., Вольф П.Г., Мауэр Дж.П., Фауски Б.Д., Соса К. и Шуеттпельц Е. (октябрь 2018 г.). «Подвижные элементы формируют эволюцию пластома у папоротников» . Геномная биология и эволюция . 10 (10): 2669–2571. дои : 10.1093/gbe/evy189 . ПМК 6166771 . ПМИД 30165616 .
- ^ Мустафа А., Бестери Б., Майер У.Г., Боулер С., Валентин К., Бхаттачарья Д. (июнь 2009 г.). «Геномные следы загадочного пластидного эндосимбиоза у диатомовых водорослей» (PDF) . Наука . 324 (5935): 1724–6. Бибкод : 2009Sci...324.1724M . дои : 10.1126/science.1172983 . ПМИД 19556510 . S2CID 11408339 .
- ^ Новак Э.К., Фогель Х., Грот М., Гроссман А.Р., Мелконян М., Глёкнер Г. (январь 2011 г.). «Эндосимбиотический перенос генов и регуляция транскрипции переносимых генов у Paulinella chromatophora» . Молекулярная биология и эволюция . 28 (1): 407–22. дои : 10.1093/molbev/msq209 . ПМИД 20702568 .
- ^ Арчибальд Дж. М. (декабрь 2006 г.). «Геномика водорослей: изучение отпечатка эндосимбиоза» . Современная биология . 16 (24): Р1033-5. Бибкод : 2006CBio...16R1033A . дои : 10.1016/j.cub.2006.11.008 . ПМИД 17174910 . S2CID 17830745 .
- ^ Кусевицкий С., Нотт А., Моклер Т.С., Хонг Ф., Сачетто-Мартинс Г., Сурпин М., Лим Дж., Миттлер Р., Чори Дж. (май 2007 г.). «Сигналы от хлоропластов сходятся, чтобы регулировать экспрессию ядерных генов» . Наука . 316 (5825): 715–9. Бибкод : 2007Sci...316..715K . дои : 10.1126/science.1140516 . ПМИД 17395793 .
- ^ Хедтке Б., Бёрнер Т., Вейхе А. (август 1997 г.). «РНК-полимеразы митохондриального и хлоропластного фагового типа у арабидопсиса». Наука . 277 (5327): 809–11. дои : 10.1126/science.277.5327.809 . ПМИД 9242608 .
- ^ Харрис Э.Х., Бойнтон Дж.Э., Гиллхэм Н.В. (декабрь 1994 г.). «Хлоропластные рибосомы и синтез белка» . Микробиологические обзоры . 58 (4): 700–54. дои : 10.1128/MMBR.58.4.700-754.1994 . ПМК 372988 . ПМИД 7854253 .
- ^ Jump up to: а б Такенака М, Церманн А, Вербицкий Д, Хертель Б, Бреннике А (2013). «Редактирование РНК у растений и его эволюция» Ежегодный обзор генетики . 47 (1): 335–52. doi : 10.1146/annurev-genet-111212-133519 . ПМИД 24274753 .
- ^ Тиллих М., Краузе К. (июль 2010 г.). «Все тонкости редактирования и сплайсинга пластидных РНК: уроки паразитических растений». Новая биотехнология . Специальный выпуск: Ежегодный обзор биотехнологии 2010. Основы РНК и применение биотехнологий. 27 (3): 256–66. дои : 10.1016/j.nbt.2010.02.020 . ПМИД 20206308 .
- ^ Jump up to: а б с д и ж Кришнан Н.М., Рао Б.Дж. (май 2009 г.). «Сравнительный подход к выяснению репликации генома хлоропластов» . БМК Геномика . 10 (237): 237. дои : 10.1186/1471-2164-10-237 . ПМК 2695485 . ПМИД 19457260 .
- ^ Хайнхорст, Гордон К. Кэннон, Сабина (1993). «Репликация ДНК в хлоропластах» . Журнал клеточной науки . 104 : 1–9. дои : 10.1242/jcs.104.1.1 .
- ^ «Влияние химических мутагенов на нуклеотидную последовательность» . Биоциклопедия . Проверено 24 октября 2015 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а Солл Дж., Шляйфф Э. (март 2004 г.). «Импорт белка в хлоропласты» (PDF) . Обзоры природы. Молекулярно-клеточная биология . 5 (3): 198–208. дои : 10.1038/nrm1333 . ПМИД 14991000 . S2CID 32453554 .
- ^ Килинг П.Дж. (март 2010 г.). «Эндсимбиотическое происхождение, диверсификация и судьба пластид» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 365 (1541): 729–48. дои : 10.1098/rstb.2009.0103 . ПМЦ 2817223 . ПМИД 20124341 .
- ^ Jump up to: а б Биология, 8-е издание — Кэмпбелл и Рис . Бенджамин Каммингс. 2008. с. 340. ИСБН 978-0-321-54325-7 .
- ^ Jump up to: а б с д Мудрый Р.Р., Хубер Дж.К. (2007). Строение и функции пластид . Берлин: Шпрингер. стр. 53–74. ISBN 978-1-4020-6570-5 .
- ^ Jump up to: а б с д Ли Д.В., Ли С., Ли Дж.Дж., Ли К.Х., Ким С., Чонг Г.В., Хван И (февраль 2006 г.). «Функциональная характеристика мотивов последовательности транзитного пептида малой субъединицы рубиско Arabidopsis» . Физиология растений . 140 (2): 466–83. дои : 10.1104/стр.105.074575 . ПМЦ 1361317 . ПМИД 16384899 .
- ^ Jump up to: а б с д и Мэй Т., Солл Дж. (январь 2000 г.). «Белки 14-3-3 образуют в растениях управляющий комплекс с белками-предшественниками хлоропластов» . Растительная клетка . 12 (1): 53–64. дои : 10.1105/tpc.12.1.53 . ПМК 140214 . ПМИД 10634907 .
- ^ Lung SC, Chuong SD (апрель 2012 г.). «Сигнал сортировки, подобный транзитному пептиду, на С-конце направляет рецептор препротеина Bienertia sinuspersici Toc159 к внешней мембране хлоропласта» . Растительная клетка . 24 (4): 1560–78. дои : 10.1105/tpc.112.096248 . ПМЦ 3398564 . ПМИД 22517318 .
- ^ Jump up to: а б с д Вагеманн К., Солл Дж. (март 1996 г.). «Фосфорилирование транзитной последовательности белков-предшественников хлоропластов» . Журнал биологической химии . 271 (11): 6545–54. дои : 10.1074/jbc.271.11.6545 . ПМИД 8626459 . S2CID 26014578 .
- ^ Jump up to: а б с д и ж г час я Джарвис П., Солл Дж. (декабрь 2001 г.). «Импорт белков Toc, Tic и хлоропластов». Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1541 (1–2): 64–79. дои : 10.1016/S0167-4889(01)00147-1 . ПМИД 11750663 .
- ^ Сунь Ю.Дж., Форухар Ф., Ли Хм Х.М., Ту С.Л., Йе Ю.Х., Као С., Шр Х.Л., Чжоу CC, Чен С., Сяо CD (февраль 2002 г.). «Кристаллическая структура Toc34 гороха, новая ГТФаза транслокона белка хлоропластов». Структурная биология природы . 9 (2): 95–100. дои : 10.1038/nsb744 . ПМИД 11753431 . S2CID 21855733 .
- ^ Jump up to: а б с д и Агне Б, Андрес С, Монтандон С, Крист Б, Эртан А, Юнг Ф, Инфангер С, Бишоф С, Багинский С, Кесслер Ф (июль 2010 г.). «Кислый А-домен Arabidopsis TOC159 представляет собой гиперфосфорилированный белок» . Физиология растений . 153 (3): 1016–30. дои : 10.1104/стр.110.158048 . ПМЦ 2899928 . ПМИД 20457805 .
- ^ Jump up to: а б с д и ж г час я Кикучи С., Бедар Дж., Хирано М., Хирабаяши Ю., Оиси М., Имаи М., Такасе М., Иде Т., Накаи М. (февраль 2013 г.). «Обнаружение белкового транслокона на мембране внутренней оболочки хлоропласта». Наука . 339 (6119): 571–4. Бибкод : 2013Sci...339..571K . дои : 10.1126/science.1229262 . ПМИД 23372012 . S2CID 5062593 .
- ^ Карран С.П., Келер С.М. (2004). Митохондриальная функция и биогенез . Спрингер. п. 59. ИСБН 9783540214892 .