Транспортная РНК
| тРНК | |
|---|---|
| Идентификаторы | |
| Символ | т |
| Рфам | RF00005 |
| Другие данные | |
| РНК Тип | ген , тРНК |
| PDB Структуры | PDBe 3icq, 1asy, 1asz, 1il2, 2tra, 3tra, 486d, 1fir, 1yfg, 3eph, 3epj, 3epk, 3epl, 1efw, 1c0a, 2ake, 2azx, 2dr2, 1f7u, 1f7v, 3foz, 2hgp, 2j02, 2ow8 , 2в46, 2в48, 2вдг, 2вдч, 2вдк, 2вдм, 2чч1 |
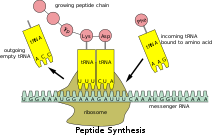
Транспортная РНК (сокращенно тРНК , ранее называвшаяся мРНК , для растворимой РНК [ 1 ] ) представляет собой адаптерную молекулу , состоящую из РНК , обычно от 76 до 90 нуклеотидов (у эукариот), длиной [ 2 ] который служит физической связью между мРНК и аминокислотной последовательностью белков. Транспортная РНК (тРНК) делает это, перенося аминокислоту в белоксинтезирующий механизм клетки, называемый рибосомой . Дополнение трехнуклеотидного кодона ( матричной РНК мРНК) трехнуклеотидным антикодоном тРНК приводит к синтезу белка на основе кода мРНК. Таким образом, тРНК являются необходимым компонентом трансляции , биологического синтеза новых белков в соответствии с генетическим кодом .
Обзор
[ редактировать ]В то время как конкретная нуклеотидная последовательность мРНК определяет, какие аминокислоты включены в белковый продукт гена, из которого транскрибируется мРНК, роль тРНК заключается в указании, какая последовательность генетического кода соответствует какой аминокислоте. [ 3 ] мРНК кодирует белок в виде ряда смежных кодонов, каждый из которых распознается определенной тРНК. Один конец тРНК соответствует генетическому коду в трехнуклеотидной последовательности, называемой антикодоном . Антикодон образует три комплементарные пары оснований с кодоном в мРНК во время биосинтеза белка.
На другом конце тРНК имеется ковалентное присоединение к аминокислоте, соответствующей последовательности антикодона. Каждый тип молекулы тРНК может быть присоединен только к одному типу аминокислот, поэтому в каждом организме имеется множество типов тРНК. Поскольку генетический код содержит несколько кодонов, определяющих одну и ту же аминокислоту, существует несколько молекул тРНК, несущих разные антикодоны, несущие одну и ту же аминокислоту.
Ковалентное присоединение к 3'-концу тРНК катализируется ферментами, называемыми аминоацил-тРНК-синтетазами . Во время синтеза белка тРНК с прикрепленными аминокислотами доставляются в рибосому с помощью белков, называемых факторами элонгации , которые способствуют ассоциации тРНК с рибосомой, синтезу нового полипептида и транслокации (движению) рибосомы вдоль мРНК. Если антикодон тРНК совпадает с мРНК, другая тРНК, уже связанная с рибосомой, переносит растущую полипептидную цепь от ее 3'-конца к аминокислоте, прикрепленной к 3'-концу вновь доставленной тРНК, - реакция, катализируемая рибосомой. Большое количество отдельных нуклеотидов в молекуле тРНК может быть химически модифицировано , часто путем метилирования или дезамидирования . Эти необычные основания иногда влияют на взаимодействие тРНК с рибосомами , а иногда встречаются в антикодоне, изменяя свойства спаривания оснований. [ 4 ]
Структура
[ редактировать ]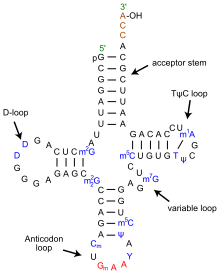

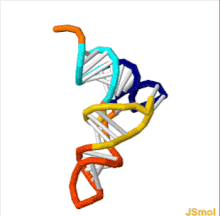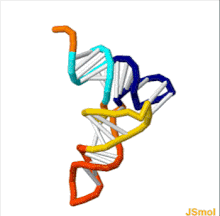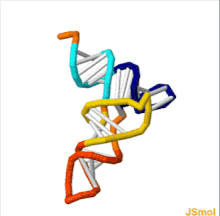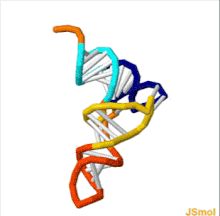
Структуру тРНК можно разложить на ее первичную структуру , ее вторичную структуру (обычно визуализируемую как структуру клеверного листа ) и ее третичную структуру. [ 6 ] структуру, которая позволяет им встраиваться в участки P и A рибосомы (все тРНК имеют схожую L-образную 3D - ). Структура клеверного листа становится трехмерной L-образной структурой за счет коаксиального укладки спиралей, что является распространенным мотивом третичной структуры РНК . Длина каждого плеча, а также «диаметр» петли в молекуле тРНК варьируются от вида к виду. [ 6 ] [ 7 ] Структура тРНК состоит из следующего:
- Акцепторный стебель представляет собой стебель из 7-9 пар оснований (п.н.), образованный спариванием оснований 5'-концевого нуклеотида с 3'-концевым нуклеотидом (который содержит хвост CCA, используемый для прикрепления аминокислоты). Акцепторный стебель может содержать пары оснований, отличные от Уотсона-Крика. [ 6 ] [ 8 ]
- Хвост CCA представляет собой последовательность цитозин -цитозин- аденин на 3'-конце молекулы тРНК. Аминокислота, загруженная на тРНК с помощью аминоацил-тРНК-синтетазы , с образованием аминоацил-тРНК , ковалентно связана с 3'-гидроксильной группой на хвосте CCA. [ 9 ] Эта последовательность важна для распознавания тРНК ферментами и имеет решающее значение при трансляции. [ 10 ] [ 11 ] У прокариот последовательность CCA транскрибируется в некоторых последовательностях тРНК. В большинстве прокариотических тРНК и эукариотических тРНК последовательность CCA добавляется во время процессинга и поэтому не появляется в гене тРНК. [ 12 ]
- Петля D представляет собой стебель длиной от 4 до 6 пар оснований, заканчивающийся петлей, которая часто содержит дигидроуридин . [ 6 ]
- Петля антикодона представляет собой стебель длиной 5 пар оснований, петля которого содержит антикодон . [ 6 ]
- Петля TΨC названа так из-за характерного присутствия в петле необычного основания Ψ, где Ψ — это псевдоуридин , модифицированный уридин . Модифицированное основание часто встречается в последовательности 5'-TΨCGA-3', где Т ( риботимидин , m5U) и А образуют пару оснований. [ 13 ]
- Вариабельная петля или V-петля расположена между петлей антикодона и петлей ΨU и, как следует из названия, имеет размер от 3 до 21 основания. В некоторых тРНК «петля» достаточно длинна, чтобы сформировать жесткий стебель — вариабельное плечо . [ 14 ] тРНК с V-петлей длиной более 10 оснований классифицируется как «класс II», а остальная часть называется «классом I». [ 15 ]
Антикодон
[ редактировать ]Антикодон [ 16 ] представляет собой единицу из трех нуклеотидов, соответствующую трем основаниям мРНК кодона . Каждая тРНК имеет отдельную триплетную последовательность антикодонов, которая может образовывать 3 комплементарные пары оснований, одному или нескольким кодонам аминокислоты. Некоторые антикодоны соединяются более чем с одним кодоном из-за нестабильного спаривания оснований . Часто первый нуклеотид антикодона не встречается в мРНК: инозин , который может образовывать водородные связи с более чем одним основанием в соответствующем положении кодона. [ 4 ] : 29.3.9 В генетическом коде одна аминокислота обычно определяется всеми четырьмя вариантами третьего положения или, по крайней мере, как пиримидинами , так и пуринами ; например, аминокислота глицин кодируется последовательностями кодонов GGU, GGC, GGA и GGG. Другие модифицированные нуклеотиды также могут появляться в первом положении антикодона — иногда известном как «положение качания», — что приводит к тонким изменениям в генетическом коде, как, например, в митохондриях . [ 17 ] Возможность колебания оснований уменьшает количество требуемых типов тРНК: вместо 61 типа, по одному на каждый смысловой кодон стандартного генетического кода), для однозначной трансляции всех 61 смыслового кодона требуется только 31 тРНК. [ 3 ] [ 18 ]
Номенклатура
[ редактировать ]ТРНК обычно называют по предполагаемой аминокислоте (например, тРНК-Asn ), по ее антикодоновой последовательности (например, тРНК(GUU) ) или по тому и другому (например, тРНК-Asn(GUU) или тРНК Асн
ГУУ ). [ 19 ] Эти две особенности описывают основную функцию тРНК, но на самом деле не охватывают всего разнообразия вариаций тРНК; в результате для различения добавляются числовые суффиксы. [ 20 ] тРНК, предназначенные для одной и той же аминокислоты, называются «изотипами»; они с одинаковой последовательностью антикодонов называются «изоакцепторами»; и они, оба одинаковые, но различающиеся в других местах, называются «изодекодерами». [ 21 ]
Аминоацилирование
[ редактировать ]Аминоацилирование – это процесс добавления аминоацильной группы к соединению. Он ковалентно связывает аминокислоту с 3'-концом CCA молекулы тРНК. Каждая тРНК аминоацилируется (или заряжается ) определенной аминокислотой с помощью аминоацил-тРНК-синтетазы . Обычно для каждой аминокислоты существует одна аминоацил-тРНК-синтетаза, несмотря на то, что для каждой аминокислоты может быть более одной тРНК и более одного антикодона. Узнавание соответствующей тРНК синтетазами не опосредовано исключительно антикодоном, и акцепторный стебель часто играет заметную роль. [ 22 ] Реакция:
У некоторых организмов может отсутствовать одна или несколько синтетаз аминофосфат-тРНК. Это приводит к зарядке тРНК химически родственной аминокислотой, а с помощью фермента или ферментов тРНК модифицируется для правильного заряда. Например, у Helicobacter pylori отсутствует глутаминил-тРНК-синтетаза. Таким образом, глутамат-тРНК-синтетаза заряжает тРНК-глутамин (тРНК-Gln) глутаматом . Затем амидотрансфераза преобразует кислотную боковую цепь глутамата в амид, образуя правильно заряженную gln-тРНК-Gln.
Связывание с рибосомой
[ редактировать ]Рибосома : имеет три сайта связывания молекул тРНК, которые занимают пространство между двумя субъединицами рибосомы А (аминоацил) , [ 24 ] Сайты P (пептидил) и E (выход) . Кроме того, рибосома имеет два других сайта связывания тРНК, которые используются во время декодирования мРНК или во время инициации синтеза белка . Это сайт T (называемый фактором элонгации Tu ) и сайт I (инициация). [ 25 ] [ 26 ] По соглашению, сайты связывания тРНК обозначаются следующим образом: сайт на малой субъединице рибосомы указан первым, а сайт на большой субъединице рибосомы указан вторым. Например, сайт A часто пишется как A/A, сайт P — P/P, а сайт E — E/E. [ 25 ] Связывающие белки, такие как L27, L2, L14, L15, L16 в A- и P-сайтах, были определены с помощью аффинного мечения AP Czernilofsky et al. ( Proc. Natl. Acad. Sci, США , стр. 230–234, 1974).
После завершения инициации трансляции первая аминоацил-тРНК располагается в сайте P/P и готова к циклу элонгации, описанному ниже. Во время элонгации трансляции тРНК сначала связывается с рибосомой как часть комплекса с фактором элонгации Tu ( EF-Tu ) или его эукариотическим ( eEF-1 ) или архейным аналогом. Этот начальный сайт связывания тРНК называется сайтом A/T. В сайте A/T половина A-сайта находится в малой субъединице рибосомы , где расположен сайт декодирования мРНК. Сайт декодирования мРНК — это место, где мРНК кодон считывается во время трансляции. Половина Т-сайта расположена в основном на большой субъединице рибосомы , где EF-Tu или eEF-1 взаимодействует с рибосомой. После завершения декодирования мРНК аминоацил-тРНК связывается в сайте A/A и готова к образованию следующей пептидной связи. [ 27 ] образовываться с присоединенной к нему аминокислотой. Пептидил-тРНК, которая переносит растущий полипептид на аминоацил-тРНК, связанную в сайте A/A, связывается в сайте P/P. После образования пептидной связи тРНК в сайте P/P ацилируется или имеет свободный 3'-конец , а тРНК в сайте A/A диссоциирует растущую полипептидную цепь. Чтобы обеспечить следующий цикл элонгации, тРНК затем перемещаются через гибридные сайты связывания A/P и P/E, прежде чем завершить цикл и находиться в сайтах P/P и E/E. Как только тРНК A/A и P/P переместились в сайты P/P и E/E, мРНК также переместилась на один кодон , и сайт A/T стал вакантным, готовым к следующему раунду декодирования мРНК. ТРНК, связанная с сайтом E/E, затем покидает рибосому.
Сайт P/I фактически первым связывается с аминоацил-тРНК, которая у бактерий доставляется с помощью фактора инициации, называемого IF2 . [ 26 ] Однако существование сайта P/I в рибосомах эукариот или архей пока не подтверждено. Белок L27 P-сайта был определен методом аффинного мечения E. Collatz и AP Czernilofsky ( FEBS Lett. , Vol. 63, pp. 283-286, 1976).
гены тРНК
[ редактировать ]Организмы различаются по количеству генов тРНК в геноме . Например, нематодный червь C. elegans , широко используемый модельный организм в генетических исследованиях, имеет 29 647 [ 28 ] гены в его ядерном геноме, из которых 620 кодируют тРНК. [ 29 ] [ 30 ] почкующихся дрожжей Saccharomyces cerevisiae В геноме имеется 275 генов тРНК. Количество генов тРНК на геном может широко варьироваться: виды бактерий из таких групп, как Fusobacteria и Tenericutes, имеют около 30 генов на геном, в то время как сложные эукариотические геномы, такие как рыбки данио ( Danio rerio ), могут нести более 10 тысяч генов тРНК. [ 31 ]
В геноме человека, который, по оценкам января 2013 г., насчитывает около 20 848 генов, кодирующих белки [ 32 ] Всего существует 497 ядерных генов, кодирующих цитоплазматические молекулы тРНК, и 324 псевдогена, происходящих от тРНК - генов тРНК, которые, как считается, больше не функционируют. [ 33 ] (хотя было показано, что псевдо-тРНК участвуют в устойчивости бактерий к антибиотикам). [ 34 ] Как и у всех эукариот, существует 22 гена митохондриальной тРНК. [ 35 ] у людей. Мутации в некоторых из этих генов связаны с тяжелыми заболеваниями, такими как синдром MELAS . участки в ядерных хромосомах , очень похожие по последовательности на гены митохондриальных тРНК (тРНК-двойники). Также были идентифицированы [ 36 ] Эти двойники тРНК также считаются частью ядерной митохондриальной ДНК (гены, переносимые из митохондрий в ядро). [ 36 ] [ 37 ] Феномен множественных ядерных копий митохондриальной тРНК (тРНК-двойников) наблюдался у многих высших организмов от человека до опоссума. [ 38 ] предполагая возможность того, что двойники функциональны.
Гены цитоплазматических тРНК можно сгруппировать в 49 семейств в соответствии с их антикодоновыми свойствами. Эти гены обнаружены на всех хромосомах, кроме 22-й и Y-хромосомы. Наблюдается высокая кластеризация на 6р (140 генов тРНК), а также на хромосоме 1. [ 33 ]
HGNC . в сотрудничестве с Базой данных геномных тРНК ( GtRNAdb ) и экспертами в этой области утвердил уникальные названия для человеческих генов, кодирующих тРНК
Обычно гены тРНК бактерий короче (в среднем = 77,6 п.н.), чем тРНК архей (в среднем = 83,1 п.н.) и эукариот (в среднем = 84,7 п.н.). [ 31 ] Зрелая тРНК следует противоположному образцу: тРНК бактерий обычно длиннее (медиана = 77,6 нт), чем тРНК архей (медиана = 76,8 нт), при этом у эукариот наблюдаются самые короткие зрелые тРНК (медиана = 74,5 нт). [ 31 ]
Эволюция
[ редактировать ]Содержание геномной тРНК является отличительной особенностью геномов между биологическими доменами жизни: археи представляют собой простейшую ситуацию с точки зрения содержания геномной тРНК с одинаковым количеством копий гена, бактерии имеют промежуточную ситуацию, а эукарии представляют собой наиболее сложную ситуацию. [ 39 ] Эукарии содержат не только больше генов тРНК, чем два других царства, но также и высокую вариабельность числа копий генов среди разных изоакцепторов, и эта сложность, по-видимому, обусловлена дупликацией генов тРНК и изменениями специфичности антикодонов. [ нужна ссылка ] .
Эволюция числа копий гена тРНК у разных видов связана с появлением специфических ферментов модификации тРНК (уридинметилтрансфераз у бактерий и аденозиндезаминаз у эукарий), которые увеличивают способность декодирования данной тРНК. [ 39 ] Например, тРНК Земля кодирует четыре различных изоакцептора тРНК (AGC, UGC, GGC и CGC). У эукарий изоакцепторы AGC чрезвычайно богаты числом копий гена по сравнению с остальными изоакцепторами, и это коррелирует с модификацией A-to-I его качающегося основания. Такая же тенденция была продемонстрирована для большинства аминокислот эукариальных видов. Действительно, эффект этих двух модификаций тРНК также проявляется в смещении использования кодонов . Гены с высокой экспрессией, по-видимому, обогащены кодонами, которые используют исключительно кодоны, которые будут декодироваться этими модифицированными тРНК, что предполагает возможную роль этих кодонов - и, следовательно, этих модификаций тРНК - в эффективности трансляции. [ 39 ]
Многие виды в ходе эволюции утратили специфические тРНК. Например, и у млекопитающих, и у птиц отсутствуют одни и те же 14 из 64 возможных генов тРНК, но другие формы жизни содержат эти тРНК. [ 40 ] Для трансляции кодонов, для которых отсутствует точно спаривающаяся тРНК, организмы прибегают к стратегии, называемой колебанием , при которой несовершенно совпадающие пары тРНК/мРНК по-прежнему приводят к трансляции, хотя эта стратегия также увеличивает склонность к ошибкам трансляции. [ 41 ] Причины, по которым гены тРНК были утрачены в ходе эволюции, остаются дискуссионными, но могут быть связаны с повышением устойчивости к вирусной инфекции. [ 42 ] Поскольку триплеты нуклеотидов могут представлять больше комбинаций, чем аминокислот и связанных с ними тРНК, в генетическом коде существует избыточность, и несколько разных трехнуклеотидных кодонов могут экспрессировать одну и ту же аминокислоту. Это смещение кодонов является причиной необходимости оптимизации кодонов.
Гипотетическое происхождение
[ редактировать ]Верхняя половина тРНК (состоящая из Т-плеча и акцепторного стебля с 5'-концевой фосфатной группой и 3'-концевой группой CCA) и нижняя половина (состоящая из D-плеча и антикодона) представляют собой независимые единицы структуры. так и по функции. Верхняя половина, возможно, возникла первой, включая 3'-концевую геномную метку, которая первоначально могла маркировать тРНК-подобные молекулы для репликации в мире ранних РНК . Нижняя половина, возможно, развилась позже в результате расширения, например, когда в мире РНК начался синтез белка и превратил его в мир рибонуклеопротеинов ( мир RNP ). Этот предложенный сценарий называется гипотезой геномных меток . Фактически, тРНК и тРНК-подобные агрегаты оказывают важное каталитическое влияние (т.е. как рибозимы до сих пор ) на репликацию. Эти роли можно рассматривать как « молекулярные (или химические) окаменелости » мира РНК. [ 43 ] В марте 2021 года исследователи сообщили о доказательствах, свидетельствующих о том, что ранней формой транспортной РНК могла быть молекула рибозима- репликатора на самых ранних стадиях развития жизни, или абиогенезе . [ 44 ] [ 45 ]
фрагменты тРНК
[ редактировать ]Фрагменты, полученные из тРНК (или tRF), представляют собой короткие молекулы, которые появляются после расщепления зрелых тРНК или транскрипта-предшественника. [ 46 ] [ 47 ] [ 48 ] [ 49 ] Как цитоплазматические, так и митохондриальные тРНК могут образовывать фрагменты. [ 50 ] Считается, что существует по крайней мере четыре структурных типа tRF, которые происходят из зрелых тРНК, включая относительно длинные половины тРНК и короткие 5'-tRF, 3'-tRF и i-tRF. [ 46 ] [ 50 ] [ 51 ] ТРНК-предшественник может быть расщеплена с образованием молекул из 5'-лидерной или 3'-концевой последовательностей. Ферменты расщепления включают ангиогенин, Dicer, РНКазу Z и РНКазу P. [ 46 ] [ 47 ] Особенно в случае с ангиогенином, tRF имеют характерно необычный циклический фосфат на 3'-конце и гидроксильную группу на 5'-конце. [ 52 ] tRF, по-видимому, играют роль в интерференции РНК , особенно в подавлении ретровирусов и ретротранспозонов, которые используют тРНК в качестве праймера для репликации. Полу-тРНК, расщепляемые ангиогенином, также известны как тРНК. Биогенез более мелких фрагментов, включая те, которые функционируют как piRNA , менее изучен. [ 53 ]
tRF имеют множество зависимостей и ролей; такие как проявление значительных изменений между полами, расами и статусом заболевания. [ 50 ] [ 54 ] [ 55 ] Функционально они могут загружаться на Ago и действовать через пути РНКи. [ 48 ] [ 51 ] [ 56 ] участвуют в образовании стрессовых гранул, [ 57 ] вытеснять мРНК из РНК-связывающих белков [ 58 ] или запретить трансляцию. [ 59 ] На системном или организменном уровне четыре типа tRF обладают разнообразным спектром активности. Функционально tRF связаны с вирусной инфекцией, [ 60 ] рак, [ 51 ] пролиферация клеток [ 52 ] а также с эпигенетической трансгенерационной регуляцией метаболизма. [ 61 ]
tRF не ограничиваются людьми, и было показано, что они существуют во многих организмах. [ 51 ] [ 62 ] [ 63 ] [ 64 ]
Для желающих узнать больше о tRF доступны два онлайн-инструмента: платформа для интерактивного исследования фрагментов т - митохондриальных и ядерных MINTbase РНК ( ) . [ 65 ] [ 66 ] и реляционная база данных РНК трансферной ( , связанных с фрагментов tRFdb ) . [ 67 ] MINTbase также предоставляет схему именования tRF, называемую tRF-номерными знаками (или кодами MINT), которая не зависит от генома; схема сжимает последовательность РНК в более короткую строку.
Сконструированные тРНК
[ редактировать ]тРНК с модифицированными антикодонами и/или акцепторными стеблями можно использовать для модификации генетического кода. Ученые успешно перепрофилировали кодоны (смысловые и стоп-кодоны), чтобы принять аминокислоты (природные и новые) как для инициации (см.: стартовый кодон ), так и для элонгации.
В 1990 году тРНК fMet2
CUA (модифицированный из тРНК fMet2
CAU Ген metY ) был встроен в E. coli , заставляя его инициировать синтез белка на стоп-кодоне UAG, если ему предшествует сильная последовательность Шайна-Дальгарно . При инициации он вставляет не только традиционный формилметионин , но и формилглутамин, поскольку глутамил-тРНК-синтаза также распознает новую тРНК. [ 68 ] Эксперимент был повторен в 1993 году, теперь с использованием тРНК-удлинителя, модифицированной для распознавания метионил-тРНК-формилтрансферазой . [ 69 ] Аналогичный результат был получен и у Mycobacterium . [ 70 ] Более поздние эксперименты показали, что новая тРНК была ортогональна обычному стартовому кодону AUG, не обнаруживая никаких обнаруживаемых событий нецелевой инициации трансляции в геномно перекодированном штамме E. coli . [ 71 ]
Биогенез тРНК
[ редактировать ]В эукариотических клетках тРНК транскрибируются РНК -полимеразой III в виде пре-тРНК в ядре. [ 72 ] РНК-полимераза III распознает две высококонсервативные последующие последовательности промотора: 5'-интрагенную контрольную область (5'-ICR, D-контрольная область или A-бокс) и 3'-ICR (T-контрольная область или B-бокс) внутри тРНК. гены. [ 2 ] [ 73 ] [ 74 ] Первый промотор начинается с +8 зрелой тРНК, а второй промотор расположен на 30–60 нуклеотидов ниже первого промотора. Транскрипция завершается после отрезка четырех и более тимидинов . [ 2 ] [ 74 ]
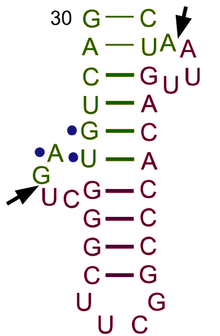
Пре-тРНК претерпевают обширные модификации внутри ядра. Некоторые пре-тРНК содержат интроны , которые подвергаются сплайсингу или разрезанию с образованием функциональной молекулы тРНК; [ 75 ] у бактерий они самосплайсируются , тогда как у эукариот и архей они удаляются с помощью эндонуклеаз, сплайсирующих тРНК . [ 76 ] Эукариотическая пре-тРНК содержит структурный мотив «выпуклость-спираль-выпуклость» (BHB), который важен для распознавания и точного сплайсинга интрона тРНК эндонуклеазами. [ 77 ] Это положение и структура мотива эволюционно законсервированы. Однако некоторые организмы, например одноклеточные водоросли, имеют неканоническое положение BHB-мотива, а также 5'- и 3'-концы сплайсированной последовательности интрона. [ 77 ] 5'-последовательность удаляется Р. РНКазой [ 78 ] тогда как 3'-конец удаляется ферментом Z. тРНКаза [ 79 ] Заметным исключением является архея Nanoarchaeum equitans , которая не обладает ферментом РНКазы P и имеет промотор, расположенный таким образом, что транскрипция начинается на 5'-конце зрелой тРНК. [ 80 ] Нематричный 3'-CCA-хвост добавляется нуклеотидилтрансферазой . [ 81 ] Прежде чем тРНК будут экспортированы в цитоплазму с помощью Los1/ Xpo-t , [ 82 ] [ 83 ] тРНК аминоацилированы . [ 84 ] Порядок обработки событий не сохраняется. Например, у дрожжей сплайсинг осуществляется не в ядре, а на цитоплазматической стороне митохондриальных мембран. [ 85 ]
История
[ редактировать ]Существование тРНК было впервые выдвинуто Фрэнсисом Криком как « гипотеза адаптера », основанная на предположении, что должна существовать молекула-адаптер, способная опосредовать трансляцию алфавита РНК в белковый алфавит. Пол Замечник , Махлон Хоугланд и Мэри Луиза Стивенсон открыли тРНК. [ 86 ] [ 87 ] [ 88 ] Значительные исследования структуры были проведены в начале 1960-х годов Алексом Ричем и Дональдом Каспаром , двумя исследователями из Бостона, группой Жака Фреско в Принстонском университете и группой из Соединенного Королевства в Королевском колледже Лондона . [ 89 ] В 1965 году Роберт Холли из Корнелльского университета сообщил о первичной структуре и предложил три вторичные структуры. [ 90 ] тРНК была впервые кристаллизована в Мэдисоне, штат Висконсин, Робертом М. Боком. [ 91 ] Структура клеверного листа была подтверждена несколькими другими исследованиями, проведенными в последующие годы. [ 92 ] и было окончательно подтверждено с помощью исследований рентгеновской кристаллографии в 1974 году. Две независимые группы, Ким Сун-Хоу, работавшая под руководством Александра Рича , и британская группа, возглавляемая Аароном Клугом , опубликовали одни и те же результаты кристаллографии в течение года. [ 93 ] [ 94 ]
Клиническая значимость
[ редактировать ]Вмешательство в аминоацилирование может быть полезно в качестве подхода к лечению некоторых заболеваний: раковые клетки могут быть относительно уязвимы к нарушению аминоацилирования по сравнению со здоровыми клетками. Синтез белка, связанный с раком и вирусной биологией, часто очень зависит от конкретных молекул тРНК. Например, при раке печени зарядка тРНК-Lys-CUU лизином поддерживает рост и метастазирование раковых клеток печени, тогда как здоровые клетки гораздо меньше зависят от этой тРНК для поддержания клеточной физиологии. [ 95 ] Аналогичным образом, вирус гепатита Е требует ландшафта тРНК, который существенно отличается от ландшафта, связанного с неинфицированными клетками. [ 96 ] Следовательно, ингибирование аминоацилирования определенных видов тРНК считается новым многообещающим направлением рационального лечения множества заболеваний.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Плешиа О.Дж., Пальчук Н.К., Кора-Фигероа Э., Мукерджи А., Браун В. (октябрь 1965 г.). «Продукция антител к растворимой РНК (сРНК)» . Труды Национальной академии наук Соединенных Штатов Америки . 54 (4): 1281–1285. Бибкод : 1965PNAS...54.1281P . дои : 10.1073/pnas.54.4.1281 . ПМК 219862 . ПМИД 5219832 .
- ^ Перейти обратно: а б с Шарп С.Дж., Шаак Дж., Кули Л., Берк DJ, Сёлль Д. (1985). «Структура и транскрипция генов эукариотической тРНК». Критические обзоры CRC по биохимии . 19 (2): 107–144. дои : 10.3109/10409238509082541 . ПМИД 3905254 .
- ^ Перейти обратно: а б Крик Ф.Х. (декабрь 1968 г.). «Происхождение генетического кода». Журнал молекулярной биологии . 38 (3): 367–379. дои : 10.1016/0022-2836(68)90392-6 . ПМИД 4887876 . S2CID 4144681 .
- ^ Перейти обратно: а б Страйер Л., Берг Дж.М., Тимочко Дж.Л. (2002). Биохимия (5-е изд.). Сан-Франциско: WH Freeman. ISBN 978-0-7167-4955-4 .
- ^ «Трансферная РНК (тРНК)» . Proteopedia.org . Проверено 7 ноября 2018 г.
- ^ Перейти обратно: а б с д и Ито Ю, Секине С, Суэцугу С, Ёкояма С (июль 2013 г.). «Третичная структура бактериальной сереноцистеиновой тРНК» . Исследования нуклеиновых кислот . 41 (13): 6729–6738. дои : 10.1093/нар/gkt321 . ПМЦ 3711452 . ПМИД 23649835 .
- ^ Гуденбор Дж. М., Пан Т. (29 октября 2006 г.). «Разнообразие генов тРНК у эукариот» . Исследования нуклеиновых кислот . 34 (21): 6137–6146. дои : 10.1093/nar/gkl725 . ПМЦ 1693877 . ПМИД 17088292 .
- ^ Ян М., Роджерс М.Дж., Зёлль Д. (июль 1991 г.). «Антикодон и акцепторные стволовые нуклеотиды в тРНК (Gln) являются основными элементами узнавания глутаминил-тРНК-синтетазы E. coli». Природа . 352 (6332): 258–260. Бибкод : 1991Natur.352..258J . дои : 10.1038/352258a0 . ПМИД 1857423 . S2CID 4263705 .
- ^ Ибба М., Солл Д. (июнь 2000 г.). «Синтез аминоацил-тРНК». Ежегодный обзор биохимии . 69 (1): 617–650. doi : 10.1146/annurev.biochem.69.1.617 . ПМИД 10966471 .
- ^ Спринцл М., Крамер Ф. (1979). «Конец -CCA тРНК и его роль в биосинтезе белка». Прогресс в исследованиях нуклеиновых кислот и молекулярной биологии . 22 : 1–69. дои : 10.1016/s0079-6603(08)60798-9 . ISBN 978-0-12-540022-0 . ПМИД 392600 .
- ^ Грин Р., Ноллер Х.Ф. (1997). «Рибосомы и трансляция». Ежегодный обзор биохимии . 66 : 679–716. doi : 10.1146/annurev.biochem.66.1.679 . ПМИД 9242921 .
- ^ Эби М., Киршнер Г., Чен Дж.Ю., Виджайрагаван У., Джейкобсон А., Мартин Н.К., Абельсон Дж. и др. (сентябрь 1990 г.). «Выделение термочувствительного мутанта с измененной тРНК-нуклеотидилтрансферазой и клонирование гена, кодирующего тРНК-нуклеотидилтрансферазу, в дрожжах Saccharomyces cerevisiae» . Журнал биологической химии . 265 (27): 16216–16220. дои : 10.1016/S0021-9258(17)46210-7 . ПМИД 2204621 .
- ^ Чан, CW; Четнани, Б; Мондрагон, А. (сентябрь 2013 г.). «Структура и функция структурного мотива Т-петли в некодирующих РНК» . Междисциплинарные обзоры Wiley. РНК . 4 (5): 507–22. дои : 10.1002/wrna.1175 . ПМЦ 3748142 . ПМИД 23754657 .
- ^ Прабхакар А., Кран Н., Чжан Дж., Варгас-Родригес О., Крупкин М., Фу З., Акоста-Рейес Ф.Дж., Ге Х, Чой Дж., Црнкович А., Эренберг М., Пуглиси Е.В., Сёлль Д., Пуглиси Дж. (июль 2022 г.). «Обнаружение препятствий трансляции при разработке синтетической тРНК» . Нуклеиновые кислоты Рез . 50 (18): 10201–10211. дои : 10.1093/nar/gkac576 . ПМЦ 9561287 . ПМИД 35882385 .
- ^ Бреннан, Т.; Сундаралингам, М. (1 ноября 1976 г.). «Структура молекул транспортной РНК, содержащих длинную вариабельную петлю» . Исследования нуклеиновых кислот . 3 (11): 3235–3252. дои : 10.1093/нар/3.11.3235 . ПМК 343166 . ПМИД 794835 .
- ^ Фельзенфельд Г., Кантони Г.Л. (май 1964 г.). «Использование исследований термической денатурации для исследования базовой последовательности сериновой мРНК дрожжей» . Труды Национальной академии наук Соединенных Штатов Америки . 51 (5): 818–826. Бибкод : 1964PNAS...51..818F . дои : 10.1073/pnas.51.5.818 . ПМК 300168 . ПМИД 14172997 .
- ^ Сузуки Т, Сузуки Т (июнь 2014 г.). «Полный ландшафт посттранскрипционных модификаций митохондриальных тРНК млекопитающих» . Исследования нуклеиновых кислот . 42 (11): 7346–7357. дои : 10.1093/nar/gku390 . ПМК 4066797 . ПМИД 24831542 .
- ^ Лодиш Х., Берк А., Мацудайра П., Кайзер К.А., Кригер М., Скотт М.П., Зипурски С.Л., Дарнелл Дж. (2004). Молекулярно-клеточная биология . WH Фриман: Нью-Йорк. 5-е изд. ISBN 978-0716743668 [ нужна страница ]
- ^ Паризьен, Марк; Ван, Сяоюнь; Пан, Тао (декабрь 2013 г.). «Разнообразие генов тРНК человека из проекта 1000 геномов» . Биология РНК . 10 (12): 1853–1867. дои : 10.4161/rna.27361 . ПМЦ 3917988 . ПМИД 24448271 .
- ^ Чан, ПП; Лоу, ТМ (4 января 2016 г.). «GtRNAdb 2.0: расширенная база данных генов транспортных РНК, идентифицированных в полных и черновых геномах» . Исследования нуклеиновых кислот . 44 (Д1): Д184-9. дои : 10.1093/nar/gkv1309 . ПМК 4702915 . ПМИД 26673694 .
- ^ Хьюз, Летиция А.; Радлер, Даниэль Л.; Сиира, Стефан Дж.; МакКаббин, Тим; Рэйвен, Сэмюэл А.; Браун, Жасмин М.; Эрмер, Джудит А.; Риентес, Жанетт; Роджер, Дженнифер; Марселлен, Эстебан; Рэкхэм, Оливер; Филиповская, Александра (18 апреля 2023 г.). «Изменение числа копий в генах-изодекодерах тРНК нарушает развитие млекопитающих и сбалансированную трансляцию» . Природные коммуникации . 14 (1): 2210. Бибкод : 2023NatCo..14.2210H . дои : 10.1038/s41467-023-37843-9 . ПМЦ 10113395 . ПМИД 37072429 .
- ^ Шиммель П., Жье Р., Морас Д., Ёкояма С. (октябрь 1993 г.). «Оперативный код РНК для аминокислот и возможная связь с генетическим кодом» . Труды Национальной академии наук Соединенных Штатов Америки . 90 (19): 8763–8768. Бибкод : 1993PNAS...90.8763S . дои : 10.1073/pnas.90.19.8763 . ПМК 47440 . ПМИД 7692438 .
- ^ Данкл Дж.А., Ван Л., Фельдман М.Б., Пулк А., Чен В.Б., Капрал Г.Дж., Носке Дж., Ричардсон Дж.С., Бланшар С.С., Кейт Дж.Х. (май 2011 г.). «Структуры бактериальной рибосомы в классическом и гибридном состояниях связывания тРНК» . Наука . 332 (6032): 981–984. Бибкод : 2011Sci...332..981D . дои : 10.1126/science.1202692 . ПМК 3176341 . ПМИД 21596992 .
- ^ Коневега А.Л., Соболева Н.Г., Махно В.И., Семенков Ю.П., Винтермейер В., Роднина М.В., Катунин В.И. (январь 2004 г.). «Пуриновые основания в положении 37 тРНК стабилизируют взаимодействие кодон-антикодон в сайте рибосомы А путем стэкинга и Mg2+-зависимых взаимодействий» . РНК . 10 (1): 90–101. дои : 10.1261/rna.5142404 . ПМК 1370521 . ПМИД 14681588 .
- ^ Перейти обратно: а б Агиррезабала X, Фрэнк Дж (август 2009 г.). «Удлинение трансляции как динамическое взаимодействие между рибосомой, тРНК и факторами элонгации EF-G и EF-Tu» . Ежеквартальные обзоры биофизики . 42 (3): 159–200. дои : 10.1017/S0033583509990060 . ПМЦ 2832932 . ПМИД 20025795 .
- ^ Перейти обратно: а б Аллен Г.С., Завьялов А., Гурски Р., Эренберг М., Фрэнк Дж. (июнь 2005 г.). «Крио-ЭМ-структура комплекса инициации трансляции Escherichia coli» . Клетка . 121 (5): 703–712. дои : 10.1016/j.cell.2005.03.023 . ПМИД 15935757 . S2CID 16146867 .
- ^ Тирумалай М.Р., Ривас М., Тран К., Фокс Дж.Э. (ноябрь 2021 г.). «Центр пептидилтрансферазы: окно в прошлое» . Микробиол Мол Биол Rev. 85 (4): e0010421. дои : 10.1128/MMBR.00104-21 . ПМЦ 8579967 . ПМИД 34756086 .
- ^ Веб-сайт WormBase, http://www.wormbase.org. Архивировано 20 апреля 2017 г. на Wayback Machine , выпуск WS187, дата 25 января 2008 г.
- ^ Спит Дж., Лоусон Д. (январь 2006 г.). «Обзор структуры генов» . Червячная книга : 1–10. дои : 10.1895/wormbook.1.65.1 . ПМЦ 4781370 . ПМИД 18023127 .
- ^ Хартвелл Л.Х., Худ Л., Голдберг М.Л., Рейнольдс А.Е., Сильвер Л.М., Верес Р.К. (2004). Генетика: От генов к геномам 2-е изд. МакГроу-Хилл: Нью-Йорк. п. 264.
- ^ Перейти обратно: а б с САНТОС, Фенисия Брито; Дель-Бем, Луис-Эдуардо (январь 2023 г.). «Эволюция числа копий и репертуара тРНК в клеточной жизни» . Гены . 14 (1): 27. doi : 10.3390/genes14010027 . ISSN 2073-4425 . ПМЦ 9858662 . ПМИД 36672768 .
- ^ Выпуск Ensembl 70 — январь 2013 г. http://www.ensembl.org/Homo_sapiens/Info/StatsTable?db=core. Архивировано 15 декабря 2013 г. на Wayback Machine.
- ^ Перейти обратно: а б Ландер Э.С., Линтон Л.М., Биррен Б., Нусбаум С., Зоди М.К., Болдуин Дж. и др. (Международный консорциум по секвенированию генома человека) (февраль 2001 г.). «Первичное секвенирование и анализ генома человека» (PDF) . Природа . 409 (6822): 860–921. Бибкод : 2001Natur.409..860L . дои : 10.1038/35057062 . ПМИД 11237011 .
- ^ Роджерс Т.Э., Атаиде С.Ф., Дэйр К., Кац А., Сево С., Рой Х., Ибба М. (2012). «Псевдо-тРНК модулирует устойчивость к антибиотикам у Bacillus cereus» . ПЛОС ОДИН . 7 (7): е41248. Бибкод : 2012PLoSO...741248R . дои : 10.1371/journal.pone.0041248 . ПМК 3399842 . ПМИД 22815980 .
- ^ Хартвелл Л.Х., Худ Л., Голдберг М.Л., Рейнольдс А.Е., Сильвер Л.М., Верес Р.К. (2004). Генетика: От генов к геномам 2-е изд. МакГроу-Хилл: Нью-Йорк. п. 529.
- ^ Перейти обратно: а б Телонис АГ, Лоэр П., Кирино Ю., Ригуцос И. (2014). «Ядерные и митохондриальные тРНК-двойники в геноме человека» . Границы генетики . 5 : 344. дои : 10.3389/fgene.2014.00344 . ПМК 4189335 . ПМИД 25339973 .
- ^ Рамос А., Барбена Э., Матейу Л., дель Мар Гонсалес М., Майрал К., Лима М., Монтьель Р., Алуха М.П., Сантос С. и др. (ноябрь 2011 г.). «Ядерные вставки митохондриального происхождения: обновление базы данных и полезность в исследованиях рака». Митохондрия . 11 (6): 946–953. дои : 10.1016/j.mito.2011.08.009 . ПМИД 21907832 .
- ^ Телонис АГ, Кирино Ю, Ригуцос И (2015). «Митохондриальные двойники тРНК в ядерных хромосомах: могут ли они быть функциональными?» . РНК Биол . 12 (4): 375–380. дои : 10.1080/15476286.2015.1017239 . ПМЦ 4615777 . ПМИД 25849196 .
- ^ Перейти обратно: а б с Новоа Э.М., Павон-Этернод М., Пан Т., Рибас де Пуплана Л. (март 2012 г.). «Роль модификаций тРНК в структуре генома и использовании кодонов» . Клетка . 149 (1): 202–213. дои : 10.1016/j.cell.2012.01.050 . ПМИД 22464330 . S2CID 16487609 .
- ^ Оу Икс, Пэн В., Ян З, Цао Дж, Ван М., Пеппеленбош, член парламента, Пань Ц, Ченг А (ноябрь 2020 г.). «Эволюционно недостающие и консервативные гены тРНК у человека и птиц» . Заразить. Жене. Эвол . 85 : 104460. doi : 10.1016/j.meegid.2020.104460 . hdl : 1765/129010 . ПМИД 32679345 .
- ^ Оу Икс, Цао Дж, Ченг А, депутат Пеппеленбош, Пан Ц (март 2019 г.). «Ошибки трансляционного декодирования: колебание тРНК или неправильное включение?» . ПЛОС Генетика . 15 (3): 2979–2986. дои : 10.1371/journal.pgen.1008017 . ПМЦ 3158919 . ПМИД 21930591 .
- ^ Оу X, Ван М, Мао С, Цао J, Ченг А, Чжу Д, Чен С, Цзя Р, Лю М, Ян Ц, Ву Ю, Чжао X, Чжан С, Лю Ю, Ю Ю, Чжан Л, Чэнь Х , член парламента от Пеппеленбоша, Пан Кью (июль 2018 г.). «Несовместимая трансляция приводит к конвергентной эволюции и ослаблению вируса во время разработки живой аттенуированной вакцины» . Передний. Клетка. Заразить. Микробиол . 8 : 249. дои : 10.3389/fcimb.2018.00249 . ПМК 6058041 . ПМИД 30073153 .
- ^ Майзелс, Нэнси; Вайнер, Алан М. (1999). «Гипотеза геномных меток - что молекулярные окаменелости говорят нам об эволюции тРНК» . Мир РНК (2-е изд.). Лабораторный пресс Колд-Спринг-Харбор. CiteSeerX 10.1.1.708.7795 . ISBN 978-0-87969-561-3 . Проверено 16 февраля 2024 г.
- ^ Кюнляйн, Александра; Ланцмих, Саймон А.; Брун, Дитер (2 марта 2021 г.). «Последовательности тРНК могут собираться в репликатор» . электронная жизнь . 10 . doi : 10.7554/eLife.63431 . ПМЦ 7924937 . ПМИД 33648631 .
- ^ Максимилиан, Людвиг (3 апреля 2021 г.). «Решение проблемы курицы и яйца – «на шаг ближе к реконструкции происхождения жизни» » . СайТехДейли . Проверено 3 апреля 2021 г.
- ^ Перейти обратно: а б с Гебетсбергер Дж., Полачек Н. (декабрь 2013 г.). «Нарезка тРНК для увеличения функционального разнообразия нкРНК» . Биология РНК . 10 (12): 1798–1806. дои : 10.4161/rna.27177 . ПМЦ 3917982 . ПМИД 24351723 .
- ^ Перейти обратно: а б Сигемацу М., Хонда С., Кирино Ю. (2014). «Транспортная РНК как источник малых функциональных РНК» . Журнал молекулярной биологии и молекулярной визуализации . 1 (2): 8. ПМК 4572697 . ПМИД 26389128 .
- ^ Перейти обратно: а б Собала А., Хутвагнер Г. (2011). «Фрагменты транспортной РНК: происхождение, процессинг и функции» (PDF) . Междисциплинарные обзоры Wiley: РНК . 2 (6): 853–862. дои : 10.1002/wrna.96 . hdl : 10453/18187 . ПМИД 21976287 . S2CID 206554146 .
- ^ Ким С.П., Хутвагнер Г. (ноябрь 2015 г.). «Фрагменты, полученные из тРНК (tRF): новые роли древней РНК в регуляции экспрессии генов» . Жизнь . 5 (4): 1638–1651. Бибкод : 2015Жизнь....5.1638К . дои : 10.3390/life5041638 . ПМЦ 4695841 . ПМИД 26703738 .
- ^ Перейти обратно: а б с Telonis AG, Loher P, Honda S, Jing Y, Palazzo J, Kirino Y, Rigoutsos I (июль 2015 г.). «Анализ сложностей фрагментов, полученных из тРНК, с использованием персонализированных транскриптомов выявляет новые классы фрагментов и неожиданные зависимости» . Онкотаргет . 6 (28): 24797–822. дои : 10.18632/oncotarget.4695 . ПМЦ 4694795 . ПМИД 26325506 .
- ^ Перейти обратно: а б с д Кумар П., Анайя Дж., Мудунури С.Б., Дутта А. (октябрь 2014 г.). «Метаанализ фрагментов РНК, полученных из тРНК, показывает, что они эволюционно консервативны и связаны с белками AGO для распознавания конкретных мишеней РНК» . БМК Биология . 12:78 . дои : 10.1186/s12915-014-0078-0 . ПМК 4203973 . ПМИД 25270025 .
- ^ Перейти обратно: а б Honda S, Loher P, Shigematsu M, Palazzo JP, Suzuki R, Имото I, Ригуцос I, Кирино Y (июль 2015 г.). «Зависимые от половых гормонов половинки тРНК усиливают пролиферацию клеток при раке молочной железы и простаты» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (29): Е3816–Е3825. Бибкод : 2015PNAS..112E3816H . дои : 10.1073/pnas.1510077112 . ПМЦ 4517238 . ПМИД 26124144 .
- ^ Шорн, Эй Джей; Мартиенссен, Р. (октябрь 2018 г.). «Тай-брейк: хозяин и ретротранспозоны играют в тРНК» . Тенденции в клеточной биологии . 28 (10): 793–806. дои : 10.1016/j.tcb.2018.05.006 . ПМК 6520983 . ПМИД 29934075 .
- ^ Telonis AG, Ригуцос I (март 2018 г.). «Расовые различия во вкладе изоформ микроРНК и фрагментов, полученных из тРНК, в трижды негативный рак молочной железы» . Рак Рез . 78 (5): 1140–54. дои : 10.1158/0008-5472.CAN-17-1947 . ПМЦ 5935570 . ПМИД 29229607 .
- ^ Телонис А.Г., Лохер П., Маги Р., Плиацика В., Лондин Э., Кирино Ю., Ригуцос I (июнь 2019 г.). «Фрагменты тРНК переплетаются с мРНК со специфическим содержанием повторов и связаны с различиями» . Рак Рез . 79 (12): 3034–49. дои : 10.1158/0008-5472.CAN-19-0789 . ПМК 6571059 . ПМИД 30996049 .
- ^ Сигемацу М., Кирино Ю. (2015). «Короткая некодирующая РНК, производная тРНК, как взаимодействующие партнеры белков-аргонавтов» . Регуляция генов и системная биология . 9 : 27–33. дои : 10.4137/GRSB.S29411 . ПМК 4567038 . ПМИД 26401098 .
- ^ Эмара М.М., Иванов П., Хикман Т., Даура Н., Тисдейл С., Кедерша Н., Ху Г.Ф., Андерсон П. (апрель 2010 г.). «Ангиогенин-индуцированные стресс-индуцированные тРНК-РНК способствуют индуцированной стрессом сборке стрессовых гранул» . Журнал биологической химии . 285 (14): 10959–10968. дои : 10.1074/jbc.M109.077560 . ПМЦ 2856301 . ПМИД 20129916 .
- ^ Гударзи Х., Лю Х., Нгуен Х.К., Чжан С., Фиш Л., Тавазои С.Ф. (май 2015 г.). «Эндогенные фрагменты тРНК подавляют прогрессирование рака молочной железы посредством смещения YBX1» . Клетка . 161 (4): 790–802. дои : 10.1016/j.cell.2015.02.053 . ПМЦ 4457382 . ПМИД 25957686 .
- ^ Иванов П., Эмара М.М., Виллен Дж., Гиги С.П., Андерсон П. (август 2011 г.). «Ангиогенин-индуцированные фрагменты тРНК ингибируют инициацию трансляции» . Молекулярная клетка . 43 (4): 613–623. doi : 10.1016/j.molcel.2011.06.022 . ПМК 3160621 . ПМИД 21855800 .
- ^ Селицкий С.Р., Баран-Гейл Дж., Хонда М., Ямане Д., Масаки Т., Фаннин Э.Э., Герра Б., Ширасаки Т., Шимаками Т., Канеко С., Лэнфорд Р.Э., Лемон С.М., Сетупати П. (январь 2015 г.). «При хроническом гепатите В и С количество малых РНК, происходящих из тРНК, увеличивается и их больше, чем микроРНК» . Научные отчеты . 5 : 7675. Бибкод : 2015NatSR...5E7675S . дои : 10.1038/srep07675 . ПМЦ 4286764 . ПМИД 25567797 .
- ^ Шарма Ю, Конин CC, Ши Дж.М., Боскович А., Дерр А.Г., Бинг XY, Беллинни С., Кукукурал А., Серра Р.В., Сан Ф., Сонг Л., Кароне Б.Р., Риччи Э.П., Ли XZ, Фокье Л., Мур М.Дж., Салливан Р. , Мелло СиСи, Гарбер М, Рэндо О.Дж. (январь 2016 г.). «Биогенез и функция фрагментов тРНК при созревании и оплодотворении сперматозоидов у млекопитающих» . Наука 351 (6271): 391–396. Бибкод : 2016Sci...351..391S . doi : 10.1126/science.aad6780 . ПМЦ 4888079 . ПМИД 26721685 .
- ^ Касас Э., Кай Дж., Нил Дж.Д. (2015). «Характеристика циркулирующих фрагментов РНК, полученных из транспортной РНК, у крупного рогатого скота» . Границы генетики . 6 : 271. дои : 10.3389/fgene.2015.00271 . ПМЦ 4547532 . ПМИД 26379699 .
- ^ Хиросе Ю., Икеда К.Т., Норо Э., Хираока К., Томита М., Канаи А. (июль 2015 г.). «Точное картирование и динамика фрагментов тРНК (tRF) в развитии Triops cancriformis (креветки-головастики)» . БМК Генетика . 16:83 . дои : 10.1186/s12863-015-0245-5 . ПМК 4501094 . ПМИД 26168920 .
- ^ Караиско С., Накви А.С., Суонсон К.Е., Григорьев А. (сентябрь 2015 г.). «Возрастная модуляция фрагментов тРНК у дрозофилы и их потенциальных мишеней» . Биология Директ . 10:51 . дои : 10.1186/s13062-015-0081-6 . ПМЦ 4572633 . ПМИД 26374501 .
- ^ Плиацика В., Лохер П., Телонис АГ, Ригуцос I (август 2016 г.). «MINTbase: основа для интерактивного исследования фрагментов митохондриальной и ядерной тРНК» . Биоинформатика . 32 (16): 2481–2489. doi : 10.1093/биоинформатика/btw194 . ПМЦ 4978933 . ПМИД 27153631 .
- ^ Плиацика В., Лохер П., Маги Р., Телонис А.Г., Лондин Э., Сигемацу М., Кирино Ю., Ригуцос I (январь 2018 г.). «MINTbase v2.0: комплексная база данных фрагментов, полученных из тРНК, которая включает ядерные и митохондриальные фрагменты из всех проектов Атласа генома рака» . Исследования нуклеиновых кислот . 46(Д1) (Д1): Д152–Д159. дои : 10.1093/nar/gkx1075 . ПМЦ 5753276 . ПМИД 29186503 .
- ^ Кумар П., Мудунури С.Б., Анайя Дж., Дутта А. (январь 2015 г.). «tRFdb: база данных фрагментов транспортной РНК» . Исследования нуклеиновых кислот . 43 (Проблема с базой данных): D141-5. дои : 10.1093/nar/gku1138 . ПМЦ 4383946 . ПМИД 25392422 .
- ^ Варшней, У; РаджБхандари, UL (февраль 1990 г.). «Инициация синтеза белка с терминирующего кодона» . Труды Национальной академии наук . 87 (4): 1586–1590. Бибкод : 1990PNAS...87.1586V . дои : 10.1073/pnas.87.4.1586 . ПМК 53520 . ПМИД 2406724 .
- ^ Варшней, У; Ли, КП; РаджБхандари, UL (15 марта 1993 г.). «От элонгаторной тРНК к инициаторной тРНК» . Труды Национальной академии наук . 90 (6): 2305–2309. Бибкод : 1993PNAS...90.2305V . дои : 10.1073/pnas.90.6.2305 . ПМК 46075 . ПМИД 8460138 .
- ^ Говиндан А., Мирьяла С., Мондал С., Варшни У. (ноябрь 2018 г.). «Разработка аналитических систем для декодирования янтарных кодонов на стадиях инициации и элонгации микобактерий» . Журнал бактериологии . 200 (22). дои : 10.1128/jb.00372-18 . ПМК 6199473 . ПМИД 30181124 .
- ^ Винсент Р.М., Райт Б.В., Яшке П.Р. (апрель 2019 г.). «Измерение ортогональности тРНК янтарного инициатора в геномно перекодированном организме». ACS Синтетическая биология . 8 (4): 675–685. дои : 10.1021/acsynbio.9b00021 . ПМИД 30856316 . S2CID 75136654 .
- ^ Белый Р.Дж. (март 1997 г.). «Регуляция РНК-полимераз I и III белком ретинобластомы: механизм контроля роста?». Тенденции биохимических наук . 22 (3): 77–80. дои : 10.1016/S0968-0004(96)10067-0 . ПМИД 9066256 .
- ^ Шарп С., Дингерманн Т., Зёлль Д. (сентябрь 1982 г.). «Минимальные внутригенные последовательности, необходимые для стимулирования транскрипции гена тРНК эукариот» . Исследования нуклеиновых кислот . 10 (18): 5393–5406. дои : 10.1093/нар/10.18.5393 . ПМК 320884 . ПМИД 6924209 .
- ^ Перейти обратно: а б Диечи Г., Фиорино Г., Кастельнуово М., Тейхманн М., Пагано А. (декабрь 2007 г.). «Расширяющийся транскриптом РНК-полимеразы III». Тенденции в генетике . 23 (12): 614–622. дои : 10.1016/j.tig.2007.09.001 . hdl : 11381/1706964 . ПМИД 17977614 .
- ^ Токкини-Валентини Г.Д., Фрусколони П., Токкини-Валентини Г.П. (декабрь 2009 г.). «Процессинг претРНК, содержащей несколько интронов» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (48): 20246–20251. Бибкод : 2009PNAS..10620246T . дои : 10.1073/pnas.0911658106 . ПМК 2787110 . ПМИД 19910528 .
- ^ Абельсон Дж., Тротта Ч.Р., Ли Х. (май 1998 г.). «сплайсинг тРНК» . Журнал биологической химии . 273 (21): 12685–12688. дои : 10.1074/jbc.273.21.12685 . ПМИД 9582290 .
- ^ Перейти обратно: а б Сома А (2014). «Циркулярно перестановленные гены тРНК: их экспрессия и значение для их физиологической значимости и развития» . Границы генетики . 5 : 63. дои : 10.3389/fgene.2014.00063 . ПМЦ 3978253 . ПМИД 24744771 .
- ^ Фрэнк Д.Н., Пейс Н.Р. (1998). «Рибонуклеаза P: единство и разнообразие рибозима, процессирующего тРНК» . Ежегодный обзор биохимии . 67 (1): 153–180. doi : 10.1146/annurev.biochem.67.1.153 . ПМИД 9759486 .
- ^ Себальос М., Виоке А. (2007). «тРНКаза Z». Буквы о белках и пептидах . 14 (2): 137–145. дои : 10.2174/092986607779816050 . PMID 17305600 .
- ^ Рандау Л., Шредер И., Зёлль Д. (май 2008 г.). «Жизнь без РНКазы Р». Природа . 453 (7191): 120–123. Бибкод : 2008Natur.453..120R . дои : 10.1038/nature06833 . ПМИД 18451863 . S2CID 3103527 .
- ^ Вайнер А.М. (октябрь 2004 г.). «Созревание тРНК: полимеризация РНК без матрицы нуклеиновой кислоты» . Современная биология . 14 (20): Р883-5. Бибкод : 2004CBio...14.R883W . дои : 10.1016/j.cub.2004.09.069 . ПМИД 15498478 .
- ^ Кутай У., Липовски Г., Изаурральде Е., Бишофф Ф.Р., Шварцмайер П., Хартманн Е., Герлих Д. (февраль 1998 г.). «Идентификация рецептора ядерного экспорта, специфичного для тРНК» . Молекулярная клетка . 1 (3): 359–369. дои : 10.1016/S1097-2765(00)80036-2 . ПМИД 9660920 .
- ^ Артс Г.Дж., Форнерод М., Маттай И.В. (март 1998 г.). «Идентификация рецептора ядерного экспорта тРНК» . Современная биология . 8 (6): 305–314. Бибкод : 1998CBio....8..305A . дои : 10.1016/S0960-9822(98)70130-7 . ПМИД 9512417 . S2CID 17803674 .
- ^ Артс Г.Дж., Куерстен С., Ромби П., Эресманн Б., Маттай И.В. (декабрь 1998 г.). «Роль экспортина-т в избирательном ядерном экспорте зрелых тРНК» . Журнал ЭМБО . 17 (24): 7430–7441. дои : 10.1093/emboj/17.24.7430 . ПМК 1171087 . ПМИД 9857198 .
- ^ Ёсихиса Т., Юноки-Эсаки К., Осима С., Танака Н., Эндо Т. (август 2003 г.). «Возможность сплайсинга цитоплазматической пре-тРНК: эндонуклеаза сплайсинга тРНК дрожжей преимущественно локализуется в митохондриях» . Молекулярная биология клетки . 14 (8): 3266–3279. дои : 10.1091/mbc.E02-11-0757 . ПМК 181566 . ПМИД 12925762 .
- ^ Замечник, Пол Чарльз. «Влияние повышения концентрации АТФ на включение С14-АТФ в РНК фракции pH 5» . Collections.countway.harvard.edu . Проверено 28 февраля 2024 г.
- ^ Кресдж, Николь; Симони, Роберт Д.; Хилл, Роберт Л. (7 октября 2005 г.). «Открытие тРНК Полом К. Замечником» . Журнал биологической химии . 280 (40): е37–е39. doi : 10.1016/S0021-9258(20)79029-0 – через www.jbc.org.
- ^ Хоугланд, Махлон Б. (1959). «Нуклеиновые кислоты и белки» . Научный американец . 201 (6): 55–61. ISSN 0036-8733 .
- ^ Кларк Б.Ф. (октябрь 2006 г.). «Кристаллическая структура тРНК» (PDF) . Журнал биологических наук . 31 (4): 453–457. дои : 10.1007/BF02705184 . ПМИД 17206065 . S2CID 19558731 .
- ^ Холли Р.В., Апгар Дж., Эверетт Г.А., Мэдисон Дж.Т., Маркизи М., Меррилл Ш.Х., Пенсвик Дж.Р., Замир А. (март 1965 г.). «Структура рибонуклеиновой кислоты». Наука . 147 (3664): 1462–1465. Бибкод : 1965Sci...147.1462H . дои : 10.1126/science.147.3664.1462 . ПМИД 14263761 . S2CID 40989800 .
- ^ «Некролог» . Нью-Йорк Таймс . 4 июля 1991 года.
- ^ «Нобелевская премия по физиологии и медицине 1968 года: Роберт В. Холли – факты» . Нобелевская премия по связям с общественностью AB. 2022 . Проверено 18 марта 2022 г.
- ^ Ладнер Дж. Э., Джек А., Робертус Дж. Д., Браун Р. С., Роудс Д., Кларк Б. Ф., Клуг А. (ноябрь 1975 г.). «Структура дрожжевой РНК-переносчика фенилаланина с разрешением 2,5 А» . Труды Национальной академии наук Соединенных Штатов Америки . 72 (11): 4414–4418. Бибкод : 1975PNAS...72.4414L . дои : 10.1073/pnas.72.11.4414 . ПМЦ 388732 . ПМИД 1105583 .
- ^ Ким Ш., Куигли Г.Дж., Суддат Ф.Л., Макферсон А., Снеден Д., Ким Дж.Дж., Вайнцирл Дж., Рич А. (январь 1973 г.). «Трехмерная структура дрожжевой РНК-переносчика фенилаланина: сворачивание полинуклеотидной цепи». Наука . 179 (4070): 285–288. Бибкод : 1973Sci...179..285K . дои : 10.1126/science.179.4070.285 . ПМИД 4566654 . S2CID 28916938 .
- ^ Чжан Р., Ноордам Л., Оу Икс, Ма Б., Ли Ю, Дас П., Ши С., Лю Дж., Ван Л., Ли П., Верстеген М.М., Редди Д.С., ван дер Лаан Л.Дж., Пеппеленбош М.П., Квеккебум Дж., Смитс Р., Пан Кью (январь 2021 г.). «Биологический процесс зарядки лизина-тРНК является терапевтически целенаправленным при раке печени» . Печень Межд . 41 (1): 206–219. дои : 10.1111/liv.14692 . ПМК 7820958 . ПМИД 33084231 .
- ^ Оу X, Ма Б, Чжан Р, Мяо З, Ченг А, Пеппеленбош, член парламента, Пан Ц (июнь 2020 г.). «Упрощенный метод qPCR, выявляющий ремоделирование тРНКома при заражении вирусом гепатита Е генотипа 3» . Письма ФЭБС . 594 (12): 2005–2015. дои : 10.1002/1873-3468.13764 . hdl : 1765/126038 . ПМИД 32133647 .
Внешние ссылки
[ редактировать ]- tRNAdb (обновленная и полностью переработанная версия компиляции тРНК Spritzls)
- Удивительная роль тРНК в развитии рака молочной железы
- Связь тРНК с болезнями сердца и инсультом
- GtRNAdb: коллекция тРНК, идентифицированных из полных геномов.
- HGNC: Генная номенклатура тРНК человека
- Молекула месяца © RCSB Protein Data Bank :
- Запись Rfam для тРНК