Аспарагин-пептид-лиаза
Аспарагин-пептидлиаза — одна из семи групп, в которых протеазы , также называемые протеолитическими ферментами, пептидазами или протеиназами, классифицируются в соответствии с их каталитическим остатком. Каталитический механизм аспарагин-пептидлиаз включает в себя остаток аспарагина, действующий как нуклеофил, выполняющий реакцию нуклеофильного элиминирования, а не гидролиз , катализирующий разрыв пептидной связи . [ 1 ]
Существование этого седьмого каталитического типа протеаз, у которых расщепление пептидной связи происходит путем самопроцессинга, а не гидролиза, было продемонстрировано с открытием кристаллической структуры саморасщепляющегося предшественника автотранспортера Tsh из E. coli . [ 2 ]
Синтез
[ редактировать ]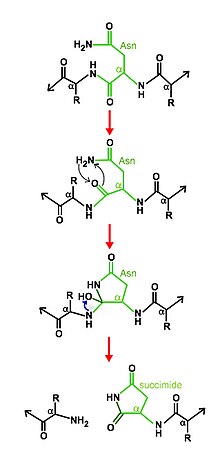
Эти ферменты синтезируются в виде предшественников или пропептидов, которые расщепляются в результате аутопротеолитической реакции. [ 2 ]
Саморасщепляющаяся природа аспарагинпептидлиаз противоречит общему определению фермента, учитывая, что ферментативная активность разрушает фермент. Однако самопроцессинг представляет собой действие протеолитического фермента, несмотря на то, что фермент не подлежит восстановлению в результате реакции. [ 1 ]
Активный центр и каталитический механизм
[ редактировать ]Вся протеолитическая активность аспарагиновых пептидлиаз заключается только в саморасщеплении, после чего дальнейшая пептидазная активность не возникает. [ 3 ]
Основным остатком активного центра является аспарагин, но есть и другие остатки, участвующие в каталитическом механизме , которые различаются в разных семействах аспарагиновых пептидлиаз. [ 2 ] [ 4 ] [ 5 ]
Механизм расщепления заключается в циклизации аспарагина при помощи других остатков активного центра. В определенных условиях циклическая структура аспарагина нуклеофильно атакует свою С-концевую пептидную связь с основной цепью, образуя новую связь с образованием стабильного сукцинимида , отщепляющегося от основной цепи и, следовательно, высвобождающего две половины продукта. [ 6 ] [ 7 ]
Торможение
[ редактировать ]неизвестны Ингибиторы . [ 3 ]
Классификация
[ редактировать ]База данных протеаз MEROPS включает следующие десять семейств аспарагиновых пептид-лиаз, которые входят в 6 различных кланов протеаз. [ 3 ]
Протеолитические ферменты подразделяются на семейства на основе сходства последовательностей. Каждое семейство включает протеолитические ферменты с гомологичными последовательностями и общим каталитическим типом. Кланы представляют собой группы семейств протеолитических ферментов со родственной структурой, в которых каталитический тип не консервативен.
| Клан | Семья | МЕРОПС ID | Пептидазы и гомологи | НК- ИУБМБ | PDB идентификатор |
|---|---|---|---|---|---|
| ЧТО | N1 | Н01.001 | белок оболочки нодавируса | 3.4.23.44 | 2ББВ |
| неназначенный | неназначенные пептидлиазы семейства N1 | * | - | ||
| Н2 | №02.001 | белок оболочки тетравируса | * | 1OHF | |
| непептидазный гомолог | нелиазные гомологи семейства N2 | * | - | ||
| неназначенный | неназначенные пептидлиазы семейства N2 | * | - | ||
| N8 | N08.001 | Капсид пикорнавируса Саморасщепляющийся белок типа VP0 | * | 1NCQ | |
| непептидазный гомолог | нелиазные гомологи семейства N8 | * | - | ||
| неназначенный | неназначенные пептидлиазы семейства N8 | * | - | ||
| Примечание: | N6 | N06.001 | Белок YscU ( Yersinia pseudotuberculosis ) | * | 2JLJ |
| N06.002 | Белок SpaS ( Salmonella sp.) | * | 3C01 ; 2ВТ1 | ||
| N06.003 | Белок EscU ( Escherichia coli ) | * | 3БЗО | ||
| N06.004 | Белок HrcU ( Xanthomonas sp.) | * | - | ||
| N06.A01 | Белок FlhB ( Escherichia coli ) | * | - | ||
| непептидазный гомолог | нелиазные гомологи семейства N6 | * | - | ||
| неназначенный | неназначенные пептидлиазы семейства N6 | * | - | ||
| Северная Каролина | N7 | N07.001 | белок оболочки реовируса типа 1 | * | 1JMU |
| N07.002 | белок оболочки аквареовируса | * | - | ||
| неназначенный | неназначенные пептидлиазы семейства N7 | * | - | ||
| без даты | N4 | N04.001 | Tsh-ассоциированный саморасщепляющийся домен ( Escherichia coli ) и подобные | * | 3АЕХ |
| Н04.002 | Домен автотранспортера гамма-белка EspP ( Escherichi тип ) | * | 2 КОМ | ||
| непептидазный гомолог | нелиазные гомологи семейства N4 | * | - | ||
| неназначенный | неназначенные пептидлиазы семейства N4 | * | - | ||
| NE | N5 | N05.001 | саморасщепляющийся белок пикобирнавируса | * | 2ВФ1 |
| неназначенный | неназначенные пептидлиазы семейства N5 | * | - | ||
| ПД | N9 | N09.001 | интеинсодержащая протонная каталитическая субъединица А АТФазы V-типа | 3.6.3.14 | 1ВДЕ |
| непептидазный гомолог | нелиазные гомологи семейства N9 | * | - | ||
| неназначенный | неназначенные пептидлиазы семейства N9 | * | - | ||
| №10 | Н10.001 | интеинсодержащая субъединица А ДНК-гиразы | * | - | |
| Н10.002 | интеинсодержащий предшественник репликативной ДНК-хеликазы | * | 1МИ8 | ||
| Н10.003 | интеин-содержащая ДНК-полимераза III субъединица альфа-предшественник | 2.7.7.7 | 2КЭК | ||
| Н10.004 | интеинсодержащий предшественник фактора инициации трансляции IF-2 | - | |||
| Н10.005 | интеинсодержащая ДНК-полимераза II, предшественник большой субъединицы DP2 Mername-AA281 | * | - | ||
| Н10.006 | интеинсодержащая ДНК-полимераза II, предшественник большой субъединицы DP2 Mername-AA282 | 2.7.7.7 | - | ||
| Н10.007 | интеинсодержащий ДНК-зависимый предшественник ДНК-полимеразы | * | 2CW7 ; 2CW8 | ||
| Н10.008 | интеинсодержащая субъединица А ДНК-гиразы ( Mycobacterium xenopi ) | * | 1:002 ; 4ОЗ6 | ||
| Н10.009 | Интеин Mtu RecA ( Mycobacterium sp.) | * | 2IN9 | ||
| непептидазный гомолог | нелиазные гомологи семейства N10 | * | - | ||
| неназначенный | неназначенные пептидлиазы семейства N10 | * | - | ||
| N11 | Н11.001 | интеинсодержащая АТФ-зависимая пептид-лиаза хлоропластов | * | - | |
| непептидазный гомолог | нелиазные гомологи семейства N11 | * | - | ||
| неназначенный | неназначенные пептидлиазы семейства N11 | * | - |
*Пока не включен в IUBMB рекомендации .
Распространение и виды
[ редактировать ]Десять различных семейств аспарагиновых пептид-лиаз делятся на три разных типа:
- Белки вирусной оболочки
- Белки-автотранспортеры
- Интеинсодержащие белки
Существует пять семейств белков оболочки вируса (N1, N2, N8, N7 и N5), два семейства белков-автотранспортеров (N6 и N4) и три семейства интеинсодержащих белков (N9, N10 и N11).
Белки вирусной оболочки
[ редактировать ]Существует пять семейств белков оболочки вируса , в которых процессинг происходит по остатку аспарагина. Эти пять семейств входят в три клана: клан NA (семейства N1, N2 и N8), клан NC (семейство N7) и клан NE (семейство N5). [ 8 ]
Семейство N1: известное аутолитическое расщепление опосредуется эндопептидазой нодавируса с С-конца белка оболочки и происходит только внутри собранного вириона . [ 9 ]
Семейство N2: включает эндопептидазы тетравирусов. Известное аутолитическое расщепление происходит с С-конца белка оболочки. Расщепление происходит на поздних стадиях сборки вириона. [ 10 ]
Семейство N8: Известно аутолитическое расщепление вирусного капсидного белка полиовируса VP0 на VP2 и Vp4 в провирионе. [ 11 ]
Семейство N7: известное автолитическое расщепление происходит с N-конца белка оболочки. [ 12 ]
Семейство N5: известное автолитическое расщепление происходит с N-конца белка оболочки. [ 13 ]
Белки-автотранспортеры
[ редактировать ]
Белки-аутотранспортеры представляют собой белки внешней мембраны или секретируемые белки, обнаруженные у широкого спектра грамотрицательных бактерий . Эти белки содержат три структурных мотива: сигнальную последовательность, домен-пассажир, расположенный на N-конце, и домен транслокатора или аутотранспортера, расположенный на C-конце, образуя структуру бета-цилиндра . Эти структуры способствуют самотранспорту белка. Белки-аутотранспортеры обычно связаны с функциями вирулентности. Этот факт, их взаимодействие с клетками-хозяевами и широкое распространение генов, кодирующих аутотранспортеры, открывают возможность представлять собой терапевтические мишени для разработки вакцин против грамотрицательных патогенов. [ 14 ]
Два семейства, к которым база данных MEROPS классифицирует аспарагиновые пептидлиазы, представляют собой белки-автотранспортеры: семейства N4 и N6. [ 3 ]
Семейство N4 включает секретируемые факторы вирулентности или аутотранспортеры энтеробактерий. Их единственная протеолитическая активность — высвобождение фактора вирулентности из предшественника, что позволяет ему секретироваться. Остатки активного центра в аспарагиновых пептидлиазах семейства N4 представляют собой N1100, Y1227, E1249 и R1282.
Семейство N6 включает аутопроцессирующие эндопептидазы, участвующие в системе секреции белков типа III, в которой аутопротеолиз необходим для обеспечения секреции белков. Система секреции типа III секретирует белки непосредственно в клетки-хозяева с помощью инъекций — полой трубчатой структуры, которая проникает в клетку-хозяина. Секретируемые белки могут проходить через инъекцию в цитоплазму клетки-хозяина. Консервативным остатком активного центра в аспарагинпептидлиазах семейства N6 является N263.
Интеинсодержащие белки
[ редактировать ]Интеин — это белок, содержащийся в другом белке — экстеине . ДНК паразита инфицирует ген интеина, который кодирует эндонуклеазу . Полученная кДНК (комплементарная ДНК) кодирует экстеин вместе с интеином. Интеин содержит саморасщепляющийся домен, в который вложена эндонуклеаза. Домен интеина осуществляет два протеолитических расщепления на своем N-конце и С-конце и высвобождается из экстеина, разделяя его на два фрагмента. Затем эти два фрагмента соединяются вместе, и экстеин остается полностью функциональным белком.
N-концевой остаток интеинового домена должен представлять собой серин , треонин или цистеин , и он атакует предыдущую пептидную связь с образованием сложного или тиоэфира. Первый остаток второй части экстеина также должен представлять собой серин, треонин или цистеин, и этот второй нуклеофил образует разветвленный посредник. С-концевой остаток интеинового домена всегда представляет собой аспарагин, который циклизуется с образованием сукцинимида, расщепляя собственную пептидную связь и высвобождая интеин из экстеина. Наконец, в экстеине сложноэфирная или тиоэфирная связь перестраивается с образованием нормальной пептидной связи. [ 15 ]
Известны три семейства интеинсодержащих белков (N9, N10 и N11), все они входят в клан PD, содержащий протеолитические ферменты разных каталитических типов. Решена третичная структура каталитической субъединицы протон-АТФазы интеина V типа ( Saccharomyces cerevisiae ), члена семейства N9, а также нескольких интеинов из семейства N10.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Роулингс, Северная Дакота; Барретт, Эй Джей; Бейтман, А. (4 ноября 2011 г.). «Аспарагиновые пептид-лиазы: седьмой каталитический тип протеолитических ферментов» . Журнал биологической химии . 286 (44): 38321–8. дои : 10.1074/jbc.M111.260026 . ПМК 3207474 . ПМИД 21832066 .
- ^ Jump up to: а б с Тадзима, Н.; Каваи, Ф.; Парк, Ю.Ю.; Тейм, младший (2010). «Новый интеиноподобный аутопротеолитический механизм в белках-аутотранспортерах». Журнал молекулярной биологии . 402 (4): 645–56. дои : 10.1016/j.jmb.2010.06.068 . ПМИД 20615416 .
- ^ Jump up to: а б с д Роулингс, Нил Д.; Барретт, Алан Дж.; Финн, Роберт (2016). «Двадцать лет базы данных MEROPS протеолитических ферментов, их субстратов и ингибиторов» . Исследования нуклеиновых кислот . 44 (Д1): Д343–Д350. дои : 10.1093/nar/gkv1118 . ПМК 4702814 . ПМИД 26527717 .
- ^ Даутин Н., Барнард Т.Дж., Андерсон Д.Э. и Бернштейн HD (2007) EMBO J. 26, 1942–1952
- ^ Дж. Марч, Продвинутая органическая химия, 4-е изд., Уайли, Нью-Йорк, 1992 г.
- ^ Дехарт, член парламента, и Андерсон, BD (2007) J. Pharm. наук. 96, 2667-2685 гг.
- ^ Р. А. Росси, Р. Х. де Росси, Ароматическое замещение по механизму SRN1, Серия монографий ACS № 178, Американское химическое общество, 1983.
- ^ Роулингс, Нил Д.; Салвесен, Гай С. (2012). Справочник по протеолитическим ферментам, 3-е издание . Академическое издательство [Выходные данные]. ISBN 9780123822192 .
- ^ Редди, А., Шнееманн, А. и Джонсон, Дж.Э. Эндопептидаза нодавируса. В Справочнике по протеолитическим ферментам, 2-е изд. (Барретт, А.Дж., Роулингс, Н.Д. и Весснер, ред. Дж.Ф.), стр.197-201, Elsevier, Лондон (2004).
- ^ Тейлор, DJ и Джонсон, JE Складывание и сборка частиц нарушаются одноточечными мутациями вблизи сайта автокаталитического расщепления капсидного белка омега-вируса Nudaurelia capensis. Белковая наука (2005) 14, 401-408.
- ^ «МЕРОПС — база данных пептидаз» . merops.sanger.ac.uk . Проверено 22 октября 2016 г.
- ^ «МЕРОПС — база данных пептидаз» . merops.sanger.ac.uk . Проверено 22 октября 2016 г.
- ^ «МЕРОПС — база данных пептидаз» . merops.sanger.ac.uk . Проверено 22 октября 2016 г.
- ^ Уэллс Т.Дж., Три Дж.Дж., Улетт Г.К., Шембри М.А.. Белки-автотранспортеры: новые мишени на поверхности бактериальных клеток. (2007) 274(2), 163-72
- ^ Алан Дж. Барретт, Нил Д. Роулингс, Дж. Фред Весснер. Справочник по протеолитическим ферментам. Третье издание. (2013) (стр. 14-16)
Дальнейшее чтение
[ редактировать ]- Роулингс Н.Д., Барретт А.Дж., Бейтман А. Аспарагиновые пептидлиазы: седьмой каталитический тип протеолитических ферментов . 4 ноября 2011 г.;286(44):38321-8.
- Алан Дж. Барретт, Нил Д. Роулингс, Дж. Фред (2012). Справочник по протеолитическим ферментам . Третье издание. ISBN 9780123822208
- Гояо Ву (2013) Аминокислоты: биохимия и питание . ISBN 9781439861899
- Клаудия Брикс, Вальтер Штекер (21 января 2014 г.). Протеазы: структура и функции . ISBN 9783709108857
- Цзинь Чжан, Сохум Мехта, Карстен Шульц (2016). Оптические зонды в биологии . ISBN 9781466510128
Внешние ссылки
[ редактировать ]- Международное общество протеолиза
- Графический интерфейс сайтов разреза протеазы
- Merops - база данных пептидаз. Архивировано 14 ноября 2006 г. в Wayback Machine.
- Карта протеолиза
- База данных протеаз TopFIND, охватывающая сайты разрезов, субстраты и концы белков.
- Список протеаз и их особенностей (см. также [1] ). Архивировано 30 апреля 2011 г. на Wayback Machine .
- Протеазы Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)