ПТПРК
| ПТПРК | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ПТПРК , R-PTP-каппа, протеинтирозинфосфатаза, рецептор типа К, рецептор протеинтирозинфосфатазы типа К | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 602545 ; МГИ : 103310 ; Гомологен : 55693 ; GeneCards : ПТПРК ; ОМА : ПТПРК - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Тирозин-протеинфосфатаза каппа рецепторного типа представляет собой фермент , который у человека кодируется PTPRK геном . [ 5 ] [ 6 ] [ 7 ] ПТПРК также известен как ПТПкаппа и ПТПκ.
Функция
[ редактировать ]Белок, кодируемый этим геном, является членом семейства протеинтирозинфосфатаз (PTP). Белковые тирозинфосфатазы — это белковые ферменты, которые удаляют фосфатные фрагменты из тирозина остатков в других белках. Тирозинкиназы — это ферменты, которые добавляют фосфаты к остаткам тирозина и являются ферментами, противоположными PTP. Известно, что PTP являются сигнальными молекулами, которые регулируют различные клеточные процессы, включая рост клеток, дифференцировку, митотический цикл и онкогенную трансформацию.
Ген PTPRK человека расположен на длинном плече хромосомы 6, предполагаемой области генома, которая является супрессором опухоли . [ 8 ]
Во время разработки
[ редактировать ]Та же репортерная конструкция, которую использовали Шен и его коллеги и описанная выше, была создана Skarnes et al. во время скрининга для выявления генов, важных для развития мышей. [ 9 ] Трансгенная мышь была создана путем объединения репортерного гена β-галактозидазы (β-гал) с сигнальной последовательностью и трансмембранным доменом трансмембранного белка CD4 типа I. Если бы трансген был включен в ген с сигнальной последовательностью, активность β-гал оставалась бы в цитозоле клетки и, следовательно, была бы активной. Если бы репортерный ген был включен в ген, у которого отсутствовала сигнальная последовательность, активность β-гал находилась бы в ЭР, где она теряла бы активность β-гал. Эта конструкция встроена в фосфатазный домен PTPkappa. [ 10 ] Мыши, полученные из этих ES-клеток, были жизнеспособными, что позволяет предположить, что активность PTPkappa-фосфатазы не является необходимой для эмбрионального развития. [ 9 ] [ 10 ]
Дополнительные исследования показали, какую роль PTPkappa играет в развитии нервной системы. PTPkappa способствует росту нейритов из эмбриональных нейронов мозжечка и, таким образом, может участвовать в расширении аксонов или наведении in vivo. [ 11 ] Невриты представляют собой отростки нейронов, которые можно считать эквивалентом аксонов и дендритов in vitro. Было показано, что для расширения нейритов мозжечка на очищенных слитых белках PTPkappa необходима активность Grb2 и MEK1. [ 11 ]
В Т-клетках
[ редактировать ]Также было показано, что PTPkappa регулирует развитие CD4+-положительных Т-клеток. [ 12 ] PTPkappa и ген THEMIS удалены у крыс линии Long-Evans Cinnamon (LEC) и оба необходимы для дефицита CD4+ Т-клеток, наблюдаемого у этой линии крыс. [ 12 ] [ 13 ] Было показано, что делеция PTPkappa вызывает иммунодефицит Т-хелперов у штамма LEC. [ 14 ]
Путем экспрессии доминантно-негативной формы PTPkappa или использования короткой шпилечной РНК для PTPkappa в стволовых клетках, полученных из костного мозга, ингибируется развитие CD4(+) Т-клеток. [ 15 ] PTPkappa, вероятно, регулирует развитие Т-клеток, положительно регулируя фосфорилирование ERK1/2 посредством регуляции фосфорилирования MEK1/2 и c-Raf. [ 15 ]
Передача сигналов кадгерин-катенин
[ редактировать ]PTPkappa локализуется в местах межклеточного контакта, где ко-локализуется и коиммунопреципитирует с β-катенином и плакоглобином/γ-катенином. [ 6 ] β-катенин может быть субстратом PTPkappa. [ 6 ] [ 16 ] Присутствие полноразмерной PTPkappa в клетках меланомы снижает уровень свободного цитозольного β-катенина, что, как следствие, снижает уровень ядерного β-катенина и снижает экспрессию генов, регулируемых β-катенином, циклина D1 и c-myc. . [ 17 ] Экспрессия полноразмерной PTPkappa в клетках меланомы, которые обычно не экспрессируют ее, приводит к снижению миграции клеток и пролиферации клеток. Поскольку было показано, что присутствие PTPkappa на клеточной мембране связывает β-катенин с плазматической мембраной, эти данные позволяют предположить, что одним из механизмов, посредством которого PTPkappa действует как супрессор опухоли, является регулирование внутриклеточной локализации свободного β-катенина. [ 17 ]
Внутриклеточные фрагменты PTPkappa, PΔE и PIC, каталитически активны и могут также дефосфорилировать β-катенин. [ 16 ] Фосфорилированный тирозином β-катенин перемещается в ядро клетки и активирует TCF-опосредованную транскрипцию, способствуя пролиферации и миграции клеток. В то время как полноразмерная PTPkappa противодействует TCF-опосредованной транскрипции, фрагмент PIC усиливает ее, возможно, регулируя другие белки в TCF-опосредованной транскрипции. [ 16 ] Это позволяет предположить, что фосфатазная активность фрагмента PIC противоположна активности полноразмерной PTPkappa. [ 16 ]
PTPkappa взаимодействует посредством коиммунопреципитации с E-кадгерином, α-катенином и β-катенином в ацинарных клетках поджелудочной железы до растворения слипчивых соединений на крысиной модели панкреатита. [ 18 ] Авторы предполагают, что присутствие PTPkappa на плазматической мембране в ассоциации с комплексом кадгерин/катенин важно для поддержания адгезионного соединения в ацинарных клетках поджелудочной железы, так же, как это было предложено выше в клетках меланомы. [ 18 ]
Передача сигналов EGFR
[ редактировать ]Использование короткой интерферирующей РНК (миРНК) PTPkappa для снижения экспрессии белка PTPkappa в линии эпителиальных клеток молочной железы, MCF10A, приводило к усилению пролиферации клеток. [ 19 ] Напротив, было продемонстрировано, что экспрессия PTPkappa снижает пролиферацию клеток в клетках яичника китайского хомячка. [ 20 ] Механизм, предложенный для объяснения влияния PTPkappa на пролиферацию клеток, заключается в дефосфорилировании PTPkappa EGFR непосредственно на тирозинах 1068 и 1173. Снижение экспрессии PTPkappa в клетках CHO с помощью siRNA PTPkappa увеличивало фосфорилирование EGFR. [ 20 ] Таким образом, гипотеза состоит в том, что PTPkappa действует как ген-супрессор опухоли путем дефосфорилирования и инактивации EGFR. [ 20 ]
Кроме того, было показано, что гликозилирование N-ацетилглюкозаминилтрансферазой-V (GnT-V) снижает экспрессию полноразмерной PTPkappa, вероятно, за счет увеличения ее расщепления. [ 21 ] Было показано, что это аберрантное гликозилирование увеличивает фосфорилирование EGFR по тирозину 1068, вероятно, из-за снижения связанной с плазматической мембраной экспрессии PTPkappa и, следовательно, снижения PTPkappa-опосредованного дефосфорилирования его мембраносвязанных субстратов, таких как EGFR. [ 22 ]
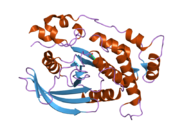
Структура
[ редактировать ]PTPkappa обладает внеклеточной областью, одной трансмембранной областью и двумя тандемными каталитическими доменами и, таким образом, представляет собой PTP рецепторного типа (RPTP). Внеклеточная область содержит домен антигена меприна-А5-PTP mu (MAM), Ig-подобный домен и четыре повтора, подобных фибронектину типа III. [ 23 ] PTPkappa является членом подсемейства R2B RPTP, которое включает RPTPM , RPTPT и RPTPU . PTPkappa имеет наибольшее сходство последовательностей с PTPmu и PTPrho.
Анализ кристаллической структуры первого фосфатазного домена PTPkappa показывает, что он имеет много общих конформационных особенностей с PTPmu, включая беспрепятственную открытую конформацию каталитически важной петли WPD и петлю связывания фосфата для цистеина активного центра (Cys1083). PTPkappa существует в виде мономера в растворе с оговоркой, что в зависимости от природы используемого буфера наблюдаются димеры PTPkappa. [ 24 ]
Альтернативный сплайсинг
[ редактировать ]Альтернативный сплайсинг экзонов 16, 17а и 20а описан для ПТПРК. [ 25 ] Две новые формы PTPRK были идентифицированы из полноразмерных последовательностей кДНК мыши, и было предсказано, что они приведут к двум вариантам сплайсинга PTPkappa: секретируемой форме PTPkappa и мембраносвязанной форме. [ 26 ]
Гомофильное связывание
[ редактировать ]PTPkappa опосредует гомофильную агрегацию клеток через свой внеклеточный домен. [ 27 ] PTPkappa только опосредует связывание между клетками, экспрессирующими PTPkappa (т.е. гомофильными), и не будет опосредовать агрегацию клеток между клетками, экспрессирующими PTPkappa, PTPmu или PTPrho (т.е. гетерофильными). [ 28 ] [ 29 ]
Регулирование
[ редактировать ]Протеолиз и N-гликозилирование
[ редактировать ]Полноразмерный белок PTPkappa расщепляется фурином с образованием двух расщепленных фрагментов, которые остаются связанными с плазматической мембраной: внеклеточной (E) субъединицы и внутриклеточной фосфатазной (P) субъединицы. [ 6 ] [ 23 ] В ответ на высокую плотность клеток или приток кальция после стимуляции трифлуоперазином (TFP) PTPkappa дополнительно расщепляется ADAM 10 с образованием выделившегося внеклеточного фрагмента и мембраносвязанного внутриклеточного фрагмента PΔE. [ 16 ] Связанный с мембраной фрагмент PΔE далее расщепляется комплексом гамма-секретазы с образованием высвобождаемого из мембраны фрагмента PIC, который может перемещаться в клеточное ядро, где он становится каталитически активным. [ 16 ]
Было продемонстрировано, что гликозилирование внеклеточного домена PTPkappa происходит преимущественно в клетках рака толстой кишки WiDr, которые сверхэкспрессируют N-ацетилглюкозаминилтрансферазу V (GnT-V). [ 21 ] Сверхэкспрессия GnT-V в этих клетках увеличивала расщепление и отщепление эктодомена PTPkappa и увеличивала миграцию клеток WiDr в трансвелловых анализах. [ 21 ] В результате гликозилирования PTPkappa с помощью GnT-V EGFR фосфорилируется по тирозину 1068 и активируется, что, вероятно, является причиной повышенной миграции клеток, наблюдаемой после расщепления PTPkappa. [ 22 ]
Выделение PTPkappa также может регулироваться присутствием белка, связывающего галектин-3, как было показано на клетках WiDr. [ 30 ] Авторы предполагают, что соотношение галектина-3-связывающего белка и галектина-3 влияет на расщепление и отщепление PTPkappa, хотя точный механизм того, как эти белки регулируют расщепление PTPkappa, не определен.
По активным формам кислорода при раке
[ редактировать ]Одним из механизмов, посредством которого активность тирозинфосфатазы PTPkappa может быть нарушена при раке, является окислительное ингибирование, опосредованное активными формами кислорода, генерируемыми либо перекисью водорода in vitro, либо УФ-облучением клеток кожи in vivo. [ 31 ] В бесклеточных анализах присутствие перекиси водорода снижает активность тирозинфосфатазы PTPkappa и увеличивает фосфорилирование тирозина EGFR. [ 31 ] УФ-облучение первичных кератиноцитов человека дает те же результаты, а именно снижение активности тирозинфосфатазы PTPkappa и увеличение фосфорилирования тирозина EGFR. Фосфорилирование EGFR затем приводит к пролиферации клеток, что позволяет предположить, что PTPkappa может действовать как супрессор опухоли при раке кожи в дополнение к меланоме. [ 31 ]
Выражение
[ редактировать ]PTPkappa экспрессируется в кератиноцитах человека. TGFβ1 является ингибитором роста кератиноцитов человека. Стимуляция культивируемой линии клеток кератиноцитов человека HaCaT TGFβ1 увеличивает уровни мРНК PTPkappa (PTPRK), как показал анализ нозерн-блоттинга. [ 32 ] TGFβ1 также увеличивал мРНК и белок PTPkappa в нормальных и опухолевых клеточных линиях молочной железы. [ 19 ] Сверхэкспрессия HER2 снижает экспрессию мРНК и белка PTPkappa. [ 19 ]
Клиническое значение
[ редактировать ]Меланома и рак кожи
[ редактировать ]Анализ экспрессии мРНК PTPkappa в нормальных меланоцитах, а также в клетках и тканях меланомы продемонстрировал, что PTPkappa подавлен или отсутствует в 20% случаев при меланоме, что позволяет предположить, что PTPkappa является геном-супрессором опухоли при меланоме. [ 33 ] Форма PTPkappa с точечной мутацией в четвертом повторе фибронектина III была идентифицирована как специфический антиген меланомы, распознаваемый CD4+ Т-клетками у пациента с меланомой с 10-летней выживаемостью без опухолей после резекции лимфатического узла. [ 34 ] Эта конкретная мутированная форма PTPkappa не была идентифицирована в 10 других клеточных линиях меланомы и, таким образом, может представлять собой уникальную мутацию у одного пациента. [ 34 ]
Лимфома
[ редактировать ]PTPkappa также был идентифицирован как предполагаемый ген-супрессор опухоли, который обычно удаляется при первичных лимфомах центральной нервной системы (PCNSL). [ 35 ]
Было обнаружено, что снижение уровня PTPkappa происходит после заражения вирусом Эпштейна-Барра (EBV) клеток лимфомы Ходжкина. [ 36 ]
Колоректальный рак
[ редактировать ]Используя генетический скрининг на основе транспозонов, исследователи обнаружили, что нарушение гена PTPRK в эпителии желудочно-кишечного тракта приводит к поражению кишечника, которое классифицируется как интраэпителиальная неоплазия, аденокарцинома или аденома. [ 37 ]
Рак легких
[ редактировать ]Было показано, что мРНК PTPRK значительно снижается с помощью RT-PCR в клеточных линиях, полученных из рака легких человека. [ 38 ]
Рак простаты
[ редактировать ]Также было показано, что PTPRK подавляется в ответ на андрогенную стимуляцию в клетках рака предстательной железы LNCaP человека. [ 39 ] Механизм подавления PTPRK заключается в экспрессии микроРНК, miR-133b, активность которой повышается в ответ на андрогенную стимуляцию. [ 39 ]
Рак молочной железы
[ редактировать ]Пациенты со сниженной экспрессией транскрипта PTPRK имеют более короткое время выживания при раке молочной железы и с большей вероятностью имеют метастазы рака молочной железы или умирают от рака молочной железы. [ 40 ] В экспериментальной модели рака молочной железы количество PTPRK было снижено в клеточных линиях рака молочной железы с помощью рибозимов PTPRK. [ 40 ] В этих клетках адгезия к матригелю, трансвелловая миграция и рост клеток увеличивались после снижения экспрессии PTPRK, что снова подтверждает функцию PTPRK в качестве супрессора опухоли. [ 40 ]
Глиома
[ редактировать ]Асем и его коллеги выявили события потери гетерозиготности (LOH) в образцах злокачественной глиомы и идентифицировали PTPRK как важный ген-кандидат в одной области LOH. [ 41 ] Наблюдалась значительная корреляция между наличием мутаций PTPRK и коротким временем выживания пациентов. [ 41 ] PTPRK амплифицировали из кДНК опухоли для подтверждения наблюдаемого LOH. В этих образцах наблюдалось 6 различных мутаций, две из которых (по одной в каждом фосфатазном домене) нарушали ферментативную активность ПТПРК. [ 42 ] Экспрессия PTPkappa дикого типа в клетках U87-MG и U251-MG приводила к снижению пролиферации, миграции и инвазии клеток. [ 42 ] Однако экспрессия вариантов PTPkappa с мутациями в фосфатазных доменах увеличивает пролиферацию, миграцию и инвазию клеток, что подтверждает роль мутированных вариантов PTPkappa в онкогенности. [ 42 ]
В разработке
[ редактировать ]Гибридизация in situ локализовала мРНК PTPkappa в головном мозге, легких, скелетных мышцах, сердце, плаценте, печени, почках и кишечнике во время развития. [ 43 ] Также было обнаружено, что PTPkappa экспрессируется в развивающейся сетчатке, в нестин-положительных радиальных клетках-предшественниках, а затем в процессе развития - в слое ганглиозных клеток, внутреннем плексиформном слое и внешних сегментах фоторецепторов. [ 44 ] Белок PTPkappa также наблюдается в нервных клетках-предшественниках и радиальных глиальных клетках развивающихся верхних холмиков мыши. [ 45 ]
В мозге взрослых крыс мРНК PTPkappa высоко экспрессируется в областях мозга с клеточной пластичностью и ростом, таких как обонятельная луковица, гиппокамп и кора головного мозга. [ 23 ] мРНК PTPkappa также наблюдается в мозжечке взрослых мышей. [ 25 ]
Используя репортерный ген β-галактозидазы (β-gal), встроенный в фосфатазный домен мышиного гена PTPkappa (PTPRK), Шен и его коллеги определили детальную картину экспрессии эндогенной PTPRK. [ 10 ] Активность β-гал наблюдалась во многих областях переднего мозга взрослого человека, включая слои II и IV, и в меньшей степени в слое VI коры. Активность β-гал также наблюдалась в апикальных дендритах кортикальных пирамидных клеток, гранулярном слое обонятельных и добавочных обонятельных луковиц, переднем гипоталамусе, паравентрикулярном ядре, а также в гранулярном и пирамидальном слоях зубчатой извилины и областях СА 1-3 гиппокамп. [ 10 ] В среднем мозге β-гал наблюдалась в субталамическом ядре, верхних и нижних холмах и в красном ядре. Активность β-гал наблюдалась также в нейральной сетчатке, во внутреннем ядерном слое и в небольших ганглиозных клетках слоя ганглиозных клеток. [ 10 ]
Взаимодействия
[ редактировать ]Показано, что ПТПРК взаимодействует с:
- Бета-катенин , [ 6 ] [ 16 ] [ 18 ]
- Е-кадгерин ( CDH-1 ), [ 18 ]
- Рецептор эпидермального фактора роста (EGFR), [ 19 ]
- ЕЕ2 , [ 19 ]
- Плакоглобин , [ 6 ] и
- α-катенин . [ 18 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с ENSG00000273993 GRCh38: выпуск Ensembl 89: ENSG00000152894, ENSG00000273993 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000019889 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Ян Ю, Гиль MC, Чхве Э.Ю., Пак Ш., Пюн К.Х., Ха Х (март 1997 г.). «Молекулярное клонирование и хромосомная локализация человеческого гена, гомологичного мышиному R-PTP-каппа, протеину тирозинфосфатазы рецепторного типа». Джин . 186 (1): 77–82. дои : 10.1016/S0378-1119(96)00684-1 . ПМИД 9047348 .
- ^ Перейти обратно: а б с д и ж Фукс М., Мюллер Т., Лерх М.М., Ульрих А. (август 1996 г.). «Ассоциация человеческой протеин-тирозинфосфатазы каппа с представителями семейства броненосцев» . J Биол Хим . 271 (28): 16712–9. дои : 10.1074/jbc.271.28.16712 . ПМИД 8663237 .
- ^ «Ген Энтреза: протеин тирозинфосфатаза PTPRK, тип рецептора, K».
{{cite web}}: Отсутствует или пусто|url=( помощь ) - ^ Чжан Ю, Зиберт Р, Маттисен П, Ян Ю, Ха Х, Шлегельбергер Б (1998). «Цитогенетическое определение и физическое картирование человеческого гена R-PTP-каппа (PTPRK) с предполагаемой областью гена-супрессора опухоли 6q22.2-q22.3» . Геномика . 51 (2): 309–11. дои : 10.1006/geno.1998.5323 . ПМИД 9722959 .
- ^ Перейти обратно: а б Скарнес В.К., Мосс Дж.Э., Хертли С.М., Беддингтон Р.С. (1995). «Захват генов, кодирующих мембранные и секретируемые белки, важные для развития мышей» . Proc Natl Acad Sci США . 92 (14): 6592–6. Бибкод : 1995PNAS...92.6592S . дои : 10.1073/pnas.92.14.6592 . ПМК 41564 . ПМИД 7604039 .
- ^ Перейти обратно: а б с д и Шен П., Канолл П.Д., Сап Дж., Мусаккио Дж.М. (1999). «Экспрессия усеченного рецепторного белка тирозинфосфатазы каппа в мозгу взрослой трансгенной мыши» . Мозговой Рес . 826 (2): 157–71. дои : 10.1016/s0006-8993(99)01179-8 . ПМИД 10224293 . S2CID 40530391 .
- ^ Перейти обратно: а б Дросопулос Н.Е., Уолш Ф.С., Доэрти П. (1999). «Растворимая версия рецептороподобного протеина тирозинфосфатазы каппа стимулирует рост нейритов через Grb2/MEK1-зависимый сигнальный каскад». Мол клеточные нейроны . 13 (6): 441–9. дои : 10.1006/mcne.1999.0758 . ПМИД 10383829 . S2CID 35458154 .
- ^ Перейти обратно: а б Косе Х., Сакаи Т., Цукумо С., Вэй К., Ямада Т., Ясутомо К., Мацумото К. (2007). «Задержка созревания развития тимоцитов вызвана делецией гена рецептороподобного протеина тирозинфосфатазы каппа у крыс LEC». Геномика . 89 (6): 673–7. дои : 10.1016/j.ygeno.2007.03.001 . ПМИД 17434290 . S2CID 28407283 .
- ^ Ивата Р., Сасаки Н., Аги Т. (2010). «Непрерывная делеция генов Ptprk и Themis вызывает иммунодефицит Т-хелперов (thid) у крыс LEC» . Биомед Рес . 31 (1): 83–7. дои : 10.2220/biomedres.31.83 . ПМИД 20203423 .
- ^ Асано А., Цубомацу К., Юнг К.Г., Сасаки Н., Агуи Т. (2007). «Делекционная мутация гена протеинтирозинфосфатазы каппа (Ptprk) ответственна за CD4+ Т-клеточный иммунодефицит (thid) у крыс LEC» (PDF) . Геном Мамм . 18 (11): 779–86. дои : 10.1007/s00335-007-9062-0 . hdl : 2115/33866 . ПМИД 17909891 . S2CID 20866657 .
- ^ Перейти обратно: а б Эрденебаяр Н., Маэкава Ю., Нисида Дж., Китамура А., Ясутомо К. (2009). «Протеин-тирозинфосфатаза-каппа регулирует развитие CD4+ Т-клеток посредством передачи сигналов, опосредованной ERK1/2». Биохимия Биофиз Рес Коммьюнити . 390 (3): 489–93. дои : 10.1016/j.bbrc.2009.09.117 . ПМИД 19800317 .
- ^ Перейти обратно: а б с д и ж г Андерс Л., Мертинс П., Ламмих С., Мургия М., Хартманн Д., Сафтиг П., Хаас С., Ульрих А. (2006). «Фурин-, ADAM 10- и гамма-секретаза-опосредованное расщепление рецепторной тирозинфосфатазы и регуляция транскрипционной активности бета-катенина» . Мол Клеточная Биол . 26 (10): 3917–34. дои : 10.1128/MCB.26.10.3917-3934.2006 . ПМК 1489012 . ПМИД 16648485 .
- ^ Перейти обратно: а б Новеллино Л., Де Филиппо А., Дехо П., Перроне Ф., Пилотти С., Пармиани Г., Кастелли С. (2008). «PTPRK негативно регулирует транскрипционную активность дикого типа и мутировавшего онкогенного бета-катенина и влияет на мембранное распределение комплексов бета-катенин/E-кадгерин в раковых клетках». Сигнал ячейки . 20 (5): 872–83. дои : 10.1016/j.cellsig.2007.12.024 . ПМИД 18276111 .
- ^ Перейти обратно: а б с д и Шнекенбургер Дж., Майерле Дж., Крюгер Б., Бухвалов И., Вайс Ф.У., Альбрехт Е., Самойлова В.Е., Домшке В., Лерх М.М. (2005). «Белок тирозинфосфатаза каппа и SHP-1 участвуют в регуляции межклеточных контактов в слипчивых соединениях экзокринной части поджелудочной железы» . Гут . 54 (10): 1445–55. дои : 10.1136/gut.2004.063164 . ПМК 1774702 . ПМИД 15987791 .
- ^ Перейти обратно: а б с д и Ван С.Э., Ву Ф.Ю., Шин И, Цюй С., Артеага С.Л. (2005). «Трансформирующий фактор роста {бета} (TGF-{бета})-Smad-ген-мишень, белок-рецептор тирозинфосфатазы типа каппа, необходим для функции TGF-{бета}» . Мол Клеточная Биол . 25 (11): 4703–15. дои : 10.1128/MCB.25.11.4703-4715.2005 . ПМК 1140650 . ПМИД 15899872 .
- ^ Перейти обратно: а б с Сюй Ю, Тан Л.Дж., Грахчук В., Вурхис Дж.Дж., Фишер Г.Дж. (2005). «Протеин-тирозинфосфатаза-каппа рецепторного типа регулирует функцию рецептора эпидермального фактора роста» . J Биол Хим . 280 (52): 42694–700. дои : 10.1074/jbc.M507722200 . ПМИД 16263724 .
- ^ Перейти обратно: а б с Ким Ю.С., Кан ХИ, Ким Дж.И., О С., Ким Ч.Х., Рю С.Дж., Миёси Э., Танигучи Н., Ко Дж.Х. (2006). «Идентификация целевых белков N-ацетилглюкозаминилтрансферазы V при раке толстой кишки человека и влияние протеинтирозинфосфатазы каппа на усиление миграции раковых клеток». Протеомика . 6 (4): 1187–91. дои : 10.1002/pmic.200500400 . ПМИД 16404719 . S2CID 6580919 .
- ^ Перейти обратно: а б Ван С, Ян Й, Ян З, Лю М, Ли З, Сунь Л, Мэй С, Чен Х, Чен Л, Ван Л, Чжа Икс (2009). «Передача сигналов миграции, опосредованная EGF, активируется N-ацетилглюкозаминилтрансферазой-V через рецепторный белок тирозинфосфатазу каппа». Арх Биохим Биофиз . 486 (1): 64–72. дои : 10.1016/j.abb.2009.02.005 . ПМИД 19236842 .
- ^ Перейти обратно: а б с Цзян Ю.П., Ван Х., Д'Эстахио П., Мусаккио Дж.М., Шлезингер Дж., Сап Дж. (1993). «Клонирование и характеристика R-PTP-каппа, нового члена семейства рецепторных белков тирозинфосфатазы с протеолитически расщепленной внеклеточной областью, подобной молекуле клеточной адгезии» . Мол Клеточная Биол . 13 (5): 2942–51. дои : 10.1128/MCB.13.5.2942 . ПМК 359687 . ПМИД 8474452 .
- ^ Эсваран Дж., Дебрецени Дж.Э., Лонгман Э., Барр А.Дж., Кнапп С. (2006). «Кристаллическая структура домена 1 белка тирозинфосфатазы каппа фосфатазы человека» . Белковая наука . 15 (6): 1500–5. дои : 10.1110/ps.062128706 . ПМК 2242534 . ПМИД 16672235 .
- ^ Перейти обратно: а б Беско Дж., Попеско М.К., Давулури Р.В., Фростхольм А., Роттер А. (2004). «Геномная структура и альтернативный сплайсинг протеинтирозинфосфатаз мышиного рецептора R2B (PTPkappa, mu, rho и PCP-2)» . БМК Геномика . 5 (1): 14. дои : 10.1186/1471-2164-5-14 . ПМЦ 373446 . ПМИД 15040814 .
- ^ Форрест А.Р., Тейлор Д.Ф., Кроу М.Л., Чок А.М., Уодделл Н.Дж., Колле Г., Фолкнер Г.Дж., Кодзиус Р., Катаяма С., Уэллс С., Кай С., Кавай Дж., Карнинчи П., Хаяшизаки Ю., Гриммонд С.М. (2006). «Общегеномный обзор сложности транскрипции мышиных протеинкиназ и фосфатаз» . Геном Биол . 7 (1): Р5. дои : 10.1186/gb-2006-7-1-r5 . ПМЦ 1431701 . ПМИД 16507138 .
- ^ Сап Дж., Цзян Ю.П., Фридлендер Д., Грумет М., Шлессингер Дж. (1994). «Рецептор тирозинфосфатазы R-PTP-каппа опосредует гомофильное связывание» . Мол Клеточная Биол . 14 (1): 1–9. дои : 10.1128/MCB.14.1.1 . ПМК 358350 . ПМИД 8264577 .
- ^ Зондаг Г.К., Конингштейн Г.М., Цзян Ю.П., Сап Дж., Муленаар В.Х., Геббинк М.Ф. (1995). «Гомофильные взаимодействия, опосредованные рецепторными тирозинфосфатазами мю и каппа. Критическая роль нового внеклеточного домена МАМ» . J Биол Хим . 270 (24): 14247–50. дои : 10.1074/jbc.270.24.14247 . ПМИД 7782276 .
- ^ Бека С., Чжан П., Крейг С.Е., Лодовски Д.Т., Ван З., Брэйди-Калней С.М. (2010). «Характеристика адгезивных свойств протеинтирозинфосфатаз рецепторов подсемейства IIb» . Клеи Cell Communication . 17 (2): 34–47. дои : 10.3109/15419061.2010.487957 . ПМЦ 3337334 . ПМИД 20521994 .
- ^ Ким Ю.С., Юнг Дж.А., Ким Х.Дж., Ан Ю.Х., Ю Дж.С., О С., Чо С., Ю Х.С., Ко Дж.Х. (2011). «Белок, связывающий галектин-3, способствует подвижности клеток при раке толстой кишки, стимулируя выделение протеинтирозинфосфатазы каппа пропротеинконвертазой 5». Биохимия Биофиз Рес Коммьюнити . 404 (1): 96–102. дои : 10.1016/j.bbrc.2010.11.071 . ПМИД 21094132 .
- ^ Перейти обратно: а б с Сюй Ю, Шао Ю, Вурхис Дж.Дж., Фишер Г.Дж. (2006). «Окислительное ингибирование протеин-тирозинфосфатазы каппа рецепторного типа ультрафиолетовым облучением активирует рецептор эпидермального фактора роста в кератиноцитах человека» . J Биол Хим . 281 (37): 27389–97. дои : 10.1074/jbc.M602355200 . ПМК 3738260 . ПМИД 16849327 .
- ^ Ян Ю, Гиль М, Бён С.М., Чхве И, Пюн К.Х., Ха Х (1996). «Трансформирующий фактор роста-бета1 ингибирует пролиферацию кератиноцитов человека за счет усиления экспрессии гена тирозинфосфатазы рецепторного типа R-PTP-каппа». Биохимия Биофиз Рес Коммьюнити . 228 (3): 807–12. дои : 10.1006/bbrc.1996.1736 . ПМИД 8941358 .
- ^ Макардл Л., Рафферти М., Мэландсмо ГМ, Бергин О., Фарр С.Дж., Дерван П.А., О'Локлин С., Херлин М., Исти DJ (2001). «Гены протеинтирозинфосфатазы снижаются при меланоме» . Джей Инвест Дерматол . 117 (5): 1255–60. дои : 10.1046/j.0022-202x.2001.01534.x . ПМИД 11710941 .
- ^ Перейти обратно: а б Новеллино Л., Ренквист Н., Рини Ф., Маццокки А., Ривольтини Л., Греко А., Дехо П., Скуарчина П., Роббинс П.Ф., Пармиани Г., Кастелли С (2003). «Идентификация мутировавшего рецептороподобного протеина тирозинфосфатазы каппа как нового HLA-ограниченного антигена меланомы класса II» . Дж Иммунол . 170 (12): 6363–70. дои : 10.4049/jimmunol.170.12.6363 . ПМИД 12794170 .
- ^ Накамура М., Киши М., Сакаки Т., Хасимото Х., Накасе Х., Симада К., Исида Э., Кониси Н. (2003). «Новые локусы-супрессоры опухолей на 6q22-23 при первичных лимфомах центральной нервной системы». Рак Рез . 63 (4): 737–41. ПМИД 12591717 .
- ^ Флавелл Дж.Р., Баумфорт К.Р., Вуд В.Х., Дэвис Г.Л., Вэй В., Рейнольдс Г.М., Морган С., Бойс А., Келли Г.Л., Янг Л.С., Мюррей П.Г. (2008). «Понижающая регуляция целевого гена TGF-бета, PTPRK, вирусом Эпштейна-Барра, кодируемым EBNA1, способствует росту и выживанию клеток лимфомы Ходжкина» . Кровь . 111 (1): 292–301. дои : 10.1182/blood-2006-11-059881 . ПМИД 17720884 .
- ^ Старр Т.К., Аллаи Р., Сильверстайн К.А., Стэггс Р.А., Сарвер А.Л., Бергеманн Т.Л., Гупта М., О'Салливан М.Г., Матис И., Дюпюи А.Дж., Коллиер Л.С., Пауэрс С., Оберг А.Л., Асманн Ю.В., Тибодо С.Н., Тессаролло Л., Коупленд Н.Г., Дженкинс Н.А., Кормье Р.Т., Ларгаэспада Д.А. (2009). «Генетический скрининг на основе транспозонов на мышах идентифицирует гены, измененные при колоректальном раке» . Наука . 323 (5922): 1747–50. Бибкод : 2009Sci...323.1747S . дои : 10.1126/science.1163040 . ПМЦ 2743559 . ПМИД 19251594 .
- ^ Скрима М, Де Марко С, Де Вита Ф, Фабиани Ф, Франко Р, Пироцци Г, Рокко Г, Маланга Д, Вильетто Г (2012). «Тирозинфосфатаза нерецепторного типа PTPN13 является геном-супрессором опухоли при немелкоклеточном раке легких» . Я Джей Патол . 180 (3): 1202–14. дои : 10.1016/j.ajpath.2011.11.038 . ПМИД 22245727 .
- ^ Перейти обратно: а б Мо В, Чжан Дж, Ли Х, Мэн Д, Гао Й, Ян С, Ван Х, Чжоу С, Го Ф, Хуан Й, Аменте С, Авведименто ЕВ, Се Й, Ли Й (2013). «Идентификация новых микроРНК, нацеленных на AR, опосредующих передачу сигналов андрогенов через критические пути регуляции жизнеспособности клеток при раке простаты» . ПЛОС ОДИН . 8 (2): e56592. Бибкод : 2013PLoSO...856592M . дои : 10.1371/journal.pone.0056592 . ПМЦ 3579835 . ПМИД 23451058 .
- ^ Перейти обратно: а б с Сунь П.Х., Е Л., Мейсон М.Д., Цзян В.Г. (2013). «Протеин тирозинфосфатаза каппа (PTPRK) является отрицательным регулятором адгезии и инвазии клеток рака молочной железы и связан с плохим прогнозом рака молочной железы». J Cancer Res Clin Oncol . 139 (7): 1129–39. дои : 10.1007/s00432-013-1421-5 . ПМИД 23552869 . S2CID 20002233 .
- ^ Перейти обратно: а б Асем М., Сибеналлер З., Агарвал С., Аль-Кейлани М.С., Алькуда М.А., Райкен Т.С. (2012). «Улучшение диагностики, прогноза и прогнозирования результатов лечения глиом с использованием геномики» . ОМИКС . 16 (3): 113–22. дои : 10.1089/omi.2011.0031 . ПМК 3300066 . ПМИД 22401657 .
- ^ Перейти обратно: а б с Агарвал С., Аль-Кейлани М.С., Алькуда М.А., Сибеналлер З.А., Райкен Т.С., Асем М. (2013). «Опухолевые мутации рецептора протеинтирозинфосфатазы типа k влияют на его функцию и изменяют чувствительность к химиотерапевтическим препаратам при глиоме» . ПЛОС ОДИН . 8 (5): e62852. Бибкод : 2013PLoSO...862852A . дои : 10.1371/journal.pone.0062852 . ПМК 3656086 . ПМИД 23696788 .
- ^ Фукс М., Ван Х., Чоссек Т., Чен З., Ульрих А. (1998). «Дифференциальная экспрессия протеинтирозинфосфатаз подсемейства МАМ во время развития мышей» . Мех Дев . 70 (1–2): 91–109. дои : 10.1016/S0925-4773(97)00179-2 . ПМИД 9510027 . S2CID 9560178 .
- ^ Хорват-Брёккер А., Райнхард Дж., Иллес С., Паех Т., Зойдл Г., Харрок С., Дистлер С., Князев П., Ульрих А., Файснер А. (2008). «Рецепторные протеинтирозинфосфатазы экспрессируются циклическими клетками-предшественниками сетчатки и участвуют в развитии нейронов сетчатки мыши». Нейронаука . 152 (3): 618–45. doi : 10.1016/j.neuroscience.2008.01.016 . ПМИД 18308476 . S2CID 21471047 .
- ^ Рейнхард Дж, Хорват-Брёккер А, Иллес С, Заремба А, Князев П, Ульрих А, Файснер А (2009). «Экспрессия протеинтирозинфосфатазы во время развития верхних холмиков мыши» . Exp Brain Res . 199 (3–4): 279–97. дои : 10.1007/s00221-009-1963-6 . ПМЦ 2845883 . ПМИД 19727691 .
Дальнейшее чтение
[ редактировать ]- Лу Дж., Ли Кью, Донадел Г., Ноткинс А.Л., Лан М.С. (1998). «Профиль и дифференциальная экспрессия протеинтирозинфосфатаз в линиях клеток опухоли островков поджелудочной железы мыши» . Поджелудочная железа . 16 (4): 515–20. дои : 10.1097/00006676-199805000-00010 . ПМИД 9598814 . S2CID 35807441 .
- Бондар С, Пласа-Изуриета Л, Фернандес-Хименес Н, Ирасторза И, Витофф С, Вейменга С, Кирдо Ф, Бильбао-младший (2013). «THEMIS и PTPRK в слизистой оболочке кишечника с целиакией: совместная экспрессия при заболевании и после введения глиадина in vitro» . Eur J Hum Genet . 22 (3): 358–62. дои : 10.1038/ejhg.2013.136 . ПМЦ 3925264 . ПМИД 23820479 .