Синтаза тетрагидроканнабиноловой кислоты
| Синтаза тетрагидроканнибиноловой кислоты | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 1.21.3.7 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
Синтаза тетрагидроканнабиноловой кислоты (THCA) (полное название Δ 1 -тетрагидроканнабиноловая кислота-синтаза ) — фермент, ответственный за катализацию образования THCA из каннабигероловой кислоты (CBGA). THCA является прямым предшественником тетрагидроканнабинола (THC) , основного психоактивного компонента каннабиса , который производится из различных штаммов Cannabis sativa . Таким образом, THCA-синтаза считается ключевым ферментом, контролирующим психоактивность каннабиса. [ 1 ] Полиморфизм THCA-синтазы приводит к различным уровням ТГК в растениях каннабиса, что приводит к появлению «лекарственного типа» и «волокнистого типа» . C. sativa сортов [ 2 ] [ 3 ]
Структура
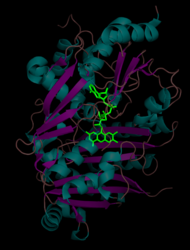
[ редактировать ]THCA-синтаза представляет собой мономерный фермент массой 60 кДа (~ 500 аминокислот) с изоэлектрической точкой 6,4. [ 4 ] Посттрансляционное N-связанное гликозилирование увеличивает общую массу примерно до 74 кДа. Третичная структура разделена на два домена (домены I и II), флавинадениндинуклеотид (FAD) между которыми расположен . Домен I состоит из восьми альфа-спиралей и восьми бета-листов и ковалентно связан с FAD. Домен II состоит из пяти альфа-спиралей, окруженных восемью бета-листами. Ферменты, которые имеют схожие аминокислотные последовательности, включают флавопротеинов фермент берберинового мостика (BBE), глюкоолигосахаридоксидазу (GOOX) и аклациномициноксидоредуктазу (AknOx). [ 1 ]
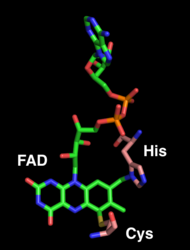
Фрагмент FAD является местом ферментативной активности и ковалентно связан с His114 и Cys176. FAD также связан водородными связями с основными и боковыми цепями соседних аминокислот. Совместная кристаллизация THCA-синтазы с субстратом или продуктом еще не завершена. [ 1 ]
-
Кофактор FAD (зеленый цвет) расположен между доменом I и доменом II THCA-синтазы. Альфа-спирали — голубые, а бета-листы — пурпурные.
-
ФАД (зеленый цвет) ковалентно связан с гистидином 114 и цистеином 176 (розовый цвет).
Механизм реакции
[ редактировать ]
THCA-синтаза, флавопротеин , использует флавинадениндинуклеотид (FAD) кофактор катализа окислительной циклизации . монотерпеновой части для каннабигероловой кислоты (CBGA) Подобные реакции циклизации происходят при биосинтезе монотерпенов из геранилпирофосфата , но не являются окислительными. [ 5 ] THCA-синтаза не проявляет каталитической активности против каннабигерола , у которого отсутствует карбоксильная группа по сравнению с CBGA, что позволяет предположить, что карбоксильная группа CBGA необходима для протекания реакции. [ 1 ]
Общая химическая реакция: CBGA + O 2 ТГКК + Н 2 О 2

Гидрид переносится из CBGA для восстановления FAD, что происходит за счет группы остатком депротонирования гидроксильной тирозина. Затем монотерпеновый фрагмент в CBGA завершает циклизацию в THCA. Окисление восстановленного ФАД O 2 дает перекись водорода (H 2 O 2 ) . [ 6 ] [ 1 ]

Биологическая функция
[ редактировать ]THCA-синтаза экспрессируется в железистых трихомах Cannabis sativa . THCA-синтаза может способствовать самозащите растений каннабиса , производя THCA и перекись водорода , которые являются цитотоксичными . Поскольку эти продукты токсичны для растения, THCA-синтаза секретируется в полость хранения трихом. [ 7 ] THCA также действует как фактор, индуцирующий некроз, открывая поры перехода проницаемости митохондрий , подавляя жизнеспособность митохондрий и приводя к старению тканей листа. [ 8 ]
Неферментативное декарбоксилирование ТГКК во время хранения или курения образует ТГК , основной психоактивный компонент каннабиса. [ 9 ] Дальнейшее разложение под воздействием температуры, автоокисления и света образует каннабинол. [ 10 ] ТГК и другие каннабиноиды Хорошо известно, что уменьшают тошноту и рвоту и стимулируют чувство голода, особенно у пациентов, проходящих химиотерапию рака . [ 11 ]
Ферменты, аналогичные THCA-синтазе, катализируют образование других каннабиноидов. Например, синтаза каннабидиоловой кислоты (CBDA) представляет собой флавопротеин, который катализирует аналогичную окислительную циклизацию CPGA в CBDA, доминирующий каннабиноидный компонент клетчатки C. sativa . CBDA подвергается аналогичному декарбоксилированию с образованием каннабидиола . [ 12 ]
Значение
[ редактировать ]Спрос на ТГК фармацевтического качества и другие каннабиноиды высок из-за интереса к их потенциальному терапевтическому использованию , но его тормозит правовое регулирование выращивания C. sativa во многих странах. [ 13 ] Прямой химический синтез ТГК затруднен из-за высокой стоимости и низких выходов. [ 14 ] Поэтому было изучено использование THCA-синтазы для производства THC, поскольку CBGA легко синтезируется, а THCA легко декарбоксилируется с образованием THC. [ 10 ] Биосинтез THCA путем экспрессии THCA-синтазы в организмах предпринимался на бактериях, насекомых и растениях табака с ограниченным успехом. Производство THCA в миллиграммах было продемонстрировано в дрожжевых клетках Pichia Pastoris в двух независимых исследованиях. [ 15 ] [ 13 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Шояма Ю, Тамада Т, Курихара К, Такеучи А, Таура Ф, Араи С, Блабер М, Шояма Ю, Моримото С, Куроки Р (октябрь 2012 г.). «Структура и функция синтазы ∆1-тетрагидроканнабиноловой кислоты (THCA), фермента, контролирующего психоактивность Cannabis sativa». Журнал молекулярной биологии . 423 (1): 96–105. дои : 10.1016/j.jmb.2012.06.030 . ПМИД 22766313 .
- ^ Стагиннус С, Цёрнтлейн С, де Мейер Э (июль 2014 г.). «ПЦР-маркер, связанный с полиморфизмом THCA-синтазы, является надежным инструментом для распознавания потенциально богатых ТГК растений Cannabis sativa L». Журнал судебной медицины . 59 (4): 919–26. дои : 10.1111/1556-4029.12448 . ПМИД 24579739 . S2CID 29683549 .
- ^ Коджома М., Секи Х., Ёсида С., Муранака Т. (июнь 2006 г.). «Полиморфизмы ДНК в гене синтазы тетрагидроканнабиноловой кислоты (THCA) у Cannabis sativa L «лекарственного типа» и «волокнистого типа». Международная судебно-медицинская экспертиза . 159 (2–3): 132–40. doi : 10.1016/j.forsciint.2005.07.005 . ПМИД 16143478 . S2CID 38866142 .
- ^ Таура Ф., Моримото С., Шояма Ю., Мечулам Р. (1995). «Первое прямое доказательство механизма Δ 1 Биосинтез -тетрагидроканнабиноловой кислоты». J. Am. Chem. Soc . 117 (38): 9766–9767. doi : 10.1021/ja00143a024 .
- ^ Сирикантарамас С., Моримото С., Шояма Ю., Исикава Ю., Вада Ю., Шояма Ю., Таура Ф. (сентябрь 2004 г.). «Ген, контролирующий психоактивность марихуаны: молекулярное клонирование и гетерологичная экспрессия синтазы дельта1-тетрагидроканнабиноловой кислоты из Cannabis sativa L» . Журнал биологической химии . 279 (38): 39767–74. дои : 10.1074/jbc.M403693200 . ПМИД 15190053 .
- ^ Сёяма Ю., Такеучи А., Таура Ф., Тамада Т., Адачи М., Куроки Р., Сёяма Ю., Моримото С. (август 2005 г.). «Кристаллизация синтазы дельта1-тетрагидроканнабиноловой кислоты (THCA) из Cannabis sativa» . Acta Crystallographica Раздел F. 61 (Часть 8): 799–801. дои : 10.1107/S1744309105023365 . ЧВК 1952348 . ПМИД 16511162 .
- ^ Сирикантарамас С., Таура Ф., Танака Ю., Исикава Ю., Моримото С., Шояма Ю. (сентябрь 2005 г.). «Синтаза тетрагидроканнабиноловой кислоты, фермент, контролирующий психоактивность марихуаны, секретируется в накопительную полость железистых трихом» . Физиология растений и клеток . 46 (9): 1578–82. дои : 10.1093/pcp/pci166 . ПМИД 16024552 .
- ^ Моримото С., Танака Ю., Сасаки К., Танака Х., Фукамидзу Т., Сёяма Ю., Сёяма Ю., Таура Ф. (июль 2007 г.). «Идентификация и характеристика каннабиноидов, которые вызывают гибель клеток посредством перехода митохондриальной проницаемости в клетках листьев каннабиса» . Журнал биологической химии . 282 (28): 20739–51. дои : 10.1074/jbc.M700133200 . ПМИД 17513301 .
- ^ Ямаути Т., Шояма Ю., Арамаки Х., Адзума Т., Нисиока I (июль 1967 г.). «Тетрагидроканнабиноловая кислота, настоящее вещество тетрагидроканнабинол» . Химический и фармацевтический вестник . 15 (7): 1075–6. дои : 10.1248/cpb.15.1075 . ПМИД 5583149 .
- ^ Jump up to: а б Морено-Санс Г (01.06.2016). «9-Тетрагидроканнабиноловая кислота А» . Исследования каннабиса и каннабиноидов . 1 (1): 124–130. дои : 10.1089/can.2016.0008 . ПМЦ 5549534 . ПМИД 28861488 .
- ^ Гусман М. (октябрь 2003 г.). «Каннабиноиды: потенциальные противораковые средства». Обзоры природы. Рак . 3 (10): 745–55. дои : 10.1038/nrc1188 . ПМИД 14570037 . S2CID 7868655 .
- ^ Таура Ф., Сирикантарамас С., Шояма Ю., Ёсикай К., Шояма Ю., Моримото С. (июнь 2007 г.). «Синтаза каннабидиоловой кислоты, фермент, определяющий хемотип в Cannabis sativa клетчаточного типа» . Письма ФЭБС . 581 (16): 2929–34. дои : 10.1016/j.febslet.2007.05.043 . ПМИД 17544411 .
- ^ Jump up to: а б Зирпель Б., Штеле Ф., Кайзер О. (сентябрь 2015 г.). «Производство Δ9-тетрагидроканнабиноловой кислоты из каннабигероловой кислоты целыми клетками Pichia (Komagataella) пасторис, экспрессирующими синтазы Δ9-тетрагидроканнабиноловой кислоты из Cannabis sativa L». Биотехнологические письма . 37 (9): 1869–75. дои : 10.1007/s10529-015-1853-x . ПМИД 25994576 . S2CID 16544089 .
- ^ Трост Б.М., Догра К (март 2007 г.). «Синтез (-)-дельта9-транс-тетрагидроканнабинола: стереоконтроль посредством реакции асимметричного аллильного алкилирования, катализируемой Мо» . Органические письма . 9 (5): 861–3. дои : 10.1021/ol063022k . ПМК 2597621 . ПМИД 17266321 .
- ^ Ланге К., Шмид А., Юлсинг М.К. (октябрь 2015 г.). «Производство синтазы Δ(9)-тетрагидроканнабиноловой кислоты в Pichia Pastoris позволяет осуществлять химический синтез каннабиноидов». Журнал биотехнологии . 211 : 68–76. дои : 10.1016/j.jbiotec.2015.06.425 . ПМИД 26197418 .