Аполипопротеин
| Аполипопротеин | |||
|---|---|---|---|
 Аполипопротеин E3 (APOE3) | |||
| Идентификаторы | |||
| Символ | Аполипопротеин | ||
| Pfam | PF01442 | ||
| InterPro | IPR000074 | ||
| Краткое содержание | 1oef / scope / supfam | ||
| OPM Суперсемейство | 172 | ||
| OPM белок | 3r2p | ||
| |||
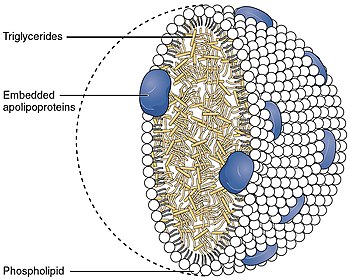
Аполипопротеины -это белки , которые связывают липиды (растворимые в масле вещества, такие как жиры, холестерин и растворимые в жировом растворевании ) с образованием липопротеинов . Они транспортируют липиды в крови , спинномозговой жидкости и лимфе .
Липидные компоненты липопротеинов нерастворимы в воде. Однако из-за их моющих средств ( амфипатических ) свойств, аполипопротеины и другие амфипатические молекулы (такие как фосфолипиды ) могут окружать липиды, создавая частицу липопротеинов, которая сама по себе растворится водой, и, таким образом, может переноситься через жидкости для тела (ie, IE, сама по себе растворимся в кровь, лимфа).
В дополнение к стабилизирующей структуре липопротеинов и солюбилизации липидного компонента, аполипопротеины взаимодействуют с рецепторами липопротеинов и белками транспорта липидов, тем самым участвуя в поглощении и клиренсе липопротеинов. Они также служат ферментов кофакторами для специфических ферментов, участвующих в метаболизме липопротеинов. [ 1 ]
Аполипопротеины также эксплуатируются вирусом гепатита С (ВГС), чтобы обеспечить вход, сборку и передачу вируса. Они играют роль в вирусном патогенезе и уклонении от вируса от нейтрализующих антител. [ 2 ]
Функции
[ редактировать ]Различные липопротеины содержат разные классы аполипопротеинов, которые влияют на их функцию.
Аполипопротеин AI (APOA1) является основным компонентом структурного белка липопротеинов высокой плотности (HDL), хотя он присутствует в других липопротеинах в меньших количествах. [ 3 ] Аполипопротеин A-IV (APOA4) присутствует в хиломикронах , липопротеинах с очень низкой плотностью (LLDL) и HDL. Считается, что он действует в основном в обратном транспорте холестерина [ 4 ] и поглощение липидов кишечника посредством сборки и секреции хиломикрона. Предполагается, что апоа-IV, синтезированный в гипоталамусе, является удовлетворительным фактором, который регулирует потребление пищи грызуна. [ 5 ] [ 1 ]
Аполипопротеин В играет особенно важную роль в том, что транспорт липопротеинов является основным организующим белком многих липопротеинов. [ 1 ]
Аполипопротеин C-III (APOC3) играет важную роль в липидном метаболизме, специфичной для регуляции метаболизма липопротеинов, богатых триглицеридов (TRL). [ 6 ]
Аполипопротеин D (APOD) представляет собой растворимый белок -носитель липофильных молекул в нейронах и глиальных клетках в центральной и периферической нервной системе, а APOD также может модулировать статус стабильности и окисления этих молекул. [ 7 ]
Аполипопротеин E (APOE) играет важную роль в транспорте и поглощении холестерина путем его высокого аффинного взаимодействия с рецепторами липопротеинов, включая липопротеинов с низкой плотностью (ЛПНП) рецептор . APOE является основным липопротеином в центральной нервной системе . Недавние выводы с APOA1 и APOE предполагают, что третичные структуры этих двух членов обмена человеком обмена аполипопротеином семейства генов связаны. [ 8 ] Трехмерная структура рецептор-связывающего рецепторного домена APOE указывает на то, что белок образует необычайно удлиненный пакет с четырьмя спичками, который может быть стабилизирован плотно упакованным ядром , который включает лейциновым взаимодействия с молния гидрофобным в основном заряженная поверхность. Основные аминокислоты, важные для рецептора связывания ЛПНП , кластерируются в поверхностное пятно на одной длинной спирали . [ 9 ]
Аполипопротеин F (APOF) является одним из незначительных аполипопротеинов в плазме крови, и это белок, ингибирующий липид, ингибирующий белок-транс-перенос, опосредованные белковым эфиром холестерила и триглицеридов. [ 10 ] [ 11 ]
Аполипопротеин М (APOM) участвует в липидном метаболизме и демонстрирует антиатеросклеротические функции, и он представлен в липопротеине высокой плотности (ЛПВП), липопротеине низкой плотности (ЛПНП) и очень низкой плотности (ЛПДЛ). [ 12 ]
Классы
[ редактировать ]Есть несколько классов аполипопротеинов и несколько подклассов:
- Аполипопротеин А ( Apo-AI , Apo-A2 , Apo-A4 и Apo-A5 ) [ А ]
- Аполипопротеин B (APO-B48 и APO B-100) [ B ]
- Аполипопротеин C ( APOC-I , APO APOC-II , APO APOC-III и APOC-IV ) [ А ]
- Аполипопротеин d
- Аполипопротеин e
- Аполипопротеин ф
- Аполипопротеин H - неправильный [ 13 ]
- Аполипопротеин L.
- Аполипопротеин m
- Аполипопротеин (а)
Обменные аполипопротеины (APOA, APOC и APOE) имеют одинаковую геномную структуру и являются членами мультигенного семейства, которые, вероятно, развивались из общего гена предков . APO-AI и APOA4 являются частью кластера гена APOA1/C3/A4/A5 на хромосоме 11 . [ 14 ]
Были описаны сотни генетических полиморфизмов аполипопротеинов, и многие из них изменяют свою структуру и функцию.
Эволюция
[ редактировать ]Кластер обменных аполипротеинов хорошо консервативный у позвоночных . [ 15 ] Семья диверсифицирована дублированием, с геном наследственного, наиболее похожим на APOC1. [ 16 ]
Помимо позвоночных, белки, похожие на обмену, апоа/C/E, и неэкспалируемый апо-B находятся у широкого спектра животных и хоанофлагеллятов . Это говорит о том, что наследственное животное уже имеет оба вида аполипопротеинов. у членистоногих аполипопротеинов В частности, диацилглицерина аполипопротеины известны как аполипофорины , а апоа/c/e-подобный, известный как аполипофорин III и Apo-B, как один, известный как аполипофорин I/II . [ 16 ]
Синтез и регулирование
[ редактировать ]Синтез аполипопротеина в кишечнике регулируется главным образом содержанием жира в рационе.
Синтез аполипопротеина в печени контролируется множеством факторов, включая диетический состав, гормоны ( инсулин , глюкагон , тироксин , эстрогены , андрогены ), потребление алкоголя и различные препараты ( статины , ниацины и фибриковые кислоты ). APOB является интегральным апопротеином, тогда как другие являются периферическими апопротеинами.
Синтез аполипопротеина, такой как APOA4 в гипоталамусе, включает в себя интеграцию сигналов для регуляции потребления пищи [ 5 ] который регулируется блуждающим нервом и холецистокинином . [ 17 ]
Болезнь
[ редактировать ]Предполагается, что аполипопротеин участвует в нескольких типах заболеваний и дисфункции.
Уровень APOC1 повышается у пациентов с невропатической болью и фибромиалгией, которые предполагают, что она играет важную роль в возникновении этих состояний. [ 18 ]
APOC3 является фактором риска сердечно -сосудистых заболеваний. Накопление плазменных TRL, вызванных повышенным APOC-III, приводящим к гипертриглицеридемии. [ 19 ]
Уровень APOD увеличивается в нервной системе с большим количеством неврологических расстройств, включая болезнь Альцгеймера, шизофрения и инсульт. [ 7 ]
Apoe участвовал в деменции и болезни Альцгеймера . [ 20 ]
APO (A) является компонентом липопротеина (A) (LP (A)) и повышенного уровня LP (A) в плазме (A) является наследственным, независимым и, возможно, причинным фактором риска для атеросклеротических сердечно -сосудистых заболеваний (ASCVD). [ 21 ] Обогащенные холестерином апобасодержащие липопротеины также участвуют в патогенезе ASCVD.
Ссылки
[ редактировать ]- ^ Jump up to: а беременный Либо римские цифры, либо арабские цифры могут использоваться для членов семейства генов. Например, APOA5 также известен как Apo av.
- ^ Изоформы из того же гена с помощью альтернативного сплайсинга .
- ^ Jump up to: а беременный в Рамасами I (декабрь 2014 г.). «Последние достижения в области физиологического метаболизма липопротеинов» . Клиническая химия и лабораторная медицина . 52 (12): 1695–727. doi : 10.1515/cclm-2013-0358 . PMID 23940067 . S2CID 6925754 .
- ^ Wrensch F, Crouchet E, Ligat G, Zeisel MB, Keck ZY, Foung SK, et al. (2018). «Взаимодействие вируса гепатита С (ВГС) -полипопротеинов и уклонение от иммунитета и их влияние на дизайн вакцины против ВГС» . Границы в иммунологии . 9 : 1436. DOI : 10.3389/fimmu.2018.01436 . PMC 6021501 . PMID 29977246 .
- ^ Фон Зихлинский А., Уильямс М., Маккормик С., Клефманн Т (июнь 2014 г.). «Абсолютная количественная оценка аполипопротеинов и связанных белков на липопротеинах плазмы человека». Журнал протеомики . 106 : 181–90. doi : 10.1016/j.jprot.2014.04.030 . PMID 24780726 .
- ^ Steinmetz A, Barbaras R, Ghalim N, Clavey V, Fruchart JC, Ailhaud G (май 1990). «Человеческий аполипопротеин A-IV связывается с сайтами рецепторов аполипопротеина AI/A-II и способствует оттоку холестерина из жировых клеток» . Журнал биологической химии . 265 (14): 7859–63. doi : 10.1016/s0021-9258 (19) 39010-6 . PMID 2159462 .
- ^ Jump up to: а беременный Liu M, Doi T, Shen L, Woods SC, Seeley RJ, Zheng S, et al. (Май 2001). «Аполипопротеиновый AIV белка кишечника синтезируется и регулируется в гипоталамусе крысы». Американский журнал физиологии. Нормативно -правовая, интегративная и сравнительная физиология . 280 (5): R1382-7. doi : 10.1152/ajpregu.2001.280.5.r1382 . PMID 11294757 .
- ^ Ooi EM, Barrett PH, Chan DC, Watts GF (май 2008 г.). «Аполипопротеин C-III: понимание возникающего сердечно-сосудистого фактора риска». Клиническая наука . 114 (10): 611–24. doi : 10.1042/cs20070308 . PMID 18399797 .
- ^ Jump up to: а беременный Dassati S, Waldner A, Schweigreiter R (июль 2014 г.). «Аполипопротеин D занимает центральную стадию в стрессовой реакции старения и дегенеративного мозга» . Нейробиология старения . 35 (7): 1632–42. doi : 10.1016/j.neurobiolaging.2014.01.148 . PMC 3988949 . PMID 24612673 .
- ^ Сайто Х., Лунд-Кац С., Филлипс М.К. (июль 2004 г.). «Вклад доменной структуры и липидного взаимодействия в функциональность обменных человеческих аполипопротеинов». Прогресс в исследованиях липидов . 43 (4): 350–80. doi : 10.1016/j.plipres.2004.05.002 . PMID 15234552 .
- ^ Уилсон С., Варделл М.Р., Вайсграбер К.Х., Махли Р.В., Агард Д.А. (июнь 1991 г.). «Трехмерная структура рецепторного домена рецептора ЛПНП с аполипопротеином человека» человека ». Наука . 252 (5014): 1817–22. Bibcode : 1991sci ... 252.1817W . doi : 10.1126/science.2063194 . PMID 2063194 .
- ^ Wang X, Driscoll DM, Morton Re (январь 1999 г.). «Молекулярное клонирование и экспрессия белка ингибитора переноса липидов выявляют его идентичность с аполипопротеином F» . Журнал биологической химии . 274 (3): 1814–20. doi : 10.1074/jbc.274.3.1814 . PMID 9880564 .
- ^ Корен Е., МакКонати В.Дж., Алапович П (октябрь 1982). «Выделение и характеристика простых и сложных липопротеинов, содержащих аполипопротеин F из плазмы человека». Биохимия . 21 (21): 5347–51. doi : 10.1021/bi00264a035 . PMID 6816269 .
- ^ Huang LZ, Gao JL, Pu C, Zhang PH, Wang LZ, Feng G, Zhang Y (август 2015 г.). «Аполипопротеин М: Прогресс, регуляция и метаболические функции (обзор)» . Молекулярная медицина сообщает . 12 (2): 1617–24. doi : 10.3892/mmr.2015.3658 . PMID 25901639 .
- ^ Ağar C, De Groot PG, Resear JH, Marquart JA, Meijers JC (январь 2009 г.). «Бета2-гликопротеин I неправильно называется аполипопротеином H» . Журнал тромбоза и гемостаза . 7 (1): 235–6. doi : 10.1111/j.1538-7836.2008.03223.x . PMID 19017258 . S2CID 43329586 .
- ^ Фуллертон С.М., Бьюкенен А.В., Сонпар В.А., Тейлор С.Л., Смит Д.Д., Карлсон С.С. и др. (Июнь 2004 г.). «Эффекты масштаба: изменение кластера гена ApoA1/C3/A4/A5». Человеческая генетика . 115 (1): 36–56. doi : 10.1007/s00439-004-1106-x . PMID 15108119 . S2CID 24857340 .
- ^ Babin PJ, Thisse C, Durliat M, Andre M, Akimenko MA, Thisse B (август 1997). «И гены аполипопротеина E, так и AI присутствуют в неммальянских позвоночных и высоко экспрессируются во время эмбрионального развития» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (16): 8622–7. Bibcode : 1997pnas ... 94.8622b . doi : 10.1073/pnas.94.16.8622 . PMC 23048 . PMID 9238027 .
- ^ Jump up to: а беременный Хьюббе П., Римбах Г. (август 2017 г.). «Эволюция изоформ аполипопротеина человека (APOE): структура генов, функция белка и взаимодействие с диетическими факторами». Обзоры исследований старения . 37 : 146–161. doi : 10.1016/j.arr.2017.06.002 . PMID 28647612 . S2CID 3758905 .
- ^ Lo CC, Langhans W, Georgievsky M, Arnold M, Caldwell JL, Cheng S, et al. (Декабрь 2012 г.). «Аполипопротеин AIV требует холецистокинина и блуждающих нервов для подавления потребления пищи» . Эндокринология . 153 (12): 5857–65. doi : 10.1210/en.2012-1427 . PMC 3512075 . PMID 23027805 .
- ^ Линд, Энн-Ли; Просто Дэвид; Микус, Мария; Фредолини, Клаудия; Иоанну, Марина; Гердл, Бьорн; Гафури, Биджар; Баккрид, Эммануэль; Tanum, Lars (2019-10-15). «Уровни CSF аполипопротеина С1 и аутотаксина, обнаруженные, ассоциируются с невропатической болью и фибромиалгией» . Журнал исследований боли . 12 : 2875–2889. doi : 10.2147/jpr.s215348 . PMC 6800548 . PMID 31686904 .
- ^ Chan DC, Chen MM, Ooi EM, Watts GF (май 2008 г.). «ABC аполипопротеина C-III: клинически полезный новый фактор риска сердечно-сосудистой системы?» Полем Международный журнал клинической практики . 62 (5): 799–809. doi : 10.1111/j.1742-1241.2007.01678.x . PMID 18201179 . S2CID 34553066 .
- ^ Chang Ty, Yamauchi Y, Hasan Mt, Chang C (декабрь 2017 г.). «Клеточный холестерин гомеостаз и болезнь Альцгеймера» . Журнал липидных исследований . 58 (12): 2239–2254. doi : 10.1194/jlr.r075630 . PMC 5711498 . PMID 28298292 .
- ^ Wu MF, Xu KZ, Guo YG, Yu J, Wu Y, Lin LM (октябрь 2019). «Липопротеин (A) и атеросклеротические сердечно -сосудистые заболевания: современное понимание и перспективы будущих». Сердечно -сосудистые лекарства и терапия . 33 (6): 739–748. doi : 10.1007/s10557-019-06906-9 . PMID 31655942 . S2CID 204886420 .