Николау Таксол полный синтез

, Полный синтез таксола Николау опубликованный К.С. Николау касается полного синтеза таксола и его группой в 1994 году , . [1] Таксол является важным лекарственным средством для лечения рака , но он также дорог, поскольку это соединение добывается из ограниченного ресурса, а именно из тиса тихоокеанского .
Этот синтетический путь получения таксола — один из нескольких; другие группы представили свои собственные решения, в частности группа Холтона с линейным синтезом, начиная с борнеола , группа Сэмюэля Данишефского, начиная с кетона Виланда-Мишера , и группа Вендера из пинена .
Синтез Николау является примером конвергентного синтеза , поскольку молекула собирается из трех предварительно собранных синтонов. Две основные части представляют собой циклогексеновые кольца A и C, которые соединены двумя короткими мостиками, образуя 8-членное кольцо посередине (кольцо B). Третья предварительно собранная деталь — амидный хвост. Кольцо D представляет собой оксетановое кольцо, конденсированное с кольцом C. Два ключевых химических превращения — это реакция Шапиро и реакция сочетания пинакола . [2] Общий синтез был опубликован в 1995 году в серии из четырех статей. [3] [4] [5] [6]
Ретросинтез
[ редактировать ]Как показано на ретросинтетической схеме I, таксол был получен из диола 7.2 путем образования сложноэфирной связи в соответствии с методом Одзимы-Холтона. Этот диол получается из карбоната 6.3 добавлением фениллития . Оксетановое производного кольцо в соединении 6.3 получено реакцией S N 2 с участием мезилата, ацеталя 4.9. Кольцо B было замкнуто посредством реакции Мак-Мерри с участием диальдегида 4.8, который в конечном итоге был получен из альдегида 4.2 и гидразона 3.6 с использованием реакции сочетания Шапиро .
 |
| Схема ретросинтеза 1 |
|---|
Схема ретросинтеза II показывает, что и альдегид, и гидразон, использованные в реакции сочетания Шапиро, были синтезированы с использованием реакций Дильса-Альдера .
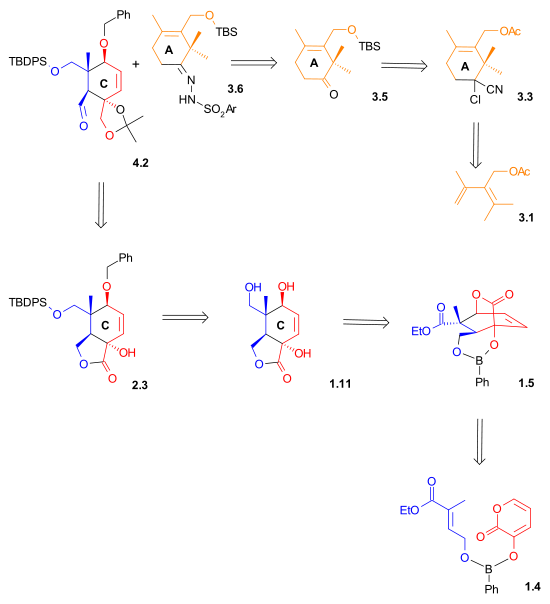 |
| Схема ретросинтеза 2 |
|---|
Синтез C-кольца
[ редактировать ]Как показано на схеме 1 , синтез кольца С начался с реакции Дильса-Альдера между диеном 1.3 и диенофилом 1.1 в присутствии фенилборной кислоты ( 1.2 ), которая после присоединения 2,2-диметил-1,3- пропандиол дал пятичленный лактон 1,8 с выходом 62%. Бор служил молекулярным связующим звеном и выравнивал как диен, так и диенофил для этого эндо-циклоприсоединения Дильса-Альдера . После защиты гидроксильных групп в виде трет -бутилдиметилсилиловых эфиров восстановление сложного эфира алюмогидридом лития и селективное снятие защиты со вторичной гидроксильной группы дает лактондиол 1.11 . Необычные гидраты лактонов 1.9 и 1.10 были выделены в качестве синтетических интермедиатов этого процесса.
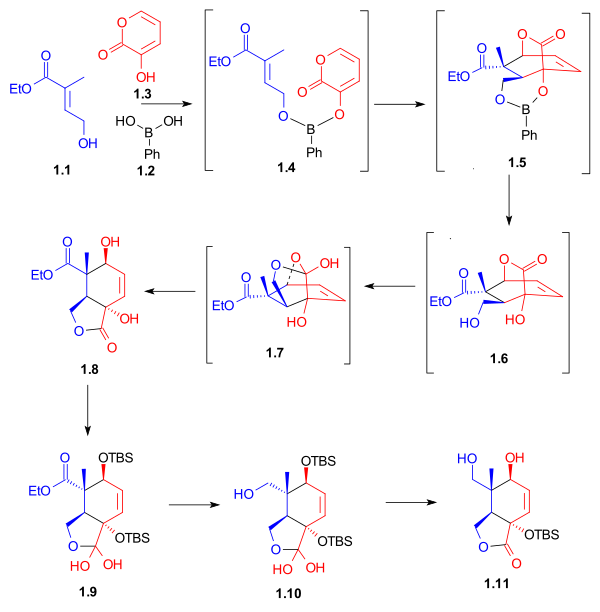 |
| Схема 1 |
|---|
Лактондиол 2.1 после селективной защиты восстанавливали алюмогидридом лития с получением триола 2.4 . Этот триол после превращения в ацетонид был селективно окислен до альдегида с использованием перрутената тетрапропиламмония (TPAP) и N-оксида N-метилморфолина . Альдегид 2.6 послужил отправной точкой для построения кольца Б ( схема 4 , соединение 4.2 ).
 |
| Схема 2 |
|---|
Кольцевой синтез
[ редактировать ]Синтез кольца А ( схема 3 ) начинался с реакции Дильса-Альдера диена 3.1 с коммерчески доступным диенофилом 2-хлоракрилонитрилом 3.2 с получением циклогексена 3.3 с полной региоселективностью . Гидролиз цианохлоргруппы и одновременный отщепление ацетатной группы привели к гидроксикетону 3.4 . Гидроксильную группу защищали трет-бутилдиметилсилиловым эфиром ( 3.5 ). При подготовке к реакции Шапиро этот кетон был превращен в гидразон 3.6 .
 |
| Схема 3 |
|---|
Синтез кольца B
[ редактировать ]
Соединение кольца A и кольца C создало 8-членное кольцо B. Одно соединение было получено посредством нуклеофильного присоединения соединения виниллития к альдегиду, а другое соединение - посредством реакции сочетания пинакола двух альдегидов ( схема 4 ).
Реакция Шапиро соединения виниллития, полученного из гидразона 4.1, с альдегидом 4.2 образует первое соединение, которое станет кольцом B. Считается, что контроль стереохимии в 4.3 обусловлен относительным затруднением грани Si в ориентации, показанной справа, из-за близости аксиальной метильной группы. Эпоксидирование ванадил (ацетилацетатом) превращало алкен 4.3 в эпоксид 4.4 , который при восстановлении алюмогидридом лития давал диол 4.5 . Этот диол затем защищали как карбонатный эфир 4.6 . Карбонатная группа также служила для создания жесткости кольцевой структуры для неизбежной реакции сочетания пинакола . Две силилэфирные группы удаляли, а диол 4.7 затем окисляли до диальдегида 4.8 с использованием N- - метилморфолина N оксида в присутствии каталитического количества перрутената тетрапропиламмония . На заключительном этапе образования кольца B происходит соединение пинакола с использованием условий, разработанных МакМерри ( хлорид титана (III) и цинк / медь). сплав ) дал диол 4,9 .
 |
| Схема 4 |
|---|
Разрешение
[ редактировать ]На этом этапе синтеза таксола материал представлял собой рацемическую смесь . желаемого энантиомера аллиловый два спирт 4.9 ацилировали Для получения (1S)-(-)-камфанхлоридом и диметиламинопиридином , получая диастереомера . Затем их разделяли с помощью стандартной колоночной хроматографии . Желаемый энантиомер затем выделяли, обрабатывая один из разделенных дизатереомеров бикарбонатом калия в метаноле .
 |
| Энантиомерное разрешение 4,9 . |
Синтез D-кольца
[ редактировать ]Желаемый в результате разделения энантиомер, аллиловый спирт 5.1 ( схема 5 ), ацетилировали уксусным ангидридом и 4-(диметиламино)пиридином в метиленхлориде с получением моноацетата 5.2 . Примечательно, что эта реакция была исключительно для аллильного спирта, а соседняя гидроксильная группа не ацетилировалась . Спирт 5.2 окисляли тетрапропиламмония перрутенатом и N - оксидом N-метилморфолина с образованием кетона 5.3 . Алкен 5.3 подвергся гидроборированию в тетрагидрофуране . Окисление основным пероксидом водорода и бикарбонатом натрия дало спирт 5,4 с выходом 35%, с выходом региоизомера 15%. Ацетонид удаляли, получая триол 5,5 . Этот спирт моноацетилировали с получением ацетата 5,6 . Бензильную группу удалили и заменили триэтилсилильной группой. Диол 5.7 селективно активировали метансульфонилхлоридом и 4-(диметиламино)пиридином с получением мезилата 5.8 с выходом 78%.
 |
| Схема 5 |
|---|
Ацетильную 6.1 группу в спирта ( схема 6 ) удалили с образованием первичного 6.2 . Кольцо таксола (D) было добавлено путем внутримолекулярного нуклеофильного замещения с участием этой гидроксильной группы с получением оксетана 6.3 . После ацетилирования фениллитий использовали для раскрытия сложноэфирного кольца карбоната с образованием спирта 6,5 . Аллильное окисление хлорхроматом пиридиния , ацетатом натрия и целитом дало кетон 6,6 , который впоследствии был восстановлен боргидридом натрия с получением вторичного спирта 6,7 . Это было последнее соединение перед добавлением амидного хвоста .
 |
| Схема 6 |
|---|
Добавление хвоста
[ редактировать ]Как показано на схеме 7 , лактам Охимы 7.1 прореагировал со спиртом 7.2 с бис(триметилсилил)амидом натрия в качестве основания. Этот спирт представляет собой триэтилсилиловый эфир природного соединения баккатина III. Родственное соединение, 10-деацетилбаккатин III, обнаружено в Taxus baccata , также известном как европейский тис, в концентрации 1 грамм на килограмм листьев. Удаление триэтилсилильной защитной группы дало таксол.
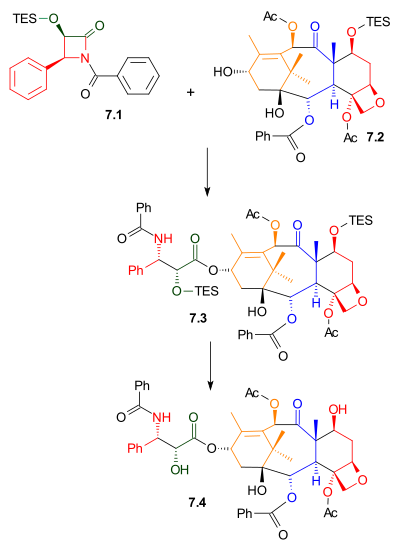 |
| Схема 7 |
|---|
Синтез предшественников
[ редактировать ]Синтез диенофила Дильса-Альдера для кольца C
[ редактировать ]Этиловый эфир пропионовой кислоты ( 1 ) бромировали и затем переводили в реактив Виттига с помощью трифенилфосфина . Альдегид 6 получали из аллилового спирта ( 4 ) защитой трет-бутилдифенилсилиловым эфиром ( 5 ) с последующим озонолизом . Реагент Виттига 3 и альдегид 6 прореагировали по реакции Виттига с образованием ненасыщенного эфира 7 , с которого была снята защита с образованием диенофила 8 (схема 1, соединение 1).

Синтез диена Дильса-Альдера кольца А.
[ редактировать ]конденсация ацетона Альдольная и этилацетоацетата дала β-кетоэфир 3 . Реакция Гриньяра с участием метилмагнийбромида привела к получению спирта 4 , который подвергли катализируемому кислотой элиминированию с образованием диена 5 . Восстановление и ацетилирование дали диен 7 (схема 3, соединение 1).

Защитные группы
[ редактировать ]В синтезе используются следующие защитные группы:
| Защитная группа | Реагенты защиты | Реагенты для снятия защиты | Использование в синтезе |
|---|---|---|---|
| Ас (ацетил) | Уксусный ангидрид , пиридин , 4-(диметиламино)пиридин и дихлорметан. | Карбонат калия в метаноле и водном растворителе | Защита предотвратила мезилирование первичного кислорода в 5.8 . |
| Ацетонид | 2,2-диметоксипропан и камфорсульфоновая кислота и дихлорметан | Соляная кислота , метанол, вода и этиловый эфир. | Защита вицинального диола 2.4 оставшуюся гидроксильную группу спирта 2.5 позволила селективно окислить с образованием альдегида 2.6 . Ацетонид был удален гораздо позже в ходе синтеза при подготовке к замыканию кольца D. |
| Бн (бензил) | Гидрид калия , йодид тетра-н-бутиламмония и бромистый бензил. | Водород, Pd(OH) 2 /C | Вторичный спирт 2.2 защищали как бензиловый эфир, чтобы могло произойти восстановление лактона 2.3 . Значительно позднее в ходе синтеза защита была снята с образованием спирта 5.7 , который был повторно защищен в виде триэтилсилилового эфира. |
| Карбонатный эфир | Гидрид калия , фосген | Фениллитий | Защита добавляет жесткости кольцевой структуре для реакции сочетания пинакола с образованием диола 4.9 , а также предотвращает нежелательное окисление при образовании диальдегида 4.8 . Позднее раскрытие эфирного кольца карбоната дает спирт 6,5 . |
| TBDPS (трет-бутилдифенилсилил) | трет- Бутилдифенилсилилхлорид, имидазол и диметилформамид | Тетра-н-бутиламмоний фторид | Первичный спирт 2.1 защищали при подготовке к восстановлению лактона в 2.3 . Защитную группу удалили, получив диол 4.7 при подготовке к реакции сочетания пинакола . |
| TBS (трет-бутилдиметилсилил) [1] | трет- бутилдиметилсилилтрифлат, лутидин , 4-(диметиламино)пиридин и дихлорметан. | Камфорсульфоновая кислота , дихлорметан и метанол. | Вторичная гидроксильная группа в 1.8 была кратковременно защищена во время защиты третичной гидроксильной группы в том же соединении. |
| TBS (трет-бутилдиметилсилил) [2] | трет- бутилдиметилсилилтрифлат, лутидин, 4-(диметиламино)пиридин и дихлорметан | Камфорсульфоновая кислота | Защита третичной гидроксильной группы в 1.8 была необходима для обеспечения избирательной защиты других гидроксильных групп в кольце C. |
| TBS (трет-бутилдиметилсилил) [3] | трет- Бутилдиметилсилилхлорид, имидазол и дихлорметан | Тетра-н-бутиламмоний фторид | Защита гидроксильной группы в 3.4 позволила кетону вступить в реакцию Шапиро с образованием соединения вииллития 3.7 . |
| ТЭС (триэтилсилил) [1] | Триэтилсилилхлорид и пиридин . | Гидролиз с использованием плавиковой кислоты , пиридина и тетрагидрофурана. | Защита вторичной гидроксильной группы в 5.7 была необходима для окончательного присоединения хвоста к спирту 7.2 . |
| ТЭС (триэтилсилил) [2] | См . лактам Оджимы . | Гидролиз с использованием плавиковой кислоты и пиридина. | Защищенный вторичный спирт в лактаме Одзимы 7.1 в реакции со спиртом 7.2 в хвостовом соединении. |
См. также
[ редактировать ]- Общий синтез паклитаксела
- Полный синтез таксола Данишефского
- Общий синтез Холтона Таксола
- Полный синтез таксола Куваджима
- Полный синтез таксола Мукаямы
- Полный синтез таксола Вендера
Внешние ссылки
[ редактировать ]Ссылки
[ редактировать ]- ^ Классика в тотальном синтезе: цели, стратегии, методы К.К. Николау , Э.Дж. Соренсен ISBN 3-527-29231-4
- ^ Николау, Коннектикут ; Ян, З; Лю, Джей-Джей; Уэно, Х; Нантермет, П.Г.; Гай, РК; Клэйборн, CF; Рено, Дж; и др. (февраль 1994 г.). «Тотальный синтез таксола». Природа . 367 (6464): 630–4. Бибкод : 1994Natur.367..630N . дои : 10.1038/367630a0 . ПМИД 7906395 .
- ^ КЦ Николау ; ПГ Нантермет; Х. Уэно; РК Гай; Э.А. Куладурос и Э.Дж. Соренсен (1995). «Полный синтез таксола. 1. Ретросинтез, деградация и восстановление». Дж. Ам. хим. Соц . 117 (2): 624–633. дои : 10.1021/ja00107a006 . S2CID 30357150 .
- ^ КЦ Николау ; Ж.-Ж. Лю; З. Ян; Х. Уэно; Э. Дж. Соренсен; КФ Клэйборн; РК Гай; С.-К. Хван; М. Накада и П.Г. Нантермет (1995). «Полный синтез таксола. 2. Создание промежуточных соединений колец A и C и первоначальные попытки построить кольцевую систему ABC». Дж. Ам. хим. Соц . 117 (2): 634–644. дои : 10.1021/ja00107a007 .
- ^ К.С. Николау; З. Ян; Ж.-Ж. Лю; ПГ Нантермет; КФ Клэйборн; Ж. Рено; РК Гай и К. Сибаяма (1995). «Полный синтез таксола. 3. Формирование кольцевого скелета ABC таксола». Дж. Ам. хим. Соц . 117 (2): 645–652. дои : 10.1021/ja00107a008 .
- ^ КЦ Николау ; Х. Уэно; Ж.-Ж. Лю; ПГ Нантермет; З. Ян; Ж. Рено; К. Полваннан и Р. Чадха (1995). «Полный синтез таксола. 4. Заключительные этапы и завершение синтеза». Дж. Ам. хим. Соц . 117 (2): 653–659. дои : 10.1021/ja00107a009 .