Оксалат железа(II)

| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
Оксалат железа(II)
| |
| Другие имена
оксалат железа
оксалат железа | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Информационная карта ECHA | 100.007.472 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| FeC 2 O 4 (безводный) FeC 2 O 4 · 2 H 2 O (дигидрат) | |
| Молярная масса | 143,86 г/моль (безводный) 179,89 г/моль (дигидрат) |
| Появление | желтый порошок |
| Запах | без запаха |
| Плотность | 2,28 г/см 3 |
| Температура плавления | дигидрат: 150–160 ° C (302–320 ° F; 423–433 К) (разлагается) |
| дигидрат: 0,097 г/100 мл (25 °С) [ 1 ] | |
| Опасности | |
| СГС Маркировка : | |
 [ 2 ] [ 2 ]
| |
| Предупреждение | |
| Х302 , Х312 [ 2 ] | |
| Р280 [ 2 ] | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Оксалат железа ( оксалат железа(II) ) — неорганическое соединение с формулой FeC 2 O 4 (H 2 O) x , где x равно 0 или 2. Это соединения оранжевого цвета, плохо растворимые в воде.
Структура и реакции
[ редактировать ]Как и другие оксалаты железа, оксалаты железа имеют октаэдрические Fe-центры. Дигидрат FeC 2 O 4 (H 2 O) x представляет собой координационный полимер , состоящий из цепочек оксалатно-мостиковых железистых центров, каждый из которых имеет два аква-лиганда. [ 3 ]
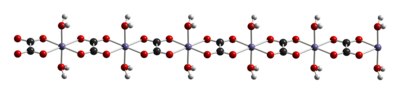
При нагревании до 120 °С дигидрат дегидратируется, а безводный оксалат железа разлагается около 190 °С. [ 4 ] Продукты термического разложения представляют собой смесь оксидов железа и пирофорного металлического железа, а также выделяющиеся углекислый газ , окись углерода и вода. [ 5 ]
Оксалаты железа являются предшественниками фосфатов железа , которые имеют ценность в аккумуляторах. [ 6 ]
Естественное явление
[ редактировать ]По состоянию на 2020 год безводный оксалат железа (II) среди минералов неизвестен. Однако дигидрат известен как гумбольдтин . [ 7 ] [ 8 ] Близкий, но гораздо более сложный минерал — степановит .
Na[Mg(H 2 O) 6 ] [Fe 3+ (C 2 O 4 ) 3 ]·3H 2 O - пример триоксалатоферрата(III). [ 9 ] [ 8 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Дигидрат оксалата железа(II)» .
- ^ Jump up to: а б с Sigma-Aldrich Co. , Дигидрат оксалата железа(II) . Проверено 3 мая 2014 г.
- ^ Этиго, Такуя; Кимата, Мицуёси (2008). «Монокристаллическая рентгеновская дифракция и спектроскопические исследования гумбольдтина и линдбергита: слабый эффект Яна – Теллера Fe. 2+ ion». Физика и химия минералов . 35 (8): 467–475. Bibcode : 2008PCM....35..467E . doi : 10.1007/s00269-008-0241-7 . S2CID 98739882 .
- ^ Му, Джейкоб; Перлмуттер, Д.Д. (1981). «Термическое разложение карбонатов, карбоксилатов, оксалатов, ацетатов, формиатов и гидроксидов». Термохимика Акта . 49 (2–3): 207–218. дои : 10.1016/0040-6031(81)80175-х .
- ^ Германек, Мартин; Зборил, Радек; Машлан, Мирослав; Мачала, Либор; Шнеевайс, Олдрич (2006). «Термическое поведение дигидрата оксалата железа (II) в атмосфере его конверсионных газов». Дж. Матер. Хим . 16 (13): 1273–1280. дои : 10.1039/b514565a .
- ^ Эллис, БЛ; Макахнук, WRM; Макимура, Ю.; Тогхилл, К.; Назар, Л.Ф. (2007). «Многофункциональный железофосфатный катод на 3,5 В для аккумуляторных батарей». Природные материалы . 6 (10): 749–753. Бибкод : 2007NatMa...6..749E . дои : 10.1038/nmat2007 . ПМИД 17828278 .
- ^ «Гумбольдтин» .
- ^ Jump up to: а б «Список минералов» . 21 марта 2011 г.
- ^ «Степановец» .