Анализ связывания лигандов
Анализ связывания лигандов ( LBA ) — это анализ или аналитическая процедура, которая основана на связывании лигандов молекул с рецепторами , антителами или другими макромолекулами . [ 1 ] Для определения присутствия и количества образовавшихся комплексов лиганд-рецептор используется метод обнаружения, который обычно определяется электрохимически или методом флуоресцентного обнаружения . [ 2 ] Этот тип аналитического теста можно использовать для проверки наличия в образце целевых молекул, которые, как известно, связываются с рецептором. [ 3 ]
Существует множество типов анализов связывания лигандов, как радиоактивных , так и нерадиоактивных. [ 4 ] [ 5 ] [ 6 ] Некоторые новые типы называются анализами «смешай и измерь», поскольку для их выполнения требуется меньше шагов, например, без удаления несвязанных реагентов. [ 5 ]
Анализы связывания лигандов используются в основном в фармакологии для различных нужд. человеческого организма В частности, несмотря на эндогенные рецепторы , гормоны и другие нейромедиаторы , фармакологи используют анализы для создания лекарств , которые являются селективными или имитируют эндогенно обнаруженные клеточные компоненты. С другой стороны, такие методы также доступны для создания антагонистов рецепторов, чтобы предотвратить дальнейшие каскады. [ 7 ] Такие достижения дают исследователям возможность не только количественно определять гормоны и гормональные рецепторы, но и вносить важную фармакологическую информацию в разработку лекарств и планы лечения. [ 8 ]
История
[ редактировать ]Исторически методы анализа связывания лигандов широко использовались для количественного определения концентрации гормонов или рецепторов гормонов в плазме или тканях. Методика лиганда связывания анализа позволила количественно оценить концентрацию гормона в тестируемом материале путем сравнения эффектов тестируемого образца с результатами различных количеств известного белка ( лиганда ).
Основы, на которых был создан анализ связывания лигандов, заложены в результате Карла Ландштейнера в 1945 году и его работы по иммунизации животных посредством производства антител к определенным белкам. [ 9 ] Работа Ландштейнера продемонстрировала, что технология иммуноанализа позволяет исследователям проводить анализ на молекулярном уровне. О первом успешном анализе связывания лиганда сообщили в 1960 году Розалин Сассман Ялоу и Соломон Берсон . [ 9 ] Они исследовали взаимодействие связывания инсулина и инсулиноспецифического антитела, а также разработали первый радиоиммуноанализ (РИА) на инсулин. Эти открытия предоставили ценную информацию о чувствительности и специфичности белковых гормонов, обнаруженных в жидкостях крови. [ 9 ] Ялоу и Берсон получили Нобелевскую премию по медицине за свои достижения. Благодаря развитию технологии РИА исследователи смогли выйти за рамки использования радиоактивности и вместо этого использовать жидкостные и твердофазные, конкурентные и иммунорадиометрические анализы. [ 9 ] В результате этих монументальных открытий исследователи продолжили развитие методов анализа связывания лигандов во многих областях биологии, химии и т.п. Например, лаборатория Лоис в Калифорнийском технологическом институте использует искусственно созданные лиганды и рецепторы на нейронах для отслеживания потока информации в мозге. [ 10 ] Они специально используют индуцированный лигандами внутримембранный протеолиз, чтобы распутать связи мозга у дрозофилы и других моделей. [ 11 ] Когда искусственный лиганд на одном нейроне связывается с рецептором на другом, экспрессия GFP активируется в акцепторном нейроне, что демонстрирует полезность анализов связывания лигандов в нейробиологии и биологии. [ 12 ]
Приложения
[ редактировать ]Анализы связывания лигандов позволяют оценить взаимодействия, происходящие между двумя молекулами, такие как связывание с белками, а также степень сродства (слабое, сильное или отсутствие связи), при котором реагенты связываются друг с другом. [ 13 ] Существенные аспекты анализов связывания включают, помимо прочего, уровень концентрации реагентов или продуктов ( см. раздел «Радиоактивность» ), поддержание константы равновесия реагентов на протяжении всего анализа, а также надежность и достоверность связанных реакций. [ 13 ] Хотя анализы связывания просты, они не могут предоставить информацию о том, влияет ли тестируемое соединение на функцию мишени. [ 14 ]
Радиолигандные анализы
[ редактировать ]Радиолиганды используются для измерения связывания лигандов с рецепторами и в идеале должны обладать высоким сродством, низким неспецифическим связыванием, высокой специфической активностью для обнаружения низкой плотности рецепторов и специфичностью рецепторов. [ 7 ]
Уровни радиоактивности радиолиганда (на моль) называются удельной активностью (SA), которая измеряется в Ки/ммоль. [ 15 ] Фактическая концентрация радиолиганда определяется конкретной сырьевой базой, из которой произошел радиолиганд (от производителей). [ 15 ] Следующее уравнение определяет фактическую концентрацию:
Привязка насыщенности
[ редактировать ]Анализ насыщения используется в различных типах тканей, таких как фракции частично очищенной плазмы из гомогенатов тканей , клетки, трансфицированные клонированными рецепторами , и клетки, которые либо находятся в культуре, либо изолированы перед анализом. [ 7 ] Анализ связывания насыщения может определить сродство и плотность рецептора. Это требует, чтобы выбранная концентрация нового лиганда была определена эмпирически.
Для экспериментов этого типа применяются две распространенные стратегии: [ 7 ] Увеличение количества добавляемого радиолиганда при сохранении как постоянной удельной активности , так и постоянной концентрации радиолиганда или снижение удельной активности радиолиганда за счет добавления немеченого лиганда. [ 7 ]
График Скэтчарда
[ редактировать ]
График Скэтчарда (график Розенталя) можно использовать для демонстрации сродства радиолиганда. На графике этого типа соотношение связанного/свободного радиолиганда отображается в зависимости от связанного радиолиганда. Наклон константе линии равен отрицательной величине, обратной сродства (K). Пересечение линии с осью X является оценкой Bmax. [ 7 ] График Скэтчарда можно стандартизировать по соответствующему эталону, чтобы можно было напрямую сравнивать плотность рецепторов в различных исследованиях и тканях. [ 7 ] Этот типовой график показывает, что радиолиганд связывается с одним сродством. Если бы лиганд связывался с несколькими сайтами, имеющими разное сродство к радиолигандам, то на графике Скэтчарда вместо этого была бы вогнутая линия. [ 7 ]
Нелинейная аппроксимация кривой
[ редактировать ]Программы нелинейной аппроксимации кривой, такие как анализ данных равновесного связывания (EBDA) и LIGAND, используются для расчета оценок параметров связывания на основе экспериментов по насыщению и конкурентному связыванию. [ 16 ] EBDA выполняет первоначальный анализ, который преобразует измеренную радиоактивность в молярные концентрации и создает наклоны Хилла и преобразования Скэтчарда на основе данных . Анализ, проведенный EBDA, затем может быть использован LIGAND для оценки указанной модели связывания. [ 16 ]
Обязательная конкуренция
[ редактировать ]Конкурентное связывание используется для определения наличия селективности в отношении конкретного лиганда для подтипов рецепторов, что позволяет определить плотность и долю каждого подтипа в ткани. [ 7 ] Кривые конкуренции получают путем построения графика специфического связывания, которое представляет собой процент от общего связывания, в зависимости от логарифмической концентрации конкурирующего лиганда. [ 7 ] Крутая кривая конкуренции обычно указывает на связывание с одной популяцией рецепторов, тогда как пологая кривая или кривая с четкими точками перегиба указывает на множественные популяции сайтов связывания. [ 16 ]
Анализы нерадиоактивного связывания
[ редактировать ]Несмотря на различные методы, используемые для нерадиоактивных анализов, они требуют, чтобы лиганды проявляли аналогичные характеристики связывания с их радиоактивным эквивалентом. Таким образом, результаты как нерадиоактивных, так и радиоактивных анализов останутся неизменными. [ 5 ] Одно из самых больших различий между анализами радиоактивных и нерадиоактивных лигандов связано с опасностью для здоровья человека. Радиоактивные анализы вредны, поскольку при них образуются радиоактивные отходы; тогда как в анализах нерадиоактивных лигандов используется другой метод, позволяющий избежать образования токсичных отходов. Эти методы включают, помимо прочего, поляризацию флуоресценции (FP), резонансный перенос энергии флуоресценции (FRET) и поверхностный плазмонный резонанс (SPR). Для измерения процесса связывания лиганда с рецептором большинство нерадиоактивных методов требуют, чтобы маркировка не мешала молекулярным взаимодействиям. [ 5 ]
Поляризация флуоресценции
[ редактировать ]Поляризация флуоресценции (FP) является синонимом анизотропии флуоресценции . Этот метод измеряет изменение скорости вращения лиганда, меченного флуоресцентной меткой, после его связывания с рецептором. [ 5 ] Поляризованный свет используется для возбуждения лиганда и измеряется количество излучаемого света. [ 5 ] Деполяризация излучаемого света зависит от того, связан ли лиганд (например, с рецептором). Если лиганд несвязан, он будет иметь сильную деполяризацию (лиганд сможет быстро вращаться, вращая свет). Если лиганд связан, совокупный больший размер приводит к более медленному вращению и, следовательно, к уменьшению деполяризации. [ 5 ] Преимущество этого метода в том, что он требует только одного этапа маркировки. Однако этот метод менее точен при низких наномолярных концентрациях. [ 5 ]
Кинетический анализ исключения
[ редактировать ]Анализ кинетического исключения (KinExA) измеряет свободный (несвязанный) лиганд или свободный рецептор, присутствующий в смеси лиганда, рецептора и комплекса лиганд-рецептор. Измерения позволяют количественно оценить концентрацию активного лиганда и константы связывания (равновесие, скорость включения и выключения) взаимодействия. [ 17 ]
Резонансный перенос энергии флуоресценции
[ редактировать ]
Флуоресцентно-резонансная передача энергии (FRET) использует энергию, передаваемую между молекулами-донорами и молекулами-акцепторами, находящимися в непосредственной близости. [ 5 ] FRET использует флуоресцентно-меченный лиганд, как и FP. [ 5 ] Передача энергии внутри FRET начинается с возбуждения донора. [ 5 ] Диполь -дипольное взаимодействие между донором и молекулой-акцептором передает энергию от донора к молекуле-акцептору. [ 5 ] Если лиганд связан с комплексом рецептор-антитело, то акцептор будет излучать свет. [ 5 ] При использовании FRET крайне важно, чтобы между акцептором и донором было расстояние менее 10 нм, а также перекрывающийся спектр поглощения между акцептором и донором, и чтобы антитело не мешало и не блокировало сайт связывания лиганда. [ 5 ]
Поверхностный плазмонный резонанс
[ редактировать ]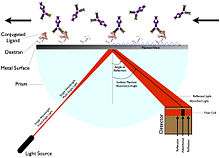
Поверхностный плазмонный резонанс (ППР) не требует маркировки лиганда. [ 5 ] Вместо этого он работает, измеряя изменение угла, под которым поляризованный свет отражается от поверхности ( показатель преломления ). [ 5 ] Угол связан с изменением массы или толщины слоя, например, с иммобилизацией лиганда, изменяющей угол резонанса, что увеличивает отраженный свет. [ 5 ] Устройство, для которого рассчитывается SPR, включает в себя сенсорный чип, проточную ячейку, источник света, призму и детектор положения с фиксированным углом. [ 5 ]
Жидкофазные анализы связывания
[ редактировать ]Иммунопреципитация
[ редактировать ]Жидкофазный лиганд-связывающий анализ иммунопреципитации (ИП) — это метод, который используется для очистки или обогащения конкретного белка или группы белков с использованием антитела из сложной смеси. Экстракт разрушенной ткани или клеток смешивают с антителом против интересующего антигена, в результате чего образуется комплекс антиген-антитело. [ 18 ] Когда концентрация антигена низкая, осаждение комплекса антиген-антитело может занять часы или даже дни, и становится трудно выделить небольшое количество образовавшегося осадка. [ 18 ]
Иммуноферментный анализ ( ИФА ) или вестерн-блоттинг — это два разных способа получения и анализа очищенного антигена (или нескольких антигенов). Этот метод включает очистку антигена с помощью прикрепленного антитела на твердой (шариковой) подложке, такой как агарозная смола. [ 19 ] Иммобилизованный белковый комплекс может быть получен либо в одну стадию, либо последовательно. [ 19 ]
IP также можно использовать в сочетании с мечением биосинтетических радиоизотопов. Используя эту комбинацию методов, можно определить, синтезируется ли конкретный антиген тканью или клеткой. [ 18 ]
Твердофазные анализы связывания
[ редактировать ]Многолуночный планшет
[ редактировать ]
Многолуночные планшеты представляют собой несколько чашек Петри, объединенных в один контейнер, с количеством отдельных лунок от 6 до более 1536. Анализы в многолуночных планшетах удобны для работы с необходимыми дозами и повторами. [ 20 ] Существует широкий спектр типов пластин, которые имеют стандартизированную площадь основания, вспомогательное оборудование и системы измерения. [ 20 ] Электроды могут быть встроены в нижнюю часть планшетов для сбора информации в результате анализов связывания. [ 9 ] Связывающие реагенты иммобилизуются на поверхности электрода и затем могут быть проанализированы. [ 9 ]
Многолуночные планшеты производятся для того, чтобы позволить исследователям создавать и манипулировать различными типами анализов (т. е. биоанализами , иммуноанализами и т. д.) внутри каждого многолуночного планшета. [ 20 ] Из-за различий в форматировании многолуночных планшетов нередко возникают артефакты. Артефакты возникают из-за различной среды в разных лунках планшета, особенно вблизи краев и центра лунок. Такие эффекты известны как эффекты колодцев, краевые эффекты и эффекты пластин. Таким образом, подчеркивается необходимость правильного размещения образцов анализа как внутри, так и между каждым планшетом. [ 20 ]
Многолуночные планшеты часто используются при измерении активности биологических анализов in vitro или при измерении иммунореактивности с помощью иммуноанализов. [ 20 ] Артефактов можно избежать, поддерживая однородность планшета, применяя одну и ту же дозу конкретной среды в каждой лунке, а также поддерживая атмосферное давление и температуру для снижения влажности. [ 20 ]
Переплет на бусинах
[ редактировать ]Анализы связывания лигандов на шариках представляют собой методы выделения основных белков, ДНК/РНК или других биомолекул, находящихся в неопределенных суспензиях, и могут использоваться во многих биохроматографических приложениях. Биоаффинные лиганды ковалентно связаны с шариками кремнезема с концевыми отрицательно заряженными силанольными группами или шариками полистирола и используются для выделения и очистки основных белков или адсорбции биомолекул. После связывания разделение осуществляется центрифугированием (разделение по плотности) или притяжением магнитного поля (только для магнитных частиц). Гранулы можно промывать, чтобы обеспечить чистоту выделенной молекулы, прежде чем растворять ее методами ионного обмена. Методы прямого анализа, основанные на ферментативном/флуоресцентном обнаружении (например, HRP, флуоресцентный краситель), можно использовать для определения на гранулах или количественного определения связанных биомолекул. [ 21 ] [ 22 ] [ 23 ]
Привязка на столбце
[ редактировать ]Фильтр
[ редактировать ]Фильтрационные анализы представляют собой твердофазный анализ связывания лигандов, в котором используются фильтры для измерения сродства между двумя молекулами. В анализе связывания фильтров фильтры используются для улавливания клеточных мембран путем всасывания среды через них. [ 8 ] Этот быстрый метод осуществляется с высокой скоростью, при которой можно добиться фильтрации и извлечения найденной фракции. [ 24 ] Промывка фильтров буфером удаляет остаточные несвязанные лиганды и любые другие присутствующие лиганды, которые могут быть вымыты из мест связывания. [ 8 ] Комплексы рецептор-лиганд, присутствующие во время промывания фильтра, не будут существенно диссоциировать, поскольку они будут полностью улавливаться фильтрами. [ 8 ] Характеристики фильтра важны для каждой выполняемой работы. Более толстый фильтр полезен для более полного улавливания мелких кусочков мембраны, но может потребовать более длительного времени промывки. [ 8 ] Рекомендуется предварительно обработать фильтры, чтобы задержать отрицательно заряженные части мембраны. [ 8 ] Замачивание фильтра в растворе, который придает фильтру положительный поверхностный заряд, притягивает отрицательно заряженные фрагменты мембраны. [ 8 ]
Привязка ячеек в реальном времени
[ редактировать ]В этом типе анализа связывание лиганда с клетками отслеживается с течением времени. Полученный сигнал пропорционален количеству лигандов, связанных с целевой структурой, часто рецептором, на поверхности клетки. Информацию о взаимодействии лиганд-мишень получают из изменения сигнала во времени, и кинетические параметры, такие как константа скорости ассоциации k a , константа скорости диссоциации k d и аффинность K D. можно рассчитать [ 25 ] Измеряя взаимодействие непосредственно на клетках, не требуется выделения целевого белка, что в противном случае может быть затруднительно, особенно для некоторых мембранных белков. [ 26 ] Чтобы гарантировать измерение взаимодействия с намеченной целевой структурой, рекомендуется использовать соответствующие биологические средства контроля, такие как клетки, не экспрессирующие целевую структуру.
Измерения в реальном времени с использованием подходов без меток или на основе меток использовались для анализа биомолекулярных взаимодействий на фиксированных или живых клетках. [ 27 ] [ 28 ]
Преимущество измерения взаимодействий лиганд-рецептор в режиме реального времени заключается в том, что для точного определения аффинности не требуется достигать равновесия связывания. [ 29 ]
Специфичность привязки
[ редактировать ]Эффекты лекарств являются результатом их селективности связывания со свойствами макромолекул организма или сродства, с которым различные лиганды связываются с субстратом. [ 30 ] Более конкретно, специфичность и селективность лиганда по отношению к соответствующему рецептору дает исследователям возможность изолировать и вызывать определенные эффекты лекарств путем манипулирования концентрацией лигандов и плотностью рецепторов. [ 30 ] Гормоны и нейротрансмиттеры являются важными эндогенными регуляторными лигандами, влияющими на физиологические рецепторы организма. [ 30 ] Лекарства, действующие на эти рецепторы, невероятно избирательны и вызывают необходимые реакции сигнальных молекул. [ 30 ]
Специфическое связывание относится к связыванию лиганда с рецептором, и возможно, что для одного лиганда существует более одного сайта специфического связывания. [ 31 ] Неспецифическое связывание относится к связыванию лиганда с чем-то иным, чем назначенный ему рецептор, например с различными другими рецепторами или различными типами переносчиков в клеточной мембране. [ 31 ] Например, различные антагонисты могут связываться с рецепторами нескольких типов. В случае мускариновых антагонистов они также могут связываться с гистаминовыми рецепторами. [ 31 ] Такие схемы связывания технически считаются специфичными, поскольку место назначения лиганда специфично для нескольких рецепторов. Однако исследователи, возможно, не уделяют особого внимания такому поведению по сравнению с другими связывающими факторами. [ 31 ] Тем не менее, поведение неспецифического связывания является очень важной информацией, которую необходимо получить. Эти оценки измеряются путем изучения того, как лиганд связывается с рецептором, одновременно реагируя на замещающий агент (антагонист), который предотвращает возникновение специфического связывания. [ 31 ]
Специфические типы связывания для взаимодействия лигандов и рецепторов: [ 30 ]
| Имитирует эндогенные эффекты | Подавляет эндогенные эффекты |
|---|---|
| Агонист | Антагонист |
| Частичный агонист | Негативные антагонисты (см.: Обратный агонист ) |
Технологические достижения
[ редактировать ]Технологии анализа связывания лигандов продолжают развиваться, что связано с увеличением скорости и сохранением экономичности процедур при сохранении и повышении точности и чувствительности. [ 9 ] Некоторые технологические достижения включают новые связывающие реагенты в качестве альтернативы антителам. [ 9 ] альтернативные растворы красителей и системы микропланшетов, а также разработка метода пропуска этапа фильтрации, который требуется во многих процессах анализа связывания лигандов. [ 16 ]
Значимой сигнальной молекулой в клетках является кальций (Ca 2+ ), который можно обнаружить с помощью ацетоксиметилового красителя Fluo-4 . Он связывается со свободным Ca 2+ ионы, которые, в свою очередь, немного увеличивают флуоресценцию Fluo-4 AM. [ 16 ] Недостаток красителя Fluo-4 заключается в том, что для удаления внеклеточного красителя требуется этап промывания, что может давать нежелательные фоновые сигналы. Например, промывание создает дополнительную нагрузку на клетки, а также отнимает время, что мешает своевременному проведению анализа. [ 16 ] Недавно была разработана альтернативная система с раствором красителя и микропланшета под названием FLIPR® (считыватель флуорометрических планшетов), в которой используется реагент для анализа кальция 3, не требующий этапа промывания. В результате изменение флуоресценции красителя можно наблюдать в режиме реального времени без задержки с помощью возбуждающего лазера и устройства с зарядовой связью . [ 16 ]
Многие анализы связывания лигандов требуют этапа фильтрации для разделения связанных и несвязанных лигандов перед скринингом. метод под названием «Сцинтилляционный анализ близости» Недавно был разработан (SPA), который исключает этот важный этап. Он действует через шарики кристаллической решетки, которые покрыты молекулами, связывающими лиганды, и заполнены ионами церия . При стимуляции изотопом они испускают вспышки света, которые легко измерить. Лиганды метят радиоактивным изотопом 3H или 125I и вводят в анализ. Поскольку только радиолиганды, которые непосредственно связываются с гранулами, инициируют сигнал, свободные лиганды не мешают процессу скрининга. [ 16 ]
Ограничения
[ редактировать ]
По своей природе анализы должны проводиться в контролируемой среде in vitro, поэтому этот метод не дает информации о связывании рецепторов in vivo. Полученные результаты могут только подтвердить, что конкретный лиганд соответствует рецептору, но анализы не дают возможности узнать распределение лиганд-связывающих рецепторов в организме.
Связывание лигандов и распределение рецепторов in vivo можно изучить с помощью позитронно-эмиссионной томографии (ПЭТ), которая работает путем индукции радионуклида в лиганд, который затем высвобождается в организм изучаемого организма. Радиомеченные лиганды пространственно локализуются с помощью ПЭТ-сканера, чтобы выявить области в организме с высокой концентрацией рецепторов. [ 16 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Лаки Дж.А., Дроссман Х., Костичка Т., Смит Л.М. (1993). «Высокоскоростное секвенирование ДНК методом капиллярного гель-электрофореза» . Часть I. Рекомбинантная ДНК . Методы энзимологии. Том. 218. стр. 154–72. дои : 10.1016/0076-6879(93)18014-4 . ISBN 9780121821197 . ПМИД 8510530 .
- ^ Нинфа А.Дж., Баллоу Д.П., Бенор М., ред. (2010). Фундаментальные лабораторные подходы к биохимии и биотехнологии . Дирборн, Мичиган: Мичиганский университет.
- ^ Муллис К.Б., Фалуна Ф.А. (1987). «Специфический синтез ДНК in vitro посредством цепной реакции, катализируемой полимеразой». Рекомбинантная ДНК, часть F. Методы энзимологии. Том. 155. С. 335–50. дои : 10.1016/0076-6879(87)55023-6 . ISBN 9780121820565 . ПМИД 3431465 .
- ^ Ситтампалам Г.С., Каль С.Д., Янзен В.П. (октябрь 1997 г.). «Высокопроизводительный скрининг: достижения в области аналитических технологий». Современное мнение в области химической биологии . 1 (3): 384–91. дои : 10.1016/S1367-5931(97)80078-6 . ПМИД 9667878 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р де Йонг Л.А., Угес Д.Р., Франке Дж.П., Бишофф Р. (декабрь 2005 г.). «Анализ связывания рецептора с лигандом: технологии и приложения». Журнал хроматографии. Б. Аналитические технологии в биомедицине и науках о жизни . 829 (1–2): 1–25. дои : 10.1016/j.jchromb.2005.10.002 . ПМИД 16253574 .
- ^ Джозеф Р. Лакович. (1991) Темы флуоресцентной спектроскопии: биохимические приложения.
- ^ Jump up to: а б с д и ж г час я дж Давенпорт А.П., Рассел Ф.Д. (1996). «Анализ связывания радиолигандов: теория и практика». В Стивене Дж. Мэзере (ред.). Современные направления радиофармацевтических исследований и разработок . Спрингер Нидерланды. стр. 169–179. ISBN 978-94-010-7289-2 .
- ^ Jump up to: а б с д и ж г Халм ЕС, Треветик Массачусетс (ноябрь 2010 г.). «Анализ связывания лигандов при равновесии: проверка и интерпретация» . Британский журнал фармакологии . 161 (6): 1219–37. дои : 10.1111/j.1476-5381.2009.00604.x . ПМЦ 3000649 . ПМИД 20132208 .
- ^ Jump up to: а б с д и ж г час Хан М.Н., Финдли Дж.В., ред. (2009). Разработка, валидация и внедрение лиганд-связывающих анализов в области разработки лекарств . Хобокен, Нью-Джерси: John Wiley & Sons. ISBN 978-0470541494 .
- ^ «ЛОИС ЛАБ» . ЛОИС ЛАБОРАТОРИЯ . Проверено 30 января 2024 г.
- ^ Хуан, Тин-Хао; Нисман, Питер; Арасу, Дипшика; Ли, Донхён; Де Ла Круз, Обри Л.; Кальехас, Антука; Хонг, Элизабет Дж.; Лоис, Карлос (12 декабря 2017 г.). «Отслеживание нейрональных цепей у трансгенных животных с помощью транснейронального контроля транскрипции (TRACT)» . электронная жизнь . 6 : е32027. doi : 10.7554/eLife.32027 . ISSN 2050-084X . ПМЦ 5777821 . ПМИД 29231171 .
- ^ Хуан, Тин-Хао; Нисман, Питер; Арасу, Дипшика; Ли, Донхён; Де Ла Круз, Обри Л.; Кальехас, Антука; Хонг, Элизабет Дж.; Лоис, Карлос (12 декабря 2017 г.). «Отслеживание нейрональных цепей у трансгенных животных с помощью транснейронального контроля транскрипции (TRACT)» . электронная жизнь . 6 : е32027. doi : 10.7554/eLife.32027 . ISSN 2050-084X . ПМЦ 5777821 . ПМИД 29231171 .
- ^ Jump up to: а б Поллард Т.Д. (декабрь 2010 г.). «Руководство по простым и информативным анализам связывания» . Молекулярная биология клетки . 21 (23): 4061–7. дои : 10.1091/mbc.e10-08-0683 . ПМЦ 2993736 . ПМИД 21115850 .
- ^ Офферманс С., Вальтер Розенталь, ред. (2008). Энциклопедия молекулярной фармакологии (2-е изд.). Берлин: Шпрингер. п. 585. ИСБН 9783540389163 .
- ^ Jump up to: а б с Каль С.Д., Ситтампалам Г.С., Вайднер Дж. (май 2012 г.). «Расчеты и приборы, используемые для анализов связывания радиолигандов» . Руководство по проведению анализа : 1–21. ПМИД 22553868 .
- ^ Jump up to: а б с д и ж г час я Давенпорт АП (2005). Методы связывания рецепторов . Хумана Пресс. стр. 18–19, 101–102, 121–122, 203–204. ISBN 978-1-58829-420-3 .
- ^ Дарлинг, Райан Дж; Бро, Пьер-Александр (2004). «Технология кинетического исключения анализа: характеристика молекулярных взаимодействий» . АНАЛИЗА и технология разработки лекарств . 2 (6): 647–657.
- ^ Jump up to: а б с Голдсби РА (2003). Иммунология (5е изд.). Нью-Йорк: WH Freeman. п. 152 . ISBN 978-0716749479 .
- ^ Jump up to: а б «Техническое руководство и протоколы по иммунопреципитации (ИП)» (PDF) . Thermo Fisher Scientific Inc. Архивировано из оригинала (PDF) 24 марта 2014 года . Проверено 20 марта 2014 г.
- ^ Jump up to: а б с д и ж Робинсон С.Дж., Садик М., Деминг С.Н., Эстдейл С., Бергельсон С., Литтл Л. (январь 2014 г.). «Критерии приемлемости анализа для анализов биологической активности на основе многолуночных планшетов». БиоПроцесс Интернэшнл . 12 (1): 30–41.
- ^ «SIMAG Basic: Магнитные нано- и микрочастицы» .
- ^ «SIMAG Affinity: Магнитные нано- и микрочастицы от Chemicell» .
- ^ «Главная страница — Accelero® Bioanalytics GMBH» .
- ^ Мосс Т., изд. (2001). «Анализ связывания фильтра». ДНК-белковые взаимодействия: принципы и протоколы (2-е изд.). Тотова, Нью-Джерси: Humana Press. стр. 1–12. ISBN 9780896036710 .
- ^ Бондза С., Фой Э., Брукс Дж., Андерссон К., Робинсон Дж., Ришале П., Буйс Дж. (2017). «Характеристика связывания антител с рецепторами живых иммунных клеток в реальном времени» . Границы в иммунологии . 8 : 455. дои : 10.3389/fimmu.2017.00455 . ПМК 5401896 . ПМИД 28484455 .
- ^ Смит С.М. (2011). «Стратегии очистки мембранных белков». Белковая хроматография . Методы молекулярной биологии. Том. 681. Хумана Пресс. стр. 485–96. дои : 10.1007/978-1-60761-913-0_29 . hdl : 2262/72470 . ISBN 9781607619123 . ПМИД 20978985 .
- ^ Ван В., Инь Л., Гонсалес-Малерва Л., Ван С., Юй Икс, Итон С. и др. (октябрь 2014 г.). «Кинетика связывания лекарственного средства с рецептором in situ в отдельных клетках: количественное исследование устойчивости к противоопухолевым лекарствам без меток» . Научные отчеты . 4 (1): 6609. Бибкод : 2014NatSR...4E6609W . дои : 10.1038/srep06609 . ПМК 4196117 . ПМИД 25312029 .
- ^ Бьёркелунд Х., Гедда Л., Барта П., Мальмквист М., Андерссон К. (12 сентября 2011 г.). «Гефитиниб индуцирует димеры рецепторов эпидермального фактора роста, что изменяет характеристики взаимодействия с ¹²⁵I-EGF» . ПЛОС ОДИН . 6 (9): e24739. Бибкод : 2011PLoSO...624739B . дои : 10.1371/journal.pone.0024739 . ПМК 3171474 . ПМИД 21931838 .
- ^ Сюй Б, Варасте З, Орлова А, Андерссон К, Лархаммар Д, Бьоркелунд Х (ноябрь 2013 г.). «Обнаружение взаимодействия лигандов с рецепторами, связанными с G-белком, на живых клетках в режиме реального времени» . Связь с биохимическими и биофизическими исследованиями . 441 (4): 820–4. дои : 10.1016/j.bbrc.2013.10.149 . ПМИД 24211197 .
- ^ Jump up to: а б с д и Гудман и Гилман «Фармакологические основы терапии» . The McGraw Hill Companies Inc., 1996. стр. 29–37. ISBN 978-0-07-026266-9 .
- ^ Jump up to: а б с д и Хейлетт Д.Г. (2003). «Прямое измерение связывания лекарств с рецепторами». В Foreman JC, Johansen T (ред.). Учебник рецепторной фармакологии (второе изд.). Бока-Ратон, Флорида: CRC LLC, стр. 153–180. ISBN 978-0849310294 .
