2,5-десикопиперазин
статьи Ведущий раздел , возможно, потребуется переписать . Причина приведена: эта статья не о составном 2,5-дикетопиперазине, а в группе из 2,5-дикетопиперазинов. ( Июнь 2024 г. ) |

| |
| Имена | |
|---|---|
| Имя IUPAC
2.5-Piperazedione
| |
| Предпочтительное имя IUPAC
Пипазин-2,5-дион | |
| Другие имена
Циклические дипептиды, циклодипептиды, DKP, CDPS 2,5 диоксопиперазины (DOPS), дипептидные ангидриды
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 3dmet | |
| 112112 | |
| Чеби | |
| Химический | |
| Chemspider | |
| ЕС номер |
|
| 217756 | |
| Кегг | |
PubChem CID
|
|
| НЕКОТОРЫЙ | |
| Характеристики | |
| C 4 H 6 N 2 O 2 | |
| Молярная масса | 114.104 g·mol −1 |
| Точка плавления | 311–312 ° C (592–594 ° F; 584–585 K) |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
2,5-дикетопиперазин является органическим соединением с формулой (NHCH 2 C (O)) 2 . Соединение имеет кольцо с шестьючковых, содержащее две амидные группы в противоположных положениях на кольце. Впервые это было соединение, содержащее пептидную связь, которая была характеризуется рентгеновской кристаллографией в 1938 году. [ 1 ] Это родитель большого класса из 2,5-дикетопиперазинов ( 2,5-дкп ) с формулой (nhch 2 (r) c (o)) 2 (r = h, ch 3 и т. Д.). Это вездесущий пептид в природе. Они часто встречаются в ферментационных бульонах и дрожжевых культурах, а также встроены в более крупные более сложные архитектуры в различных натуральных продуктах , а также в нескольких лекарствах. [ 2 ] Кроме того, они часто производятся в виде продуктов деградации полипептидов , особенно в обработанных продуктах и напитках. [ 3 ] Они также были идентифицированы в содержимое кометов . [ 4 ]
Появление как натуральные продукты
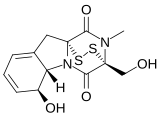
[ редактировать ]Существует широко распространенное появление 2,5-дикетопиперазинного ядра в биологически активных натуральных продуктах. Наиболее структурно разнообразные 2,5-дикетопиперазиновые натуральные продукты основаны на триптофане и пролине , модифицированных гетероциклизацией и добавлением изопенила. Они варьируются от гепатоксического бревианамида F (цикло ( L -trp- l -pro)) до индулированного треморогенного веррукугеного и спиротростатина B , который представляет многообещающий класс антимитотических агентов остановки, структурно сложно (+)- Стехасидин. A, мостовой 2,5-дикетопиперазин, который обладает уникальной системой кольцевой кольцевой кольцевой кольцевой кольцевой кольца Diazaoctane и активна против клеточной линии HCT-116 человека . [ 2 ]
- Биологически активные триптофан-пролин 2,5-дикетопиперазиновые натуральные продукты
-
(+) Стехасидин а
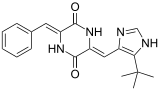
Другие мостики 2,5-дикетопиперазины включают бицикломицин , антибактериальный агент, используемый в качестве пищевых добавок для предотвращения диареи у животных, в то время как производные тио, такие как цитотоксический мостовой эпиполитиодиоксопиперазин, представлены глиотоксином . Ненасыщенные производные иллюстрируются фенилахистином противораковым микротрубочками , связывающим микротрубочками и микотоксином Roquefortine C, обнаруженным в синих сырах. [ 2 ]
- Другие биологически активные 2,5-дикетопиперазиновые натуральные продукты
Появление в продуктах и напитках
[ редактировать ]2,5-дикетопиперазины часто образуются при химической и термической обработке пищи и напитков в качестве продуктов разложения полипептидов. Они были обнаружены в тушеной говядине, пиве, хлебе, авамори спиртах , какао, куриной эссенции, жареным кофе, сыре улов , сушеном кальмаре, старом саки и дрожже. В пищевых системах было показано, что 2,5-дикетопиперазины являются важными сенсорными соединениями, способствующими вкусу конечных продуктов и воспринимаются как вяжущие , соленые, зернистые, металлические или горькие. Хотя они варьируются от пролина, ароматического, алифатического до полярных 2,5-дикетопиперазинов, пролин 2,5-дикетопиперазины являются наиболее распространенными и структурно разнообразными 2,5-дикетопиперазинами, обнаруженными в пище. Производный валин цикло ( L -Val -L -Pro) в концентрации 1742 часа млн. PPM был идентифицирован как самый важный горький 2,5 -дикетопиперазин, способствующий горькому вкусу жареного какао. Он также был обнаружен как один из основных 2,5-дикетопиперазинов в экстракте дрожжевой экстракта и тушеной говядины, а также присутствует в куриной сущности и кофе. [ 3 ] Он также был выделен из различных морских микроорганизмов и был идентифицирован как активная молекула сигнала , чувствительное к кворуму LASI , важную для роста растений Pseudomonas aeruginosa . [ 2 ] Наиболее изученным из всех простых 2,5-дикетопиперазинов является гистидилпролин-2,5-дикетопиперазин цикло ( L -HIS- l -Pro) [ 5 ] который находится в различных продуктах, с особенно высокими концентрациями в рыбных и рыбных продуктах. Он хорошо поглощается перорально и пересекает барьер крови-мранка посредством не насыщенного механизма. Это также происходит у людей [ 6 ] В качестве метаболита из тиротропин-рилизинг-гормона (TRH) и проявляет широкий спектр центральной нервной системы, эндокринной, электрофизиологической и сердечно-сосудистых эффектов. [ 5 ] Производные цикло (L-HIS-L-Pro) широко изучались для разработки терапевтических агентов для нейродегенерации . [ 7 ] [ 2 ]
Структура и конформация
[ редактировать ]Эти циклические дипептиды включают как донорские, так и акцепторные группы для водородных связей . Они конформационно ограничены почти плоскими каркасами. Разнообразие может быть введено на шести позициях, а стереохимия контролируется на четырех позициях. Они стабильны для протеолиза . Эти характеристики лежат в основе биологической активности и полезности в лекарственной химии. Как следствие их преобладающего биосинтетического происхождения из L -α -аминокислот, наиболее естественно встречающиеся 2,5 -DKPS настроены Cyclo ( L -XAA -l -AAA) в качестве изомеров . 2,5-DKPS Epimerize в основных, кислых и тепловых условиях. Состав цис и транс -изомеров в состоянии равновесия широко варьируется в зависимости от основной части боковых цепей, если присутствует кольцо (например, пролин ) или атомы азота алкилируются. Хотя эпимеризация была исторически проблемой в синтезе 2,5-DKP, недавно было разработано несколько легких методов, которые избегают эпимеризации. [ 2 ]
Биосинтез
[ редактировать ]2,5-DKP синтезируются различными организмами, включая людей. В целом, они возникают в результате действия тРНК-зависимых циклодипептид-синтаз , типа фермента, ответственного за создание циклической амидной связи между двумя пептидами. [ 8 ] Ферменты циклодипептид оксидаза и S-аденозилметионин-зависимых O/N метилтрансферазы ACT в тандеме для химического модификации циклических дипептидов. [ 8 ]
Синтез
[ редактировать ]2,5 -дикетопиперазины обычно готовится одним из трех методов: амидной связи n - алкилирование и C. ацилирование , образование

Амидная связь
[ редактировать ]Чаще всего 2,5-дикетопиперазины генерируются путем циклизации дипептидов. В дополнение ко многим методам синтеза пептидов , реакция UGI может быть применена. Дипептиды с эфирной термином самопроизвольно подвергаются велосипеде часто. Гистика может быть проблематичной. [ 9 ] Реакция UGI с использованием изонитрила, аминокислоты, альдегида и амина может вырабатывать дипептид с одинаково высоким выходом и оптической чистотой, к тому, что образуется стандартными пептидными муфтами. [ 10 ] Обычно изонитрил выбирается для того, чтобы дать лабильный терминал амида для обеспечения циклизации. Например, прямое образование кольца с 2,5-DKP через такую активированную группу покину n-замещенного 2,5-дикетопиперазина 7 . [ 11 ]
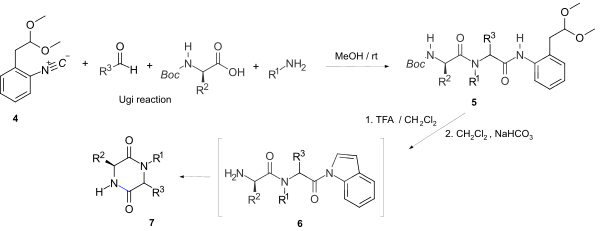
Мягкая кислотная и хемоселективная активация после UGI 5 , включающую одновременное образование индоламида и удаление TERT-бутоксикарбонила (BOC), дает активную амиду 6 , что позволяет циклизировать 7, не влияя на другие пептидические или даже эфирные мокроты и стереохимические удержание хиральных центров .
N -alkylation
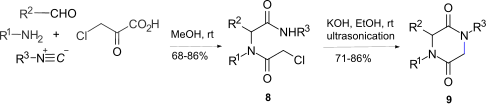
[ редактировать ]Внутримолекулярное амид -алкилирование амидов альфа -халоацетамида 8 с этанольным гидроксидом калия с использованием ультразвукового обеспечения дало 2,5 -дикетопиперазины 9 , где 8 было получено реакцией UGI [ 12 ] Между аминами, альдегидами, изоцианидами и хлоруксусной кислотой . Однако этот маршрут ограничен эпимеризацией в стереогенном центре и неспособностью получить 2,5-дикетопиперазиновое кольцо, если r 1 = Алкил.
C -Acylation
[ редактировать ]Образование 2,5-дикетопиперазинового кольца путем энолята ацилирования [ 13 ] Был использован при строительстве 2,5-дикетопиперазинового кольца в 11 путем внутримолекулярной циклизации энолята 10 на карбониле фенил- карбамата с получением 11 с выходом 90%.

Реакция
[ редактировать ]Реакционная способность при углероде (C-3 и C-6)
[ редактировать ]Регио- и стереоконтроллируемая C-функционализация 2,5-дикетопиперазинов в C-3 и C-6 включает энолят , радикальные и катионные предшественники (и N -ацилиминий-ион) и чувствительны к полярным и стерическим эффектам.
Алкилирование inolates
[ редактировать ]Алкилирование бистара - метоксибензила ( PMB ) защищено 2,5-DKP 1 с использованием основания LHMD и алкил бромид R 1 Br, дал моно -алкилированное производное 2 , которое при дальнейшем алкилировании дало симметричную транс -диспубленную производную 3

Галогенирование и смещение
[ редактировать ]3-монобромиды 6 и 3,6-дибромиды 5 приготовлены из бензил-защищенного 2,5-DKP 4 путем радикального галогенирования с N-бромсукцинимидом в тетрахлориде углерода. Смещение этих лабильных бромидов легко возникает с диапазоном нуклеофилов SR, OR, NR2, алкила и арила, чтобы получить 7 . [ 2 ]

Альдол дополнение
[ редактировать ]Одна или двукратная Aldol конденсация N- ацетилированного 2,5-DKP 8 дает доступ к 3-дегидро-2,5-дикетопиперазинам 9 и 3,6-дидегидро-2,5-дикетопиперазины 10 и конденсацию 8 может контролировать поэтапным образом, используя триэтиламин в диметилформамиде, чтобы получить несимметричный 3,6-дидегидро-2,5-дикетопиперазины 10 (R 1 = С 1 , Р 2 = С 2 ). [ 2 ]

Реакционная способность в азоте
[ редактировать ]Алкилирование
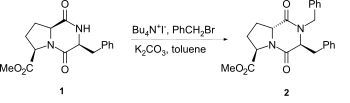
[ редактировать ]Наиболее распространенный метод алкилирования азота лактама 2,5-дикетопиперазинов основан на использовании гидрида натрия в качестве основания. Однако эпимеризация может возникнуть, особенно с пролиновыми 2,5-дикетопиперазинами, даже с более мягкими методами, такими как в условиях катализатора фазы, например, от 1 до 2 . [ 2 ]
Реактивность в карбонильных углеродах (C-2 и C-5)
[ редактировать ]Снижение
[ редактировать ]Снижение карбонильных групп хирального 2,5-дикетопиперазина с гидридом алюминия лития (Lialh 4 ) чисто дает соответствующие хиральные пиперазины . Например, цикло ( L -фе -l -фе) 1 дает хиральный пиперазин (2 с , 5 с ) -дибензилпиперазин 2. [ 14 ]

Синтез дигидропиразина и пиразина
[ редактировать ]Реакция из лактам, полученных из энол фосфатов 4 из 2,5-дикетопиперазинов с катализируемыми палладиевыми реакциями (восстановление, сузуки и реакции перекрестного связывания), позволяет синтез ряд функционализированных 1,4-дигидропиразинов 5 , которые могут ароматизировать до 1 функционализированных 1,4-дигидропиразинов. , 4- пиразины 6 в присутствии кислоты. [ 15 ]

Биологические функции
[ редактировать ]Было показано, что 2,5-DKP играют роль в межвидовом чувствительном кворуме . Например, было показано, что цикло 2,5-DKP (PHE-PRO) играет роль в регуляции экспрессии генов у разных различных видов бактерий, включая V. Fishceri, V. Holera , Lactobacillus reuteri , Staphylococcus aureus , среди другие [ 8 ]
Приложения
[ редактировать ]Терапия
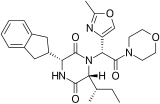
[ редактировать ]Многочисленные натуральные и синтетические 2,5-дкп биологически активны . Эти небольшие, конформационно жесткие, хиральные шаблоны имеют множественную функциональность акцептора и доноров H-связки и имеют несколько сайтов для структурной разработки разнообразных функциональных групп с определенной стереохимией. Эти характеристики не только позволяют им связываться с высокой аффинностью с большим разнообразием рецепторов, демонстрируя широкий спектр биологической активности, но и позволяет развивать лекарственные физико-химические свойства, необходимые для процесса многообъясняющей оптимизации лекарственный продукт. Структурная взаимосвязь (SAR) была изучена для многих из этих 2,5-DKP-шаблонов, и некоторые из них были разработаны в клинические препараты. These include tadalafil (a PDE5 inhibitor for erectile dysfunction ), retosiban (an oxytocin antagonist for preterm labor ), aplaviroc (a CCR5 antagonists for HIV ), epelsiban (an oxytocin antagonist for premature ejaculation ) and the experimental cancer drug Плинабулин (NPI-2358/KPU-2), который активно активен в многочисленных (MDR) опухолевых клеточных линиях. [ 2 ]
- 2,5-дикетопиперазиновая терапия
Благодаря своей роли в бактериальной общении 2,5-DKPS может использоваться в качестве лекарства для лечения бактериальных заболеваний. Например, цис было показано, что -цикло 2,5-DKP (LEU-TYR) ингибирует образование бактериальной биопленки; Это свойство может быть использовано для лечения инфекций, вызванных образованием бактериальной биопленки. Эти химические вещества могут быть использованы для имитации сигналов для определения кворума для регуляции экспрессии генов патогенных бактерий и помогать борьбе с бактериальной инфекцией. [ 8 ]
Реагенты
[ редактировать ]Дикетопиперазин получает из глицилсерина является реагентом для приготовления C-алкилированных производных глицина. Этот подход полезен для производства неестественных аминокислот со стереохимическим контролем. Дикетопиперазиновый скелет защищает как N, так и O термина глицина. Для этого применения дикетопиперазин O -алкилируется сопутствующей N -депротонацией, чтобы дать то, что называется реагентом Schöllkopf . [ 16 ]
Ссылки
[ редактировать ]- ^ Кори Р.Б. (июль 1938 г.). «Кристаллическая структура дикетопиперазина». Журнал Американского химического общества . 60 (7): 1598–1604. doi : 10.1021/ja01274a023 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж Бортвик объявление (май 2012 г.). «2,5-дикетопиперазины: синтез, реакции, лекарственная химия и биологически активные натуральные продукты». Химические обзоры . 112 (7): 3641–3716. doi : 10.1021/cr200398y . PMID 22575049 .
- ^ Jump up to: а беременный Borthwick Ad, Da Costa NC (2017). «2,5-дикетопиперазины в пище и напитках: вкус и биологическая активность». Критические обзоры в области питания и питания . 57 (4): 718–742. doi : 10.1080/10408398.2014.911142 . PMID 25629623 . S2CID 1334464 .
- ^ Shimoyama A, Ogasawara R (апрель 2002 г.). «Дипептиды и дикетопиперазины в ямато-791198 и углеродистых хондритах Murchison». Происхождение жизни и эволюции биосферы . 32 (2): 165–179. Bibcode : 2002oleb ... 32..165s . doi : 10.1023/a: 1016015319112 . PMID 12185674 . S2CID 21283306 .
- ^ Jump up to: а беременный Minelli A, Bellezza I, Grottelli S, Galli F (август 2008 г.). «Сосредоточьтесь на цикло (HIS-PRO): История и перспективы как антиоксидант-пептид». Аминокислоты . 35 (2): 283–289. doi : 10.1007/s00726-007-0629-6 . PMID 18163175 . S2CID 22563583 .
- ^ Прасад С (декабрь 1995). «Биоактивные циклические дипептиды». Пептиды . 16 (1): 151–164. doi : 10.1016/0196-9781 (94) 00017-z . PMID 7716068 . S2CID 44314137 .
- ^ Cornacchia C, Hunter I, Baldassarre L, Crumb A, Feliciani F, Pinnen F (январь 2012 г.). «Дикетопиперазины как нейропротекторные агенты». Мини -обзоры по лекарственной химии . 12 (1): 2–12. Doi : 10.2174/1389555712798868959 . PMID 22070690 .
- ^ Jump up to: а беременный в дюймовый Ilaria B (2014). «Циклические дипептиды: от жуков до мозга» . Тенденции в молекулярной медицине . 20 (10): 551–8. doi : 10.1016/j.molmed.2014.08.003 . PMID 25217340 .
- ^ Tullberg M, Grøtli M, Luthman K (июль 2006 г.). «Эффективный синтез 2, 5-дикетопиперазинов с использованием микроволнового отопления». Тетраэдр . 62 (31): 7484–7491. doi : 10.1016/j.tet.2006.05.010 .
- ^ Dömling A (январь 2006 г.). «Недавние разработки в многокомпонентных реакциях на основе изоцианидов в прикладной химии». Химические обзоры . 106 (1): 17–89. doi : 10.1021/cr0505728 . PMID 16402771 .
- ^ Rhoden CR, Rivera DG, Kreye O, Bauer AK, Westermann B, Wessjohann LA (октябрь 2009 г.). «Быстрый доступ к N-замещенным дикетопиперазинам с помощью One-Pot UGI-4CR/Destrotection+ активация/циклизация (UDAC)». Журнал комбинаторной химии . 11 (6): 1078–1082. doi : 10.1021/cc900106u . PMID 19795905 .
- ^ Marcaccini S, Pepino R, Pozo MC (апрель 2001 г.). «Облегченный синтез 2, 5-дикетопиперазинов на основе химии изоцианида». Тетраэдр буквы . 42 (14): 2727–2728. doi : 10.1016/s0040-4039 (01) 00232-5 .
- ^ Пенг Дж, Клайв Д.Л. (декабрь 2008 г.). «Асимметричный синтез системы ABC-кольца противоопухолевой антибиотики MPC1001». Журнал органической химии . 74 (2): 513–519. doi : 10.1021/jo802344t . PMID 19067592 .
- ^ Nail U, Menzel H, Lednor PW, Beck W, Guyot A, Bartholin M (май 1981). «Попытки, катализируемое Rhodium (I) асимметричным гидрированием α-ацетамидокиминовой кислоты с мономерами и полимерами аминофосси/родия (I) катализируемым асимметричным гидрогенированием α-ацетамидо коричневой кислоты с мономерными и полимерными аминофосфинами». Журнал естественных исследований б . 36 (5): 578–584. Doi : 10.1515/ZNB-1981-0510 . S2CID 95022362 .
- ^ Chainaud M, Gillaizeau I, Ouhamou N, Coudert G (август 2008 г.). «Новые основные моменты в синтезе и реакционной способности 1, 4-дигидропиразиновых производных». Тетраэдр . 64 (35): 8059–8066. doi : 10.1016/j.tet.2008.06.080 .
- ^ Вирт Т (1997). «Новые стратегии для α-алкилированных α-аминокислот». Angewandte Chemie International Edition на английском языке . 36 (3): 225–227. doi : 10.1002/anie.199702251 .