Формиат С-ацетилтрансфераза
| формиат С-ацетилтрансфераза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 2.3.1.54 | ||
| Номер CAS. | 9068-08-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
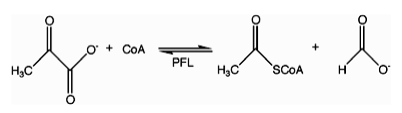
В энзимологии ( формиат С-ацетилтрансфераза пируватформиат лиаза ) ( EC 2.3.1.54 ) является ферментом . Пируватформиат-лиаза обнаружена в Escherichia coli. [ 1 ] и другие организмы . Он помогает регулировать анаэробный глюкозы метаболизм . Используя радикальную неокислительно-восстановительную химию, он катализирует обратимое превращение пирувата и кофермента-А в формиат и ацетил-КоА . Реакция происходит следующим образом:
Этот фермент принадлежит к семейству трансфераз , особенно к тем ацилтрансферазам, которые переносят группы, отличные от аминоацильных групп. Систематическое название этого класса ферментов — ацетил-КоА:формиат С-ацетилтрансфераза . Другие широко используемые названия включают пируватформиат-лиазу , пировиноградную формиат-лиазу и формиат-ацетилтрансферазу . Этот фермент участвует в трех метаболических путях : метаболизме пирувата , метаболизме пропаноата и метаболизме бутаноата .
Структурные исследования
[ редактировать ]По состоянию на конец 2007 года 8 структур для этого класса ферментов было решено PDB с кодами доступа 1CM5 , 1H16 , 1H17 , 1H18 , 1MZO , 1QHM , 2PFL и 3PFL .
Пируватформиат лиаза представляет собой гомодимер, 85 кДа и 759 остатков состоящий из субъединиц массой . Он имеет 10-нитевой бета-/альфа-бочонок , в который вставлен бета-пальец, содержащий основные каталитические остатки . Активный центр фермента, выявленный с помощью рентгеновской кристаллографии , содержит три незаменимые аминокислоты, которые осуществляют катализ ( Gly734 , Cys418 и Cys419), три основных остатка, которые удерживают рядом субстрат пируват ( Arg435 , Arg176 и Ala272 ), и два фланкирующих гидрофобных остатка ( Trp333 и Phe432 ). [ 2 ]
Исследования обнаружили структурное сходство между активным центром пируватформиатлиазы и ферментами рибонуклеотидредуктазы (RNR) класса I и класса III. [ 2 ] [ 3 ]
Механизм
[ редактировать ]Роль трех каталитических остатков
[ редактировать ]Было показано, что: [ 4 ] [ 5 ]
- Gly734 (глициловый радикал) - переносит радикал на Cys418 и выключает его через Cys419.
- Cys418 (тиильный радикал) - осуществляет химию ацилирования пирувата. по атому углерода карбонила
- Cys419 (тиильный радикал) - осуществляет атома водорода. перенос
Шаги
[ редактировать ]- Предлагаемый механизм пируватформиатлиазы начинается с радикального переноса от Gly734 к Cys418 через Cys419.
- Тиильный радикал Cys418 ковалентно присоединяется к C2 (второму атому углерода) пирувата, образуя промежуточное соединение ацетил-фермента (который теперь содержит радикал).
- Промежуточное соединение ацетил-фермента высвобождает формильный радикал, который подвергается переносу атома водорода с помощью Cys419. При этом образуются формиат и радикал Cys419.
- коэнзим-А поступает и подвергается переносу атома водорода с радикалом Cys419 с образованием радикала кофермента-А.
- Затем радикал коэнзима-А захватывает ацетильную группу у Cys418, образуя ацетил-КоА, оставляя после себя радикал Cys418.
- Пируватформиат-лиаза затем может подвергнуться радикальному переносу, чтобы вернуть радикал обратно на Gly734.
Обратите внимание, что каждый шаг обратим. [ 4 ] [ 5 ]
Регулирование
[ редактировать ]Два дополнительных фермента регулируют состояния «включено» и «выключено» пируватформиатлиазы, регулируя анаэробный метаболизм глюкозы: пируватформиатлиаза активаза (AE) и пируватформиатлиаза деактиваза. Активированная пируватформиат-лиаза позволяет образовывать ацетил-КоА, небольшую молекулу, важную для производства энергии, когда пируват доступен. Деактивированная пируватформиат-лиаза даже при наличии субстратов не катализирует реакцию.
Активаза пируватформиат-лиазы является частью суперсемейства радикалов SAM ( S-аденозилметионин ). Фермент включает пируватформиат-лиазу, превращая Gly734 (GH) в радикал Gly734 (G * ) через 5'- дезоксиаденозильный радикал (через радикал SAM ). [ 6 ]
Для получения дополнительной информации о радикальной активации SAM и радикальных ферментах SAM см. обсуждение Wang et al., 2007. [ 7 ]
Деактиваза пируватформиатлиазы «выключает» пируватформиатлиазу путем тушения радикала Gly734. [ 8 ] Кроме того, пируватформиат лиаза чувствительна к молекулярному кислороду (O 2 ), присутствие которого отключает фермент. [ 9 ]
Ссылки
[ редактировать ]- ^ Кнаппе Дж., Блашковски Х.П., Гробнер П., Шмитт Т. (1974). «Пируватформиат-лиаза Escherichia coli: промежуточное соединение ацетил-фермента». Евро. Дж. Биохим . 50 (1): 253–63. дои : 10.1111/j.1432-1033.1974.tb03894.x . ПМИД 4615902 .
- ^ Перейти обратно: а б Беккер А., Фриц-Вольф К., Кабш В., Кнаппе Дж., Шульц С., Фолькер Вагнер А.Ф. Структура и механизм действия глицильного радикала фермента пируватформиат-лиазы. 1999 Нац. Структура. Биол. 6: 969–975.
- ^ Леппанен В.М., Меркель MC, Оллис Д.Л., Вонг К.К., Козарич Дж.В., Гольдман А. Пируватформиат-лиаза структурно гомологична рибонуклеотидредуктазе I типа. 1999 Структура 7: 733–744.
- ^ Перейти обратно: а б Беккер А., Кабш В. Рентгеновская структура пируватформиата-лиазы в комплексе с пируватом и КоА. Как фермент использует тиильный радикал Cys-418 для расщепления пирувата. 2002 Журнал биологической химии. 277(42): 40036–42.
- ^ Перейти обратно: а б Плага В., Вильхабер Г., Уоллак Дж., Кнаппе Дж. Модификация Cys-418 пируватформиат-лиазы метакриловой кислотой на основе ее радикального механизма. 2000 ФЕВС Письмо. 466 (1): 45–8.
- ^ Фрей М., Роте М., Вагнер А.Ф., Кнаппе Дж. Аденозилметионин-зависимый синтез глицилового радикала в пируватформиат-лиазе путем отщепления атома водорода глицина C-2 pro-S. Исследования [2H]глицинзамещенного фермента и пептидов, гомологичных сайту глицина 734. 1994 J Biol Chem. 269(17):12432–7.
- ^ Ван, Южная Каролина, Фрей, Пенсильвания. S-аденозилметионин как окислитель: радикальное суперсемейство SAM. 2007 Тенденции Биохимии. наук. 32 (3): 101–10.
- ^ Нньепи, Г-н, Пэн, Ю., Бродерик, Дж . Б. Инактивация пируватформиата-лиазы E. coli: роль AdhE и малых молекул. 2007 Arch Biochem Biophys. 459 (1): 1–9.
- ^ Чжан В., Вонг К.К., Мальоццо Р.С., Козарич Дж.В. Инактивация пируватформиата диоксидом кислорода: определение механистического взаимодействия глицина 734 и цистеина 419 с помощью ЭПР быстрого замораживания. 2001 Биохимия 40(13): 4123–30.