Сериновая о-ацетилтрансфераза
| сериновая о-ацетилтрансфераза | |||
|---|---|---|---|
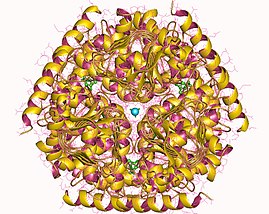 Сериновая ацетилтрансфераза Гексамер, Haemophilus influenzae | |||
| Идентификаторы | |||
| ЕС №. | 2.3.1.30 | ||
| CAS №. | 9023-16-9 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| Джин Онтология | Друг / Quickgo | ||
| |||
В фермере сериновая о-ацетилтрансфераза ( EC 2.3.1.30 ) представляет собой фермент , который катализирует химическую реакцию
- ацетил -коа + л -серин Coa + o -ацетил -л -серин
Таким образом, двумя субстратами этого фермента являются ацетил -КоА и L -серин , тогда как два его продукта являются CoA и O -ацетил -L -серин .
Этот фермент принадлежит к семейству трансфераз , в частности, те ацилтрансферазы, переносящие группы, отличные от аминоацильных групп. Систематическим названием этого класса ферментов является ацетил-КоА: L-сериновая о-ацетилтрансфераза . Другие общие названия включают сатазу , L-сериновую ацетилтрансферазу , сериновую ацетилтрансферазу и серин-трансацетилазу . Этот фермент участвует в метаболизме цистеина и метаболизме серы .
Структурные исследования
[ редактировать ]В конце 2007 года 7 структур для этого класса ферментов были решены PDB с кодами согласия 1S80 , 1SSM , 1SSQ , 1SST , 1T3D , 1Y7L и 2ISQ .
N терминального белкового домена
[ редактировать ]| Терминальный домен сатазы | |||
|---|---|---|---|
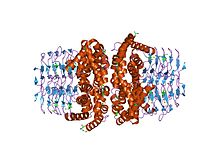 Структура фермента серин ацетилтрансфераза-апофермент (усеченный) | |||
| Идентификаторы | |||
| Символ | Сто | ||
| Pfam | PF06426 | ||
| InterPro | IPR010493 | ||
| |||
В молекулярной биологии сатаза белкового домена ферменту является короткой для сериновой ацетилтрансферазы и относится к , который катализирует преобразование L -серин в L -цистеин в E. coli . [ 1 ] Более конкретно, его роль заключается в катализаторе активации L -серин с помощью ацетил-КоА . Эта запись относится к N-концу белка , который имеет последовательность , которая сохраняется в растениях и бактериях . [ 2 ]
Важность функции
[ редактировать ]N-концевой домен белковой сериновой ацетилтрансферазы помогает катализировать перенос ацетила . Этот конкретный фермент катализирует серин в цистеин, который в конечном итоге преобразуется в незаменимый аминокислотный метионин . Особый интерес для ученых представляет способность использовать естественную способность фермента, сериновой ацетилтрансферазы, создавать питательные аминокислоты и использовать эту способность через трансгенные растения . Эти трансгенные растения будут содержать более незаменимые аминокислоты серы, означающие более здоровую диету для людей и животных. [ 3 ]
Структура
[ редактировать ]Амино-концевой альфа-спиральный домен, в частности, аминокислотные остатки HIS158 ( гистидин в положении 158) и ASP143 ( аспарагиновая кислота в положении 143) образуют каталитическую триаду с субстратом для переноса ацетила . [ 4 ] Есть восемь альфа-спиралей, которые формируют N-концевой домен. [ 4 ]
Ссылки
[ редактировать ]- ^ Denk D, Böck A (март 1987 г.). «Биосинтез L-цистеина в Escherichia coli: нуклеотидная последовательность и экспрессия гена сериновой ацетилтрансферазы (Cyse) из мутанта, вызывающего цистеин, и цистеиновый мутант» . J. Gen. Microbiol . 133 (3): 515–25. doi : 10.1099/00221287-133-3-515 . PMID 3309158 .
- ^ Сайто К., Йокояма Х, Ноджи М., Муракоши I (июль 1995 г.). «Молекулярное клонирование и характеристика растительной сериновой ацетилтрансферазы, играющей регуляторную роль в биосинтезе цистеина из арбуза» . Дж. Биол. Химический 270 (27): 16321–6. doi : 10.1074/jbc.270.27.16321 . PMID 7608200 .
- ^ Табе Л., Вирц М., Молвиг Л., Дру М, Ад Р (март 2010 г.). «Сверхэкспрессия сериновой ацеталитрансферазы приводила к значительному увеличению о-ацетилсерина и свободного цистеина в развивающихся семенах зернового бобового» . J. Exp. Бот . 61 (3): 721–33. doi : 10.1093/jxb/erp338 . PMC 2814105 . PMID 19939888 .
- ^ Jump up to: а беременный Pye Ve, Tingey AP, Robson RL, Moody PC (сентябрь 2004 г.). «Структура и механизм сериновой ацетилтрансферазы из Escherichia coli» . Дж. Биол. Химический 279 (39): 40729–36. doi : 10.1074/jbc.m403751200 . PMID 15231846 .
- Кредич Н.М., Томкинс Г.М. (1966). «Энзимный синтез L-цистеина в Escherichia coli и Salmonella typhimurium» . Дж. Биол. Химический 241 (21): 4955–65. doi : 10.1016/s0021-9258 (18) 99657-2 . PMID 5332668 .
- Смит Ик, Томпсон Дж.Ф. (1971). «Очистка и характеристика L-сериновой трансацетилазы и O-ацетил-L-сериновой сульфгидрилазы из проростков почечных бобов (Phaseolus vulgaris)». Биохим. Биофиз. Акт . 227 (2): 288–95. doi : 10.1016/0005-2744 (71) 90061-1 . PMID 5550822 .
