Радиохирургия
| Радиохирургия | |
|---|---|
 Интраоперационная фотография, показывающая расположение радиохирургической системы. Пациент на фотографии лечится от рака прямой кишки. | |
| Специальность | Онкология / Нейрохирургия |
| Медлайн Плюс | 007577 |
| электронная медицина | 1423298 |
Радиохирургия – это операция с применением радиации . [1] то есть разрушение точно выбранных участков ткани с использованием ионизирующего излучения , а не иссечение лезвием. Как и другие формы лучевой терапии (также называемые лучевой терапией), ее обычно используют для лечения рака . Первоначально радиохирургия была определена шведским нейрохирургом Ларсом Лекселлом как «единичная фракция высокой дозы радиации, стереотаксически направленная на интересующую внутричерепную область». [2]
В стереотаксической радиохирургии ( SRS ) слово « стереотаксический » относится к трехмерной системе координат , которая обеспечивает точную корреляцию виртуальной цели, видимой на диагностических изображениях пациента, с фактическим положением цели у пациента. Стереотаксическую радиохирургию также можно назвать стереотаксической лучевой терапией тела (SBRT) или стереотаксической абляционной лучевой терапией (SABR), когда она используется за пределами центральной нервной системы (ЦНС). [3]
История
[ редактировать ]Стереотаксическая радиохирургия была впервые разработана в 1949 году шведским нейрохирургом Ларсом Лекселлом для лечения небольших объектов в мозге, которые не поддавались традиционной хирургии. В первоначальном стереотаксическом инструменте, который он придумал, использовались зонды и электроды. [4] Первая попытка заменить электроды излучением была предпринята в начале пятидесятых годов рентгеновскими лучами . [5] Принцип действия этого инструмента заключался в том, чтобы поразить внутричерепную цель узкими лучами радиации с разных направлений. Траектории лучей сходятся в целевом объеме, доставляя туда смертельную кумулятивную дозу радиации, ограничивая при этом дозу на прилегающие здоровые ткани. Десять лет спустя был достигнут значительный прогресс, во многом благодаря вкладу физиков Курта Лидена и Бёрье Ларссона. [6] В это время стереотаксические протонные пучки. рентгеновские лучи заменили [7] Пучок тяжелых частиц представлял собой прекрасную замену хирургическому ножу, но синхроциклотрон оказался слишком неуклюжим. Лекселл приступил к разработке практичного, компактного, точного и простого инструмента, которым мог бы пользоваться сам хирург. В 1968 году в результате появился «Гамма-нож», который был установлен в Каролинском институте и состоял из нескольких источников кобальта-60, радиоактивных помещенных в своего рода шлем с центральными каналами для облучения гамма-лучами. [8] Этот прототип был разработан для создания щелевидных радиационных поражений при функциональных нейрохирургических процедурах для лечения боли, двигательных или поведенческих расстройств, которые не поддаются обычному лечению. Успех этого первого устройства привел к созданию второго устройства, содержащего 179 источников кобальта-60. Этот второй аппарат «Гамма-нож» был разработан для создания сферических поражений для лечения опухолей головного мозга и внутричерепных артериовенозных мальформаций (АВМ). [9] Дополнительные блоки были установлены в 1980-х годах, все они имели 201 источник кобальта-60. [10]
Параллельно с этими разработками аналогичный подход был разработан для линейного ускорителя частиц или линейного ускорителя. Установка первого клинического линейного ускорителя на 4 МэВ началась в июне 1952 года в отделении радиотерапевтических исследований Совета медицинских исследований (MRC) в больнице Хаммерсмит в Лондоне. [11] Система была передана для физических и других испытаний в феврале 1953 года, а лечение пациентов началось 7 сентября того же года. Тем временем работы в Стэнфордской микроволновой лаборатории привели к разработке ускорителя на 6 МэВ, который был установлен в больнице Стэнфордского университета в Калифорнии в 1956 году. [12] Установки линейного ускорителя быстро стали популярными устройствами для традиционной фракционированной лучевой терапии , но так продолжалось до 1980-х годов, прежде чем специализированная радиохирургия на линейном ускорителе стала реальностью. В 1982 году испанский нейрохирург Дж. Барсиа-Салорио начал оценивать роль фотонной радиохирургии на основе кобальта, а затем на основе линейного ускорителя для лечения АВМ и эпилепсии . [13] В 1984 году Бетти и Деречинский описали радиохирургическую систему на базе линейного ускорителя. [14] Уинстон и Лутц еще больше усовершенствовали технологии радиохирургических прототипов на основе Linac, включив улучшенное устройство стереотаксического позиционирования и метод измерения точности различных компонентов. [15] С использованием модифицированного линейного ускорителя первый пациент в Соединенных Штатах был пролечен в Бостонской женской больнице Бригам в феврале 1986 года. [ нужна ссылка ]
21 век
[ редактировать ]Технологические усовершенствования в области медицинской визуализации и вычислений привели к более широкому клиническому внедрению стереотаксической радиохирургии и расширили ее возможности в 21 веке. [16] [17] Точность и точность локализации, подразумеваемые словом «стереотаксический», по-прежнему имеют первостепенное значение для радиохирургических вмешательств и значительно улучшаются с помощью технологий визуального контроля, таких как N-локализатор. [18] и локализатор Штурм-Пастыра [19] которые изначально были разработаны для стереотаксической хирургии .
В 21 веке первоначальная концепция радиохирургии расширилась и теперь включает лечение, включающее до пяти фракций , а стереотаксическая радиохирургия была переопределена как отдельная нейрохирургическая дисциплина, которая использует генерируемое извне ионизирующее излучение для инактивации или уничтожения определенных целей, обычно в голове или позвоночнике. без необходимости хирургического разреза. [20] Независимо от сходства концепций стереотаксической радиохирургии и фракционированной лучевой терапии механизм достижения лечения слегка отличается, хотя сообщается, что оба метода лечения имеют одинаковые результаты при определенных показаниях. [21] Стереотаксическая радиохирургия уделяет больше внимания доставке точных высоких доз на небольшие участки, чтобы разрушить целевую ткань, сохраняя при этом прилегающую нормальную ткань. Тот же принцип используется и в традиционной лучевой терапии, хотя более вероятно использование более низких мощностей дозы, распространяющихся на большие площади (например, как при лечении VMAT ). Фракционная лучевая терапия в большей степени зависит от различной радиочувствительности мишени и окружающих нормальных тканей к общей накопленной дозе радиации . [20] Исторически область фракционированной лучевой терапии развилась из первоначальной концепции стереотаксической радиохирургии после открытия принципов радиобиологии : восстановления, рекомбинации, репопуляции и реоксигенации. [22] Сегодня оба метода лечения дополняют друг друга, поскольку опухоли, которые могут быть устойчивы к фракционированной лучевой терапии, могут хорошо реагировать на радиохирургию, а опухоли, которые слишком велики или расположены слишком близко к критическим органам для безопасной радиохирургии, могут быть подходящими кандидатами на фракционированную лучевую терапию. [21]
Сегодня программы радиохирургии «Гамма-нож» и «Линак» коммерчески доступны по всему миру. Хотя Гамма-нож предназначен для радиохирургии, многие ускорители созданы для традиционной фракционированной лучевой терапии и требуют дополнительных технологий и опыта, чтобы стать специализированными инструментами радиохирургии. Между этими разными подходами нет четкой разницы в эффективности. [23] [24] Крупнейшие производители, Varian и Elekta, предлагают специализированные радиохирургические ускорители, а также аппараты, предназначенные для традиционного лечения с возможностями радиохирургии. Системы, предназначенные для дополнения обычных линейных ускорителей технологией формирования луча, планирования лечения и инструментов визуализации. [25] Примером специализированного линейного ускорителя для радиохирургии является CyberKnife , компактный ускоритель, установленный на роботизированной руке, которая перемещается вокруг пациента и облучает опухоль из большого набора фиксированных положений, тем самым имитируя концепцию Гамма-ножа.
Механизм действия
[ редактировать ]
Фундаментальным принципом радиохирургии является принцип избирательной ионизации тканей с помощью пучков излучения высокой энергии. Ионизация – это производство ионов и свободных радикалов , которые повреждают клетки . Эти ионы и радикалы, которые могут образовываться из воды в клетке или биологических материалов, могут нанести непоправимый ущерб ДНК, белкам и липидам, что приведет к гибели клетки. Таким образом, биологическая инактивация осуществляется в объеме обрабатываемой ткани с точным разрушающим эффектом. Доза радиации обычно измеряется в греях (один грей (Гр) — это поглощение одного джоуля энергии на килограмм массы). Единицей, которая пытается принять во внимание как различные органы, подвергающиеся облучению, так и тип излучения, является зиверт , единица, которая описывает как количество выделяемой энергии, так и биологическую эффективность. [ нужна ссылка ]
Клинические применения
[ редактировать ]При использовании вне ЦНС ее можно назвать стереотаксической лучевой терапией тела (SBRT) или стереотаксической абляционной лучевой терапией (SABR). [3]
Мозг и позвоночник
[ редактировать ]Радиохирургия выполняется многопрофильной командой нейрохирургов , радиационных онкологов и медицинских физиков для эксплуатации и обслуживания сложнейших, высокоточных и сложных инструментов, включая медицинские линейные ускорители, установку «Гамма-нож» и установку «Кибер-нож». Высокоточное облучение целей в головном и спинном мозге планируется с использованием информации медицинских изображений, полученных с помощью компьютерной томографии , магнитно-резонансной томографии и ангиографии . [ нужна ссылка ]
Радиохирургия показана прежде всего для терапии опухолей, сосудистых поражений и функциональных нарушений. При использовании этого метода необходимо использовать значительную клиническую оценку, и необходимо учитывать тип поражения, патологию, если таковая имеется, размер, местоположение, возраст и общее состояние здоровья пациента. Общие противопоказания к радиохирургии включают чрезмерно большой размер целевого поражения или слишком большое количество поражений для практического лечения. Пациенты могут лечиться в течение одного-пяти дней амбулаторно . Для сравнения, средняя продолжительность пребывания в больнице после краниотомии (традиционной нейрохирургии, требующей вскрытия черепа) составляет около 15 дней. Результат радиохирургии может быть очевиден только через несколько месяцев после лечения. Поскольку радиохирургия не удаляет опухоль, а инактивирует ее биологически, отсутствие роста очага поражения обычно считается успехом лечения. Общие показания к радиохирургии включают многие виды опухолей головного мозга, такие как акустические невриномы , герминомы , менингиомы. , метастазы , невралгия тройничного нерва, артериовенозные мальформации и опухоли основания черепа и другие.
Стереотатическая радиохирургия метастазов в позвоночник эффективна для контроля боли в 90% случаев и обеспечивает стабильность опухолей при визуализационной оценке в 95% случаев, а также более эффективна при метастазах в позвоночник с вовлечением одного или двух сегментов. Между тем, традиционная дистанционная лучевая терапия больше подходит при множественном поражении позвоночника. [26]
Комбинированная терапия
[ редактировать ]SRS можно назначать отдельно или в сочетании с другими методами лечения. При метастазах в головной мозг эти варианты лечения включают лучевую терапию всего мозга (WBRT), хирургическое вмешательство и системную терапию. Однако недавний систематический обзор не обнаружил различий во влиянии на общую выживаемость или смертность из-за метастазов в головной мозг при сравнении лечения только SRS с лечением SRS плюс WBRT или только WBRT. [27]
Другие органы тела
[ редактировать ]Распространение стереотаксической лучевой терапии на другие поражения увеличивается, включая рак печени, рак легких, рак поджелудочной железы и т. д. [ нужна ссылка ]
Риски
[ редактировать ]В декабре 2010 года газета New York Times сообщила, что при использовании метода радиохирургии с линейным ускорителем произошла передозировка радиации, во многом из-за неадекватных мер безопасности в оборудовании, модернизированном для стереотаксической радиохирургии. [28] В США эти устройства регулируются Управлением по контролю за продуктами и лекарствами (FDA), тогда как Гамма-нож регулируется Комиссией по ядерному регулированию .
Это свидетельствует о том, что иммунотерапия может быть полезна для лечения радиационного некроза после стереотаксической лучевой терапии. [29]
Типы источников радиации
[ редактировать ]Выбор подходящего типа излучения и устройства зависит от многих факторов, включая тип поражения, размер и расположение по отношению к критическим структурам. Данные свидетельствуют о том, что аналогичные клинические результаты возможны при использовании всех различных методов. Более важными, чем используемое устройство, являются вопросы, касающиеся показаний к лечению, общей введенной дозы, графика фракционирования и соответствия плану лечения. [ нужна ссылка ]
Гамма-нож
[ редактировать ]
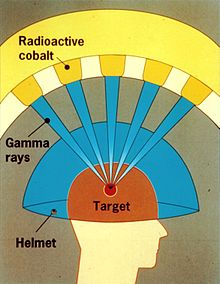
Гамма-нож (также известный как Гамма-нож Лекселла) используется для лечения опухолей головного мозга путем проведения высокоинтенсивной гамма-лучевой терапии таким образом, чтобы концентрировать излучение в небольшом объеме. Устройство было изобретено в 1967 году в Каролинском институте в Стокгольме , Швеция, Ларсом Лекселлом , нейрохирургом румынского происхождения Ладиславом Штайнером и радиобиологом Бёрье Ларссоном из Уппсальского университета , Швеция.
Гамма-нож обычно содержит 201 источник кобальта-60 примерно по 30 кюри каждый (1,1 ТБк ), помещенный в полусферическую решетку в сильно экранированной сборке. Устройство направляет гамма-излучение через целевую точку в мозгу пациента. Пациент носит специализированный шлем, который хирургически фиксируется к черепу, так что опухоль головного мозга остается неподвижной в точке воздействия гамма-лучей. доза Таким образом , абляционная радиации направляется через опухоль за один сеанс лечения, при этом окружающие ткани головного мозга относительно щадятся.
Терапия гамма-ножом, как и вся радиохирургия, использует дозы радиации для уничтожения раковых клеток и уменьшения опухолей, которые вводятся именно для того, чтобы не повредить здоровую ткань мозга. Радиохирургия Гамма-нож способна точно сфокусировать множество лучей гамма-излучения на одной или нескольких опухолях. Каждый отдельный луч имеет относительно низкую интенсивность, поэтому излучение мало влияет на промежуточные ткани мозга и концентрируется только на самой опухоли.
Радиохирургия Гамма-ножа доказала свою эффективность у пациентов с доброкачественными или злокачественными опухолями головного мозга размером до 4 см (1,6 дюйма), сосудистыми пороками развития, такими как артериовенозные мальформации (АВМ), болью и другими функциональными проблемами. [30] [31] [32] [33] Для лечения невралгии тройничного нерва процедуру можно применять повторно у пациентов.
Острые осложнения после радиохирургии Гамма-ножа встречаются редко. [34] и осложнения связаны с состоянием, которое лечат. [35] [36]
Терапия на основе линейных ускорителей
[ редактировать ]Линейный ускоритель (linac) производит рентгеновские лучи в результате удара ускоренных электронов о мишень с высоким z , обычно вольфрам. Этот процесс также называют «рентгенотерапией» или «фотонной терапией». Эмиссионная головка, или « гентри », механически вращается вокруг пациента по полному или частичному кругу. Стол, на котором лежит больной, «кушетка» также может перемещаться небольшими линейными или угловыми шагами. Комбинация движений гентри и кушетки позволяет компьютеризированно планировать объем ткани, подлежащей облучению. Устройства с высокой энергией 6 МэВ обычно используются для лечения головного мозга из-за глубины воздействия. Диаметр энергетического луча, выходящего из излучающей головки, можно регулировать в соответствии с размером поражения с помощью коллиматоров . Это могут быть сменные отверстия различного диаметра, обычно от 5 до 40 мм с шагом 5 мм, или многолепестковые коллиматоры, состоящие из ряда металлических пластинок, которые можно динамически перемещать во время лечения, чтобы придать лучу лучи соответствующую форму. масса, подлежащая абляции. По состоянию на 2017 год [update] Линаки были способны достигать чрезвычайно узкой геометрии луча, например, от 0,15 до 0,3 мм. Поэтому их можно использовать для нескольких видов операций, которые до сих пор выполнялись открытым или эндоскопическим способом, например, при невралгии тройничного нерва. Данные долгосрочного наблюдения показали, что она столь же эффективна, как и радиочастотная абляция, но уступает хирургическому вмешательству в предотвращении рецидива боли. [ нужна ссылка ]
Первые такие системы были разработаны Джоном Р. Адлером , профессором нейрохирургии и радиационной онкологии Стэнфордского университета , а также Расселом и Питером Шонбергами из Schonberg Research и коммерциализированы под торговой маркой CyberKnife.
Протонно-лучевая терапия
[ редактировать ]Протоны также могут использоваться в радиохирургии в процедуре, называемой протонной лучевой терапией (ПБТ) или протонной терапией . Протоны извлекаются из материалов-доноров протонов с помощью медицинского синхротрона или циклотрона и ускоряются при последовательных проходах через круглый, вакуумированный канал или полость с использованием мощных магнитов для формирования их пути, пока они не достигнут энергии, необходимой для простого прохождения через человеческое тело, обычно около 200 МэВ. Затем они направляются в область тела пациента, подлежащую лечению, – мишень облучения. В некоторых аппаратах, которые доставляют протоны только определенной энергии, между источником луча и пациентом вставляется специальная маска из пластика, позволяющая регулировать энергию луча и обеспечивать соответствующую степень проникновения. Явление пика Брэгга выброшенных протонов дает преимущества протонной терапии перед другими формами излучения, поскольку большая часть энергии протонов передается на ограниченном расстоянии, поэтому ткани за пределами этого диапазона (и в некоторой степени также ткани внутри этого диапазона) сохраняются. от воздействия радиации. Это свойство протонов, получившее название « Эффект глубинной бомбы » по аналогии со взрывным оружием, используемым в противолодочной войне, позволяет создавать конформное распределение дозы даже вокруг целей очень неправильной формы, а также для более высоких доз на цели, окруженные или ограниченные радиационно-чувствительными структурами, такими как оптическая система. хиазма или ствол мозга Развитие методов «модулированной интенсивности» позволило достичь аналогичных соответствий с помощью радиохирургии с линейным ускорителем. [ нужна ссылка ]
По состоянию на 2013 год [update] не было никаких доказательств того, что протонно-лучевая терапия в большинстве случаев лучше, чем любые другие виды лечения, за исключением «несколько редких случаев рака у детей». Критики, реагируя на рост числа очень дорогих установок ПБТ, говорили о « гонке медицинских вооружений », «сумасшедшей медицине и неустойчивой государственной политике». [37]
Ссылки
[ редактировать ]- ^ Elsevier , Иллюстрированный медицинский словарь Дорланда , Elsevier.
- ^ Лекселл Л. (декабрь 1951 г.). «Стеротаксический метод и радиохирургия головного мозга». Acta Chirurgica Scandinavica . 102 (4): 316–319. ПМИД 14914373 .
- ^ Перейти обратно: а б «Стереотаксическая лучевая терапия | Лечение рака | Исследования рака в Великобритании» . www.cancerresearchuk.org .
- ^ Лекселл Л. (1949). «Стеротаксический аппарат для внутримозговой хирургии». Acta Chirurgica Scandinavica . 99 : 229.
- ^ Лекселл Л. (декабрь 1951 г.). «Стеротаксический метод и радиохирургия головного мозга». Acta Chirurgica Scandinavica . 102 (4): 316–319. ПМИД 14914373 .
- ^ Ларссон Б., Лекселл Л., Рексед Б., Сурандер П., Майр В., Андерссон Б. (ноябрь 1958 г.). «Пучок высокоэнергетических протонов как нейрохирургический инструмент». Природа . 182 (4644): 1222–1223. Бибкод : 1958Natur.182.1222L . дои : 10.1038/1821222a0 . ПМИД 13590280 . S2CID 4163683 .
- ^ Лекселл Л., Ларссон Б., Андерссон Б., Рексед Б., Сурандер П., Майр В. (октябрь 1960 г.). «Поражения в глубине мозга, вызванные пучком протонов высокой энергии» . Акта Радиологика . 54 (4): 251–264. дои : 10.3109/00016926009172547 . ПМИД 13760648 .
- ^ Лекселл Л. (сентябрь 1983 г.). «Стереотаксическая радиохирургия» . Журнал неврологии, нейрохирургии и психиатрии . 46 (9): 797–803. дои : 10.1136/jnnp.46.9.797 . ПМК 1027560 . ПМИД 6352865 .
- ^ Ву А., Линднер Г., Майц А.Х., Календ А.М., Лансфорд Л.Д., Фликинджер Дж.К., Блумер В.Д. (апрель 1990 г.). «Физика метода гамма-ножа на сходящихся пучках в стереотаксической радиохирургии». Международный журнал радиационной онкологии, биологии, физики . 18 (4): 941–949. дои : 10.1016/0360-3016(90)90421-ф . ПМИД 2182583 .
- ^ Уолтон Л., Бомфорд С.К., Рамсден Д. (сентябрь 1987 г.). «Аппарат стереотаксической радиохирургии Шеффилда: физические характеристики и принципы работы». Британский журнал радиологии . 60 (717): 897–906. дои : 10.1259/0007-1285-60-717-897 . ПМИД 3311273 .
- ^ Фрай Д.В., Р-Шерсби-Харви РБ (ноябрь 1948 г.). «Линейный ускоритель бегущей волны для электронов с энергией 4 МэВ». Природа . 162 (4126): 859–861. Бибкод : 1948Natur.162..859F . дои : 10.1038/162859a0 . ПМИД 18103121 . S2CID 4075004 .
- ^ Бернье Дж., Холл Э.Дж., Джачча А. (сентябрь 2004 г.). «Радиационная онкология: век достижений». Обзоры природы. Рак . 4 (9): 737–747. дои : 10.1038/nrc1451 . ПМИД 15343280 . S2CID 12382751 .
- ^ Барсиа-Салорио Х.Л., Эрандес Дж., Бросета Х., Гонсалес-Дардер Х., Сьюдад Дж. (1982). «Радиохирургическое лечение каротидно-кавернозных свищей». Прикладная нейрофизиология . 45 (4–5): 520–522. дои : 10.1159/000101675 . ПМИД 7036892 .
- ^ Бетти О.О. (1984). «Гиперселективное облучение головного мозга линейным ускорителем». Достижения в стереотаксической и функциональной нейрохирургии 6 . Том. 33. С. 385–390. дои : 10.1007/978-3-7091-8726-5_60 . ISBN 978-3-211-81773-5 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Уинстон К.Р., Лутц В. (март 1988 г.). «Линейный ускоритель как нейрохирургический инструмент стереотаксической радиохирургии». Нейрохирургия . 22 (3): 454–464. дои : 10.1227/00006123-198803000-00002 . ПМИД 3129667 .
- ^ Де Саллес А (2008). «Радиохирургия от головного мозга к позвоночнику: 20-летний опыт». Реконструктивная нейрохирургия . Acta Neurochirurgica Supplementum. Том. 101. С. 163–168. дои : 10.1007/978-3-211-78205-7_28 . ISBN 978-3-211-78204-0 . ПМИД 18642653 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Тиммерман Р., МакГарри Р., Яннуцос С., Папьес Л., Тюдор К., ДеЛука Дж. и др. (октябрь 2006 г.). «Чрезмерная токсичность при лечении центральных опухолей в исследовании фазы II стереотаксической лучевой терапии тела неоперабельного рака легких на ранней стадии» . Журнал клинической онкологии . 24 (30): 4833–4839. дои : 10.1200/JCO.2006.07.5937 . ПМИД 17050868 .
- ^ Галлоуэй-младший (2015). «Введение и исторические перспективы хирургии под визуальным контролем». В Голби А.Дж. (ред.). Нейрохирургия под визуальным контролем . Амстердам: Эльзевир. стр. 2–4. дои : 10.1016/B978-0-12-800870-6.00001-7 . ISBN 978-0-12-800870-6 .
- ^ Штурм В., Пастир О., Шлегель В., Шарфенберг Х., Забель Х.Дж., Нетцебанд Г. и др. (1983). «Стереотаксическая компьютерная томография с модифицированной установкой Рихерта-Мундингера как основа комплексных стереотаксических нейрорадиологических исследований». Акта Нейрохирургика . 68 (1–2): 11–17. дои : 10.1007/BF01406197 . ПМИД 6344559 . S2CID 38864553 .
- ^ Перейти обратно: а б Барнетт Г.Х., Лински М.Э., Адлер Дж.Р., Козценс Дж.В., Фридман В.А., Хайльбрун М.П. и др. (январь 2007 г.). «Стереотаксическая радиохирургия - определение, санкционированное нейрохирургией». Журнал нейрохирургии . 106 (1): 1–5. дои : 10.3171/jns.2007.106.1.1 . ПМИД 17240553 . S2CID 1007105 .
- ^ Перейти обратно: а б Комбс С.Е., Вельцель Т., Шульц-Эртнер Д., Хубер П.Е., Дебус Дж. (январь 2010 г.). «Различия в клинических результатах после однократной радиохирургии на основе LINAC по сравнению с фракционированной стереотаксической лучевой терапией для пациентов с вестибулярными шванномами». Международный журнал радиационной онкологии, биологии, физики . 76 (1): 193–200. дои : 10.1016/j.ijrobp.2009.01.064 . ПМИД 19604653 .
- ^ Бернье Дж., Холл Э.Дж., Джачча А. (сентябрь 2004 г.). «Радиационная онкология: век достижений». Обзоры природы. Рак . 4 (9): 737–747. дои : 10.1038/nrc1451 . ПМИД 15343280 . S2CID 12382751 .
- ^ Матис С., Эйснер В. (6 октября 2010 г.). Гамма-нож против адаптированных линейных ускорителей: сравнение двух радиохирургических применений (отчет). HTA-Projektbericht 47. eISSN 1993-0496 . ISSN 1993-0488 .
- ^ Макдермотт М.В. (2010). Радиохирургия . Каргерское медицинское и научное издательство. п. 196. ИСБН 9783805593656 .
- ^ Шоэльс К.М., Уль С., Лаундерс Дж., Инамдар Р., Брюнинг В., Салливан Н., Типтон К.Н. (2011). «Устройства для SBRT, продаваемые в настоящее время» . Стереотаксическая лучевая терапия тела . Агентство медицинских исследований и качества (США). ПМИД 21735562 .
- ^ Хоаким А.Ф., Гизони Э., Тедески Х., Перейра Э.Б., Джакомини Л.А. (июнь 2013 г.). «Стереотаксическая радиохирургия метастазов в позвоночник: обзор литературы» . Эйнштейн (Сан-Паулу) . 11 (2): 247–255. дои : 10.1590/S1679-45082013000200020 . ПМЦ 4872903 . ПМИД 23843070 .
- ^ «Лучевая терапия метастазов в головной мозг | Программа эффективного здравоохранения (EHC)» . effecthealthcare.ahrq.gov . Проверено 24 октября 2023 г.
- ^ «Точный луч невидимо отклоняется, причиняя вред вместо исцеления» . Нью-Йорк Таймс . 28 декабря 2010 г.
- ^ Кайдар-Персон О, Загар ТМ, Дил А, Мошос С.Дж., Юенд М.Г., Сасаки-Адамс Д. и др. (июль 2017 г.). «Частота радиационного некроза после стереотаксической лучевой терапии метастазов меланомы в головном мозге: потенциальное влияние иммунотерапии». Противораковые препараты . 28 (6): 669–675. doi : 10.1097/CAD.0000000000000497 . ПМИД 28368903 . S2CID 3560210 .
- ^ Режис Дж., Бартоломей Ф., Хаяши М., Шовель П. (2002). «Какая роль радиохирургии при мезиальной височной эпилепсии». Централблатт по нейрохирургии . 63 (3): 101–105. дои : 10.1055/s-2002-35824 . ПМИД 12457334 .
- ^ Квон Ю, Ван CJ (1995). «Стереотаксическая радиохирургия гамма-ножом для лечения дистонии». Стереотаксическая и функциональная нейрохирургия . 64 (Приложение 1): 222–227. дои : 10.1159/000098782 . ПМИД 8584831 .
- ^ Доннет А., Валад Д., Режис Дж. (февраль 2005 г.). «Лечение гамма-ножом рефрактерной кластерной головной боли: проспективное открытое исследование» . Журнал неврологии, нейрохирургии и психиатрии . 76 (2): 218–221. дои : 10.1136/jnnp.2004.041202 . ПМЦ 1739520 . ПМИД 15654036 .
- ^ Герман Дж.М., Пети Дж.Х., Амин П., Квок Ю., Датта П.Р., Чин Л.С. (май 2004 г.). «Повторная радиохирургия гамма-ножом при рефрактерной или рецидивирующей невралгии тройничного нерва: результаты лечения и оценка качества жизни». Международный журнал радиационной онкологии, биологии, физики . 59 (1): 112–116. дои : 10.1016/j.ijrobp.2003.10.041 . ПМИД 15093906 .
- ^ Чин Л.С., Лацио Б.Е., Биггинс Т., Амин П. (май 2000 г.). «Острые осложнения после радиохирургии гамма-ножом встречаются редко». Хирургическая неврология . 53 (5): 498–502, обсуждение 502. doi : 10.1016/S0090-3019(00)00219-6 . ПМИД 10874151 .
- ^ Стаффорд С.Л., Поллок Б.Е., Фут Р.Л., Линк М.Дж., Горман Д.А., Шомберг П.Дж., Ливитт Дж.А. (ноябрь 2001 г.). «Радиохирургия менингиомы: контроль опухоли, результаты и осложнения у 190 последовательных пациентов». Нейрохирургия . 49 (5): 1029–37, обсуждение 1037–8. дои : 10.1097/00006123-200111000-00001 . ПМИД 11846894 . S2CID 13646182 .
- ^ Чо Д.Ю., Цао М., Ли В.Ю., Чанг К.С. (май 2006 г.). «Социально-экономические затраты на открытую хирургию и радиохирургию гамма-ножом при доброкачественных опухолях основания черепа». Нейрохирургия . 58 (5): 866–73, обсуждение 866–73. дои : 10.1227/01.NEU.0000209892.42585.9B . ПМИД 16639320 . S2CID 38660074 .
- ^ Роксана Нельсон (30 января 2013 г.). «Неопределенность в отношении протонно-лучевой терапии сохраняется» . Медскейп . Проверено 22 марта 2017 г.
Внешние ссылки
[ редактировать ]- Книга «Лечение опухолей, которые движутся вместе с дыханием» по радиохирургии движущихся целей (июль 2007 г.)
- Книга Shaped Beam Radiosurgery по радиохирургии на базе LINAC с использованием многолепестковой коллимации (март 2011 г.)