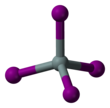
Тетраиодид кремния

| |||
|
| |||

| |||
| Имена | |||
|---|---|---|---|
| Другие имена
тетраиодид кремния
Тетраиодсилан | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.033.355 | ||
| Номер ЕС |
| ||
ПабХим CID
|
|||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| СиИ 4 | |||
| Молярная масса | 535.7034 g/mol | ||
| Появление | белый порошок | ||
| Плотность | 4,198 г/см 3 | ||
| Температура плавления | 120,5 ° С (248,9 ° F; 393,6 К) | ||
| Точка кипения | 287,4 ° С (549,3 ° F; 560,5 К) | ||
| реагирует | |||
| Растворимость в органических растворителях | растворимый | ||
| Структура | |||
| четырехгранный | |||
| Опасности | |||
| СГС Маркировка : | |||
   
| |||
| Опасность | |||
| Х301 , Х311 , Х314 , Х317 , Х334 , Х360 | |||
| P201 , P202 , P260 , P261 , P264 , P270 , P272 , P280 , P281 , P285 , P301+P310 , P301+P330+P331 , P302+P352 , P303 +P361+P353 , P304+P340 , П304+П341 , П305+ P351+P338 , P308+P313 , P310 , P312 , P321 , P322 , P330 , P333+P313 , P342+P311 , P361 , P363 , P405 , P501 | |||
| NFPA 704 (огненный алмаз) | |||
| Родственные соединения | |||
Другие анионы
|
Тетрафторид кремния Тетрахлорид кремния Тетрабромид кремния | ||
Другие катионы
|
Тетраиодид углерода Тетраиодид германия Йодид олова(IV) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Тетраиодид кремния – химическое соединение формулы Si I 4 . Это тетраэдрическая молекула с длиной связи Si-I 2,432(5) Å. [1]
SiI 4 является предшественником амидов кремния формулы Si(NR 2 ) 4 (R = алкил). [2] Он также представлял интерес для производства и травления кремния в микроэлектронике .
Синтез и реакции
[ редактировать ]Это соединение получают обработкой кремниево-медной смеси йодом: [3]
- Си + И 2 → СиI 4
Быстро реагирует с водой и влагой воздуха.
Его также можно производить в больших масштабах путем реакции кремния или карбида кремния с йодом при нагревании примерно до 200 °C. Более академический интерес представляет реакция силана с парами йода при 130–150 °C, так как при этом образуется ряд соединений: от иодсилана SiH 3 I до дийодсилана SiH 2 I 2 , а трииодсилана SiHI 3 также . Эти соединения представляют собой бесцветные жидкости при комнатной температуре. [4] Последний легко отличить от аналогичного соединения углерода йодоформа , который при комнатной температуре представляет собой твердое вещество желтого цвета.
Сравнение с другими SiX 4 соединениями
[ редактировать ]| SiHСиХ4 | СиФ 4 | SiCl 4 | СиБр 4 | СиИ 4 | |
|---|---|---|---|---|---|
| BP (˚C) [5] | -111.9 | -90.3 | 56.8 | 155.0 | 290.0 |
| мп (˚С) [5] | -185 | -95.0 | -68.8 | 5.0 | 155.0 |
| Длина связи Si-X (Å) | >0,74 [6] | 1.55 | 2.02 | 2.20 | 2.43 |
| Энергия связи Si-X (кДж/моль) [7] | 384 | 582 | 391 | 310 | 234 |
Ссылки
[ редактировать ]- ^ Колониц, Мария; Харгиттай, Магдольна (1998). «Молекулярная структура тетраиодида кремния». Структурная химия . 9 (5): 349–352. дои : 10.1023/А:1022462926682 . S2CID 96658381 .
- ^ Банерджи, Чиранджиб; Уэйд, Кейси Р.; Суле, Аксель; Юрсич, Грегори; МакЭндрю, Джеймс; Белот, Джон А. (2006). «Прямой синтез и полная характеристика тетракис (диалкиламино)силанов, не содержащих галогенидов». Неорганическая химия . 9 (7): 761. doi : 10.1016/j.inoche.2006.04.027 .
- ^ П.В. Шенк (1963). «Кремний и германий». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 2 страницы = 689. Нью-Йорк, Нью-Йорк: Академическая пресса.
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Jump up to: а б Соединения кремния, галогениды кремния. Коллинз, В.: Энциклопедия химической технологии Кирка-Отмера; Джон Вили и сыновья, Inc, 2001.
- ^ «Какова длина связи HH?» . Ответы.com .
- ^ Эбсворт, EAV в летучих соединениях кремния; Таубе, Х.; Мэддок, AG; неорганическая химия; Книга Pergamon Press: Нью-Йорк, штат Нью-Йорк, 1963; Том. 4.
Внешние ссылки
[ редактировать ]