2,5-Дикетопиперазин
статьи первый раздел Возможно, придется переписать . Причина такова: эта статья посвящена не соединению 2,5-дикетопиперазина, а группе 2,5-дикетопиперазинов. ( июнь 2024 г. ) |

| |
| Имена | |
|---|---|
| Название ИЮПАК
2,5-пиперазиндион
| |
| Предпочтительное название ИЮПАК
Пиперазин-2,5-дион | |
| Другие имена
Циклические дипептиды, циклодипептиды, ДКП, ЦДП, 2,5-диоксопиперазины (ДОФ), дипептидные ангидриды
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 3DMeet | |
| 112112 | |
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Номер ЕС |
|
| 217756 | |
| КЕГГ | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Характеристики | |
| С 4 Н 6 Н 2 О 2 | |
| Молярная масса | 114.104 g·mol −1 |
| Температура плавления | 311–312 ° C (592–594 ° F; 584–585 К) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
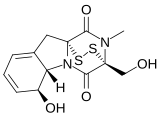
2,5-Дикетопиперазин представляет собой органическое соединение формулы (NHCH 2 C(O)) 2 . Соединение имеет шестичленное кольцо, содержащее две амидные группы в противоположных положениях кольца. Это было первое соединение, содержащее пептидную связь, которое было охарактеризовано методом рентгеновской кристаллографии в 1938 году. [ 1 ] Это родитель большого класса 2,5-дикетопиперазинов ( 2,5-ДКП ). с формулой (NHCH 2 (R)C(O)) 2 (R = H, CH 3 и т.д.). Это вездесущие пептиды в природе. Они часто встречаются в ферментационных бульонах и дрожжевых культурах, а также встроены в более крупные и сложные структуры различных натуральных продуктов , а также в некоторые лекарства. [ 2 ] Кроме того, они часто производятся как продукты распада полипептидов , особенно в обработанных пищевых продуктах и напитках. [ 3 ] Они также были идентифицированы в содержимом комет . [ 4 ]
Встречаемость в виде натуральных продуктов
[ редактировать ]2,5-дикетопиперазиновое ядро широко распространено в биологически активных природных продуктах. Наиболее структурно разнообразные природные продукты 2,5-дикетопиперазина основаны на триптофане и пролине , модифицированных путем гетероциклизации и присоединения изопренила. Они варьируются от гепатоксического бревианамида F (цикло( L -Trp- L -Pro)) до аннелированного треморогенного веррукулогена и спироаннелированного спиротрипростатина B , которые представляют собой многообещающий класс антимитотических агентов, а также структурно сложного (+)- стефацидина. А, мостиковый 2,5-дикетопиперазин, который обладает уникальной бицикло[2.2.2]диазаоктановой кольцевой системой и активен в отношении клеточной линии HCT-116 толстой кишки человека . [ 2 ]
- Биологически активный триптофан-пролин 2,5-дикетопиперазин Натуральные продукты
-
(+) Стефацидин А
Другие мостиковые 2,5-дикетопиперазины включают бицикломицин , антибактериальный агент, используемый в качестве пищевой добавки для предотвращения диареи у животных, тогда как тиопроизводные, такие как цитотоксический мостиковый эпиполитиодиоксопиперазин, представлены глиотоксином . К ненасыщенным производным относятся фенилагистин ( противораковый агент, связывающий микротрубочки ) , и микотоксин рокефортин C, обнаруженный в голубых сырах. [ 2 ]
- Другие биологически активные натуральные продукты 2,5-дикетопиперазин
Встречаемость в продуктах питания и напитках
[ редактировать ]2,5-Дикетопиперазины часто образуются при химической и термической обработке пищевых продуктов и напитков как продукты деградации полипептидов. Они были обнаружены в тушеной говядине, пиве, хлебе, спиртных напитках Авамори , какао, куриной эссенции, жареном кофе, сыре Конте , сушеных кальмарах, выдержанном саки и дрожжевом экстракте. Было показано, что в пищевых системах 2,5-дикетопиперазины являются важными органолептическими соединениями, обусловливающими вкус конечных продуктов и воспринимаемыми как вяжущие , соленые, зернистые, металлические или горькие. Хотя они варьируются от пролиновых, ароматических, алифатических до полярных 2,5-дикетопиперазинов, пролин-2,5-дикетопиперазины являются наиболее распространенными и структурно разнообразными 2,5-дикетопиперазинами, обнаруженными в пищевых продуктах. Производное валина цикло( L -Val- L -Pro) в концентрации 1742 ppm было идентифицировано как наиболее важный горький 2,5-дикетопиперазин, обусловливающий горький вкус жареного какао. Он также был обнаружен в качестве одного из основных 2,5-дикетопиперазинов в автолизированном дрожжевом экстракте и тушеной говядине, а также присутствует в куриной эссенции и кофе. [ 3 ] Он также был выделен из множества морских микроорганизмов и идентифицирован как активная сигнальная молекула LasI, воспринимающая кворум, важная для стимулирования роста растений Pseudomonas aeruginosa . [ 2 ] Наиболее изученным из всех простых 2,5-дикетопиперазинов является гистидилпролин-2,5-дикетопиперазин цикло( L -His- L -Pro). [ 5 ] который содержится в различных продуктах питания, особенно в высоких концентрациях в рыбе и рыбных продуктах. Он хорошо всасывается при пероральном приеме и проникает через гематоэнцефалический барьер по ненасыщаемому механизму. Встречается и у людей [ 6 ] как метаболит тиреотропин -рилизинг-гормона (ТРГ) и оказывает широкий спектр эффектов на центральную нервную систему, эндокринную, электрофизиологическую и сердечно-сосудистую систему. [ 5 ] Производные цикло(L-His-L-Pro) широко изучались с целью разработки терапевтических средств против нейродегенерации . [ 7 ] [ 2 ]
Структура и конформация
[ редактировать ]Эти циклические дипептиды включают как донорные, так и акцепторные группы для образования водородных связей . Они представляют собой конформационно ограниченные почти плоские каркасы. Разнообразие может быть введено максимум в шести позициях, а стереохимия контролируется максимум в четырех позициях. Они устойчивы к протеолизу . Эти характеристики лежат в основе его биологической активности и полезности в медицинской химии. Вследствие преобладающего биосинтетического происхождения из L -α- аминокислот большинство встречающихся в природе 2,5-ДКП имеют цис -конфигурацию как цикло( L -Xaa- L -Yaa) -изомеры . 2,5-ДКП эпимеризуются в основных, кислых и термических условиях. Состав цис- и транс -изомеров в равновесном состоянии широко варьируется в зависимости от массы боковых цепей, наличия кольца (например, пролина ) или алкилированности атомов азота. Хотя эпимеризация исторически была проблемой при синтезе 2,5-ДКП, недавно было разработано несколько мягких методов, позволяющих избежать эпимеризации. [ 2 ]
Биосинтез
[ редактировать ]2,5-ДКП синтезируются различными организмами, включая человека. Как правило, они возникают под действием тРНК-зависимой циклодипептидсинтазы — типа фермента, ответственного за создание циклической амидной связи между двумя пептидами. [ 8 ] Ферменты циклодипептидоксидаза и S-аденозилметионин-зависимые O/N метилтрансферазы действуют совместно, химически модифицируя циклические дипептиды. [ 8 ]
Синтез
[ редактировать ]2,5-Дикетопиперазины обычно получают одним из трех методов: образованием амидной связи, N - алкилированием и C - ацилированием .

Образование амидной связи
[ редактировать ]Чаще всего 2,5-дикетопиперазины образуются путем циклизации дипептидов. Помимо многих методов синтеза пептидов , реакцию Уги можно применить . Дипептиды с сложноэфирным концом часто спонтанно циклизуются. Рацемизация может быть проблематичной. [ 9 ] Реакция Уги с использованием изонитрила, аминокислоты, альдегида и амина может дать дипептид с таким же высоким выходом и оптической чистотой, как и дипептид, образующийся при стандартных пептидных сочетаниях. [ 10 ] Обычно изонитрил выбирают для получения лабильного концевого амида, обеспечивающего циклизацию. Например, прямое образование кольца 2,5-ДКП через такую активированную уходящую группу с использованием стабильного, легкодоступного и универсального конвертируемого изонитрила 1-изоциано-2-(2,2-диметоксиэтил)бензола 4 привело к синтезу в одном реакторе. N-замещенного 2,5-дикетопиперазина 7 . [ 11 ]
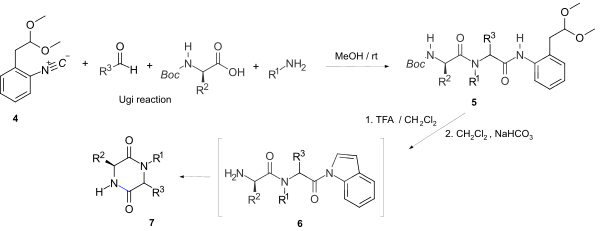
Мягкая кислотная и хемоселективная после Ugi, активация 5 включающая одновременное образование индоламида и удаление трет-бутоксикарбонила (Boc), дает активный амид 6 , который позволяет циклизироваться до 7, не затрагивая другие пептидные или даже сложноэфирные фрагменты и со стереохимическим сохранением хиральных центров .
N -Алкилирование
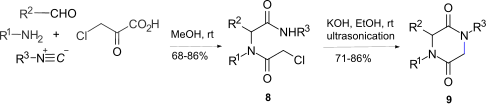
[ редактировать ]Внутримолекулярное амидное N -алкилирование альфа -галогенацетамидамидов 8 этанольным гидроксидом калия с использованием ультразвука привело к 2,5-дикетопиперазинам 9 , где 8 получен по реакции Уги. [ 12 ] между аминами, альдегидами, изоцианидами и хлоруксусной кислотой . Однако этот путь ограничен эпимеризацией в стереогенном центре и невозможностью получить 2,5-дикетопиперазиновое кольцо, если R 1 = Алкил.
С- Ацилирование
[ редактировать ]Образование 2,5-дикетопиперазинового кольца путем енолят- ацилирования. [ 13 ] был использован при построении 2,5-дикетопиперазинового кольца в 11 путем внутримолекулярной циклизации енолята 10 фенилкарбамата на карбонил с получением 11 с выходом 90%.

Реакции
[ редактировать ]Реакционная способность по отношению к углероду (C-3 и C-6)
[ редактировать ]Регио- и стереоконтролируемая C-функционализация 2,5-дикетопиперазинов по C-3 и C-6 включает енолатные , радикальные и катионные предшественники (и ион N -ацилиминия) и чувствительны к полярным и стерическим эффектам.
Алкилирование енолятов
[ редактировать ]Алкилирование биспараметоксибензила ) ( pMB защищенного 2,5-DKP 1 с использованием основания LHMDS и алкилбромида R. 1 Br, дал моноалкилированное производное 2 , которое при дальнейшем алкилировании дало симметричное транс -дизамещенное производное 3

Галогенирование и вытеснение
[ редактировать ]3-монобромиды 6 и 3,6-дибромиды 5 получают из бензилзащищенного 2,5-ДКП 4 радикальным галогенированием в N-бромсукцинимидом четыреххлористом углероде. Замещение этих лабильных бромидов легко происходит рядом нуклеофилов SR, OR, NR2, алкила и арила с образованием 7 . [ 2 ]

Альдольное добавление
[ редактировать ]Одно- или двукратная альдольная конденсация N -ацетилированного 2,5-ДКП 8 дает доступ к 3-дегидро-2,5-дикетопиперазинам 9 и 3,6-дидегидро-2,5-дикетопиперазинам 10 и конденсации 8 можно контролировать ступенчато, используя триэтиламин в диметилформамиде, чтобы получить несимметричный 3,6-дидегидро-2,5-дикетопиперазины 10 (R 1 = С 1 , Р 2 = С 2 ). [ 2 ]

Реакционная способность по азоту
[ редактировать ]Алкилирование
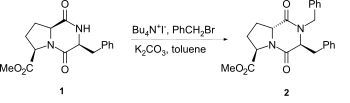
[ редактировать ]Наиболее распространенный метод алкилирования лактамного азота 2,5-дикетопиперазинов основан на использовании гидрида натрия в качестве основания. Однако эпимеризация может происходить, особенно, с 2,5-дикетопиперазинами, конденсированными с пролином, даже при использовании более мягких методов, таких как в катализатора межфазного переноса например 1-2 , . условиях [ 2 ]
Реакционная способность по карбонильным атомам углерода (C-2 и C-5)
[ редактировать ]Снижение
[ редактировать ]Восстановление карбонильных групп хирального 2,5-дикетопиперазина алюмогидридом лития (LiAlH 4 ) приводит к получению соответствующих хиральных пиперазинов . Например, цикло( L -Phe- L -Phe) 1 дает хиральный пиперазин (2S , 5S ) -дибензилпиперазин 2. [ 14 ]

Синтез дигидропиразина и пиразина
[ редактировать ]из лактама, Реакция енолфосфатов полученных 4, 2,5-дикетопиперазинов с реакциями, катализируемыми палладием (восстановление, реакции кросс-сочетания Сузуки и Стилле ), позволяет синтезировать ряд функционализированных 1,4-дигидропиразинов 5 , которые можно ароматизировать до 1 ,4- пиразины 6 в присутствии кислоты. [ 15 ]

Биологические функции
[ редактировать ]Было показано, что 2,5-ДКП играют роль в межвидовом ощущении кворума бактерий . Например, было показано, что 2,5-ДКП цикло(Phe-Pro) играет роль в регуляции экспрессии генов у множества различных видов бактерий, включая V. fishceri, V. cholera , Lactobacillus reuteri , Staphylococcus aureus и т. д. другие. [ 8 ]
Приложения
[ редактировать ]Терапия
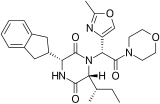
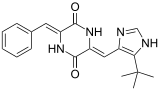
[ редактировать ]Многочисленные природные и синтетические 2,5-ДКП биоактивны . Эти небольшие, конформационно-жесткие, хиральные матрицы обладают множеством акцепторных и донорных функций Н-связей и имеют множество сайтов для структурной разработки различных функциональных групп с определенной стереохимией. Эти характеристики не только позволяют им связываться с высоким сродством к большому количеству рецепторов, проявляя широкий спектр биологической активности, но также позволяют развивать физико-химические свойства, подобные лекарственным средствам, необходимые для многокритериального процесса оптимизации преобразования свинца в лекарственный продукт. Взаимосвязь структура -активность (SAR) была исследована для многих из этих матриц 2,5-DKP, и некоторые из них были разработаны в виде клинических лекарств. К ним относятся тадалафил ( ингибитор ФДЭ5 при эректильной дисфункции ), ретозибан (антагонист окситоцина при преждевременных родах ), аплавирок ( антагонист CCR5 при ВИЧ ), эпелсибан (антагонист окситоцина при преждевременной эякуляции ) и экспериментальное лекарство от рака. плинабулин (NPI-2358/KPU-2), который активен в линиях опухолевых клеток с множественной лекарственной устойчивостью (MDR). [ 2 ]
- 2,5-Дикетопиперазин Терапия
Благодаря своей роли в бактериальной коммуникации 2,5-ДКП могут быть использованы в качестве лекарства для лечения бактериальных заболеваний. Например, 2,5-ДКП цис было показано, что -цикло(Leu-Tyr) ингибирует образование бактериальной биопленки; это свойство можно использовать для лечения инфекций, вызванных образованием бактериальной биопленки. Эти химические вещества можно использовать для имитации сигналов определения кворума, чтобы регулировать экспрессию генов патогенных бактерий и помогать бороться с бактериальной инфекцией. [ 8 ]
Реагенты
[ редактировать ]Дикетопиперазин, получаемый из глицилсерина, является реагентом для получения С-алкилированных производных глицина. Этот подход полезен для производства неприродных аминокислот со стереохимическим контролем. Скелет дикетопиперазина защищает как N-, так и О-концы глицина. Для этого применения дикетопиперазин O-алкилируется с сопутствующим N -депротонированием с получением так называемого реагента Шёллькопфа . [ 16 ]
Ссылки
[ редактировать ]- ^ Кори Р.Б. (июль 1938 г.). «Кристаллическая структура дикетопиперазина». Журнал Американского химического общества . 60 (7): 1598–1604. дои : 10.1021/ja01274a023 .
- ^ Jump up to: а б с д и ж г час я дж Бортвик AD (май 2012 г.). «2,5-Дикетопиперазины: синтез, реакции, медицинская химия и биоактивные натуральные продукты». Химические обзоры . 112 (7): 3641–3716. дои : 10.1021/cr200398y . ПМИД 22575049 .
- ^ Jump up to: а б Бортвик AD, Да Коста, Северная Каролина (2017). «2,5-Дикетопиперазины в продуктах питания и напитках: вкус и биологическая активность». Критические обзоры в области пищевой науки и питания . 57 (4): 718–742. дои : 10.1080/10408398.2014.911142 . ПМИД 25629623 . S2CID 1334464 .
- ^ Симояма А., Огасавара Р. (апрель 2002 г.). «Дипептиды и дикетопиперазины в углеродистых хондритах Ямато-791198 и Мерчисона». Происхождение жизни и эволюция биосферы . 32 (2): 165–179. Бибкод : 2002OLEB...32..165S . дои : 10.1023/А:1016015319112 . ПМИД 12185674 . S2CID 21283306 .
- ^ Jump up to: а б Минелли А., Беллецца И., Гроттелли С., Галли Ф. (август 2008 г.). «Фокус на цикло (His-Pro): история и перспективы как антиоксидантного пептида». Аминокислоты . 35 (2): 283–289. дои : 10.1007/s00726-007-0629-6 . ПМИД 18163175 . S2CID 22563583 .
- ^ Прасад С (декабрь 1995 г.). «Биоактивные циклические дипептиды». Пептиды . 16 (1): 151–164. дои : 10.1016/0196-9781(94)00017-Z . ПМИД 7716068 . S2CID 44314137 .
- ^ Корначчиа К., Каччиаторе И., Бальдассар Л., Моллика А., Феличиани Ф., Пиннен Ф. (январь 2012 г.). «Дикетопиперазины как нейропротекторы». Мини-обзоры по медицинской химии . 12 (1): 2–12. дои : 10.2174/138955712798868959 . ПМИД 22070690 .
- ^ Jump up to: а б с д Илария Б (2014). «Циклические дипептиды: от жуков к мозгу» . Тенденции молекулярной медицины . 20 (10): 551–8. doi : 10.1016/j.molmed.2014.08.003 . ПМИД 25217340 .
- ^ Туллберг М., Гротли М., Лутман К. (июль 2006 г.). «Эффективный синтез 2,5-дикетопиперазинов с использованием микроволнового нагрева». Тетраэдр . 62 (31): 7484–7491. дои : 10.1016/j.tet.2006.05.010 .
- ^ Дёмлинг А. (январь 2006 г.). «Последние разработки в области многокомпонентных реакций на основе изоцианидов в прикладной химии». Химические обзоры . 106 (1): 17–89. дои : 10.1021/cr0505728 . ПМИД 16402771 .
- ^ Роден Ч.Р., Ривера Д.Г., Крей О., Бауэр А.К., Вестерманн Б., Вессйоханн Л.А. (октябрь 2009 г.). «Быстрый доступ к N-замещенным дикетопиперазинам с помощью Ugi-4CR / снятия защиты + активации / циклизации в одном горшке (UDAC)». Журнал комбинаторной химии . 11 (6): 1078–1082. дои : 10.1021/cc900106u . ПМИД 19795905 .
- ^ Маркаччини С., Пепино Р., Посо MC (апрель 2001 г.). «Простой синтез 2,5-дикетопиперазинов на основе химии изоцианидов». Буквы тетраэдра . 42 (14): 2727–2728. дои : 10.1016/S0040-4039(01)00232-5 .
- ^ Пэн Дж., Клайв Д.Л. (декабрь 2008 г.). «Асимметричный синтез системы ABC-кольц противоопухолевого антибиотика MPC1001». Журнал органической химии . 74 (2): 513–519. дои : 10.1021/jo802344t . ПМИД 19067592 .
- ^ Нагель У., Мензель Х., Леднор П.В., Бек В., Гайо А., Бартолин М. (май 1981 г.). «Попытки катализируемого родием (I) асимметричного гидрирования α-ацетамидокоричной кислоты с мономерными и полимерными аминофосфинами / Катализируемое родием (I) асимметричное гидрирование α-ацетамидокоричной кислоты с мономерными и полимерными аминофосфинами». Журнал естественных исследований Б. 36 (5): 578–584. дои : 10.1515/znb-1981-0510 . S2CID 95022362 .
- ^ Шено М., Жилайзо И., Уаму Н., Кудер Г. (август 2008 г.). «Новые достижения в синтезе и реакционной способности производных 1,4-дигидропиразина». Тетраэдр . 64 (35): 8059–8066. дои : 10.1016/j.tet.2008.06.080 .
- ^ Вирт Т (1997). «Новые стратегии использования α-алкилированных α-аминокислот». Angewandte Chemie International Edition на английском языке . 36 (3): 225–227. дои : 10.1002/anie.199702251 .