ДКМУ
| |

| |
| Имена | |
|---|---|
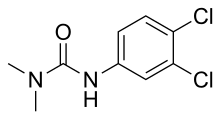
| Предпочтительное название ИЮПАК
N '-(3,4-Дихлорфенил) -N , N -диметилмочевина | |
| Другие имена
3-(3,4-Дихлорфенил)-1,1-диметилмочевина, Кармекс, Диурон, Дирекс
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.005.778 |
| Номер ЕС |
|
| КЕГГ | |
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 3077, 2767 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 9 Н 10 Cl 2 Н 2 О | |
| Молярная масса | 233.09 g·mol −1 |
| Появление | белое кристаллическое твердое вещество [ 1 ] |
| Плотность | 1,48 г/см 3 |
| Температура плавления | 158 ° С (316 ° F; 431 К) |
| Точка кипения | 180 ° С (356 ° F; 453 К) |
| 42 мг/л | |
| Давление пара | 0,000000002 мм рт.ст. (20°C) [ 1 ] |
| Опасности | |
| СГС Маркировка : | |
  
| |
| Предупреждение | |
| Х302 , Х351 , Х373 , Х410 | |
| P201 , P202 , P260 , P264 , P270 , P273 , P281 , P301+P312 , P308+P313 , P314 , P330 , P391 , P405 , P501 | |
| точка возгорания | негорючий [ 1 ] |
| NIOSH (пределы воздействия на здоровье в США): | |
ПЭЛ (допустимо)
|
никто [ 1 ] |
РЕЛ (рекомендуется)
|
СВВ 10 мг/м 3 [ 1 ] |
IDLH (Непосредственная опасность)
|
без даты [ 1 ] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
DCMU ( 3-(3,4-дихлорфенил)-1,1-диметилмочевина ) — альгицид и гербицид класса арилмочевины , ингибирующий фотосинтез . Он был представлен компанией Bayer в 1954 году под торговым названием Diuron .
История
[ редактировать ]В 1952 году химики компании EI du Pont de Nemours and Company запатентовали серию арилмочевины в производных качестве гербицидов . Несколько соединений, подпадающих под этот патент, были коммерциализированы в качестве гербицидов: хлортолурон (3-хлор-4-метилфенил) и DCMU, пример (3,4-дихлорфенила). [ 2 ] [ 3 ] Впоследствии на рынок мира поступило более тридцати родственных аналогов мочевины с таким же механизмом действия. [ 4 ]
Синтез
[ редактировать ]Как описано в патенте Дюпона, исходным материалом является 3,4-дихлоранилин , который обрабатывают фосгеном с образованием производного изоцианата . Впоследствии его подвергают реакции с диметиламином с получением конечного продукта. [ 2 ]
- Арил-NH 2 + COCl 2 → Арил-NCO
- Арил-NCO + NH(CH 3 ) 2 → Арил-NHCON(CH 3 ) 2
Механизм действия
[ редактировать ]DCMU — очень специфический и чувствительный ингибитор фотосинтеза. Q B пластохинона Он блокирует сайт связывания фотосистемы II , препятствуя потоку электронов от фотосистемы II к пластохинону. [ 5 ] Это прерывает фотосинтетическую цепь переноса электронов при фотосинтезе и, таким образом, снижает способность растения превращать световую энергию в химическую энергию ( АТФ и восстановительный потенциал ).
DCMU только блокирует поток электронов из фотосистемы II, он не влияет на фотосистему I или другие реакции фотосинтеза, такие как поглощение света или фиксация углерода в цикле Кальвина . [ нужна ссылка ]
Однако, поскольку он блокирует попадание электронов, образующихся в результате окисления воды в ФС II , в пул пластохинона, «линейный» фотосинтез эффективно прекращается, поскольку нет доступных электронов для выхода из фотосинтетического цикла потока электронов для восстановления НАДФ. + к НАДФН. Фактически было обнаружено, что DCMU не только не ингибирует циклический путь фотосинтеза , но при определенных обстоятельствах фактически стимулирует его. [ 6 ] [ 7 ]
Из-за этих эффектов DCMU часто используется для изучения потока энергии при фотосинтезе .
Токсичность
[ редактировать ]DCMU (Диурон) был охарактеризован как известный/вероятный канцероген для человека на основании испытаний на животных. [ 8 ] [ 9 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Карманный справочник NIOSH по химическим опасностям. «#0247» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б Патент США 2655445 , Тодд К.В., «3-(Галофенил)-1-метил-1-(метил или этил)мочевины и гербицидные композиции и способы их использования», выдан 13 октября 1953 г., передан EI du Pont de Nemours & Ко.
- ^ Лю, Цзин (2010). «Гербициды фенилмочевины». Справочник Хейса по токсикологии пестицидов . стр. 1725–1731. дои : 10.1016/B978-0-12-374367-1.00080-X . ISBN 9780123743671 .
- ^ «Карбамидные гербициды» . alanwood.net . Проверено 26 марта 2021 г.
- ^ Мец, Дж; Пакраси, Х; Зайберт, М; Арнтцер, К. (1986). «Доказательства двойной функции белка D1, связывающего гербицид, в фотосистеме II» . Письма ФЭБС . 205 (2): 269. дои : 10.1016/0014-5793(86)80911-5 . S2CID 84205263 .
- ^ HUBER, SC EDWARDS, GE (1976), Исследования пути циклического потока электронов в хлоропластах мезофилла растения C4, Biochimica et Biophysica Acta (BBA) - Биоэнергетика, том 449, выпуск 3, 6 декабря 1976 г., страницы 420- 433, дои : 10.1016/0005-2728(76)90153-5
- ^ Хослер, JP; Йокум, CF (апрель 1987 г.). «Регуляция циклического фотофосфорилирования во время транспорта электронов, опосредованного ферредоксином: влияние DCMU и соотношение НАДФН/НАДФ» . Физиол растений . 83 (4): 965–9. дои : 10.1104/стр.83.4.965 . ПМЦ 1056483 . ПМИД 16665372 .
- ^ «Диурон» . Национальный центр биотехнологической информации . Национальная медицинская библиотека США . Проверено 9 ноября 2021 г.
- ^ Линда, Тейлор; Эстер, Ринде (8 мая 1997 г.). Экспертная оценка канцерогенности диурона (PDF) (Меморандум). Вашингтон, округ Колумбия: Агентство по охране окружающей среды США. 20460.