Осилодростат
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Истуриса |
| Другие имена | ЛКИ-699 |
| AHFS / Drugs.com | Монография |
| Данные лицензии | |
| Беременность категория | |
| Маршруты администрация | Через рот |
| Класс препарата | Ингибитор стероидогенеза |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
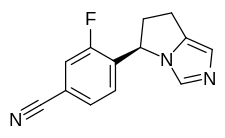
| Формула | С 13 Ч 10 Ж Н 3 |
| Молярная масса | 227.242 g·mol −1 |
| 3D model ( JSmol ) | |
Осилодростат , продаваемый под торговой маркой Isturisa , представляет собой лекарство для лечения взрослых с болезнью Кушинга , которые либо не могут пройти операцию на гипофизе, либо перенесли операцию, но все еще страдают болезнью. [ 3 ] Его принимают внутрь. [ 3 ]
Наиболее распространенными побочными эффектами являются недостаточность надпочечников , головная боль , рвота , тошнота , усталость и отеки (отек, вызванный задержкой жидкости). [ 3 ] [ 4 ]
У людей, принимающих осилодростат, также могут наблюдаться гипокортизолизм (низкий уровень кортизола), удлинение интервала QTc (нарушение сердечного ритма) и повышение уровня гормонов надпочечников предшественников (неактивное вещество, превращающееся в гормон) и андрогенов (гормон, который регулирует мужские характеристики). [ 3 ]
Осилодростат был одобрен для медицинского применения в Европейском Союзе в январе 2020 года. [ 4 ] и для медицинского использования в США в марте 2020 года. [ 3 ] [ 5 ] [ 6 ] США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) считает его первым в своем классе лекарством . [ 7 ]
Осилодростат — это активный при пероральном приеме , нестероидный кортикостероидов ингибитор биосинтеза , который был разработан компанией Novartis для лечения синдрома Кушинга и гипофизарной АКТГ гиперсекреции (специфический подтип синдрома Кушинга). [ 8 ] Он действует как мощный и селективный ингибитор альдостеронсинтазы ( CYP11B2 ) и в более высоких дозах 11β-гидроксилазы (CYP11B1). [ 8 ]
История
[ редактировать ]В октябре 2014 года Европейская комиссия присвоила осилодростату статус «сирота» для лечения синдрома Кушинга. [ 9 ]
Осилодростат был одобрен для медицинского применения в Европейском Союзе в январе 2020 года. [ 4 ] и для медицинского использования в США в марте 2020 года. [ 3 ] [ 5 ]
Безопасность и эффективность осилодростата для лечения болезни Кушинга среди взрослых оценивалась в исследовании с участием 137 взрослых субъектов (около трех четвертей женщин) со средним возрастом 41 год. [ 3 ] Большинство испытуемых либо перенесли операцию на гипофизе, которая не излечила болезнь Кушинга, либо не были кандидатами на хирургическое вмешательство. [ 3 ] В течение 24-недельного открытого периода с одной группой все субъекты получали стартовую дозу 2 миллиграмма (мг) осилодростата два раза в день, которую можно было увеличивать каждые две недели до 30 мг два раза в день. [ 3 ] В конце этого 24-недельного периода примерно у половины испытуемых уровень кортизола находился в пределах нормы. [ 3 ] После этого 71 субъект, которым не требовалось дальнейшее увеличение дозы и которые хорошо переносили препарат в течение последних 12 недель, вошли в восьминедельное двойное слепое рандомизированное исследование отмены, в котором они получали либо осилодростат, либо плацебо (неактивное лечение). [ 3 ] В конце периода отмены у 86% субъектов, получавших осилодростат, уровень кортизола оставался в пределах нормы по сравнению с 30% субъектов, принимавших плацебо. [ 3 ]
США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило осилодростат на основании данных одного клинического исследования (NCT02180217) с участием 137 субъектов с болезнью Кушинга. [ 5 ] Исследование проводилось в 66 центрах в 19 странах (США, Аргентина, Австрия, Болгария, Канада, Китай, Колумбия, Германия, Испания, Франция, Великобритания, Индия, Италия, Япония, Корея, Нидерланды, Россия, Таиланд и Япония. Турция). [ 5 ]
Было проведено одно исследование продолжительностью 48 недель, в котором оценивались преимущества и побочные эффекты осилодростата. [ 5 ] В исследование были включены субъекты с болезнью Кушинга, для которых операция на гипофизе была невозможна или не эффективна. [ 5 ] Суд был разделен на четыре периода. [ 5 ] Субъекты получали осилодростат два раза в день во все четыре периода. [ 5 ] После первых двух периодов (24 недели) пользу осилодростата оценивали по проценту субъектов, у которых уровень свободного кортизола в 24-часовой моче находился в пределах нормы. [ 5 ]
В третьем периоде (который длился восемь недель) половина субъектов, у которых был нормальный уровень свободного кортизола в моче после 24 недель лечения, продолжали принимать осилодростат, а другая половина была переведена на плацебо. [ 5 ] Ни субъекты, ни медицинские работники не знают, какое лечение проводилось в этот период. [ 5 ] Пользу осилодростата оценивали по проценту субъектов, у которых уровень кортизола был нормальным в конце этого периода, по сравнению с субъектами, получавшими плацебо. [ 5 ]
FDA присвоило осилодростату статус орфанного препарата и разрешило Novartis использовать препарат Истуриса . [ 3 ] [ 6 ]
Расходы
[ редактировать ]При рекомендуемой начальной дозе 2 мг годовой запас будет стоить 172 800 долларов США в ценах 2021 года в США. [ 10 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б «Истуриса» . Управление терапевтических товаров (TGA) . 29 августа 2022 г. Проверено 29 апреля 2023 г.
- ^ «Обновления базы данных о назначении лекарственных средств при беременности» . Управление терапевтических товаров (TGA) . 21 декабря 2022 года. Архивировано из оригинала 3 апреля 2022 года . Проверено 2 января 2023 г.
- ^ Jump up to: а б с д и ж г час я дж к л м «FDA одобрило новое лечение для взрослых с болезнью Кушинга» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 6 марта 2020 года. Архивировано из оригинала 26 июля 2020 года . Проверено 6 марта 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с «Истуриса ЭПАР» . Европейское агентство лекарственных средств (EMA) . 18 февраля 2020 года. Архивировано из оригинала 7 марта 2020 года . Проверено 6 марта 2020 г.
- ^ Jump up to: а б с д и ж г час я дж к л «Снимок судебного процесса над наркотиками: Истуриса» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 6 марта 2020 года. Архивировано из оригинала 21 сентября 2020 года . Проверено 27 марта 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б «Пакет одобрения лекарств: Истуриса» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 6 апреля 2020 года. Архивировано из оригинала 21 января 2021 года . Проверено 17 января 2021 г.
- ^ «Новые разрешения на лекарственную терапию 2020» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 31 декабря 2020 года. Архивировано из оригинала 18 января 2021 года . Проверено 17 января 2021 г.
- ^ Jump up to: а б Флезериу М, Кастинетти Ф (2016). «Обновленная информация о роли ингибиторов стероидогенеза надпочечников при синдроме Кушинга: внимание к новым методам лечения» . Гипофиз . 19 (6): 643–653. дои : 10.1007/s11102-016-0742-1 . ПМК 5080363 . ПМИД 27600150 .
- ^ «ЕС/3/14/1345» . Европейское агентство лекарственных средств (EMA) . 17 сентября 2018 г. Архивировано из оригинала 24 июля 2020 г. . Проверено 23 июля 2020 г.
- ^ Юэнь, Кевин CJ (сентябрь 2021 г.). «Осилодростат: обзор недавних клинических исследований и практические рекомендации по его использованию при лечении болезни Кушинга». Эндокринная практика . 27 (9): 956–965. doi : 10.1016/j.eprac.2021.06.012 . ПМИД 34389514 . S2CID 237009673 .
Дальнейшее чтение
[ редактировать ]- Турку А., Смит Дж.М., Охус Р. и др. (октябрь 2014 г.). «Надпочечниковые андрогены и предшественники андрогенов: определение, синтез, регуляция и физиологическое действие» . Компр Физиол . 4 (4): 1369–81. дои : 10.1002/cphy.c140006 . ISBN 9780470650714 . ПМЦ 4437668 . ПМИД 25428847 . НИХМСИД: NIHMS689229.
Внешние ссылки
[ редактировать ]- Номер клинического исследования NCT02697734 «Оценка эффективности и безопасности осилодростата при болезни Кушинга (LINC-4)» на сайте ClinicalTrials.gov.