Аденилилирование

Аденилилирование , [ 1 ] [ 2 ] Более широко известный как ампилирование , представляет собой процесс, в котором молекула аденозина монофосфата (AMP) ковалентно прикреплена к аминокислотной боковой цепи белка . [ 3 ] Это ковалентное добавление AMP к гидроксильной боковой цепи белка представляет собой посттрансляционную модификацию . [ 4 ] Аденилилирование включает в себя фосфодиэфирную связь между гидроксильной группой молекулы, подвергающейся аденилилированию, и фосфатной группой аденозинового монофосфатного нуклеотида (то есть адениловой кислоты). Ферменты , способные катализировать этот процесс, называются ампилаторами.
Известными аминокислотами, которые должны быть нацелены в белке, являются тирозин и треонин , а иногда и серины . [ 5 ] Когда заряды на белке подвергаются изменению, это влияет на характеристики белка, обычно путем изменения его формы посредством взаимодействия аминокислот, которые составляют белок. Ампилирование может оказывать различное влияние на белок. Это свойства белкового подобного, стабильность, ферментативная активность, кофакторное связывание и многие другие функциональные возможности белка. Другой функцией аденилилирования является аминокислотная активация, которая катализируется тРНК -аминоацил -синтетазой. [ 3 ] Наиболее часто идентифицированным белком для получения ампилирования являются GTPases, а глютамин -синтетаза .
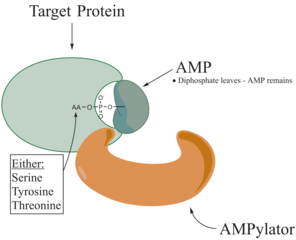
Аденилилаторы
[ редактировать ]Ферменты, ответственные за ампилирование, называемые ампилаторами или аденилалтрансферазой , падают на два разных семейства, все в зависимости от их структурных свойств и используемого механизма. Ампилатор создается двумя каталитическими гомологичными половинками. Одна половина отвечает за катализирование реакции аденилилирования, в то время как другая половина катализирует фосфоролитическую реакцию мерденилилирования [ 2 ] Полем Эти два семейства являются ДНК -β -полимеразоподобным и семейством FIC. [ 6 ]
ДНК- β -полимеразоподобный, является семейством нуклеотидилтрансферазы . [ 4 ] Это более конкретно известно как семья GLNE. Существует конкретный мотив, который используется для прояснения этой конкретной семьи. Мотив состоит из трехполированного β-листа, который является частью координации ионов магния и связывания фосфатов. Аспартат необходим для деятельности в этой семье.
домен FIC принадлежит FIDO (FIC/DOC) SuperFamilyfic Family Известно, что , которая является филаментом, вызванным циклическим доменом AMP, выполняет ампилирование. Этот термин был придуман, когда были обнаружены VOP от Vibrio parahaemolyticus, которые модифицировали Rhogtpases с помощью AMP на серине. Это семейство белков встречается во всех областях жизни на Земле. Он опосредуется механизмом АТФ-связывающего мотива альфа-спирали. Инфекционные бактерии используют этот домен для прерывания фагоцитоза и вызвать гибель клеток. Домены FIC являются эволюционно консервативными доменами у прокариот и эукариот , которые принадлежат к суперсемейству домена FIDO. [ 4 ]
Было показано, что ампилаторы сопоставимы с киназами из -за их гидролизной активности АТФ и обратимого переноса метаболита в гидроксильную боковую цепь белкового субстрата. Однако ампилирование катализирует нуклеофильную атаку на α-фосфатную группу, в то время как киназа в реакции фосфорилирования нацелена на γ-фосфат. Нуклеофильная атака ампилирования приводит к высвобождению пирофосфата, а AMP-модифицированный белок являются продуктами реакции ампилирования. [ 5 ]

Де-Аденилилаторы
[ редактировать ]Де-ампулирование-это обратная реакция, в которой молекула AMP отделяется от аминокислотной стороны цепного белка.
Есть три известных механизма для этой реакции. Бактериальная GS-атаза (GLNE) кодирует двухпартийный белок с отдельным N-концевым ампилированием и C-терминальным доменом отмены амбилирования, активность которых регулируется P II и связанными с ними посттрансляционными модификациями. Дебилирование его субстратной ампилированной глютамин-синтетазы проходит фосфоролитической реакцией между аденило-тирозином GS и ортофосфатом , что приводит к образованию ADP и немодифицированной синтетазы глутамина. [ 4 ]
Сидд, белок, введенный в клетке-хозяине с помощью патогенных бактерий Legionella pneumophila , де-аммилат Rab1 A-белок-хозяин, ампилированный другим ферментом пневмофилы Legionella , ампилазой Sidm. Несмотря на то, что преимущество патогена введения этих двух антагонистических эффекторов у хозяина остается неясной, биохимическая реакция, осуществляемая SIDD [ 7 ]
В клетках животных удаление AMP из треонина 518 BIP/GRP78 катализируется тем же ферментом, FICD, который ампилирует BIP. В отличие от бактериальной GS-атазы, FICD проводит обе реакции с тем же каталитическим доменом. [ 8 ]
Аденилилирование в прокариотах
[ редактировать ]Бактериальный гомеостаз
[ редактировать ]Ампилирование участвует в бактериальном гомеостазе. Наиболее известным примером является ампилаторная GS-атаза (GLNE), которая вносит вклад в сложную регуляцию метаболизма азота посредством ампилирования глутамин-синтетазы, которая была введена в частях ампилирования и демпилирования.
Другим примером ампилаторов, которые играют роль в бактериальном гомеостазе, является ампилаторы I -класса (FICT), которая модифицирует субъединицу GYRB ДНК -гиразы, консервативный остаток тирозина для связывания АТФ субъединицы PARE в топоизомеразе IV. Эта инактивация ДНК -гиразы путем ампилирования приводит к активации ответа SOS, который является клеточным ответом на повреждение ДНК. Активность ампилирования фиктов является обратимой и приводит только к остановке роста, но не к гибели клеток. Следовательно, фондовое ампилирование играет роль в регуляции клеточного стресса, что показано в бактериях Wolbachia, что уровень фикта увеличивается в ответ на доксициклин.
Также обнаружено, что AMPYLATOR NMFIC N. MeningTidis класса III модифицирует ампилат GYRB в консервативном тирозине для связывания АТФ. Это показывает, что домены FIC высоко консервативны, что указывает на важную роль ампилирования в регуляции клеточного стресса у бактерий. Регуляция NMFIC включает в себя зависимую от концентрации мономеризацию и аутоаминирование для активации активности NMFIC. [ 5 ]
Бактериальная патогенность
[ редактировать ]Было показано, что белки бактерий, также известные как эффекторы, используют ампилирование. Было показано, что эффекторы, такие как VOP, IBPA и DRRA, являются ампилирующими GTPases хозяина и вызывают изменения актинового цитоскелета. GTPases являются общими мишенями ампилаторов. Семейства Rho , Rab и ARF GTPase участвуют в динамике актинового цитоскелета и везикулярной торговле. Они также играют роль в клеточных механизмах контроля, таких как фагоцитоз в клетке -хозяине.
Патоген усиливает или предотвращает его интернализацию , либо индуцируя или ингибируя фагоцитоз клеток -хозяина [ 4 ] Полем Vibrio parahaemolyticus -это грамотрицательная бактерия, которая вызывает пищевое отравление в результате сырого или недоваренного потребления морепродуктов у людей. [ 9 ] VOPS, эффектор типа III, обнаруженный в Vibrio parahaemolyticus , содержит фик -домен, который имеет консервативный мотив HPFX (D/e) GN (G/K), который содержит остаток гистидина, необходимый для ампилирования. VOPS блокируется актиновая сборка путем изменения остатков треонина в области переключателя 1 Rho GTPases. Передача фрагмента усилителя с использованием АТФ к остаткам треонина приводит к стерическому препятствию и, таким образом, предотвращает взаимодействие Rho GTPases с последующими эффекторами. VOPS также аденилирует RhoA и Cell Diving Cycl 42 (CDC42), что приводит к дезагрегации сети актиновых филаментов. [ 3 ] [ 5 ] В результате контроль актинового цитоскелета клетки хозяина отключен, что приводит к округлению клеток. [ 4 ] [ 9 ]
IBPA секретируется в эукариотические клетки от H. somni , грамотрицательной бактерии у крупного рогатого скота, которая вызывает инфекцию дыхательного эпителия. Этот эффектор содержит два домена FIC в С-концевой области. Ампилирование домена IBPA FIC семейства GTPases является ответственным за его цитотоксичность. Оба домена FIC оказывают сходное влияние на цитоскелет клеток -хозяев в качестве VOPS. [ 3 ] [ 5 ] Ампилирование на остатках тирозина в области переключателя 1 блокирует взаимодействие GTPases с нижестоящими подложками, такими как PAK.
DRRA - это подложка транслокации DOT/ICM типа IV DRRA от Legionella pneumophila . Это эффектор, секретируемый L. pneumophila для модификации GTPases клеток -хозяев. Эта модификация увеличивает выживание бактерий в клетках -хозяевах. DRRA состоит из домена гуанинового специфического нуклеотидного обмена (GEF), C-концевого домена, связывающего липид и N-концевого домена с неясными цитотоксическими свойствами. Исследовательские работы показывают, что N-концевая и полноразмерная DRRA демонстрирует активность ампилаторов в отношении белка Rab1b хозяина (белок, связанный с RAS), который также является субстратом домена GEF RAB1B. Белок RAB1B является GTPase RAB для регулирования транспорта пузырьков и слияния мембраны. Аденилирование бактериями ампилаторов продлевает GTP-связанное состояние Rab1b. Таким образом, роль эффекторной DRRA связана с преимуществами вакуолей бактерий для их репликации во время инфекции. [ 3 ] [ 5 ]
Adenlylation у эукариот
[ редактировать ]Растения и дрожжи не имеют известных эндогенных ампилирующих ферментов, но геномы животных наделены единой копией гена, кодирующего ампилазу FIC-домен, ампилазы, [ 10 ] Это, вероятно, было приобретено ранним предком животных с помощью горизонтального переноса генов из прокариота. Человеческий белок, называемый обычно как FICD, ранее был идентифицирован как белок, связанный с охотником (ажиотаж; назначение, возникающее из двухгибридного экрана дрожжей, но сомнительной значимости, поскольку хантингтин и шумиха/FICD локализованы в разных клеточных компартментах) Полем Гомологи CG9523 у Drosophila melanogaster (CG9523) и C. elegans (FIC-1) также привлекли внимание. У всех животных FICD имеет аналогичную структуру. Это белок трансмембранного домена типа II , с коротким цитоплазматическим доменом с последующим мембранным якорем, который удерживает белок в эндоплазматическом ретикулуме (ER) и длинной C-концевой части, которая находится в ER и охватывает тетратропептид (TPRS), сопровождается каталитическим Фик -домен. [ 11 ]
Эндоплазматический ретикулум
[ редактировать ]Открытие ампилазы животных клеток, [ 10 ] Затем следует открытие локализации ER и что BIP является выдающимся субстратом для ее деятельности [ 12 ] были важными прорывами. BIP (также известный как GRP78), как известно, проходил инактивирующую посттрансляционную модификацию, [ 13 ] [ 14 ] Но это природа остается неуловимой. Широко предполагается, что это ADP-рибозилирование , оказалось, что это FICD-опосредованное ампилирование, так как инактивирование гена FICD в клетках отменила всю измеримую посттрансляционную модификацию BIP. [ 15 ]
BIP-это ER-локализированный белковый шаперон , активность которого жестко регулируется на уровне транскрипции посредством программы экспрессии генов, известной как развернутый белковый ответ (UPR). UPR-это гомеостатический процесс, который объединяет скорость транскрипции BIP (и многие другие белки) на бремя развернутых белков в ER (так называемый ER-стресс), чтобы помочь поддерживать протеостаз ER . Ампилирование добавляет еще один быстрый посттрансляционный слой контроля активности BIP, так как модификация THR518 субстрат-связывающего домена BIP с усилителем блокирует шаперон в неактивную конформацию. [ 16 ] [ 17 ] Эта модификация избирательно развернута, когда стресс ER уменьшается, чтобы инактивировать избыточный бип. Однако по мере того, как стресс ER снова повышается, тот же фермент, FICD, катализирует противоположную реакцию, дебилирование BIP. [ 8 ]
Постепенное понимание структурной основы ампилирования бипсов и де-амбилирования постепенно появляется, [ 18 ] [ 19 ] Как и подсказки к аллостерии , которая может регулировать переключатель в деятельности FICD [ 20 ] Но важные детали этого процесса, как это происходит в клетках, еще предстоит обнаружить.
Роль FICD в ампилировании BIP (и De-амбилирования) в THR518 хорошо подтверждается биохимическими и структурными исследованиями. Также были представлены доказательства того, что в некоторых обстоятельствах FICD может ампилировать другой остаток, Thr366 в домене связывания нуклеотидов BIP. [ 12 ]
Caenorhabditis elegans
[ редактировать ]FIC-1 является единственным белком FIC, присутствующим в генетическом коде C. elegans . В первую очередь он обнаруживается в ядерной оболочке ER взрослых клеток зародышевой линии и эмбриотических клеток, но в цитоплазме можно найти небольшие количества. Этот экстра-экс-пул FICD-1 приписывается ампилированием основных гистонов и факторов трансляции типа EEF1-A в нематоде. [ 21 ]
Хотя различные уровни ампилирования не создавали никаких заметных эффектов в рамках поведения или физиологии нематоды, черви, нокаутированные на FIC-1, были более восприимчивы к инфекции Pseudomonas aeruginosa по сравнению с аналогами с активными доменами FIC-1, что подразумевает связь между ампилированием по сравнению с аналоги Иммунные ответы в нематодах. [ 11 ]
Drosophila melanogaster
[ редактировать ]Мухи, отсутствующие в FICD (CG9523), были описаны как слепые. Первоначально этот дефект был связан с роли FICD на клеточной поверхности капитальных проекций - предполагаемого места переработки нейротрансмиттеров [ 22 ] Однако более позднее исследование, связанное с FICD-опосредованным ампилированием BIP Thr366 в визуальной проблеме [ 23 ]
Клиническое значение
[ редактировать ]Было обнаружено, что пресинаптический белок α-синуклеин является мишенью для ампилирования FICD. Во время опосредованного шумихом аденилилирование αSYN агрегация αSyn снижается, и было обнаружено, что нейротоксичность и ER-стресс снижают in vitro . Таким образом, аденилилирование αSyn, возможно, является защитной реакцией на стресс ER и агрегацию αSYN. Однако, поскольку Asyn и FICD проживают в различных отсеках, необходимо провести дальнейшие исследования, подтверждают значимость этих претензий. [ 24 ]
Обнаружение
[ редактировать ]Химические ручки
[ редактировать ]Химические ручки используются для обнаружения посттрансляционно модифицированных белков. Недавно существует N6PATP, который содержит алкинил -метку (ProPargyl) в положении N6 Атенина АТФ. Этот N6PATP объединяется с реакцией щелчка для обнаружения ампилированных белков. Для обнаружения нераспознанных модифицированных белков и субстратов вин -винов, производные АТФ с флуорофором в аденине N6 NH2 используются для этого. [ 5 ] [ 6 ]
Метод на основе антител
[ редактировать ]Антитело известно своим высоким сродством и селективностью, поэтому это хороший способ обнаружить ампилированные белки. В последнее время антитела AMP используются для непосредственного обнаружения и изоляции ампилированных белков (особенно ампилированный тирозин и ампилированный треонин) из клеток и клеточных лизатов. Ампилирование-это посттрансляционная модификация, поэтому оно будет модифицировать свойства белка, давая полярный характер AMP и гидрофобности. Таким образом, вместо использования антител, которые обнаруживают целую пептидную последовательность, предпочтительнее, поднятие антител AMP, непосредственно нацеленных на специфические аминокислоты. [ 5 ] [ 6 ]
Масс -спектрометрия
[ редактировать ]Ранее многие научные работы использовали масс -спектрометрию (MS) в различных режимах фрагментации для обнаружения ампилированных пептидов. В ответах на отличительные методы фрагментации последовательности ампилированных белков распадались в разных частях AMP. В то время как диссоциация переноса электрона (ETD) создает минимальные фрагменты и менее сложные спектры, вызванная столкновением диссоциация (CID) и фрагментация высокого энергопотребления (HCD) генерирует характерные ионы, подходящие для идентификации ампилированных белков путем генерации множественных фрагментов AMP. Из -за стабильности AMP спектры пептидной фрагментации легко читать вручную или с поисковыми системами. [ 5 ] [ 6 ]
Ингибиторы
[ редактировать ]ингибиторы ампилирования белка с ингибирующей постоянной (k i ) в диапазоне от 6 до 50 мкм и по меньшей мере 30 -кратной селективности. Были обнаружены [ 25 ] [ 5 ] [ 6 ]
Ссылки
[ редактировать ]- ^ Хан К.К., Мартинаж А. (1992). «Посттрансляционная химическая модификация белков». Международный журнал биохимии . 24 (1): 19–28. doi : 10.1016/0020-711x (92) 90225-p . PMID 1582530 .
- ^ Jump up to: а беременный Garrett RH, Grisham CM (2007). Биохимия (3 -е изд.). Белмонт, Калифорния: Томас. С. 815–20.
- ^ Jump up to: а беременный в дюймовый и Itzen A, Blankenfeldt W, Goody Rs (апрель 2011 г.). «Аденилилирование: Ренессанс забытой посттрансляционной модификации». Тенденции в биохимических науках . 36 (4): 221–8. doi : 10.1016/j.tibs.2010.12.004 . PMID 21256032 .
- ^ Jump up to: а беременный в дюймовый и фон Woolery AR, Luong P, Broberg CA, Orth K (2010). «Ампилирование: что -то старое снова новое» . Границы в микробиологии . 1 : 113. doi : 10.3389/fmicb.2010.00113 . PMC 3095399 . PMID 21607083 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж Кейси А.К., Орт К (февраль 2018 г.). «Ферменты, участвующие в ампилировании и демпилировании» . Химические обзоры . 118 (3): 1199–1215. doi : 10.1021/acs.chemrev.7b00145 . PMC 5896785 . PMID 28819965 .
- ^ Jump up to: а беременный в дюймовый и Hedberg C, Itzen A (январь 2015 г.). «Молекулярные перспективы на аденилилирование белка» . ACS Химическая биология . 10 (1): 12–21. doi : 10.1021/cb500854e . PMID 25486069 .
- ^ Чен Y, Tasccón I, Palara C, Brady. (2013). Структурный базис для Rab1 De-Ampyella . PLOS Pattogens 9 (5): E103382. doi : 13.1371/Журнал . PMC 3656104 . PMID 23696742 .
- ^ Jump up to: а беременный Preissler S, Rato C, Perera L, Saudek V, Ron D (январь 2017 г.). «FICD действует бифункционально ампилат и де-амбилат эндоплазматический бип шаперона эндоплазматического ретикулума» . Природа структурная и молекулярная биология . 24 (1): 23–29. doi : 10.1038/nsmb.3337 . PMC 5221731 . PMID 27918543 .
- ^ Jump up to: а беременный Luong P, Kinch LN, Brautigam CA, Grishin NV, Tomchick Dr, Orth K (июнь 2010 г.). «Кинетическое и структурное понимание механизма ампилирования VOPS FIC -доменом» . Журнал биологической химии . 285 (26): 20155–63. doi : 10.1074/jbc.m110.114884 . PMC 2888428 . PMID 20410310 .
- ^ Jump up to: а беременный Worby CA, Mattoo S, Kruger RP, Corbeil LB, Koller A, Mendez JC, et al. (Апрель 2009 г.). «Домен FIC: регуляция передачи сигналов клеток путем аденилилирования» . Молекулярная клетка . 34 (1): 93–103. doi : 10.1016/j.molcel.2009.03.008 . PMC 2820730 . PMID 19362538 .
- ^ Jump up to: а беременный Truttmann MC, Ploegh HL (август 2017 г.). «Усиление сигналов стресса: ампилирование белка у метазоаций» . Тенденции в клеточной биологии . 27 (8): 608–620. doi : 10.1016/j.tcb.2017.03.004 . PMC 5524611 . PMID 28433487 .
- ^ Jump up to: а беременный Хэм Х, Вулери А.Р., Трейси С., Стенесен Д., Крамер Х, Орт К (декабрь 2014 г.). «Развернутый белок-реактивный белок, регулируемый Drosophila FIC (DFI) белок обратимо, обратимо ампилирует бип-шаперон во время гомеостаза эндоплазматического ретикулума» . Журнал биологической химии . 289 (52): 36059–69. doi : 10.1074/jbc.m114.612515 . PMC 4276871 . PMID 25395623 .
- ^ Carlsson L, Lazarides E (август 1983 г.). «АДФ-рибозилирование МР 83 000, индуцируемого стрессом и регулируемым белком глюкозы в клетках птичьего и млекопитающего: модуляция с помощью теплового шока и голода с глюкозой» . Труды Национальной академии наук Соединенных Штатов Америки . 80 (15): 4664–8. Bibcode : 1983pnas ... 80.4664c . doi : 10.1073/pnas.80.15.4664 . PMC 384104 . PMID 6576354 .
- ^ Hendershot LM, Ting J, Lee As (октябрь 1988 г.). «Идентичность белка, связывающего тяжелую цепь, иммуноглобулин с белком, регулируемым глюкозой, регулируемым 78 000, и роль посттрансляционных модификаций в ее функции связывания» . Молекулярная и клеточная биология . 8 (10): 4250–6. doi : 10.1128/mcb.8.10.4250-4256.1988 . PMC 365497 . PMID 3141786 .
- ^ Preissler S, Rato C, Chen R, Antrobus R, Ding S, Fearnley IM, Ron D (декабрь 2015 г.). «Ампилирование соответствует активности BIP с нагрузкой белка клиента в эндоплазматической ретикулуме» . элиф . 4 : E12621. doi : 10.7554/elife.12621 . PMC 4739761 . PMID 26673894 .
- ^ Preissler S, Rohland L, Yan Y, Chen R, Read RJ, Ron D (октябрь 2017 г.). «Ампилирование нацелена на этап ограничивающей скорости цикла ATPase BIP для его функциональной инактивации» . элиф . 6 doi : 10.7554/elife.29428 . PMC 5667935 . PMID 29064368 .
- ^ Wieteska L, Shahidi S, Zhuravleva A (октябрь 2017 г.). «Алстерическая тонкая настройка конформационного равновесия снимает бип шаперона для посттрансляционной регуляции» . элиф . 6 doi : 10.7554/elife.29430 . PMC 5655141 . PMID 29064369 .
- ^ Fauser J, Gulen B, Pogenberg V, Pett C, Pourjafar-Dehkordi D, Krisp C, et al. (Апрель 2021 г.). «Специфичность ампилирования человеческого шаперона BIP опосредована мотивами TPR FICD» . Природная связь . 12 (1): 2426. Bibcode : 2021natco..12.2426f . doi : 10.1038/s41467-021-22596-0 . PMC 8065156 . PMID 33893288 .
- ^ Perera LA, Preissler S, Zaccai NR, Prevost S, Devos JM, Haertlein M, Ron D (август 2021 г.). «Структуры комплекса дезертирования рационализируют переключение между антагонистической каталитической активностью FICD» . Природная связь . 12 (1): 5004. Bibcode : 2021Natco..12.5004p . doi : 10.1038/s41467-021-25076-7 . PMC 8373988 . PMID 34408154 .
- ^ Perera LA, Rato C, Yan Y, Neidhardt L, McLaughlin SH, Read RJ, et al. (Октябрь 2019). «Олигомерный переключатель, зависящий от состояния в ферменте ER FICD, регулирует ампилирование и дезертирование BIP» . Embo Journal . 38 (21): E102177. doi : 10.15252/embj.2019102177 . PMC 6826200 . PMID 31531998 .
- ^ Truttmann MC, Cruz VE, Guo X, Engert C, Schwartz Tu, Ploegh HL (май 2016 г.). «Белок Caenorhabditis elegans FIC-1 является ампилазой, которая ковалентно модифицирует белки семейства теплового шока 70, факторы удлинения трансляции и гистоны» . PLOS Genetics . 12 (5): E1006023. doi : 10.1371/journal.pgen.1006023 . PMC 4854385 . PMID 27138431 .
- ^ Rahman M, Ham H, Liu X, Sugiura Y, Orth K, Krämer H (июнь 2012 г.). «Визуальная нейротрансмиссия у дрозофилы требует экспрессии FIC в глиальных капитальных проекциях» . Nature Neuroscience . 15 (6): 871–5. doi : 10.1038/nn.3102 . PMC 3578554 . PMID 22544313 .
- ^ Moehlman AT, Casey AK, Servage K, Orth K, Krämer H (июль 2018 г.). «Адаптация к постоянному свету требует FIC-опосредованного ампилирования BIP для защиты от обратимой дегенерации фоторецепторов» . элиф . 7 doi : 10.7554/elife.38752 . PMC 6066327 . PMID 30015618 .
- ^ Саньял А., Датта С., Камара А., Чандран А., Коллер А., Уотсон Б.Г. и др. (Май 2019). «Альфа-синуклеин является мишенью для FIC-опосредованного аденилилирования/ампилирования: возможные последствия для болезни Паркинсона» . Журнал молекулярной биологии . 431 (12): 2266–2282. doi : 10.1016/j.jmb.2019.04.026 . PMC 6554060 . PMID 31034889 .
- ^ Lewallen DM, Sreelatha A, Dharmarajan V, Madoux F, Chase P, Griffin PR, et al. (Февраль 2014 г.). «Ингибирование ампилирования: новый экран для идентификации первых небольших молекул -ингибиторов амбилирования белка» . ACS Химическая биология . 9 (2): 433–42. doi : 10.1021/cb4006886 . PMC 3944102 . PMID 24274060 .