Стрептококк агалактиае
| Стрептококк агалактиае | |
|---|---|

| |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Бациллота |
| Сорт: | Бациллы |
| Заказ: | лактобактерии |
| Семья: | Стрептококковые |
| Род: | Стрептококк |
| Разновидность: | С. агалактия
|
| Биномиальное имя | |
| Стрептококк агалактиае Леманн и Нейман, 1896 г.
| |
Streptococcus agalactiae (также известный как стрептококк группы B или GBS ) представляет собой грамположительный кокк (круглая бактерия ) со склонностью к образованию цепочек (что отражено в рода названии Streptococcus ). Это бета- гемолитический , каталазоотрицательный и факультативный анаэроб . [ 1 ] [ 2 ]
S. agalactiae — наиболее распространенный у человека возбудитель стрептококков, принадлежащих к группе В Ребекки Лэнсфилд классификации стрептококков . СГБ окружены бактериальной капсулой , состоящей из полисахаридов (экзополисахаридов). Вид подразделяется на десять серотипов (Ia, Ib, II–IX) в зависимости от иммунологической реактивности их полисахаридной капсулы. [ 1 ] [ 3 ] [ 4 ]
Термин «стрептококк группы B» во множественном числе (относящийся к серотипам) и термин « стрептококк группы B» в единственном числе (относящийся к одному виду) обычно используются как синонимы S. agalactiae , хотя S. halichoeri и S. pseudoporcinus также относятся к стрептококкам группы B. Эти виды относятся к группе B, но не часто передаются людьми и лишь изредка вызывают заболевания. [ 5 ]
В целом СГБ является безвредной комменсальной бактерией, входящей в состав микробиоты человека, колонизирующей желудочно-кишечный и мочеполовой тракт до 30% здоровых взрослых людей ( бессимптомных носителей ). Тем не менее, СГБ может вызывать тяжелые инвазивные инфекции, особенно у новорожденных, пожилых людей и людей с ослабленной иммунной системой. [ 6 ]
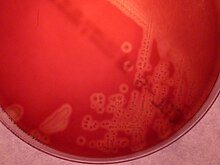
S. agalactiae также является распространенным ветеринарным патогеном, поскольку может вызывать мастит (воспаление вымени) у дойных коров. На это намекает видовое название agalactiae , означающее «без молока». [ 7 ]
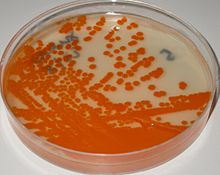



Лабораторная идентификация
[ редактировать ]СГБ легко растет на чашках с кровяным агаром в виде колоний, окруженных узкой зоной β- гемолиза . СГБ характеризуется наличием в клеточной стенке антигена группы В классификации Лансфилда ( Lancefield grouping ), который можно обнаружить непосредственно у интактных бактерий с помощью реакции латекс-агглютинации. [ 8 ] [ 9 ] Тест CAMP также является еще одним важным тестом для выявления СГБ. Фактор CAMP, продуцируемый GBS, действует синергически со стафилококковым β-гемолизином, вызывая усиленный гемолиз эритроцитов овцы или быка. [ 8 ] СГБ также способен гидролизовать гиппурат , и этот тест также можно использовать для предположительной идентификации СГБ. [ 8 ] Гемолитические штаммы GBS продуцируют оранжево-кирпично-красный неизопреноидный полиеновый ( орнитинрамнолипид) пигмент ( гранадаен ). [ 10 ] при выращивании на среде Гранада , что позволяет его легко идентифицировать. [ 11 ] GBS также можно идентифицировать с помощью приборов MALDI-TOF (матричная лазерная десорбция/ионизация-время пролета). [ 12 ] Колонии GBS можно дополнительно идентифицировать предварительно после их появления в хромогенной агаровой среде, тем не менее, GBS-подобные колонии, развивающиеся в хромогенной среде, следует подтверждать как GBS с использованием дополнительных надежных тестов (агглютинация эглатекса или тест CAMP), чтобы избежать возможной ошибочной идентификации. [ 9 ] [ 13 ] [ 14 ] Краткое описание лабораторных методов идентификации GBS представлено в ссылке 7. [ 9 ]
Колонизация СГБ
[ редактировать ]СГБ является нормальным компонентом кишечной и вагинальной микробиоты у некоторых людей, СГБ является бессимптомным (не имеющим симптомов) колонизатором желудочно -кишечного тракта и влагалища у до 30% здоровых взрослых, включая беременных женщин. [ 3 ] [ 15 ] Колонизация GBS может быть постоянной, периодической или временной. В различных исследованиях уровень вагинальной колонизации GBS колеблется от 0% до 36%, при этом в большинстве исследований сообщается, что уровень колонизации у сексуально активных женщин превышает 20%. [ 16 ] Было подсчитано, что материнская колонизация GBS во всем мире составляет 18% с региональными вариациями от 11% до 35%. [ 17 ] Эти различия в зарегистрированной распространенности бессимптомной колонизации GBS могут быть связаны с используемыми методами обнаружения и различиями в отобранных популяциях. [ 15 ] [ 18 ]
Вирулентность
[ редактировать ]Как и другие вирулентные бактерии, GBS содержит большое количество факторов вирулентности (факторы вирулентности — это молекулы, вырабатываемые бактериями, которые повышают их способность инфицировать и повреждать ткани человека), наиболее важным из которых является капсульный полисахарид (богатый сиаловой кислотой ). [ 3 ] [ 19 ] и порообразующий токсин β-гемолизин. [ 19 ] [ 20 ] [ 21 ] Сегодня считается, что пигмент GBS (гранадаен) и гемолизин являются идентичными или близкородственными молекулами. [ 22 ] [ 23 ] [ 24 ] [ 25 ]
Сиаловая кислота является заметным фактором вирулентности S. agalactiae, несмотря на то, что она обычно обнаруживается у людей и многих других животных. Экспрессируя необычно большое количество сиаловой кислоты на поверхности бактериальных клеток, S. agalactiae может подорвать врожденную иммунную систему , убеждая лейкоциты в том, что бактерии являются клетками человека. [ 26 ] [ 27 ]
Инфекция GBS у новорожденных
[ редактировать ]Колонизация влагалища СГБ обычно не вызывает проблем у здоровых женщин, однако во время беременности иногда может вызвать серьезные заболевания у матери и новорожденного. СГБ является основной причиной бактериальной неонатальной инфекции у ребенка во время беременности и после родов со значительным уровнем смертности среди недоношенных детей. Инфекции GBS у матери могут вызывать хориоамнионит (тяжелую инфекцию тканей плаценты ), реже - послеродовые инфекции (после рождения), а также связаны с преждевременными родами и гибелью плода. [ 28 ] (ИМП) при СГБ Инфекции мочевыводящих путей также могут вызывать роды и преждевременные роды. [ 3 ] В западном мире СГБ (при отсутствии эффективных мер профилактики) является основной причиной ряда бактериальных инфекций новорожденных, таких как сепсис , пневмония и менингит , которые могут привести к смерти или долгосрочным последствиям . [ 3 ]
Неонатальная инфекция GBS обычно возникает в нижних репродуктивных путях инфицированных матерей. Инфекции GBS у новорожденных подразделяются на два клинических синдрома : заболевание с ранним началом (EOD) и заболевание с поздним началом (LOD). [ 29 ] ЭОД проявляется в период от 0 до 7 дней жизни у новорожденного, причем в большинстве случаев ЭОД проявляется в течение 24 часов после рождения. [ 3 ] [ 30 ] [ 31 ] Наиболее частыми клиническими синдромами ЭОД являются сепсис без выраженного очага, пневмония и реже менингит. ЭОД передается вертикально ( вертикальная передача ), в результате воздействия СГБ на плод или ребенка из влагалища инфицированной женщины либо внутриутробно, либо во время родов после разрыва плодных оболочек. Младенцы могут заразиться во время прохождения через родовые пути, тем не менее, новорожденные, заразившиеся GBS этим путем, могут стать только колонизированными, и у этих колонизированных младенцев обычно не развивается EOD. Примерно 50% новорожденных от матерей, колонизированных GBS, также колонизированы GBS, и (без мер профилактики) у 1–2% этих новорожденных разовьется EOD. [ 32 ]
В прошлом частота ЭОД колебалась от 0,7 до 3,7 на тысячу живорождений в США. [ 3 ] и от 0,2 до 3,25 на тысячу в Европе. [ 18 ] В 2008 году, после широкого использования дородового скрининга и интранатальной антибиотикопрофилактики (IAP), CDC сообщил о частоте 0,28 случаев EOD на тысячу живорождений в США. [ 33 ] Эпиднадзор в нескольких штатах в 2006–2015 годах показывает снижение EOD с 0,37 до 0,23 на 1000 живорождений в США, но LOD остается стабильным на уровне 0,31 на 1000 живорождений. [ 34 ] По оценкам, в 2021 году в США в общей сложности 1970 смертей ((0,59 на 100 000 населения) были вызваны неонатальными инфекциями GBS. Было подсчитано, что 226 младенцев (49 на 100 000) в Соединенных Штатах имели клинически значимую инфекцию GBS, и что примерно 11 (2,4%) из этих случаев закончились смертью. [ 35 ]
Было указано, что там, где проводилась политика предоставления IAP матерям, колонизированным GBS, общий риск EOGBS составляет 0,3%. [ 36 ]
Хотя колонизация GBS у матери является ключевым фактором, определяющим EOD, другие факторы также увеличивают риск. К этим факторам относятся начало родов до 37 недель беременности ( преждевременные роды ), длительное излитие плодных оболочек (≥18 часов до родов), лихорадка во время родов (>38 °C, >100,4 °F), амниотические инфекции (хориоамнионит), ранний возраст матери и низкий уровень антител к антикапсулярному полисахариду GBS у матери. [ 3 ] [ 30 ] [ 31 ] Тем не менее, большинство детей, у которых развивается ЭОД, рождаются у матерей, инфицированных СГБ, без какого-либо дополнительного фактора риска. [ 30 ] [ 31 ] Предыдущий брат или сестра с ЭОД также является важным фактором риска развития инфекции при последующих родах, что, вероятно, отражает отсутствие у матери защитных антител к полисахаридам СГБ. Тяжелая вагинальная колонизация GBS также связана с более высоким риском ЭОД. [ 30 ] В целом, уровень смертности от ЭОД снизился с 50%, наблюдавшихся в исследованиях 1970-х годов, до 2–10% в последние годы, главным образом, вследствие усовершенствований в терапии и ведении пациентов. Смертельные неонатальные инфекции, вызванные СГБ, чаще встречаются среди недоношенных детей. [ 3 ] [ 30 ] [ 31 ] [ 37 ]
LOD GBS поражает младенцев в возрасте от 7 дней до 3 месяцев и с большей вероятностью может вызвать бактериемию или менингит. ЛОД можно получить от матери или из источников окружающей среды. Потеря слуха и умственные нарушения могут быть долгосрочными последствиями менингита GBS. [ 3 ] [ 38 ] [ 39 ] В отличие от EOD, частота LOD осталась неизменной и составила 0,26 на 1000 живорождений в США. [ 40 ] , вызванный S. agalactiae, Неонатальный менингит не проявляется характерным признаком менингита взрослых - ригидностью шеи; скорее, он проявляется неспецифическими симптомами , такими как лихорадка, рвота и раздражительность, и, следовательно, может привести к поздней диагностике. [ 2 ]
Профилактика неонатальной инфекции
[ редактировать ]Единственным надежным способом предотвращения ЭОД в настоящее время является интранатальная антибиотикопрофилактика (ИАП), то есть введение антибиотиков во время родов. Было доказано, что внутривенное введение пенициллина или ампициллина по крайней мере за 4 часа до родов женщинам, инфицированным GBS, очень эффективно предотвращает вертикальную передачу GBS от матери к ребенку и EOD. Внутривенный пенициллин остается препаратом выбора при ВБП, а внутривенный ампициллин является приемлемой альтернативой. [ 3 ] [ 30 ] [ 31 ] Для женщин с аллергией на пенициллин лабораторные требования для заказа дородовых скрининговых культур GBS должны четко указывать на наличие аллергии на пенициллин. [ 31 ] Цефазолин , клиндамицин и ванкомицин используются для профилактики ЭОД у детей, рожденных от матерей с аллергией на пенициллин. [ 30 ] [ 31 ] Внутривенное введение ванкомицина рекомендуется при ВБП у женщин, колонизированных штаммом стрептококка группы В, устойчивым к клиндамицину, и тяжелой аллергией на пенициллин. [ 29 ] [ 31 ]
Существует два способа выявления женщин-кандидатов для получения антибиотикопрофилактики во время родов: подход, основанный на оценке риска, или подход, основанный на культуральном скрининге. Подход скрининга на основе культуры выявляет кандидатов на получение IAP с использованием нижних влагалищных и ректальных культур, полученных между 36 и 37 неделями беременности. [ 30 ] [ 31 ] (32–34 недели беременности для женщин с двойней [ 41 ] ) и IAP вводят всем женщинам, инфицированным GBS. Стратегия, основанная на оценке риска, выявляет кандидатов на получение IAP по вышеупомянутым факторам риска, которые, как известно, увеличивают вероятность EOD, без учета того, является ли мать носителем GBS. [ 3 ] [ 42 ]
IAP также рекомендуется женщинам с факторами риска во время родов, если их статус носительства GBS неизвестен на момент родов, женщинам с бактериурией GBS во время беременности и женщинам, у которых ранее был ребенок с EOD. [ нужна ссылка ]
Подход, основанный на оценке риска при ВБП, в целом менее эффективен, чем подход, основанный на культуре, поскольку в большинстве случаев ЭОД развивается среди новорожденных, рожденных от матерей без факторов риска. [ 18 ]
В 2010 году Центры по контролю и профилактике заболеваний (CDC) в сотрудничестве с несколькими профессиональными группами выпустили пересмотренные рекомендации по профилактике СГБ. [ 30 ]
В 2018 году задача по пересмотру и обновлению рекомендаций по профилактике СГБ была передана от CDC. [ 43 ] в ACOG ( Американский колледж акушеров и гинекологов ), Американскую академию педиатрии и Американское общество микробиологии. [ 14 ] [ 29 ] [ 31 ]
В 2019 году комитет ACOG выпустил обновленный документ «Профилактика раннего развития стрептококковой инфекции группы B у новорожденных». [ 31 ] Этот документ не вносит важных изменений в рекомендации CDC. Ключевыми мерами, необходимыми для предотвращения раннего развития неонатального СГБ, по-прежнему остаются универсальный пренатальный скрининг с использованием культуры СГБ из мазков, собранных из нижних отделов влагалища и прямой кишки, правильный сбор и микробиологическая обработка образцов, а также правильное проведение интранатальной антибиотикопрофилактики. ACOG теперь рекомендует проводить универсальный скрининг GBS между 36 и 37 неделями беременности. Эта новая рекомендация предусматривает пятинедельное окно [ 44 ] для действительных результатов посева, включая роды, произошедшие до гестационного возраста не менее 41 недели.
Подход скрининга на основе культуры применяется в большинстве развитых стран. [ 45 ] такие как Соединенные Штаты, [ 29 ] [ 30 ] [ 31 ] Франция, [ 46 ] Испания, [ 47 ] Бельгия, [ 48 ] Канада, Аргентина, [ 49 ] и Австралия. Стратегии, основанной на риске, придерживаются в Соединенном Королевстве, [ 41 ] [ 50 ] и Нидерланды. [ 18 ] [ 51 ]
Скрининг на колонизацию GBS
[ редактировать ]Хотя статус колонизации GBS у женщин может меняться во время беременности, посев для выявления GBS, проведенный за 5 недель до родов, довольно точно предсказывает статус носительства GBS при родах. [ нужна ссылка ]
Напротив, если пренатальный посев проводится более чем за пять недель до родов, он не позволяет точно предсказать статус носительства GBS при родах. [ 30 ] [ 31 ] [ 44 ] [ 52 ] [ 53 ]
Клинические образцы, рекомендованные для посева GBS на сроке беременности 36–37 недель, эта рекомендация обеспечивает 5-недельное окно для получения достоверных результатов посева, включая роды, произошедшие до гестационного возраста не менее 41 недели. [ 31 ] (32–34 недели беременности для женщин с двойней [ 41 ] ) — это мазки, взятые из нижней части влагалища (около входа в отверстие), а затем из прямой кишки (через анальный сфинктер) без использования зеркала. [ 30 ] [ 31 ] Образцы из влагалища и прямой кишки следует отбирать предпочтительно с помощью тампонов с флоком, поскольку тампоны с флоком удаляют образцы и микроорганизмы более эффективно, чем волокнистые тампоны. [ 14 ]
Следуя рекомендациям Центров по контролю и профилактике заболеваний США (CDC), эти тампоны следует поместить в непитательную транспортную среду, а затем инокулировать в селективный обогащенный бульон, бульон Тодда Хьюитта с селективными антибиотиками ( обогатительная культура ). [ 30 ] После инкубации обогащенный бульон пересевают на чашки с кровяным агаром и GBS-подобные колонии идентифицируют с помощью CAMP-теста или с помощью латексной агглютинации с антисывороткой GBS . После инкубации обогащенный бульон также можно пересеять на Гранада. средний агар [ 11 ] где СГБ растет в виде розово-красных колоний, или на хромогенных агарах, где СГБ растет в виде окрашенных колоний. [ 9 ] [ 30 ] Колонии, подобные GBS, развивающиеся в хромогенной среде, следует подтверждать как GBS с помощью дополнительных надежных тестов во избежание ошибочной идентификации. [ 9 ]
Тесты амплификации нуклеиновых кислот (NAAT), такие как полимеразная цепная реакция (ПЦР) и зонды гибридизации ДНК , были разработаны для идентификации GBS непосредственно из ректовагинальных образцов, но они имеют высокий уровень ложноотрицательных результатов и до сих пор не могут заменить дородовой посев в большинстве случаев. точное обнаружение носителей GBS. Эта технология обнаружения СГБ должна быть улучшена и упрощена, чтобы сделать метод экономически эффективным и полезным в качестве теста на месте оказания медицинской помощи . Тем не менее, эти тесты также можно использовать для обнаружения GBS непосредственно в бульонных средах после этапа обогащения, избегая пересева инкубированного накопительного бульона на соответствующую чашку с агаром. [ 14 ]


Вакцинация
[ редактировать ]Хотя IAP для профилактики EOD приводит к значительному снижению заболеваемости, однако не существует эффективной стратегии предотвращения позднего неонатального СГБ. [ 54 ]
Вакцинация считается идеальным решением для предотвращения не только EOD и LOD, но и инфекций GBS у взрослых, находящихся в группе риска. [ 55 ] Тем не менее, хотя исследования и клинические испытания по разработке эффективной вакцины для предотвращения инфекций GBS продолжаются, в 2023 году вакцины не было. [ 56 ] [ 57 ] [ 58 ] [ 59 ] Капсулярный полисахарид GBS является не только важным фактором вирулентности GBS, но и отличным кандидатом для разработки эффективной вакцины. [ 18 ] [ 60 ] [ 61 ] [ 62 ] Вакцины на основе белка также находятся в разработке. [ 56 ] [ 63 ] [ 58 ] [ 64 ]
Инфекция GBS у взрослых
[ редактировать ]СГБ также является важным инфекционным агентом, способным вызывать инвазивные инфекции у взрослых. Серьезные, опасные для жизни инвазивные инфекции GBS все чаще выявляются у пожилых людей и лиц, страдающих от основных заболеваний, таких как диабет, цирроз печени и рак. [ 65 ] Инфекции GBS у взрослых включают инфекции мочевыводящих путей, инфекции кожи и мягких тканей ( инфекции кожи и структур кожи ), бактериемию, остеомиелит , менингит и эндокардит . [ 6 ] Инфекция GBS у взрослых может быть серьезной и связана с высокой смертностью. В целом пенициллин является антибиотиком выбора для лечения инфекции GBS. [ 66 ] [ 67 ] Гентамицин (благодаря синергизму с пенициллином G или ампициллином) также можно применять у пациентов с опасным для жизни инвазивным СГБ. [ 66 ]
Нечеловеческие инфекции
[ редактировать ]Streptococcus agalactiae исторически изучался как болезнь крупного рогатого скота , наносящая вред производству молока, что привело к его названию «agalactiae», что означает «отсутствие молока». Штаммы бычьих и человеческих бактерий, как правило, взаимозаменяемы, при этом имеются доказательства передачи инфекции от животных к человеку и наоборот. [ 68 ]
Крупный рогатый скот
[ редактировать ]СГБ является основной причиной мастита (инфекции вымени ) у молочного скота и важным источником экономических потерь для отрасли. СГБ у коров может вызывать либо острое лихорадочное заболевание, либо подострое, более хроническое состояние . Оба приводят к уменьшению выработки молока (отсюда и название: agalactiae, что означает «без молока»). [ 69 ] Вспышки в стадах являются обычным явлением, поэтому это имеет большое значение для молочной промышленности программы по снижению воздействия болезни S. agalactiae . , и за последние 40 лет во многих странах были реализованы [ 7 ] [ 68 ]
Другие животные
[ редактировать ]СГБ также вызывает серьезные эпидемии среди выращиваемой рыбы, вызывая сепсис, а также внешние и внутренние кровотечения, о которых сообщалось от диких и содержащихся в неволе рыб, вовлеченных в эпизоотии во многих странах. [ 70 ] [ 71 ] Вакцинация – эффективный метод профилактики патогенных недавно были разработаны различные виды вакцин для предотвращения инфекций, вызванных СГБ. [ 72 ]
GBS также был обнаружен у многих других животных, таких как верблюды, собаки, кошки, крокодилы, тюлени, слоны и дельфины. [ 73 ] [ 74 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б В то время как Р.А., Харди Дж.М. (2009). Род I. Streptococcus Rosenbach 1884. Руководство Берджи по систематической бактериологии: Том 3: Фирмикуты (2-е изд.). Спрингер. стр. 655–711. ISBN 978-0-387-95041-9 .
- ^ Перейти обратно: а б Райан К.Дж., Рэй К.Г. и др., ред. (2004). Медицинская микробиология Шерриса (4-е изд.). МакГроу Хилл. стр. 286–8 . ISBN 978-0-8385-8529-0 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Эдвардс М.С., Низет В. (2011). Стрептококковые инфекции группы В. Инфекционные болезни плода и новорожденного (7-е изд.). Эльзевир. стр. 419–469. ISBN 978-0-443-06839-3 .
- ^ Слотвед ХК, Конг Ф., Ламбертсен Л., Зауэр С., Гилберт Г.Л. (2007). «Серотип IX, предлагаемый новый серотип Streptococcus agalactiae» . J Clin Микробиол . 45 (9): 2929–2936. дои : 10.1128/jcm.00117-07 . ПМК 2045254 . ПМИД 17634306 .
- ^ «Руководство по обнаружению и идентификации стрептококка группы B» (PDF) . Американское общество микробиологии . 23 июля 2021 г.
- ^ Перейти обратно: а б Эдвардс М.С., Бейкер С.Дж. (2010). «Streptococcus agalactiae (стрептококк группы В)». В Манделл Г.Л., Беннетт Дж.Э., Долин Р. (ред.). Принципы и практика инфекционных болезней (7-е изд.). Эльзевир. стр. Кап. 202. ИСБН 978-0-443-06839-3 .
- ^ Перейти обратно: а б Киф GP (1997). «Мастит, вызванный Streptococcus agalactiae: обзор» . Может ли Вет Дж . 38 (7): 199–204. ПМЦ 1576741 . ПМИД 9220132 .
- ^ Перейти обратно: а б с Тилле П. (2014). Диагностическая микробиология Бейли и Скотта (13-е изд.). Эльзевир. ISBN 978-0-323-08330-0 .
- ^ Перейти обратно: а б с д и Роза-Фрайле М., Спеллерберг Б. (2017). «Надежное выявление стрептококка группы В в клинической лаборатории» . J Clin Микробиол . 55 (9): 2590–2598. дои : 10.1128/JCM.00582-17 . ПМЦ 5648696 . ПМИД 28659318 .
- ^ Роза-Фрайле М., Родригес-Грейнджер Х., Хайдур-Бенамин А., Куэрва Х.М., Сампедро А. (2006). «Гранаден: предлагаемая структура полиенового пигмента стрептококка группы B» . Прикладная и экологическая микробиология . 72 (9): 6367–6370. Бибкод : 2006ApEnM..72.6367R . дои : 10.1128/АЕМ.00756-06 . ПМЦ 1563658 . ПМИД 16957264 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б Роза-Фрайле М., Родригес-Грейнджер Дж., Куэто-Лопес М., Сампедро А., Биль Гайе Е., Аро М., Андреу А. (1999). «Использование среды Гранады для выявления колонизации стрептококками группы В у беременных» . J Clin Микробиол . 37 (8): 2674–2677. doi : 10.1128/JCM.37.8.2674-2677.1999 . ПМЦ 85311 . ПМИД 10405420 .
- ^ К.Н., Корнуэллу Э., Дэниелу Р., Гунесекере С., Яунейкайте Э., Чалкеру В., Ле Доаре К. (2019). «Оценка времяпролетной масс-спектрометрии с матричной лазерной десорбцией и ионизацией (MALDI-TOF MS) для идентификации стрептококка группы B» . BMC Рез. Примечания . 12 (1): 85. дои : 10.1186/s13104-019-4119-1 . ПМЦ 6376729 . ПМИД 30764872 .
- ^ Эль Айла Н.А., Тенси И., Клэйс Г., Саеренс Б., Кулс П., Верстрален Х., Теммерман М., Верхельст Р., Ваничаутт М. (2010). «Сравнение различных методов отбора проб и различных культуральных методов выявления носительства стрептококка группы В у беременных» . БМК Инфекционные болезни . 10 :285. дои : 10.1186/1471-2334-10-285 . ПМЦ 2956727 . ПМИД 20920213 .
- ^ Перейти обратно: а б с д Филкинс Л., Хаузер Дж., Робинсон-Данн Тиббетс Р., Боянтон Б., Ревелл П. «Руководство по обнаружению и идентификации стрептококка группы B. 10 марта 2020 г.» (PDF) . Американское общество микробиологии . Архивировано из оригинала (PDF) 27 июня 2021 года . Проверено 7 января 2021 г.
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б Баркайте Е, Бартусявичюс А, Тамелиене Р, Ключинскас М, Малецкене Л, Надисаускене Р (2008). «Распространенность материнской стрептококковой колонизации группы B в европейских странах». Acta Obstet Gynecol Scand . 87 (3): 260–271. дои : 10.1080/00016340801908759 . ПМИД 18307064 . S2CID 25897076 .
- ^ Пиньянелли С., Пулькрано Г., Скьявоне П., Ди Санто А., Заккерини П. (2015). «Оценка селективности новой хромогенной среды для обнаружения стрептококка группы В» . Индийский микробиол J Pathol . 58 (1): 45–7. дои : 10.4103/0377-4929.151186 . ПМИД 25673591 .
- ^ Рассел Н.Дж., Сил АС, О'Дрисколл М., О'Салливан К., Бьянки-Джассир Ф., Гонсалес-Гуарин Дж., Лоун Дж.Э., Бейкер С.Дж., Бартлетт Л., Катленд К., Граветт М.Г., Хит П.Т., Ле Доар К., Мадхи С.А. , Рубенс С.Э., Шраг С., Собанджо-Тер Меулен А., Векеманс Дж., Саха С.К., Ип М. (2017). «Материнская колонизация стрептококками группы B и распространение серотипов во всем мире: систематический обзор и метаанализ» . Клинические инфекционные болезни . 65 (Приложение 2): S100–S111. дои : 10.1093/cid/cix658 . ПМЦ 5848259 . ПМИД 29117327 .
- ^ Перейти обратно: а б с д и Родригес-Грейнджер Дж., Альваргонсалес Х.К., Берарди А., Бернер Р., Кунце М., Хуфнагель М., Мелин П., Дечева А., Орефичи Г., Пойарт С., Телфорд Дж., Эфстратиу А., Киллиан М., Кризова П., Балдассарри Л., Спеллерберг Б. Двери А, Роуз-Фрайар М (2012). «Возврат к профилактике стрептококковых заболеваний новорожденных, вызванных стрептококком группы B. Европейский проект DEVANI». Eur J Clin Microbiol Infect Dis . 31 (9): 2097–2114. дои : 10.1007/ s10096-012-1559-0 ПМИД 22314410 . S2CID 15588906 .
- ^ Перейти обратно: а б Раджагопал Л. (2009). «Понимание регуляции факторов вирулентности стрептококков группы B» . Будущая микробиол . 4 (2): 201–221. дои : 10.2217/17460913.4.2.201 . ПМЦ 2691590 . ПМИД 19257847 .
- ^ Армистед Б., Олер Э., Адамс Уолдорф К., Раджагопал (2019). «Двойная жизнь стрептококка группы В: бессимптомный колонизатор и мощный возбудитель» . Дж. Мол. Биол . 431 (16): 2914–2931. дои : 10.1016/j.jmb.2019.01.035 . ПМК 6646060 . ПМИД 30711542 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Армистед Б., Уидби С., Айер Л.М., Эрреро-Фонкубьерта П., Куах П., Хайдур А., Аравинд Л., Куэрва Дж.М., Джаспан Х.Б. и Раджагопал Л. (2020). «Гены cyl раскрывают биосинтетическое и эволюционное происхождение гемолитического липида стрептококка группы B, гранадаена» . Передний. Микробиол . 10 : 3123. дои : 10.3389/fmicb.2019.03123 . ПМК 6985545 . ПМИД 32038561 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Роза-Фрайле М., Драмси С., Спеллерберг Б. (2014). «Гемолизин и пигмент стрептококка группы B, история близнецов» . ФЭМС Микробиол. Преподобный . 38 (5): 932–946. дои : 10.1111/1574-6976.12071 . ПМЦ 4315905 . ПМИД 24617549 .
- ^ Уидби С., Харрелл М.И., Бернсайд К., Нго Л., Бекрафт А.К., Айер Л.М., Аравинд Л., Хитти Дж., Уолдорф К.М., Раджагопал Л. (2013). «Гемолитический пигмент стрептококка группы B позволяет бактериям проникать в плаценту человека» . Джей Эксп Мед . 210 (6): 1265–1281. дои : 10.1084/jem.20122753 . ПМЦ 3674703 . ПМИД 23712433 .
- ^ Уидби С., Ворнхаген Дж., Гендрин С., Болденов Э., Самсон Дж.М., Деринг К., Нго Л., Иезекве Э.А. младший, Гундлах Дж.Х., Эловиц М.А., Лиггитт Д., Дункан Дж.А., Адамс Уолдорф К.М., Раджагопал Л. (2015). «Стрептококковый липидный токсин вызывает проницаемость мембран и пироптоз, что приводит к повреждению плода» . ЭМБО Мол. Мед . 7 (4): 488–505. дои : 10.15252/emmm.201404883 . ПМЦ 4403049 . ПМИД 25750210 .
- ^ Леклерк С.Ю., Салливан М.Дж., Ипе Д.С., Смит Дж.П., Криппс А.В., Улетт Г.К. (2016). «Патогенез стрептококковой инфекции мочевыводящих путей зависит от бактериального штамма и β-гемолизина/цитолизина, который опосредует цитотоксичность, синтез цитокинов, воспаление и вирулентность» . наук. Представитель . 6 : 29000. Бибкод : 2016NatSR...629000L . дои : 10.1038/srep29000 . ПМЦ 4935997 . ПМИД 27383371 .
- ^ Ландвер-Кензель, Сибилла; Хеннеке, Филипп (29 октября 2014 г.). «Взаимодействие Streptococcus agalactiae и клеточного врожденного иммунитета при колонизации и заболеваниях» . Границы в иммунологии . 5 : 519. дои : 10.3389/fimmu.2014.00519 . ISSN 1664-3224 . ПМЦ 4212683 . ПМИД 25400631 .
- ^ Севери, Эммануэле; Худ, Дерек В.; Томас, Гэвин Х. (1 сентября 2007 г.). «Утилизация сиаловой кислоты бактериальными патогенами» . Микробиология . 153 (9): 2817–2822. дои : 10.1099/mic.0.2007/009480-0 . ISSN 1350-0872 . ПМИД 17768226 .
- ^ Мюллер А.Э., Оствогель П.М., Стигерс Э.А., Дорр П.Дж. (2006). «Заболеваемость, связанная с материнскими стрептококковыми инфекциями группы В» . Acta Obstet Gynecol Scand . 85 (9): 1027–1037. дои : 10.1080/00016340600780508 . ПМИД 16929406 . S2CID 11745321 .
- ^ Перейти обратно: а б с д Пуополо К.М., Линфилд Р., Каммингс Дж.Дж., КОМИТЕТ AAP ПО ПЛОДАМ И НОВОРОЖДЕННЫМ, КОМИТЕТ AAP ПО ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ. (2019). «Ведение младенцев из группы риска стрептококковой инфекции группы B» (PDF) . Педиатрия . 144 (2): e20191881. дои : 10.1542/пед.2019-1881 . ПМИД 31285392 . S2CID 195843897 . Проверено 7 января 2021 г.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б с д и ж г час я дж к л м н Верани-младший, МакГи Л., Шраг С.Дж. (2010). «Профилактика перинатальной стрептококковой инфекции группы B: пересмотренные рекомендации CDC, 2010 г.» (PDF) . Рекомендованный представитель MMWR . 59 (РР-10): 1–32.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот АКОГ. Американский колледж акушеров и гинекологов (2019). «Профилактика раннего стрептококкового заболевания группы B у новорожденных: мнение комитета ACOG, номер 782» . Акушерство и гинекология . 134 (1): е19–е40. дои : 10.1097/AOG.0000000000003334 . ПМИД 31241599 . S2CID 195659363 .
- ^ Бойер К.М., Готофф С.П. (1985). «Стратегии химиопрофилактики инфекций с ранним началом GBS». инфекции группы В. Неонатальные стрептококковые Антибиотики и химиотерапия. Том. 35. С. 267–280. дои : 10.1159/000410380 . ISBN 978-3-8055-3953-1 . ПМИД 3931544 .
- ^ CDC. «Стрептококк группы B (GBS) – клинический обзор» . Проверено 27 октября 2015 г.
- ^ Нандури С.А., Пети С., Смелзер С., Апостол М., Олден Н.Б., Харрисон Л.Х., Линфилд Р., Вагноне П.С., Бурцлафф К., Спина Н.Л., Дюфорт Э.М., Шаффнер В., Томас А.Р., Фарли М.М., Джейн Дж.Х., Пондо Т., МакГи Л. , Билл Б.В., Шраг С.Дж. (2019). «Эпидемиология инвазивных стрептококковых заболеваний группы B с ранним и поздним началом в США, 2006–2015 гг.: Лабораторный и популяционный надзор в нескольких штатах» . ЖАМА Педиатр . 173 (3): 224–233. doi : 10.1001/jamapediatrics.2018.4826 . ПМК 6439883 . ПМИД 30640366 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Центры по контролю и профилактике заболеваний. «Отчет о базовом наблюдении за активными бактериями, Сеть программ по новым инфекциям, стрептококк группы B, 2021 г.» (PDF) . Проверено 14 июля 2024 г.
- ^ Рассел Н.Дж., Сил АС, О'Салливан К., Ле Доар К., Хит П.Т., Лоун Дж.Э., Бартлетт Л., Катленд К., Граветт М., Ип М., Мадхи С.А., Рубенс К.Э., Саха С.К., Шраг С., Собанджо-Тер Меулен А. , Векеманс Дж., Бейкер С.Дж. (2017). «Риск раннего неонатального стрептококкового заболевания группы B с материнской колонизацией во всем мире: систематический обзор и метаанализ» . Клин Инфекционный Дис . 65, Приложение 2 (дополнение_2): S152–S159. дои : 10.1093/cid/cix655 . ПМК 5850448 . ПМИД 29117325 .
- ^ Эдмонд К.М., Корцалиудаки С., Скотт С., Шраг С.Дж., Заиди А.К., Казенс С., Хит П.Т. (2012). «Стрептококковая инфекция группы B у детей младше 3 месяцев: систематический обзор и метаанализ» (PDF) . Ланцет . 379 (9815): 547–556. дои : 10.1016/s0140-6736(11)61651-6 . ПМИД 22226047 . S2CID 15438484 .
- ^ Либстер, Р; Эдвардс, КМ; Левент, Ф; Эдвардс, М.С.; Ренч, Массачусетс; Кастаньини, Луизиана; Купер, Т; Спаркс, РЦ; Бейкер, CJ; Шах, ЧП (июль 2012 г.). «Отдаленные исходы стрептококкового менингита группы В». Педиатрия . 130 (1): e8–15. дои : 10.1542/пед.2011-3453 . ПМИД 22689869 . S2CID 1013682 .
- ^ Кохли-Линч М, Рассел Нью-Джерси, Сил АС, Дангор З, Танн СиДжей, Бейкер СиДжей, Бартлетт Л, Катленд С, Граветт МГ, Хит ПТ, Ип М, Ле Доар К, Мадхи С.А., Рубенс С.Э., Саха С.К., Шраг С. , Собанджо-Тер Меулен А, Векеманс Дж, О'Салливан С, Наква Ф, Бен Хамуда Х, Суа Х, Гиоргакуди К, Ладхани С, Ламагни Т, Ратту Х, Троттер С, Лоун Дж.Э. (2017). «Нарушения нервно-психического развития у детей после стрептококковой инфекции группы B во всем мире: систематический обзор и метаанализ» . Клинические инфекционные болезни . 65 (Приложение 2): С190–С199. дои : 10.1093/cid/cix663 . ПМЦ 5848372 . ПМИД 29117331 .
- ^ Бейкер Си Джей (2013). «Спектр перинатальной стрептококковой инфекции группы В». Вакцина . 31 (Приложение 4): D3–D6. doi : 10.1016/j.vaccine.2013.02.030 . ПМИД 23973344 .
- ^ Перейти обратно: а б с Хьюз Р.Г., Броклхерст П., Стир П.Дж., Хит П., Стенсон Б.М. (2017). «Профилактика раннего неонатального стрептококкового заболевания группы B. Руководство Green-top № 36, сентябрь 2017 г.» . БЖОГ . 124 (12). Королевский колледж акушеров и гинекологов: e280–e305. дои : 10.1111/1471-0528.14821 . ПМИД 28901693 .
- ^ Клиффорд В., Гарланд С.М., Гримвуд К. (2011). «Профилактика неонатальной стрептококковой инфекции группы В в 21 веке». J Педиатр Здоровье Детей . 48 (9): 808–815. дои : 10.1111/j.1440-1754.2011.02203.x . ПМИД 22151082 . S2CID 36906520 .
- ^ CDC. «Руководство по профилактике. Обновление рекомендаций 2019 года» . Проверено 4 марта 2021 г.
- ^ Перейти обратно: а б Янси М.К., Шучат А., Браун Л.К., Вентура В.Л., Маркенсон Г.Р. (1996). «Точность поздних антенатальных скрининговых культур в прогнозировании колонизации генитальных стрептококков группы B при родах». Акушерство и гинекология . 88 (5): 811–815. дои : 10.1016/0029-7844(96)00320-1 . ПМИД 8885919 .
- ^ Ле Доар К., О'Дрисколл М., Тернер К., Сидат Ф., Рассел Нью-Джерси, Сил АС, Хит П.Т., Лоун Дж.Э., Бейкер С.Дж., Бартлетт Л., Катленд К., Граветт М.Г., Ип М., Мадхи С.А., Рубенс К.Э., Саха С.К. , Шраг С., Собанджо-Тер Меулен А., Векеманс Дж., Кампманн Б. и др. (Группа исследователей антибиотиков GBS Intrapartum) (2017). «Стратегия интранатальной химиопрофилактики антибиотиками для профилактики стрептококковой инфекции группы B во всем мире: систематический обзор» . Клин Инфекционный Дис . 65 (Приложение 2): S143–S151. дои : 10.1093/cid/cix654 . ПМЦ 5850619 . ПМИД 29117324 .
- ^ Национальное агентство аккредитации и оценки здравоохранения. «Антенатальная профилактика раннего неонатального риска бактериальных инфекций. 2001» (PDF) . Проверено 22 декабря 2017 г.
- ^ Алос Кортес Х.И., Андреу Доминго А., Аррибас Мир Л., Каберо Роура Л., Куэто Лопес М., Лопес Састре Х., Мельчор Маркос Х.К., Пуэртас Прието А., де ла Роса Фрайле М., Сальседо Абизанда С., Санчес Луна М., Санчес Перес М.Дж., Торрехон Кардосо Р. (2012). «Профилактика перинатальной инфекции, вызванной стрептококком группы B. Испанские рекомендации, пересмотренные в 2012 г.» (PDF) . Преподобный Эсп Химетер . 25 (1): 79–88. ПМИД 22488547 . Проверено 1 декабря 2019 г.
- ^ Бельгийский совет здравоохранения. «ПРОФИЛАКТИКА ПЕРИНАТАЛЬНЫХ СТРЕПТОКОККОВЫХ ИНФЕКЦИЙ ГРУППЫ B. Рекомендации Совета здравоохранения Бельгии, 2003 г.» (PDF) . Проверено 22 декабря 2017 г.
- ^ Министерство здравоохранения нации. Национальное управление охраны здоровья матери и ребенка. Аргентина. «Рекомендации по профилактике, диагностике и лечению ранней неонатальной инфекции, вызванной β-гемолитическим стрептококком группы B (GBS)» (PDF) . Проверено 2 декабря 2019 г.
- ^ RCOG и GBSS UK. «Стрептококк группы B (GBS) у беременных и новорожденных» (PDF) . Проверено 7 января 2021 г.
- ^ М. Трийбелс-Смулдерс, Г.А. де Йонге, ПКМ Паскер-де Йонг, Л.Дж. Джерардс, А.Х. Адриансе, Р.А. ванЛинген, Л.А. Колле (2007). «Эпидемиология неонатальной стрептококковой инфекции группы В в Нидерландах до и после введения рекомендаций по профилактике» . Архив болезней детского возраста - Издание для плода и новорожденного . 92 (4): Ф271–Ф276. дои : 10.1136/adc.2005.088799 . ПМК 2675425 . ПМИД 17227807 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Валкенбург-ван ден Берг А.В., Хаутман-Рулофсен Р.Л., Оствогель П.М., Деккер Ф.В., Дорр П.Дж., Сприй А.Дж. (2010). «Время проведения скрининга на стрептококк группы B во время беременности: систематический обзор» . Гинекологическое и акушерское обследование . 69 (3): 174–183. дои : 10.1159/000265942 . ПМИД 20016190 . S2CID 26709882 .
- ^ Вирранниеми М, Раудаскоски Т, Хаапсамо М, Кауппила Дж, Ренко М, Пелтола Дж, Ристели Л, Лаатио Л (2019). «Влияние интервала между скринингом и родами на чувствительность культуры на поздних сроках беременности при прогнозировании колонизации стрептококка группы B во время родов: проспективное многоцентровое когортное исследование» . Acta Obstet Gynecol Scand . 98 (4): 494–499. дои : 10.1111/aogs.13522 . ПМИД 30578547 . S2CID 58106301 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Джордан Х.Т., Фарли М.М., Крейг А., Моле-Боэтани Дж., Харрисон Л.Х., Пети С., Линфилд Р., Томас А., Зански С., Гершман К., Альбанезе Б.А., Шаффнер В., Шраг С.Дж. (2008). «Возврат к необходимости вакцинопрофилактики стрептококковой инфекции группы B у новорожденных с поздним началом: популяционный анализ в нескольких штатах» . Педиатр Инфекционный Дис Дж . 27 (12): 1057–1064. дои : 10.1097/inf.0b013e318180b3b9 . ПМИД 18989238 . S2CID 1533957 .
- ^ Эдвардс М.С., Ренч М.А., Ринаудо С.Д., Фаббрини М., Тоскано Дж., Баффи Дж., Бартолини Е., Боначчи С., Бейкер С.Дж., Маргарит I (2016). «Иммунные ответы на инвазивную стрептококковую болезнь группы B у взрослых» . Экстренное заражение Dis . 22 (11): 1877–1883. дои : 10.3201/eid2211.160914 . ПМК 5088039 . ПМИД 27767008 .
- ^ Перейти обратно: а б Хит ПТ (2016). «Состояние исследований вакцин и разработки вакцин против СГБ» . Вакцина . 34 (26): 2876–2879. doi : 10.1016/j.vaccine.2015.12.072 . ПМИД 26988258 .
- ^ Дэвис Х.Г., Каррерас-Абад К., Ле Доар К., Хит П.Т. (2019). «Стрептококк группы B: испытания и невзгоды» (PDF) . Педиатр Инфекционный Дис Дж . 38 (6S, Приложение 1): S72–S76. дои : 10.1097/INF.0000000000002328 . ПМИД 31205250 .
- ^ Перейти обратно: а б Каррерас-Абад С., Рамхелавон Л., Хит П.Т., Ле Доар К. (2020). «Вакцина против стрептококка группы B: последние достижения» . Заразить устойчивость к лекарствам . 13 : 1263–1272. дои : 10.2147/IDR.S203454 . ПМЦ 7196769 . ПМИД 32425562 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Мадхи С.А. (июнь 2023 г.). «Возможность введения матери вакцин против стрептококка группы B у младенцев» . Медицинский журнал Новой Англии . 389 (3): 215–227. дои : 10.1056/NEJMoa2116045 . ПМИД 37467497 . S2CID 259995252 .
- ^ Бейкер С.Дж., Кэри В.Дж., Ренч М.А., Эдвардс М.С., Хиллиер Ш., Каспер Д.Л., Платт Р. (2014). «Материнские антитела при родах защищают новорожденных от стрептококковой инфекции группы B с ранним началом» . J Заразить Дис . 209 (5): 781–788. дои : 10.1093/infdis/jit549 . ПМЦ 3923540 . ПМИД 24133184 .
- ^ Эдвардс М.С., Гоник Б. (2013). «Профилактика широкого спектра перинатальной заболеваемости и смертности посредством вакцинации против стрептококка группы В». Вакцина . 31С : Д66–71. doi : 10.1016/j.vaccine.2012.11.046 . ПМИД 23200934 .
- ^ Мадхи, Шабир А; Катленд, Клэр Л; Хосе, Лиза; Коэн, Антонет; Говендер, Ниреша; Виттке, Фредерик; Олугбоси, Морунфолу; Меулен, Аджоке Собанджо-тер; Бейкер, Шерил; Тупой, Питер М; Нарасимхан, Вас; Слобод, Карен (2016). «Безопасность и иммуногенность исследуемой материнской трехвалентной вакцины против стрептококка группы B у здоровых женщин и их детей: рандомизированное исследование фазы 1b/2». Ланцет инфекционных заболеваний . 16 (8): 923–934. дои : 10.1016/S1473-3099(16)00152-3 . ISSN 1473-3099 . ПМИД 27139805 .
- ^ Сон JY, Лим JH, Лим С, Ён Z, Со HS (2018). «Прогресс в создании вакцины против стрептококка группы B» . Хум Вакцина Иммунотер . 14 (11): 2669–2681. дои : 10.1080/21645515.2018.1493326 . ПМК 6314413 . ПМИД 29995578 .
- ^ Домингес К., Рэндис ТМ. (2022). «На пути к разработке белковой вакцины против стрептококка группы В» . Cell Rep Med . 3 (2): 10.1016/j.xcrm.2022.100536. дои : 10.1016/j.xcrm.2022.100536 . ПМК 8861943 . ПМИД 35243427 .
- ^ Елена Гра, Майя Хайтс, Дельфин Мартини, Эвелин Майяр, Марк Дельфорж, Пьеретт Мелен, Николя Доби. (2020). «Инвазивный стрептококк группы B среди небеременных взрослых в Брюссельском столичном регионе, 2005–2019 гг.» . Eur J Clin Microbiol Infect Dis . 173 (17 сентября, 1–9): 224–233. дои : 10.1007/s10096-020-04041-0 . ПМК 6439883 . ПМИД 30640366 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б Эдвардс М.С.; . Бейкер Си Джей (2005). «Стрептококковые инфекции группы В у пожилых людей» . Клин Инфекционный Дис . 41 (6): 839–847. дои : 10.1086/432804 . ПМИД 16107984 .
- ^ Фарли ММ (2001). «Стрептококковая инфекция группы B у небеременных взрослых» . Клинические инфекционные болезни . 33 (4): 556–561. дои : 10.1086/322696 . ПМИД 11462195 .
- ^ Перейти обратно: а б Крестани, Кьяра; Форд, Тая Л.; Лисетт, Саманта Дж.; Холмс, Марк А.; Фаст, Шарлотта; Перссон-Валлер, Карин; Садокс, Рут Н. (2021). «Падение и рост числа стрептококков группы B среди молочного скота: реинтродукция из-за перехода от человека к крупному рогатому скоту?» . Микробная геномика . 7 (9). дои : 10.1099/mgen.0.000648 . ПМЦ 8715428 . ПМИД 34486971 .
- ^ Рюгг PL. (2017). «100-летний обзор: выявление, лечение и профилактика мастита» . Дж. Молочная наука . 100 (10381–10397): 10381–10397. дои : 10.3168/jds.2017-13023 . ПМИД 29153171 . Проверено 22 ноября 2019 г.
- ^ Эванс Дж.Дж., Клезиус П.Х., Пасник Дж.Дж., Бонсак Дж.Ф. (2009). «Человеческий изолят Streptococcus agalactiae из нильской тилапии (Oreochromis niloticus)» . Экстренное заражение Dis . 15 (5): 774–776. дои : 10.3201/eid1505.080222 . ПМК 2687030 . ПМИД 19402966 .
- ^ Лю Г, Чжан В, Лу С (2013). «Сравнительный геномный анализ стрептококков» . БМК Геномика . 14 :775. дои : 10.1186/1471-2164-14-775 . ПМЦ 3831827 . ПМИД 24215651 .
- ^ Лю Г, Чжу Дж, Чэнь К, Гао Т, Яо Х, Лю Ю, Чжан В, Лу С (2016). «Разработка вакцины против тилапии Streptococcus agalactiae» . Это Акват Орг . 122 (2): 163–170. дои : 10.3354/dao03084 . ПМИД 28000606 .
- ^ Деланной CMJ, Крамлиш М., Фонтейн MC, Поллок Дж., Фостер Дж., Даглиш М.П., Тернбулл Дж.Ф., Задокс Р.Н. (2013). «Человеческие штаммы Streptococcus agalactiae у водных млекопитающих и рыб» . БМК Микробиология . 13:41 . дои : 10.1186/1471-2180-13-41 . ПМЦ 3585737 . ПМИД 23419028 .
- ^ Айзенберг Т., Рау Дж., Вестерхюс Ю., Кнауф-Витценс Т., Фаузи А., Шлез К., Чёк М., Пренгер-Бернингхофф Е., Хейдель С., Стинг Р., Глейзер С.П., Пулами Д., ван дер Линден М., Эверс К. (2017) . «Streptococcus agalactiae у слонов. Сравнительное исследование с изолятами от человека, животных и домашнего скота». Ветеринар. Микробиол . 204 : 141–150. дои : 10.1016/j.vetmic.2017.04.018 . ПМИД 28532793 .