Циклический нуклеотид-управляемый ионный канал
Циклические нуклеотид-управляемые ионные каналы или CNG-каналы представляют собой ионные каналы , которые функционируют в ответ на связывание циклических нуклеотидов . CNG-каналы представляют собой неселективные катионные каналы, которые обнаруживаются в мембранах различных типов тканей и клеток и играют важную роль в сенсорной трансдукции , а также в клеточном развитии. Их функция может быть результатом комбинации связывания циклических нуклеотидов (цГМФ и цАМФ) и события деполяризации или гиперполяризации . Первоначально обнаруженные в клетках, составляющих сетчатку глаза, каналы CNG были обнаружены во многих различных типах клеток как животного , так и растительного царства . Каналы CNG имеют очень сложную структуру с различными субъединицами и доменами , которые играют решающую роль в их функционировании. Каналы CNG играют важную роль в функционировании различных сенсорных путей, включая зрение и обоняние , а также в других ключевых клеточных функциях, таких как высвобождение гормонов и хемотаксис . Было также обнаружено, что каналы СПГ существуют в прокариоты , включая многие спирохеты , хотя их точная роль в бактерий физиологии остается неизвестной.
Открытие
[ редактировать ]Открытие каналов CNG связано с открытием внутриклеточных мессенджеров, ответственных за опосредование ответов фоторецепторов сетчатки . До их открытия считалось, что циклические нуклеотиды играют роль в фосфорилировании . было обнаружено, что цГМФ способен напрямую активировать светозависимый ответ стержневых ионных каналов . В 1985 году при изучении светоадаптированной сетчатки лягушек [1] Каналы CNG были также обнаружены в фоторецепторах колбочек , химиочувствительных ресничках обонятельных сенсорных нейронов и шишковидной железе . После идентификации аминокислот из очищенных белков клонирование проводили и функциональную экспрессию каналов CNG. Молекулярное клонирование позволило обнаружить подобные каналы во многих других тканях. [2] [3] В 2000 году ученые провели исследования с использованием сетчатки мыши и молекулярного клонирования, чтобы найти новую субъединицу канала CNG6. [4]
Функция
[ редактировать ]Каналы CNG выполняют важные функции в передаче сигналов в фоторецепторах сетчатки и нейронах обонятельных рецепторов . Они активируются непосредственно циклическими нуклеотидами, и для активации каждого канала необходимо примерно 4 циклических нуклеотида. Каналы CNG неселективны и позволяют многим щелочным ионам проникать в клетку или выходить из нее, экспрессируя каналы CNG на ее мембране. Этот поток ионов может привести либо к деполяризации , либо к гиперполяризации . Каналы CNG могут активироваться исключительно цАМФ или цГМФ , а иногда и комбинацией обоих цНМФ, причем некоторые каналы более селективны, чем другие. Несмотря на то, что активность этих каналов мало зависит от напряжения, они по-прежнему считаются каналами, зависящими от напряжения. Кальций , кальмодулин и фосфорилирование модулируют открытие каналов CNG. [3]
Основная роль каналов CNG заключается в сенсорной трансдукции в различных тканях. Многие исследования показали, что каналы CNG в фоторецепторах палочек и колбочек , а также они были обнаружены в мозге , сердце , почках и половых железах . [3]
каналов CNG Гомологи у Caenorhabditis elegans , Drosophila melanogaster и Limulus polyphemus имеют неизвестные функции. Исследования показали, что гомологи C. elegans могут выполнять функции хемочувствительности . [3]
Цветовая слепота и дегенерация сетчатки возникают, когда каналы CNG имеют мутации. Мутации конкретно в субъединицах А и В приводят к полной и неполной ахроматопсии . [3]


Структура
[ редактировать ]Канал CNG состоит из четырех субъединиц вокруг центральной поры . Каждая субъединица белка состоит из 6 трансмембранных сегментов (S1-S6), P-петли , внутриклеточной аминоконцевой области и карбоксиконцевой области. P-петля и сегменты S6 вокруг поры играют роль в ионной проводимости. На карбокси-конце имеется домен, связывающий циклические нуклеотиды (CNBD), и область соединения с сегментом S6. имеется пост-CNDB-область На аминоконце . [5]
Альфа-субъединицы
[ редактировать ]Альфа-субъединицы циклических нуклеотид-зависимых каналов включают
- Циклический нуклеотид-управляемый канал альфа 1
- Циклический нуклеотид-управляемый канал альфа 2
- Циклический нуклеотид-управляемый канал альфа-3
- Циклический нуклеотид-управляемый канал альфа 4
Бета-субъединицы
[ редактировать ]Бета-субъединицы циклических нуклеотид-зависимых каналов включают:
пора
[ редактировать ]Структура поры аналогична другим ионным каналам, содержащим P-петли. Р-петля входит в мембрану поры с внеклеточной стороны и выходит на внутриклеточную сторону. Петля P входит в виде альфа-спирали и существует в виде развернутой нити. Спирали, покрывающие внутреннюю мембрану, выстилают канал. Они также образуют пучок из шести спиралей , обозначающий вход. Чтобы открыть пору, конформационное изменение . во внутреннем пучке шести спиралей должно произойти [5]
Домен связывания циклических нуклеотидов
[ редактировать ]Домен , связывающий циклические нуклеотиды, представляет собой внутриклеточный домен, расположенный в С-концевой области и имеющий последовательность, аналогичную последовательности других белков, связывающих циклические нуклеотиды. Считается, что домен состоит из β-складчатого листа и двух α-спиралей . Лист β-складок состоит из восьми антипараллельных нитей. Спирали α называются спиралями B и C. Лиганд аллостерической первоначально связывается с β-складчатым листом и посредством регуляции вызывает движение к α-спирали к β-складчатому листу. α-спираль гибка в закрытых каналах. Когда α-спираль субъединицы CNGA1 находится в непосредственной близости от другой α-спирали, они образуют дисульфидные связи между субъединицами . Это происходит главным образом в закрытых каналах, препятствуя движению α-спирали к β-складчатому листу. Когда лиганд связывается с β-складчатым листом, этот связанный циклический нуклеотид стабилизирует движение α-спирали к β-складчатому листу в каждой субъединице, оттягивая α-спирали друг от друга. [5] [6]
С-линкер
[ редактировать ]С-линкер — это область, которая соединяет CNBD с сегментом S6. Область C-линкера способствует контакту между субъединицами канала, а также способствует тетрамеризации, образованию тетрамеров . Существует множество остатков , которые играют роль в модуляции каналов CNG. В этом процессе используются такие металлы, как никель , цинк , медь и магний . Область C-линкера участвует в связывании лиганда с отверстием поры. С-линкерная область образует дисульфидные связи с N-концевыми областями. Дисульфидные связи изменяют функцию канала, поэтому, скорее всего, лежат вблизи третичной структуры . Дисульфидные связи уменьшают свободную энергию открытого состояния по сравнению с закрытым. Специфический остаток цистеина C481 в области C-линкера расположен всего в нескольких аминокислотах от связывающего домена . В закрытом состоянии C481 нереактивен; C481 должен претерпеть конформационное изменение , чтобы стать доступным для открытия канала. Дисульфидные связи образуются между соседними субъединицами и C481. Одновременно имеется остаток цистеина С35 на N-конец области C-линкера, который может достигать двух остатков C481, образуя более выгодную дисульфидную связь по сравнению со связью C481-C481. [5] [6]
регион S6
[ редактировать ]Спонтанное образование дисульфидных связей зависит от состояния, подразумевая, что конформационные изменения в пучке спирали связаны с открытием каналов. Когда ионные каналы CNG закрыты, цитоплазматические концы спиралей S6 находятся в непосредственной близости друг от друга. Малые катионы способны проходить через отверстие, что означает, что ворота находятся за пределами пучка спиралей и что спирали S6 находятся в сочетании с конформационными изменениями в селективном фильтре. [6]
P регион
[ редактировать ]Область P образует петлю, петлю поры, соединяющую области S5 и S6, которые простираются до центральной оси канала. Ионные свойства определяются остатками в петле между трансмембранными сегментами S5 и S6. Область P определяет ионную селективность ионного канала, управляемого циклическими нуклеотидами, что также определяет диаметр пор каналов CNG. P-область действует как ворота канала, поскольку предотвращает проникновение ионов в закрытом состоянии. Поре могут препятствовать небольшие конформационные изменения в этой области. P-область действует как ионный селективный фильтр, который меняет структуру в открытой конформации. В открытом состоянии четыре идентичные субъединицы составляют одну область P-петли, которая образует селективный фильтр. [6]
Семейство каналов КПГ
[ редактировать ]У позвоночных семейство генов каналов CNG состоит из шести членов и принадлежит к более крупной группе потенциал-управляемых ионных каналов . Эти гены делятся на основе сходства последовательностей на два подтипа CNGA и CNGB. [7] Каналы CNG состоят из альфа-субъединицы, известной как CNGA1, и бета-субъединицы CNGB1 . Особенностью альфа-субъединицы является то, что она способна самостоятельно формировать функциональный канал, называемый гомотетрамерным каналом . Этот гомотетрамерный канал может представлять научный интерес, поскольку его можно использовать для дальнейшего понимания природы связывания лигандов и селективности конкретного интересующего канала. Дополнительные гены, кодирующие каналы CNG, были клонированы у Caenorhabditis elegans и Drosophila melanogaster . Субъединица CNG-канала CNGA1 , ранее называемая палочковой α-субъединицей, экспрессировалась в фоторецепторах палочек и продуцировала функциональные каналы, которые закрывались цГМФ при внешней экспрессии либо в ооцитах Xenopus почки человека эмбриональной , либо в линии клеток ( HEK293 ). У людей мутированные гены CNGA1 приводят к аутосомно-рецессивной форме пигментного ретинита — дегенеративной форме слепоты. CNGB1 , ранее называвшаяся β-субъединицей стержня, является второй субъединицей стержневого канала. В отличие от CNGA1, субъединицы CNGB1, экспрессируемые отдельно, не производят функциональные каналы CNG, но совместная экспрессия субъединиц CNGA1 и CNGB1 приводит к гетеромерные каналы с модуляцией, проникновением , фармакологией и циклонуклеотидной специфичностью, сравнимыми с таковыми у нативных каналов. [8]
Каналы CNG образуют тетрамеры , а недавние исследования показывают, что нативные каналы палочек состоят из трех субъединиц CNGA1 и одной субъединицы CNGB1. Субъединицы CNGA3 , ранее называемые альфа-субъединицами конуса, образуют функциональные каналы, когда их экспрессия происходит экзогенно. С другой стороны, CNGB3 , ранее называвшаяся β-субъединицей конуса, этого не делает. Мутации в CNGA3 и CNGB3 человека приводят к полной ахроматопсии , которая представляет собой редкое аутосомно-рецессивное наследственное и врожденное заболевание, характеризующееся полным нарушением цветовосприятия. [8]
CNGA2 , ранее называвшаяся обонятельной α-субъединицей, CNGA4 , ранее называвшаяся обонятельной β-субъединицей, и CnGB1b участвуют в передаче сигналов запаха и расположение субъединиц в обонятельных сенсорных нейронах, для которых стехиометрия неизвестны. [8]
У беспозвоночных субъединица каналов CNG, называемая CNG-P1, была клонирована из D. melanogaster и экспрессируется в антеннах и зрительной системе, что указывает на то, что каналы CNG могут быть связаны с трансдукцией света у беспозвоночных. Обнаружено, что вторая предполагаемая CNG-подобная субъединица, называемая CNGL, клонированная из D. melanogaster , экспрессируется в мозге. Две субъединицы каналов CNG, Tax-2 и Tax-4, были клонированы в C. elegans и ответственны за хемочувствительность, термочувствительность и нормальный рост аксонов некоторых сенсорных нейронов у C. elegans . [8]
Обязательное событие
[ редактировать ]Лиганд может располагаться на дне полости за счет взаимодействия с фосфатсвязывающей кассетой (PBC). Эта полость относится к области в CNBD, образованной β-валком, двухпетлевой β-спиралью . Изменения, вызванные связыванием лиганда, происходят в α-спиралях (αA, αB, αC и PBC-спирали). β-ролл претерпевает лишь небольшие изменения во время связывания. После закрепления лиганда спирали αB и αC располагаются так, что образуют колпачок над полостью. Как связывание влияет на спираль αA, пока неясно. [9]
Кооперативная и некооперативная активация
[ редактировать ]Резкая концентрация между каналами CNG и концентрацией лигандов показывает, что необходимы как минимум два или три циклических нуклеотида. Считается, что второй лиганд необходим для перехода канала из закрытого в открытое. Когда третий и четвертый лиганды связываются, открытое состояние канала стабилизируется. [9] У бактерий открытие каналов CNG является результатом некооперативного связывания. [9] При различных концентрациях лигандов возникает кооперативное и некооперативное связывание, позволяющее адаптироваться к разным средам. При низких концентрациях лиганда кооперативное связывание лиганда происходит редко, поскольку кооперативное связывание при низких концентрациях ослабляет связь между каналом и лигандом, снижая чувствительность канала. [9]
Лигандная селективность
[ редактировать ]Измеряя токи, активируемые в вырезанных вывернутых наизнанку мембранных участках при суперфузии с различными концентрациями лигандов чувствительность и селективность лигандов как эндогенно , так и экзогенно , были изучены экспрессируемых каналов CNG. Все нативные каналы CNG реагируют как на цАМФ , так и на цГМФ , но для активации и открытия каналов необходимы меньшие концентрации цГМФ, чем цАМФ. Каналы CNG резко селективны между цГМФ и цАМФ в палочках и колбочках, тогда как в OSN каналы одинаково хорошо реагируют на оба лиганда. Каналы CNG, обнаруженные в OSN, гораздо более чувствительны как к цГМФ, так и к цАМФ, чем каналы CNG фоторецепторов. Исследования зависимости «доза-эффект» показали, что активация каналов сильно зависит от концентрации цГМФ; несколько молекул цГМФ кооперативно связываются с каналом. Поскольку каждая субъединица содержит один сайт связывания cNMP, а гомомерные и гетеромерные каналы, скорее всего, образуют тетрамерный комплекс, с каналом могут связываться максимум четыре молекулы-лиганда.Селективность может быть достигнута за счет дифференциального управления сродство к связыванию лиганда, эффективность гейтирования или комбинация того и другого. Сродство связывания означает, насколько прочно циклические нуклеотиды связываются с каналом. Эффективность означает способность лиганда активировать и открывать канал после его связывания. Хотя эти процессы полезны для понимания селективности, они неразрывно связаны друг с другом, поэтому экспериментально отделить один от другого очень сложно. [3]
Каналы CNG не различают Na + и К + ионы, а также позволяют Ca 2+ и мг 2+ пройти, хотя и медленнее. Прохождение этих двухвалентных ионов подавляет ток, переносимый Na. + и К + . высококонсервативный остаток глутаминовой кислоты в селективном фильтре каналов CNG образует сайт связывания с высоким сродством для Ca. Было обнаружено, что 2+ . Более того, бактериальный неселективный катионный канал, называемый каналом NaK, содержит последовательность фильтров селективности, аналогичную таковой в каналах CNG. В кристаллической структуре канала NaK дискретный Ca 2+ -идентифицирован сайт связывания во внеклеточном отверстии поры. [9]
Ингибирование каналов CNG
[ редактировать ]Исследования показали дифференциальное ингибирование каналов CNG диацилглицерином (DAG) в Xenopus ооцитах . ДАГ можно использовать в качестве ингибитора закрытого состояния. Использование DAG для ингибирования гомомультимерных стержневых каналов или каналов, которые содержат две или более идентичные пептидные цепи , было аналогично ингибированию нативных стержневых каналов. Использование ДАГ для ингибирования гомомультимерных обонятельных каналов было не столь эффективным даже при высокой концентрации ДАГ. Для эффективного ингибирования канала необходимо более одной молекулы DAG. Молекулы DAG позиционируют себя так, чтобы стабилизировать закрытое состояние канала CNG, связываясь с каналом или изменяя взаимодействие между липидным бислоем клеточной мембраны и каналом. Исследования палочек химер и обонятельных каналов позволяют предположить, что различия в ингибировании DAG обусловлены различиями в прикрепленной петле трансмембранного сегмента. [10]
Физиологическое значение
[ редактировать ]Фоторецепторы
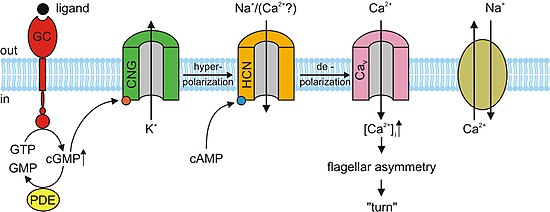
[ редактировать ]В отсутствие света цГМФ связывается с CNG-каналами фоторецепторов. Это связывание приводит к открытию каналов, что позволяет натрию (Na + ) и кальций (Ca 2+ ) внешнего сегмента фоторецептора ионы попадают в клетку, вызывая деполяризацию . Этот деполяризующий поток ионов известен как темновой ток . Когда сетчатка глаза воспринимает свет, происходит реакция, известная как каскад фототрансдукции. Это путь передачи сигнала , который приводит к активации фермента фосфодиэстеразы , который гидролизует цГМФ до 5'-ГМФ, снижая концентрацию цГМФ. В отсутствие цГМФ каналы CNG в фоторецепторах закрываются, предотвращая прохождение вышеупомянутого темнового тока. Это, в свою очередь, вызывает гиперполяризацию внешнего сегмента фоторецептора, препятствуя распространению потенциала действия и высвобождению глутамата . [3] [5] Исследования показали, что чрезмерная активация цГМФ-зависимых каналов CNG в фоторецепторах может привести к их дегенерации. Если каналы CNG фоторецептора постоянно активированы, Ca 2+ и На + Поток ионов во внешний сегмент фоторецептора увеличится, так что он деполяризуется за пределы темнового тока. Через петлю положительной обратной связи это приведет к увеличению тока Ca. 2+ в клетку. Высокая концентрация Ca 2+ в фоторецепторной клетке приведет к ее гибели, запрограммированной гибели клетки или апоптозу . [11]
Пигментный ретинит
[ редактировать ]
Пигментный ретинит (РП) — генетическое заболевание, при котором у пациентов наблюдается дегенерация палочек и колбочек фоторецепторов. пациента Потеря начинается с периферического зрения и распространяется на центральное поле зрения , в результате чего к среднему возрасту пациент остается слепым.
Около 1% пациентов с РП имеют мутации в альфа-субъединице цГМФ . Было идентифицировано восемь мутаций: четыре являются нонсенс-мутациями , одна представляет собой делецию , включающую большую часть транскрипционной единицы. Остальные три — это миссенс-мутации и мутации сдвига рамки считывания , которые приводят к укорочению аминокислотной последовательности на С-конце. До сих пор неизвестно, почему отсутствие катионных каналов, управляемых цГМФ, вызывает деградацию фоторецепторов. Мутации, вызывающие RP, также были обнаружены в гене родопсина , а также в альфа- и бета-субъединицах фосфодиэстеразы палочек , которые кодируют фототрансдукции каскады палочек. Мутация этих субъединиц косвенно нарушает функцию цГМФ-зависимых каналов палочки, что подразумевает наличие общего механизма деградации фоторецепторов. [12]
Кардиостимуляторные клетки
[ редактировать ]В нервной системе, сердце и некоторых внутренних органах клетки содержат каналы, управляемые циклическими нуклеотидами, которые определяют ритм органа. Эти каналы, формально называемые гиперполяризационно-активируемыми циклическими нуклеотидными каналами ( HCN-каналы ), также называются «каналами кардиостимулятора» из-за этой важной функции. Как следует из названия, они открыты в условиях гиперполяризации и закрыты во время деполяризации. Значение этого в синоатриальном узле (и, в качестве резерва, в атриовентрикулярном узле ) заключается в том, что по мере того, как сердце перезагружается или гиперполяризуется, после каждого удара каналы HCN открываются, позволяя положительным ионам проникать в клетку (так называемый забавный ток ), вызывающий еще одно событие деполяризации и последующее сокращение сердца. Это придает сердцу автоматизм. Первичным циклическим нуклеотидом, действующим совместно с каналом HCN, является цАМФ. [13]
Обонятельные сенсорные нейроны
[ редактировать ]Почти все реакции на запахи в обонятельных сенсорных нейронах (OSN) обеспечиваются CNG-каналами. Когда одорант связывается со своим специфическим рецептором в мембране химиочувствительных ресничек , он активирует G-белок , который вызывает последующую реакцию, активирующую фермент аденилатциклазу (AC). Этот фермент отвечает за увеличение концентрации цАМФ в OSN. цАМФ связывается с каналами CNG в мембране OSN, открывая их и делая клетку высокопроницаемой для кальция. 2+ . Ионы кальция проникают в клетку, вызывая деполяризацию . Как и во всех других типах ячеек, каналы CNG в OSN также позволяют Na + поступать в клетку. Кроме того, увеличение Ca 2+ концентрация внутри клетки активирует Ca 2+ -зависимый хлорид (Cl − ) каналы, что вызывает внутриклеточный Cl − ионы также выходят из клетки, усиливая событие деполяризации. Эта деполяризация стимулирует потенциал действия , который в конечном итоге сигнализирует о приеме запаха. В дополнение к цАМФ-зависимым ионным каналам, небольшое подмножество OSN также имеет цГМФ-селективные каналы CNG, которые содержат субъединицу CNGA3. [3]
Сперматозоиды
[ редактировать ]цАМФ и цГМФ опосредуют несколько клеточных реакций, таких как акросомальный экзоцитоз или слияние мужской спермы с женской яйцеклеткой и хемотаксис . У морских ежей видов Strongylocentrotus purpuratus speract был изучен короткий пептид . рецепторного типа Сперакт активирует гуанилатциклазу (ГЦ) и стимулирует повышение внутриклеточной концентрации цГМФ. Сперакт также увеличивает концентрацию кальция . Хотя прямая причинно-следственная связь еще не установлена, ранее упомянутые наблюдения позволяют предположить, что цГМФ активирует кальциевую проводимость . Каналы CNG являются основными кандидатами на путь входа кальция из-за их высокой проницаемости для кальция. Каналы CNG еще не обнаружены с помощью скрининга гомологии. У млекопитающих B3 . экспрессируются субъединицы канала CNG яичек A3, B1 и Гетерологичная экспрессия субъединицы А3 была клонирована из семенников и продуцировала каналы, чувствительные и селективные к цГМФ. Возможно, эти каналы участвуют в стимулированном цГМФ потоке кальция в сперма . Однако более обширная характеристика канала не была выполнена из-за низкой вероятности обнаружения активности канала. Поскольку мыши с нокаутом субъединицы А3 плодовиты , каналы CNG могут участвовать в некоторой форме контроля подвижности и даже в хемотаксическом плавательном поведении или в акросомальном экзоцитозе. Однако GC рецепторного типа в сперме млекопитающих еще не идентифицирован. Мышиная сперма экспрессирует другие каналы, такие как CatSper1 . Мужская стерильность может быть достигнута путем разрушения гена CatSper1; мышей прекращается индуцированный цАМФ приток кальция кроме того, у мутантных . Хотя CatSper для функционирования необходимы дополнительные субъединицы, они не связаны с каналами CNG, поскольку у CatSper отсутствует сайт связывания цАМФ/цГМФ. Вполне возможно, что субъединицы CNG и CatSper собираются вместе с образованием проницаемых для кальция и чувствительных к циклическим нуклеотидам ионных каналов. [3]
Почка
[ редактировать ]Чувствительные к цГМФ каналы были проанализированы в мозговом веществе почек , особенно в клетках собирательных протоков организма , которые влияют на электролитный и жидкостный баланс . Активность каналов CNG контролируется взаимодействием между цГМФ-зависимой протеинкиназой и белком G1 из-за участия цГМФ в механизмах фосфорилирования . В клетках внутренней собирательной трубочки мозгового вещества каналы CNG демонстрируют проводимость единицы катионной селективности, проницаемость для кальция и фармакологию, очень похожую на ионные каналы, управляемые циклическими нуклеотидами. Стимулятор за предсердный натрийуретический фактор (АНФ) увеличивает выработку цГМФ в почках, что повышает функцию клубочков счет сочетания расслабления и сокращения артериол . [14] Различия между кДНК сетчатки и почек связаны с функциональными различиями между каналами CNG в этих двух тканях. [3]
Гонадотропин-рилизинг гормон
[ редактировать ]Идентифицированы субъединицы А2, А4 и В1 ионных каналов CNG в линии нейрональных клеток, секретирующих гонадотропин-высвобождающий гормон (GrH) . Эти три субъединицы составляют каналы CNG на химиочувствительных ресничках OSN. При высоком внеклеточном кальции единичная проводимость CNG-каналов в палочках и OSN значительно меньше, чем измеренная в нейрональной линии. Кажется сомнительным, что каналы КПГ создадут большую удельную проводимость. [3]

Растения
[ редактировать ]и структуре сходны Каналы ионов CNG у растений по аминокислотной последовательности с неселективными катионными каналами CNG у животных, а также с трансмембранными доменами K. + -селективные каналы семейства шейкеров . Однако существуют радикальные различия, которые наблюдаются исключительно в заводских каналах КПГ. Аминокислотная последовательность поровой последовательности в CNG-каналах растений не имеет селективного фильтра, обнаруженного в CNG-каналах животных, а также не имеет мотива глицин - тирозин - глицин - аспартат (GYGD) в K + -последовательность фильтров селективности. Другие различия в последовательностях наблюдаются в каналах CNG растений, особенно в домене, связывающем циклические нуклеотиды (CNBD). , что у растений кальмодулин-связывающий домен Обнаружено (CaMBD) перекрывает α-спираль C в CNBD каналов CNG. У животных CaMBD расположены далеко от CNBD. [15] Каналы CNG играют большую роль в иммунитете растений и реакции на патогены или внешние инфекционные агенты. Они также участвуют в апоптозе растений. Считается, что ионные каналы CNG также участвуют в развитии пыльцы у растений, однако их точная роль в этом механизме до сих пор неизвестна. [15]
В отличие от каналов CNG животных, каналы CNG растений не подвергались тщательному биохимическому анализу в отношении их структуры. [15]
Прокариоты
[ редактировать ]Ионные каналы CNG имеют высокую степень последовательности и структурного сходства с каналами CNG млекопитающих. [16] Было показано , что, как и каналы CNG млекопитающих, связывание циклических нуклеотидов с CNBD регулирует активность каналов и изменяет конформационное состояние каналов. [16] [17] Поскольку эти каналы были обнаружены лишь недавно у спирохет и лептоспир . видов [16] их точная физиологическая функция у этих организмов остается неизвестной. В сочетании с фотоактивируемыми аденилатциклазами они использовались в качестве оптогенетических инструментов для ингибирования генерации потенциала действия в нейронах. [18]
Текущие и будущие исследования
[ редактировать ]Исследователи ответили на многие важные вопросы, касающиеся функций ионных каналов CNG в зрении и обонянии . В других физиологических областях роль каналов CNG менее определена. Благодаря технологическому росту теперь существует больше возможностей для понимания этих механизмов. [3]
Поскольку оксид азота (NO) участвует в стимуляции синтеза цГМФ, проводятся дальнейшие исследования, чтобы понять физиологическое взаимодействие NO с каналами CNG, особенно при ковалентной модификации каналов CNG в OSN. [3]
Ученые дополняют механизм взаимодействия сайтов связывания и интерфейсов субъединиц. Этого может не быть в некооперативных каналах CNG. Также возможно, что сайт связывания и ворота прикреплены к одной субъединице. Чтобы развить эти идеи, двойной электрон-электронный резонанс (DEER) и методы быстрой фиксации могут продемонстрировать эти механистические движения. [9]
Исследование 2007 года предполагает, что из-за различных и сложных регуляторных свойств в дополнение к большому количеству каналов СПГ в растениях необходимо провести междисциплинарное исследование для изучения каналов CNG растений. [15] Другое исследование, проведенное в марте 2011 года, признает недавние данные обратной генетики, которые помогли в дальнейшем понимании каналов CNG в растениях, а также предлагает провести дополнительные исследования для выявления восходящих и нисходящих факторов в передаче сигнала, опосредованной CNGC, в растениях. [19]
Ученые размышляют, связывается ли DAG напрямую с каналом CNG во время ингибирования. Вполне возможно, что DAG может внедриться в трансмембранные домены канала. Также возможно, что DAG вставляется в интерфейс между каналом и бислоем. Молекулярный механизм ингибирования ДАГ до сих пор до конца не изучен. [10]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Фесенко Е.Е., Колесников С.С., Любарский А.Л. (1985). «Индукция циклическим ГМФ катионной проводимости в плазматической мембране наружного сегмента палочек сетчатки». Природа . 313 (6000): 310–3. Бибкод : 1985Natur.313..310F . дои : 10.1038/313310a0 . ПМИД 2578616 . S2CID 4315094 .
- ^ Яу К.В. (апрель 1994 г.). «Циклические нуклеотидные каналы: расширяющееся новое семейство ионных каналов» . Учеб. Натл. акад. наук. США . 91 (9): 3481–3. Бибкод : 1994PNAS...91.3481Y . дои : 10.1073/pnas.91.9.3481 . ПМК 43603 . ПМИД 7513422 .
- ^ Jump up to: а б с д и ж г час я дж к л м Каупп У.Б., Зайферт Р.; Зайферт (июль 2002 г.). «Циклические нуклеотид-управляемые ионные каналы». Физиол. Преподобный . 82 (3): 769–824. CiteSeerX 10.1.1.319.7608 . doi : 10.1152/physrev.00008.2002 . ПМИД 12087135 .
- ^ Герстнер А., Зонг X, Хофманн Ф., Биль М. (февраль 2000 г.). «Молекулярное клонирование и функциональная характеристика нового модулятора и субъединицы циклического нуклеотид-зависимого канала из сетчатки мыши» . Журнал неврологии . 20 (4): 1324–1332. doi : 10.1523/JNEUROSCI.20-04-01324.2000 . ПМК 6772363 . ПМИД 10662822 .
- ^ Jump up to: а б с д и Матулеф, Кимберли; Заготта, Уильям Н. (2003). «Циклические нуклеотид-управляемые ионные каналы». Ежегодный обзор клеточной биологии и биологии развития . 19 (1): 23–44. doi : 10.1146/annurev.cellbio.19.110701.154854 . ПМИД 14570562 .
- ^ Jump up to: а б с д Ван, Цзэнчао; Джаинг, Юнцин; Лижи Лу; Жуйхуа Хуан; Цинчао Хоу; Фансюн Ши (2007). «Молекулярные механизмы циклического закрытия ионных каналов, управляемых нуклеотидами». Журнал генетики и геномики . 34 (6): 477–485. дои : 10.1016/S1673-8527(07)60052-6 . ПМИД 17601606 .
- ^ Брэдли, Джонатан (2001). «Номенклатура субъединиц ионных каналов» . Наука . 294 (5549): 2095–2096. дои : 10.1126/science.294.5549.2095 . ПМК 2901924 . ПМИД 11764791 .
- ^ Jump up to: а б с д Матулеф К., Заготта В.Н.; Заготта (2003). «Циклические нуклеотид-управляемые ионные каналы». Анну. Преподобный Cell Dev. Биол . 19 (1): 23–44. doi : 10.1146/annurev.cellbio.19.110701.154854 . ПМИД 14570562 .
- ^ Jump up to: а б с д и ж Куккамане А., Зайферт Р., Каупп У.Б. (январь 2011 г.). «Кооперативные и некооперативные ионные каналы, управляемые циклическими нуклеотидами». Тенденции биохимических наук . 36 (1): 55–64. дои : 10.1016/j.tibs.2010.07.004 . ПМИД 20729090 .
- ^ Jump up to: а б Крари Дж.И., Дин Д.М., Нгитрагул В., Куршан П.Т., Циммерман А.Л. (декабрь 2000 г.). «Механизм ингибирования циклических нуклеотид-управляемых ионных каналов диацилглицерином» . Журнал общей физиологии . 116 (6): 755–768. дои : 10.1085/jgp.116.6.755 . ПМК 2231817 . ПМИД 11099345 .
- ^ Валлацца-Дешам, Жеральдин; Сиа, Дэвид; Гун, Цзе; Джеллали, Абдельджелиль; Форстер, Валери; Сахель, Хосе А; Тессье, Люк-Анри; Пико, Серж (2005). «Чрезмерная активация циклических нуклеотид-управляемых каналов способствует нейрональной дегенерации фоторецепторов». Европейский журнал неврологии . 22 (5): 1013–1022. дои : 10.1111/j.1460-9568.2005.04306.x . ПМИД 16176343 . S2CID 36480526 .
- ^ Эшкрофт, Фрэнсис (1999). Ионные каналы и болезни . Академическая пресса . ISBN 978-0-12-065310-2 .
- ^ Ларссон, HP (2010). «Как регулируется частота сердечных сокращений в синоатриальном узле? Еще одна часть головоломки» . Журнал общей физиологии . 136 (3): 237–241. дои : 10.1085/jgp.201010506 . ПМЦ 2931147 . ПМИД 20713549 .
- ^ Биль, Мартин; Цзун, Сянган; Дистлер, Мадлен; Боссе, Ева; Клюгбауэр, Норберт; Мураками, Манабу; Флокерци, Вейт; Хофманн, Франц (1994). «Еще один член семейства циклических нуклеотид-управляемых каналов, экспрессирующийся в семенниках, почках и сердце» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (9): 3505–3509. Бибкод : 1994PNAS...91.3505B . дои : 10.1073/pnas.91.9.3505 . ПМК 43608 . ПМИД 8170936 .
- ^ Jump up to: а б с д Каплан Б., Шерман Т., Фромм Х. (май 2007 г.). «Циклические нуклеотидные каналы у растений» . ФЭБС Летт . 581 (12): 2237–46. дои : 10.1016/j.febslet.2007.02.017 . ПМИД 17321525 .
- ^ Jump up to: а б с Брамс, М.; Куш, Дж.; Спурни, Р.; Бенндорф, К.; Уленс, К. (2014). «Семейство ионных каналов, модулированных циклическими нуклеотидами прокариот» . Труды Национальной академии наук . 111 (21): 7855–7860. Бибкод : 2014PNAS..111.7855B . дои : 10.1073/pnas.1401917111 . ISSN 0027-8424 . ПМК 4040583 . ПМИД 24821777 .
- ^ Джеймс, Закари М.; Борст, Эндрю Дж.; Хайтин, Йони; Френц, Брэндон; ДиМайо, Фрэнк; Заготта, Уильям Н.; Вислер, Дэвид (2017). «КриоЭМ-структура прокариотического циклического нуклеотид-управляемого ионного канала» . Труды Национальной академии наук . 114 (17): 4430–4435. Бибкод : 2017PNAS..114.4430J . дои : 10.1073/pnas.1700248114 . ISSN 0027-8424 . ПМК 5410850 . ПМИД 28396445 .
- ^ Бек, Себастьян; Ю-Стржельчик, Цзин; Паулс, Деннис; Константин, Оана М.; Ну и дела, Кристин Э.; Эманн, Надин; Киттель, Роберт Дж.; Нагель, Георг; Гао, Шицян (2018). «Синтетические светоактивируемые ионные каналы для оптогенетической активации и ингибирования» . Границы в неврологии . 12 : 643. дои : 10.3389/fnins.2018.00643 . ISSN 1662-453X . ПМК 6176052 . ПМИД 30333716 .
- ^ Мёдер, Вольфганг; Уркарт, Уильям; Унг, Хоой; Ёсиока, Кейко (2011). «Роль циклических нуклеотид-управляемых ионных каналов в иммунитете растений» . Молекулярный завод . 4 (3): 442–452. дои : 10.1093/mp/ssr018 . ПМИД 21459831 .