микроскопия


Микроскопия — это техническая область использования микроскопов для просмотра объектов и областей объектов, которые невозможно увидеть невооруженным глазом (объекты, которые находятся за пределами диапазона разрешения нормального глаза). [1] Существуют три хорошо известные отрасли микроскопии: оптическая , электронная и сканирующая зондовая микроскопия , а также развивающаяся область рентгеновской микроскопии . [ нужна ссылка ]
Оптическая микроскопия и электронная микроскопия включают дифракцию , отражение или преломление электромагнитного излучения /электронных лучей, взаимодействующих с образцом , а также сбор рассеянного излучения или другого сигнала для создания изображения. Этот процесс может осуществляться путем облучения образца в широком поле (например, стандартная световая микроскопия и просвечивающая электронная микроскопия ) или путем сканирования тонкого луча по образцу (например, конфокальная лазерная сканирующая микроскопия и сканирующая электронная микроскопия ). Сканирующая зондовая микроскопия предполагает взаимодействие сканирующего зонда с поверхностью интересующего объекта. Развитие микроскопии произвело революцию в биологии , породило область гистологии и поэтому остается важным методом в науках о жизни и физических науках . Рентгеновская микроскопия является трехмерной и неразрушающей, позволяя повторно получать изображения одного и того же образца для исследований in situ или 4D, а также дает возможность «видеть изнутри» изучаемого образца, прежде чем приносить его в жертву методам с более высоким разрешением. 3D-рентгеновский микроскоп использует технику компьютерной томографии ( microCT ), вращая образец на 360 градусов и реконструируя изображения. КТ обычно выполняется с помощью плоского дисплея. Рентгеновский 3D-микроскоп использует ряд объективов, например, от 4X до 40X, а также может включать в себя плоскую панель.
История
[ редактировать ]
Область микроскопии ( оптическая микроскопия ) возникла как минимум в 17 веке. Более ранние микроскопы, однолинзовые лупы с ограниченным увеличением, появились, по крайней мере, еще в эпоху широкого использования линз в очках в 13 веке. [2] но более совершенные составные микроскопы впервые появились в Европе около 1620 г. [3] [4] Среди первых практиков микроскопии Галилео Галилей , который в 1610 году обнаружил, что может фокусировать свой телескоп с близкого расстояния, чтобы рассматривать мелкие объекты крупным планом. [5] [6] и Корнелис Дреббель , который, возможно, изобрел составной микроскоп около 1620 года. [7] [8] Антони ван Левенгук разработал простой микроскоп с очень большим увеличением в 1670-х годах и часто считается первым признанным микроскопистом и микробиологом . [9] [10]
Оптическая микроскопия
[ редактировать ]
Оптическая или световая микроскопия предполагает пропускание видимого света, прошедшего через образец или отраженного от него, через одну или несколько линз , чтобы обеспечить увеличенное изображение образца. [11] Полученное изображение можно обнаружить непосредственно глазом, отобразить на фотопластине или захватить в цифровом виде . Одиночная линза с насадками или система линз и оборудования для получения изображения вместе с соответствующим осветительным оборудованием, столиком для образца и опорой составляют основной световой микроскоп. Последней разработкой является цифровой микроскоп , который использует ПЗС-камеру для фокусировки на интересующем экспонате. Изображение отображается на экране компьютера, поэтому окуляры не нужны. [12]
Ограничения
[ редактировать ]Ограничения стандартной оптической микроскопии ( микроскопии светлого поля ) лежат в трех областях;
- Этот метод позволяет эффективно отображать только темные или сильно преломляющие объекты.
- Существует разрешение , ограниченное дифракцией, в зависимости от длины волны падения; В видимом диапазоне разрешение оптической микроскопии ограничено примерно 0,2 микрометра ( см.: микроскоп ), а практический предел увеличения - ~ 1500x. [13]
- Расфокусированный свет от точек за пределами фокальной плоскости снижает четкость изображения. [14]
В частности, живым клеткам обычно не хватает достаточного контраста для успешного изучения, поскольку внутренние структуры клетки бесцветны и прозрачны. Самый распространенный способ повышения контрастности — окрашивание структур селективными красителями, но это часто предполагает уничтожение и фиксацию образца. [15] Окрашивание также может привести к появлению артефактов , которые представляют собой очевидные структурные детали, вызванные обработкой образца и, таким образом, не являющиеся его особенностью. Как правило, эти методы используют различия в показателе преломления клеточных структур. Светлопольную микроскопию можно сравнить со взглядом в стеклянное окно: мы видим не стекло, а лишь грязь на нем. Разница есть, поскольку стекло — более плотный материал, и это создает разницу в фазе проходящего света. Человеческий глаз не чувствителен к этой разнице фаз, но были изобретены умные оптические решения, позволяющие преобразовать эту разницу фаз в разницу амплитуды (интенсивности света). [ нужна ссылка ]
Техники
[ редактировать ]Чтобы улучшить контрастность образца или выделить структуры в образце, необходимо использовать специальные методы. Доступен огромный выбор методов микроскопии для повышения контрастности или маркировки образца.
- Четыре примера методов просвечивания, используемых для создания контраста в образце папиросной бумаги . 1,559 мкм/пиксель.
- Яркое поле освещения, контрастность образца обусловлена поглощением света в образце.
- Освещение кроссполяризованным светом , контраст образца возникает за счет вращения поляризованного света через образец.
- Освещение темного поля , контраст образца возникает за счет света, рассеянного образцом
- Фазово-контрастное освещение, контраст образца возникает за счет интерференции лучей света различной длины через образец.
Яркое поле
[ редактировать ]Светлопольная микроскопия — самый простой из всех методов световой микроскопии. Освещение образца осуществляется проходящим белым светом, т.е. освещается снизу и наблюдается сверху. Ограничения включают низкий контраст большинства биологических образцов и низкое видимое разрешение из-за размытия материала, находящегося вне фокуса. Простота метода и минимальная требуемая подготовка проб являются существенными преимуществами. [ нужна ссылка ]
Косое освещение
[ редактировать ]Использование косого (бокового) освещения придает изображению трехмерный вид и позволяет выделить невидимые в противном случае детали. Более поздний метод, основанный на этом методе, — это модуляционный контраст Гофмана , система, обнаруженная в инвертированных микроскопах для использования в клеточных культурах. Косое освещение усиливает контраст даже на прозрачных образцах; однако, поскольку свет проникает вне оси, положение объекта будет смещаться при изменении фокуса. Это ограничение делает невозможными такие методы, как оптическое разрезание или точное измерение по оси Z.
Темное поле
[ редактировать ]Темнопольная микроскопия — это метод улучшения контрастности неокрашенных прозрачных образцов. [16] В освещении темного поля используется тщательно выровненный источник света, чтобы минимизировать количество непосредственно передаваемого (нерассеянного) света, попадающего в плоскость изображения, собирая только свет, рассеянный образцом. Темное поле может значительно улучшить контрастность изображения, особенно прозрачных объектов, при этом не требуя при этом особых настроек оборудования и подготовки образцов. Однако этот метод страдает от низкой интенсивности света на конечном изображении многих биологических образцов и по-прежнему страдает от низкого видимого разрешения.

Освещение Рейнберга — это вариант темнопольного освещения, при котором прозрачные цветные фильтры вставляются непосредственно перед конденсором, так что световые лучи при высокой апертуре окрашиваются иначе, чем лучи при низкой апертуре (т. е. фон образца может быть синим, в то время как объект выглядит самосветящимся красным). Возможны и другие цветовые комбинации, но их эффективность весьма вариабельна. [17]
Дисперсионное окрашивание
[ редактировать ]Дисперсионное окрашивание — оптический метод, позволяющий получить цветное изображение бесцветного объекта. Это метод оптического окрашивания, который не требует никаких пятен или красителей для создания цветового эффекта. Существует пять различных конфигураций микроскопа, используемых в более широком методе дисперсионного окрашивания. Они включают в себя светлопольное окрашивание по линии Беке, наклонное, темнопольное, фазово-контрастное и объективное дисперсионное окрашивание.
Фазовый контраст
[ редактировать ]
Более сложные методы покажут пропорциональные различия в оптической плотности. Фазовый контраст — широко используемый метод, который показывает различия в показателе преломления как разницу в контрасте. Он был разработан голландским физиком Фрицем Цернике в 1930-х годах (за что он был удостоен Нобелевской премии в 1953 году). Например, ядро клетки будет темным на фоне окружающей цитоплазмы. Контраст отличный; однако он не предназначен для работы с толстыми предметами. Зачастую даже вокруг мелких предметов образуется ореол, затеняющий детали. Система состоит из круглого кольца в конденсаторе, создающего конус света. Этот конус накладывается на кольцо аналогичного размера внутри фазовой объектива. Каждый объектив имеет кольцо разного размера, поэтому для каждого объектива необходимо выбирать другую настройку конденсора. Кольцо в объективе обладает особыми оптическими свойствами: оно, во-первых, снижает интенсивность прямого света, но, что более важно, создает искусственную разность фаз примерно в четверть длины волны. Поскольку физические свойства этого прямого света изменились, происходит интерференция с дифрагированным светом, в результате чего получается фазово-контрастное изображение. Одним из недостатков фазово-контрастной микроскопии является образование гало (светового кольца гало).
Дифференциальный интерференционный контраст
[ редактировать ]Более совершенным и гораздо более дорогим является использование интерференционного контраста . Различия в оптической плотности проявятся в виде различий в рельефе. ядро внутри клетки фактически проявляется как глобула в наиболее часто используемой системе дифференциального интерференционного контраста По мнению Жоржа Номарского, . Однако следует иметь в виду, что это оптический эффект , и рельеф не обязательно соответствует истинной форме. Контрастность очень хорошая, а диафрагму конденсора можно использовать полностью открытой, тем самым уменьшая глубину резкости и увеличивая разрешение.
Система состоит из специальной призмы ( призмы Номарского , призмы Волластона ) в конденсоре, разделяющей свет на обыкновенный и необыкновенный пучки. Пространственная разница между двумя лучами минимальна (меньше максимального разрешения объектива). После прохождения образца лучи воссоединяются аналогичной призмой в объективе.
В однородном образце нет разницы между двумя лучами и контраст не возникает. Однако вблизи границы преломления (скажем, ядра внутри цитоплазмы) разница между обыкновенным и необыкновенным лучами приведет к появлению рельефа на изображении. Для работы дифференциально-интерференционного контраста требуется источник поляризованного света ; На пути света необходимо установить два поляризационных фильтра: один под конденсором (поляризатор), а другой над объективом (анализатор).
Примечание. В тех случаях, когда оптическая конструкция микроскопа обеспечивает значительное поперечное разделение двух лучей, мы имеем дело с классической интерференционной микроскопией , которая не дает рельефных изображений, но, тем не менее, может быть использована для количественного определения массы-толщины. микроскопических объектов.
Отражение помех
[ редактировать ]Дополнительным методом, использующим интерференцию, является микроскопия интерференционного отражения (также известная как отраженный интерференционный контраст или RIC). Он основан на адгезии клеток к предметному стеклу для создания интерференционного сигнала. Если к стеклу не прикреплена ячейка, помех не будет.
Микроскопию интерференционного отражения можно получить, используя те же элементы, что и DIC, но без призм. Кроме того, обнаруживаемый свет отражается, а не передается, как при использовании DIC.
флуоресценция
[ редактировать ]
Когда определенные соединения освещаются светом высокой энергии, они излучают свет более низкой частоты. Этот эффект известен как флуоресценция . Часто образцы демонстрируют характерное автофлуоресцентное изображение, основанное на их химическом составе.
Этот метод имеет решающее значение в современных науках о жизни, поскольку он может быть чрезвычайно чувствительным, позволяя обнаруживать отдельные молекулы. Многие флуоресцентные красители можно использовать для окрашивания структур или химических соединений. Одним из эффективных методов является сочетание антител с флуорофором, как при иммуноокрашивании . Примерами обычно используемых флуорофоров являются флуоресцеин или родамин .
Антитела могут быть адаптированы к химическому соединению. Например, одной из часто используемых стратегий является искусственное производство белков на основе генетического кода (ДНК). Эти белки затем можно использовать для иммунизации кроликов, образуя антитела, которые связываются с белком. Затем антитела химически соединяются с флуорофором и используются для отслеживания белков в исследуемых клетках.
Высокоэффективные флуоресцентные белки, такие как зеленый флуоресцентный белок (GFP), были разработаны с использованием молекулярной биологии метода слияния генов — процесса, который связывает экспрессию флуоресцентного соединения с экспрессией целевого белка. Этот комбинированный флуоресцентный белок, как правило, нетоксичен для организма и редко нарушает функцию исследуемого белка. Генетически модифицированные клетки или организмы напрямую экспрессируют флуоресцентно меченные белки, что позволяет изучать функцию исходного белка in vivo .
Рост кристаллов белка приводит к образованию кристаллов как белка, так и соли. Оба бесцветны и микроскопичны. Для восстановления кристаллов белка требуется визуализация, которую можно выполнить с помощью собственной флуоресценции белка или с помощью трансмиссионной микроскопии. Оба метода требуют ультрафиолетового микроскопа, поскольку белки поглощают свет с длиной волны 280 нм. Белок также будет флуоресцировать при длине волны примерно 353 нм при возбуждении светом с длиной волны 280 нм. [18]
Поскольку излучение флуоресценции отличается по длине волны (цвету) от возбуждающего света, идеальное флуоресцентное изображение показывает только интересующую структуру, которая была помечена флуоресцентным красителем. Эта высокая специфичность привела к широкому использованию флуоресцентной световой микроскопии в биомедицинских исследованиях. Различные флуоресцентные красители можно использовать для окрашивания различных биологических структур, которые затем можно обнаружить одновременно, сохраняя при этом специфичность благодаря индивидуальному цвету красителя.
Чтобы заблокировать попадание возбуждающего света на наблюдателя или детектор, наборы фильтров необходимы высокого качества. Обычно они состоят из фильтра возбуждения, выбирающего диапазон длин волн возбуждения , дихроичного зеркала и эмиссионного фильтра, блокирующего свет возбуждения. Большинство флуоресцентных микроскопов работают в режиме эпи-подсветки (освещение и детектирование с одной стороны образца) для дальнейшего уменьшения количества возбуждающего света, попадающего в детектор.
См. также: Флуоресцентный микроскоп полного внутреннего отражения Нейронауки
конфокальный
[ редактировать ]Конфокальная лазерная сканирующая микроскопия использует сфокусированный лазерный луч (например, 488 нм), который сканирует образец для возбуждения флуоресценции по точкам. Излучаемый свет направляется через точечное отверстие, чтобы предотвратить попадание несфокусированного света на детектор, обычно фотоумножитель . Изображение создается на компьютере, отображая измеренные интенсивности флуоресценции в зависимости от положения возбуждающего лазера. По сравнению с полным освещением образца конфокальная микроскопия дает немного более высокое латеральное разрешение и значительно улучшает оптическое получение срезов (осевое разрешение). Поэтому конфокальная микроскопия обычно используется там, где важна трехмерная структура.
Подклассом конфокальных микроскопов являются микроскопы с вращающимся диском , которые могут одновременно сканировать несколько точек образца. Соответствующий диск с точечными отверстиями отклоняет расфокусированный свет. Световой детектор во вращающемся дисковом микроскопе представляет собой цифровую камеру, обычно EM-CCD или sCMOS .
Двухфотонная микроскопия
[ редактировать ]Двухфотонный микроскоп также является лазерно-сканирующим микроскопом, но вместо ультрафиолетового, синего или зеленого лазерного света импульсный инфракрасный лазер для возбуждения используется . Только в крошечном фокусе лазера интенсивность достаточно высока, чтобы генерировать флуоресценцию путем двухфотонного возбуждения . Это означает, что флуоресценция вне фокуса не генерируется, и для очистки изображения не требуется никаких точечных отверстий. [19] Это позволяет получать изображения глубоко в рассеивающей ткани, где конфокальный микроскоп не сможет эффективно собирать фотоны. [20] Двухфотонные микроскопы с широкоугольным детектором часто используются для функциональной визуализации, например , визуализации кальция в тканях головного мозга. [21] Несколько компаний продают их как многофотонные микроскопы , хотя преимущества от использования 3-фотонного возбуждения вместо 2-фотонного возбуждения незначительны.
Микроскопия с одноплоскостным освещением и флуоресцентная микроскопия с легким листом
[ редактировать ]Используя плоскость света, образованную фокусировкой света через цилиндрическую линзу под узким углом или сканированием линии света в плоскости, перпендикулярной оси объектива, можно получить оптические срезы с высоким разрешением. [22] [23] [24] Освещение в одной плоскости, или освещение светового листа, также достигается с использованием методов формирования луча, включающих расширители луча с несколькими призмами . [25] [26] Изображения захватываются ПЗС-матрицами. Эти варианты позволяют очень быстро и с высоким соотношением сигнал/шум захватывать изображения.
Широкопольная многофотонная микроскопия
[ редактировать ]Широкопольная многофотонная микроскопия [27] [28] [29] [30] относится к методу оптической нелинейной визуализации , при котором большая площадь объекта освещается и отображается без необходимости сканирования. Высокая интенсивность необходима для индукции нелинейных оптических процессов, таких как двухфотонная флуоресценция или генерация второй гармоники . В сканирующих многофотонных микроскопах высокая интенсивность достигается за счет жесткой фокусировки света, а изображение получается за счет сканирования луча. В широкопольной многофотонной микроскопии высокие интенсивности лучше всего достигаются с использованием импульсного лазерного источника с оптическим усилением для достижения большого поля зрения (~ 100 мкм). [27] [28] [29] Изображение в этом случае получается в виде одного кадра с помощью ПЗС-камеры без необходимости сканирования, что делает этот метод особенно полезным для одновременной визуализации динамических процессов в интересующем объекте. При использовании широкопольной многофотонной микроскопии частота кадров может быть увеличена до 1000 раз по сравнению с многофотонной сканирующей микроскопией . [28] Однако в рассеивающей ткани качество изображения быстро ухудшается с увеличением глубины.
Деконволюция
[ редактировать ]Флуоресцентная микроскопия — мощный метод, позволяющий показать специально помеченные структуры в сложной среде и предоставить трехмерную информацию о биологических структурах. Однако эта информация размывается тем фактом, что при освещении все флуоресцентно-меченные структуры излучают свет независимо от того, находятся они в фокусе или нет. Таким образом, изображение определенной структуры всегда размыто из-за света структур, находящихся не в фокусе. Это явление приводит к потере контраста, особенно при использовании объективов с высокой разрешающей способностью, обычно иммерсионных объективов с высокой числовой апертурой.
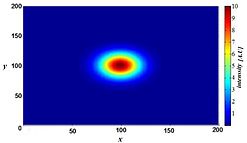
Однако размытие не вызвано случайными процессами, такими как рассеяние света, а может быть четко определено оптическими свойствами формирования изображения в системе визуализации микроскопа. Если рассмотреть небольшой флуоресцентный источник света (по сути, яркое пятно), свет, исходящий от этого пятна, распространяется дальше от нашей точки зрения, поскольку пятно становится все более не в фокусе. В идеальных условиях это создает форму «песочных часов» этого точечного источника в третьем (осевом) измерении. Эта форма называется функцией рассеяния точки (PSF) системы визуализации микроскопа. Поскольку любое флуоресцентное изображение состоит из большого количества таких небольших источников флуоресцентного света, говорят, что изображение «свернуто с помощью функции рассеяния точки». Математически смоделированная PSF системы импульсной визуализации терагерцового лазера показана справа.
Выходные данные системы визуализации можно описать с помощью уравнения:
Где n — аддитивный шум. [32] Зная эту функцию распространения точки [33] означает, что можно в определенной степени обратить этот процесс вспять с помощью компьютерных методов, широко известных как деконволюционная микроскопия. [34] Существуют различные алгоритмы для 2D- и 3D-деконволюции. Их можно условно разделить на нереставрационные и восстановительные методы. В то время как невосстановительные методы могут улучшить контрастность, удаляя расфокусированный свет из фокальных плоскостей, только восстановительные методы могут фактически переназначить свет в его правильное место происхождения. Обработка флуоресцентных изображений таким способом может быть преимуществом по сравнению с прямым получением изображений без расфокусированного света, таких как изображения, полученные при конфокальной микроскопии , поскольку световые сигналы, исключенные в противном случае, становятся полезной информацией. Для 3D-деконволюции обычно предоставляется серия изображений, взятых из разных фокальных плоскостей (называемых Z-стеком), а также знание PSF, которое может быть получено экспериментально или теоретически на основе знания всех влияющих параметров микроскопа.
Методы субдифракции
[ редактировать ]
В последнее время было разработано множество методов микроскопии сверхвысокого разрешения, которые обходят дифракционный предел .
В основном это достигается путем многократного визуализации достаточно статического образца и либо изменения возбуждающего света, либо наблюдения стохастических изменений в изображении. Используются методы деконволюции, описанные в предыдущем разделе, которые устраняют размытие, вызванное PSF, и определяют математически «правильное» происхождение света, хотя и с немного другим пониманием того, что означает значение пикселя. Если предположить , что в большинстве случаев один флуорофор образует одно пятно на одном снятом изображении, то пятна на изображениях можно заменить их расчетным положением, что значительно улучшает разрешение до уровня, значительно ниже дифракционного предела.
Чтобы реализовать такое предположение, в основе этих методов лежат знания и химический контроль над фотофизикой флуорофоров, с помощью которых достигается разрешение ~ 20 нанометров. [35] [36]
Последовательная усиленная микроскопия с временным кодированием
[ редактировать ]Усиленная микроскопия с последовательным временным кодированием (STEAM) — это метод визуализации, который обеспечивает сверхкороткую выдержку и частоту кадров за счет использования оптического усиления изображения, чтобы обойти фундаментальный компромисс между чувствительностью и скоростью, и однопиксельного фотодетектора , чтобы исключить необходимость в Ограничения на матрицу детекторов и время считывания [37] Этот метод как минимум в 1000 раз быстрее, чем современные камеры CCD и CMOS . Следовательно, он потенциально полезен для научных, промышленных и биомедицинских приложений, требующих высокой скорости получения изображений, включая диагностику и оценку ударных волн в реальном времени, микрофлюидику , МЭМС и лазерную хирургию . [38]
Расширения
[ редактировать ]Большинство современных инструментов предоставляют простые решения для микрофотографии и записи изображений в электронном виде. Однако такие возможности не всегда имеются, и более опытный микроскопист может предпочесть нарисованное от руки изображение фотографии. Это связано с тем, что микроскопист со знанием предмета может точно преобразовать трехмерное изображение в точный двухмерный рисунок. Однако в фотографии или другой системе захвата изображений только одна тонкая плоскость всегда находится в хорошем фокусе. [ нужна ссылка ]
Для создания точных микрофотографий требуется микроскопическая техника с использованием монокулярного окуляра. Крайне важно, чтобы оба глаза были открыты и чтобы глаз, который не смотрит в микроскоп, сосредоточился на листе бумаги, лежащем на столе рядом с микроскопом. Попрактиковавшись, не двигая головой и глазами, можно точно отслеживать наблюдаемые формы, одновременно «видя» кончик карандаша на микроскопическом изображении. [ нужна ссылка ]
Всегда менее утомительно наблюдать, когда микроскоп сфокусирован так, чтобы изображение было видно в бесконечности, и оба глаза всегда открыты. [ нужна ссылка ]
Другие улучшения
[ редактировать ]Микроспектроскопия: спектроскопия под микроскопом.
рентген
[ редактировать ]Поскольку разрешение зависит от длины волны света. Электронная микроскопия была разработана с 1930-х годов и в ней вместо света используются электронные лучи. Из-за гораздо меньшей длины волны электронного луча разрешение намного выше.
, хотя и менее распространена, Рентгеновская микроскопия также была разработана с конца 1940-х годов. По разрешению рентгеновская микроскопия находится между разрешающей способностью световой и электронной микроскопии.
Электронная микроскопия
[ редактировать ]До изобретения субдифракционной микроскопии длина волны света ограничивала разрешение традиционной микроскопии примерно до 0,2 микрометра. Чтобы получить более высокое разрешение, в электронных микроскопах используется электронный луч с гораздо меньшей длиной волны.
- Просвечивающая электронная микроскопия (ПЭМ) очень похожа на составной световой микроскоп, поскольку электронный луч направляется через очень тонкий срез образца. Предел разрешения в 2005 году составлял около 0,05. [ сомнительно – обсудить ] нанометра и с тех пор существенно не увеличилась.
- Сканирующая электронная микроскопия (СЭМ) визуализирует детали на поверхности образцов и дает очень красивое трехмерное изображение. Он дает результаты, очень похожие на результаты стереосветового микроскопа. Лучшее разрешение для СЭМ в 2011 году было 0,4 нанометра.
Электронные микроскопы, оборудованные для рентгеновской спектроскопии, могут проводить качественный и количественный элементный анализ. Этот тип электронного микроскопа, также известный как аналитический электронный микроскоп, может быть очень мощным инструментом для исследования наноматериалов . [39]
Сканирующая зондовая микроскопия
[ редактировать ]Это метод субдифракции. Примерами сканирующих зондовых микроскопов являются атомно-силовой микроскоп (АСМ), сканирующий туннельный микроскоп , фотонно-силовой микроскоп и микроскоп с рекурсивным слежением . Все такие методы используют физический контакт твердого наконечника зонда для сканирования поверхности объекта, которая должна быть почти плоской.
Ультразвуковая сила
[ редактировать ]Ультразвуковая силовая микроскопия (УСМ) была разработана для улучшения детализации и контрастности изображения на «плоских» областях интереса, где контрастность АСМ-изображений ограничена. Комбинация АСМ-УФМ позволяет генерировать акустическое микроскопическое изображение ближнего поля. Наконечник АСМ используется для обнаружения ультразвуковых волн и позволяет преодолеть ограничение длины волны, возникающее в акустической микроскопии. Используя упругие изменения под наконечником АСМ, можно получить изображение с гораздо большей детализацией, чем топография АСМ.
Ультразвуковая силовая микроскопия позволяет локально картировать упругость в атомно-силовой микроскопии путем приложения ультразвуковой вибрации к кантилеверу или образцу. Для количественного анализа результатов ультразвуковой силовой микроскопии измеряют кривую «сила-расстояние» с помощью ультразвуковой вибрации, приложенной к основанию кантилевера, и результаты сравнивают с моделью динамики кантилевера и взаимодействия зонда с образцом, основанной на метод конечных разностей.
Ультрафиолетовая микроскопия
[ редактировать ]Ультрафиолетовые микроскопы имеют две основные цели. Первый — использовать более короткую длину волны ультрафиолетовой электромагнитной энергии для улучшения разрешения изображения, превышающего дифракционный предел стандартных оптических микроскопов. Этот метод используется для неразрушающего контроля устройств с очень маленькими характеристиками, например, в современных полупроводниках. Второе применение УФ-микроскопов — повышение контрастности, при котором реакция отдельных образцов усиливается по сравнению с их окружением из-за взаимодействия света с молекулами внутри самого образца. Одним из примеров является рост белковых кристаллов . Кристаллы белка образуются в растворах солей. Поскольку кристаллы соли и белка образуются в процессе роста и оба обычно прозрачны для человеческого глаза, их невозможно различить с помощью стандартного оптического микроскопа. Поскольку триптофан белка поглощает свет с длиной волны 280 нм, визуализация с помощью УФ-микроскопа с полосовыми фильтрами 280 нм позволяет легко различать два типа кристаллов. Кристаллы белка кажутся темными, а кристаллы соли — прозрачными.
Инфракрасная микроскопия
[ редактировать ]Термин инфракрасная микроскопия относится к микроскопии, выполняемой в инфракрасном диапазоне волн. В типичной конфигурации прибора инфракрасный спектрометр с преобразованием Фурье (FTIR) сочетается с оптическим микроскопом и инфракрасным детектором . Инфракрасный детектор может представлять собой одноточечный детектор, линейную решетку или 2D-матрицу в фокальной плоскости. FTIR обеспечивает возможность выполнять химический анализ с помощью инфракрасной спектроскопии , а микроскоп и точечный или матричный детектор позволяют проводить этот химический анализ с пространственным разрешением, т.е. выполнять его в различных областях образца. Поэтому этот метод также называют инфракрасной микроспектроскопией. [40] [41] Альтернативная архитектура, называемая лазерной прямой инфракрасной визуализацией (LDIR), предполагает сочетание настраиваемого источника инфракрасного света и одноточечного детектора на летающем объекте. Этот метод часто используется для инфракрасной химической визуализации , где контраст изображения определяется реакцией отдельных областей образца на определенные длины волн ИК-излучения, выбранные пользователем, обычно определенные полосы ИК-поглощения и связанные с ними молекулярные резонансы . Ключевым ограничением традиционной инфракрасной микроспектроскопии является то, что пространственное разрешение ограничено дифракцией . В частности, пространственное разрешение ограничено величиной, связанной с длиной волны света. Для практических ИК-микроскопов пространственное разрешение ограничено в 1–3 раза больше длины волны, в зависимости от конкретного используемого метода и инструмента. Для длин волн среднего ИК-диапазона это устанавливает практический предел пространственного разрешения ~ 3–30 мкм.
Также существуют ИК-версии субдифракционной микроскопии. [40] [41] К ним относятся сканирующий оптический микроскоп ближнего поля (NSOM) , [42] фототермическая микроспектроскопия и инфракрасная спектроскопия на основе атомно-силового микроскопа (AFM-IR) , а также сканирующая ближнепольная оптическая микроскопия рассеянного типа (s-SNOM) [43] и нано-FTIR , которые обеспечивают наномасштабное пространственное разрешение в ИК-диапазоне.
Цифровая голографическая микроскопия
[ редактировать ]
В цифровой голографической микроскопии (ЦГМ) интерферирующие волновые фронты от когерентного (монохроматического) источника света регистрируются на датчике. Изображение реконструируется в цифровом виде с помощью компьютера по записанной голограмме . Помимо обычного светлопольного изображения с фазовым сдвигом создается изображение .
DHM может работать как в режиме отражения, так и в режиме передачи. В режиме отражения изображение с фазовым сдвигом обеспечивает измерение относительного расстояния и, таким образом, представляет собой топографическую карту отражающей поверхности. В режиме передачи изображение с фазовым сдвигом обеспечивает количественное измерение оптической толщины образца без меток. Изображения фазового сдвига биологических клеток очень похожи на изображения окрашенных клеток и успешно анализируются с помощью программного обеспечения для анализа высокого содержания .
Уникальной особенностью DHM является возможность настройки фокуса после записи изображения, поскольку все плоскости фокусировки записываются голограммой одновременно. Эта функция позволяет отображать движущиеся частицы в объеме или быстро сканировать поверхность. Еще одной привлекательной особенностью является возможность DHM использовать недорогую оптику путем программного исправления оптических аберраций.
Цифровая патология (виртуальная микроскопия)
[ редактировать ]Цифровая патология — это информационная среда на основе изображений, созданная с помощью компьютерных технологий, которая позволяет управлять информацией, полученной с цифрового слайда. Цифровая патология частично становится возможной благодаря виртуальной микроскопии , которая представляет собой практику преобразования стеклянных слайдов в цифровые слайды, которые можно просматривать, управлять и анализировать.
Лазерная микроскопия
[ редактировать ]Лазерная микроскопия — быстро развивающаяся область, в которой используются источники лазерного освещения в различных формах микроскопии. [44] Например, в лазерной микроскопии, ориентированной на биологические применения, используются лазеры ультракоротких импульсов в ряде методов, называемых нелинейной микроскопией, микроскопией насыщения и микроскопией двухфотонного возбуждения . [45]
Высокоинтенсивные короткоимпульсные лабораторные рентгеновские лазеры разрабатываются уже несколько лет. Когда эта технология будет реализована, можно будет получать увеличенные трехмерные изображения элементарных биологических структур в живом состоянии в точно определенный момент времени. Для оптимального контраста между водой и белком, а также для лучшей чувствительности и разрешения лазер следует настроить вблизи линии азота на длине волны около 0,3 нанометра. Разрешение будет ограничено главным образом гидродинамическим расширением, которое происходит при регистрации необходимого числа фотонов. [46] Таким образом, хотя образец разрушается в результате воздействия, его конфигурацию можно зафиксировать до того, как он взорвется. [47] [48] [49] [50] [51] [52] [ чрезмерное цитирование ]
Ученые работают над практическими конструкциями и прототипами рентгеновских голографических микроскопов, несмотря на длительную разработку соответствующего лазера. [53] [54] [55] [56] [57] [58] [59] [60] [ чрезмерное цитирование ]
Фотоакустическая микроскопия
[ редактировать ]
Метод микроскопии, основанный на фотоакустическом эффекте . [61] т.е. генерация (ультра)звука, вызванная поглощением света.Сфокусированный лазерный луч с модулированной интенсивностью растрово сканирует образец. Генерируемый (ультра)звук обнаруживается с помощью ультразвукового преобразователя. Обычно используются пьезоэлектрические ультразвуковые преобразователи. [62]
Контрастность изображения связана с коэффициентом поглощения образца. . В этом отличие от микроскопии светлого или темного поля, где контраст изображения обусловлен пропусканием или рассеянием. В принципе, контраст флуоресцентной микроскопии также пропорционален поглощению образца. Однако во флуоресцентной микроскопии квантовый выход флуоресценции должно быть не равно нулю, чтобы сигнал мог быть обнаружен. Однако в фотоакустической микроскопии каждое поглощающее вещество дает фотоакустический сигнал. что пропорционально
Здесь – коэффициент Грюнайзена, - энергия фотонов лазера и — энергия запрещенной зоны образца. Таким образом, фотоакустическая микроскопия кажется хорошо подходящей в качестве дополнительного метода к флуоресцентной микроскопии, поскольку высокий квантовый выход флуоресценции приводит к высоким сигналам флуоресценции, а низкий квантовый выход флуоресценции приводит к высоким фотоакустическим сигналам.
Если пренебречь нелинейными эффектами, поперечное разрешение dx ограничено дифракционным пределом Аббе :
где — длина волны возбуждающего лазера, а NA — числовая апертура объектива. Дифракционный предел Аббе справедлив, если фронт падающей волны параллелен. Однако в действительности профиль лазерного луча является гауссовым. Поэтому для расчета достижимого разрешения необходимо использовать формулы для усеченных гауссовских пучков. [63]
Любительская микроскопия
[ редактировать ]Любительская микроскопия — это исследование и наблюдение биологических и небиологических образцов в развлекательных целях. Коллекционеры минералов , насекомых , ракушек и растений могут использовать микроскопы в качестве инструментов для выявления особенностей, которые помогают им классифицировать собранные предметы. Другим любителям может быть интересно наблюдать за жизнью, обитающей в прудовой воде и других образцах. Микроскопы могут также оказаться полезными для оценки качества воды тем, кто держит домашний аквариум . Фотодокументирование и рисование микроскопических изображений доставляют дополнительное удовольствие. Проводятся конкурсы фотоискусства . Участники этого времяпрепровождения могут использовать коммерческие предметные стекла или подготовить свои собственные предметные стекла.
Хотя микроскопия является центральным инструментом документирования биологических образцов, ее часто недостаточно, чтобы оправдать описание нового вида, основанное только на микроскопических исследованиях. Часто для подтверждения открытия нового вида необходимы генетические и биохимические тесты. Лаборатория и доступ к научной литературе являются необходимостью. Однако есть одно преимущество, которое у любителей есть перед профессионалами: время исследовать свое окружение. Часто продвинутые любители объединяются с профессионалами, чтобы подтвердить свои выводы и, возможно, описать новые виды.
В конце 1800-х годов любительская микроскопия стала популярным хобби в США и Европе. Нескольким «профессиональным любителям» филантропы платили за поездки за отбор проб и микроскопические исследования, чтобы они развлекались в воскресный день (например, специалисту по диатомовым водорослям А. Грунову, которому платил (среди прочих) бельгийский промышленник). Профессор Джон Фин опубликовал «Практические советы по выбору и использованию микроскопа (второе издание, 1878 г.)», а также был редактором «Американского журнала микроскопии».
Примеры снимков любительской микроскопии:
- "домашняя пчела" Рот 100X
- Стебель риса CS 400X
- Яички кролика 100X
- Папоротник Проталлий 400X
Применение в судебной медицине
[ редактировать ]Микроскопия находит применение в судебной медицине. [64] Микроскоп может обнаруживать, разрешать и отображать мельчайшие улики, часто без каких-либо изменений или разрушений. Микроскоп используется для идентификации и сравнения волокон, волос, загрязнений, пыли и т. д.
В случае чернильных отметок, пятен крови или пуль обработка образцов не требуется, а доказательства обнаруживаются непосредственно при микроскопическом исследовании. В случае наличия следов определенных веществ подготовка проб должна быть произведена до проведения микроскопического исследования. [ нужны разъяснения ]
Световые микроскопы наиболее широко используются в судебной медицине, используя фотоны для формирования изображений. Для исследования судебно-медицинских образцов наиболее применимы следующие микроскопы: [65]
1. Составной микроскоп
2. Микроскоп сравнения.
3. Стереоскопический микроскоп.
4. Поляризационный микроскоп.
5. Микроспектрофотометр.
Такое разнообразие типов микроскопов в судебно-медицинской практике обусловлено главным образом их диапазонами увеличения, которые составляют (1-1200X), (50-30000X) и (500-250000X) для оптической микроскопии, SEM и TEM соответственно. [65]
См. также
[ редактировать ]- Список методов анализа материалов
- Цифровой микроскоп
- Цифровая патология
- Визуализирующая циклическая микроскопия
- Коррекция бесконечности
- Интерферометрическая микроскопия
- освещение по Келеру
- Список микроскопистов
- Микроденситометр
- Хронология микроскопических технологий
- Микроскопия двухфотонного возбуждения
- USB-микроскоп
- Микроскопы Ван Левенгука.
- Микроскопическое открытие Ван Левенгуком микробной жизни (микроорганизмов)
Ссылки
[ редактировать ]- ^ Эдинбургский университет (6 марта 2018 г.). «Что такое микроскопия?» . Эдинбургский университет . Архивировано из оригинала 10 апреля 2018 года . Проверено 9 апреля 2018 г.
- ^ Труды Фонда Джорджо Ронки и вклады Национального института оптики, том 30, The Foundation-1975, стр. 554
- ^ Альберт Ван Хелден; Свен Дюпре; Роб ван Гент (2010). Происхождение телескопа . Издательство Амстердамского университета. п. 24. ISBN 978-90-6984-615-6 . Архивировано из оригинала 15 февраля 2017 года.
- ^ Уильям Розенталь, Очки и другие вспомогательные средства зрения: история и руководство по коллекционированию, Norman Publishing, 1996, стр. 391–392.
- ^ Роберт Д. Уэрта, Гиганты Делфта: Йоханнес Вермеер и натурфилософы: параллельный поиск знаний в эпоху открытий, Bucknell University Press - 2003, стр. 126
- ^ А. Марк Смит, От зрения к свету: переход от древней к современной оптике, University of Chicago Press - 2014, стр. 387
- ^ Раймонд Дж. Сигер, Люди физики: Галилео Галилей, его жизнь и его работы, Elsevier - 2016, стр. 24
- ^ Дж. Уильям Розенталь, Очки и другие вспомогательные средства зрения: история и руководство по коллекционированию, Norman Publishing, 1996, стр. 391
- ^ Форд, Брайан Дж. (1992). «От дилетанта к усердному экспериментатору: переоценка Левенгука как микроскописта и исследователя» . История биологии . 5 (3). Архивировано из оригинала 19 апреля 2021 г. Проверено 16 апреля 2021 г.
- ↑ Лейн, Ник (6 марта 2015 г.). «Невидимый мир: размышления о Левенгуке (1677) «О маленьком животном». Philos Trans R Soc Lond B Biol Sci . 2015 апрель; 370 (1666): 20140344. [doi:10.1098/rstb.2014.0344]
- ^ Абрамовиц М., Дэвидсон М.В. (2007). «Введение в микроскопию» . Молекулярные выражения . Архивировано из оригинала 27 апреля 2021 г. Проверено 22 августа 2007 г.
- ^ «Микроскоп — составная, числовая апертурная и иммерсионная микроскопия | Британника» . www.britanica.com . Архивировано из оригинала 22 июня 2023 г. Проверено 22 июня 2023 г.
- ^ Аббе, Э. (1874) Вклад в теорию микроскопа и природу микроскопического зрения. Учеб. Бристоль Нат. Соц. 1, 200–261.
- ^ Поли Дж.Б. (редактор) (2006). Справочник по биологической конфокальной микроскопии (3-е изд.). Берлин: Шпрингер. ISBN 0-387-25921-X .
- ^ Лакович, Джозеф Р. (1999) Принципы флуоресцентной спектроскопии. Нью-Йорк: Kluwer Academic/Plenum.
- ^ Абрамовиц М., Дэвидсон М.В. (1 августа 2003 г.). «Освещение темного поля» . Архивировано из оригинала 23 ноября 2015 г. Проверено 21 октября 2008 г.
- ^ Абрамовиц М., Дэвидсон М.В. (1 августа 2003 г.). «Рейнбергское иллюминирование» . Архивировано из оригинала 29 сентября 2008 г. Проверено 21 октября 2008 г.
- ^ Гилл, Хариндарпал (январь 2010 г.). «Оценка эффективности флуоресценции и поглощения триптофана как инструмента выбора для идентификации кристаллов белка» . Акта Кристаллографика . F66 (Часть 3): 364–372. дои : 10.1107/S1744309110002022 . ПМЦ 2833058 . ПМИД 20208182 .
- ^ Денк, Винфрид; Свобода, Карел (март 1997 г.). «Фотонное мастерство: почему многофотонная визуализация — это больше, чем просто трюк» . Нейрон . 18 (3): 351–357. дои : 10.1016/S0896-6273(00)81237-4 . ПМИД 9115730 . S2CID 2414593 .
- ^ Денк, В.; Делани, КР; Гельперин А.; Кляйнфельд, Д.; Строубридж, штат Вашингтон; Танк, ДВ; Юсте, Р. (1994). «Анатомическая и функциональная визуализация нейронов с использованием 2-фотонной лазерной сканирующей микроскопии». Журнал методов нейробиологии . 54 (2): 151–162. дои : 10.1016/0165-0270(94)90189-9 . ПМИД 7869748 . S2CID 3772937 .
- ^ Свобода, Карел; Денк, Винфрид; Кляйнфельд, Дэвид; Танк, Дэвид В. (1997). «Динамика дендритного кальция in vivo в неокортикальных пирамидных нейронах» . Природа . 385 (6612): 161–165. Бибкод : 1997Natur.385..161S . дои : 10.1038/385161a0 . ISSN 0028-0836 . ПМИД 8990119 . S2CID 4251386 . Архивировано из оригинала 25 мая 2021 г. Проверено 20 мая 2020 г.
- ^ Войе, АХ (1993). «Изображение интактной барабанной буллы морской свинки с помощью флуоресцентной оптической микроскопии срезов в ортогональной плоскости». Исследование слуха . 71 (1–2): 119–128. дои : 10.1016/S0378-5955(02)00493-8 . ISSN 0378-5955 . ПМИД 12204356 . S2CID 12775304 .
- ^ Грегер, К.; Дж. Свогер; ЭХК Стельцер (2007). «Основные конструктивные элементы и свойства флуоресцентного одноплоскостного осветительного микроскопа» . Обзор научных инструментов . 78 (2): 023705–023705–7. Бибкод : 2007RScI...78b3705G . дои : 10.1063/1.2428277 . ISSN 0034-6748 . ПМИД 17578115 .
- ^ Буйтаерт, Ян; Э. Декамп; Д. Адрианс; Джей Джей Диркс (2012). «Семейство микроскопов OPFOS: оптическое разделение биомедицинских образцов с высоким разрешением» . Международное исследование анатомии . 2012 : 206238. arXiv : 1106.3162 . дои : 10.1155/2012/206238 . ISSN 2090-2743 . ПМЦ 3335623 . ПМИД 22567307 .
- ^ Ф. Дж. Дуарте, «Высокомощные лазеры на красителях» (Springer-Verlag, Берлин, 1991), Глава 2.
- ^ Дуарте FJ (1993), Электрооптическая интерферометрическая система микроденситометра, патент США 5255069. Архивировано 13 октября 2017 г. в Wayback Machine .
- ^ Перейти обратно: а б Петерсон, Марк Д.; Хейс, Патрик Л.; Мартинес, Имее Су; Касс, Лаура С.; Ахтил, Дженнифер Л.; Вайс, Эмили А.; Гейгер, Франц М. (1 мая 2011 г.). «Визуализация генерации второй гармоники с помощью усилителя кГц [Приглашен]». Оптические материалы Экспресс . 1 (1): 57. Бибкод : 2011OMExp...1...57P . дои : 10.1364/ome.1.000057 .
- ^ Перейти обратно: а б с Масиас-Ромеро, Карлос; Дидье, Мари Э.П.; Журден, Паскаль; Марке, Пьер; Маджистретти, Пьер; Тарун, Орли Б.; Зубков, Виталий; Раденович Александра ; Рок, Сильви (15 декабря 2014 г.). «Высокопроизводительная визуализация второй гармоники для биологических приложений без меток» . Оптика Экспресс . 22 (25): 31102–12. Бибкод : 2014OExpr..2231102M . дои : 10.1364/oe.22.031102 . hdl : 10754/563269 . ПМИД 25607059 . Архивировано из оригинала 20 июня 2020 г. Проверено 11 декабря 2019 г.
- ^ Перейти обратно: а б Ченг, Ли-Чунг; Чанг, Цзя-Юань; Лин, Чун-Ю; Чо, Кенг-Чи; Йен, Вэй-Чунг; Чанг, Нань-Шань; Сюй, Крис; Донг, Чэнь Юань; Чен, Шан-Джен (9 апреля 2012 г.). «Широкопольная многофотонная микроскопия на основе пространственно-временной фокусировки для быстрого получения оптических срезов» . Оптика Экспресс . 20 (8): 8939–48. Бибкод : 2012OExpr..20.8939C . дои : 10.1364/oe.20.008939 . ПМИД 22513605 .
- ^ Орон, Дэн; Таль, Эран; Зильберберг, Ярон (7 марта 2005 г.). «Бессканирующая микроскопия с глубинным разрешением» . Оптика Экспресс . 13 (5): 1468–76. Бибкод : 2005OExpr..13.1468O . дои : 10.1364/opex.13.001468 . ПМИД 19495022 .
- ^ Ахи, Киараш; Анвар, Мехди (26 мая 2016 г.). Анвар, Мехди Ф; Кроу, Томас В.; Манзур, Тарик (ред.). «Моделирование терагерцовых изображений на основе рентгеновских изображений: новый подход к проверке терагерцовых изображений и идентификации объектов с мелкими деталями за пределами терагерцового разрешения» . Терагерцовая физика, устройства и системы X: Передовые приложения в промышленности . Терагерцовая физика, устройства и системы X: Передовые приложения в промышленности и обороне. 9856 : 985610. Бибкод : 2016SPIE.9856E..10A . дои : 10.1117/12.2228685 . S2CID 124315172 .
- ^ Соломон, Крис (2010). Основы цифровой обработки изображений . Джон Вили и сыновья, ООО ISBN 978-0-470-84473-1 .
- ^ Нассе М.Дж.; Вёль Дж. К. (2010). «Реалистическое моделирование функции рассеяния точки освещения в конфокальной сканирующей оптической микроскопии». J. Опт. Соц. Являюсь. А. 27 (2): 295–302. Бибкод : 2010JOSAA..27..295N . дои : 10.1364/JOSAA.27.000295 . ПМИД 20126241 .
- ^ Уоллес В., Шефер Л.Х., Сведлоу-младший (2001). «Руководство для рабочего по деконволюции в световой микроскопии» . БиоТехники . 31 (5): 1076–8, 1080, 1082 пассим. дои : 10.2144/01315bi01 . ПМИД 11730015 .
- ^ Кауфман Райнер; Мюллер Патрик; Хильденбранд Георг; Хаусманн Майкл; Кремер Кристоф (2010). «Анализ кластеров мембранных белков Her2/neu в различных типах клеток рака молочной железы с использованием локализационной микроскопии». Журнал микроскопии . 242 (1): 46–54. CiteSeerX 10.1.1.665.3604 . дои : 10.1111/j.1365-2818.2010.03436.x . ПМИД 21118230 . S2CID 2119158 .
- ^ ван де Линде С.; Уолтер С.; Зауэр С. (2011). «Одномолекулярное фотопереключение и локализация» . Ауст. Дж. Чем . 64 (5): 503–511. дои : 10.1071/CH10284 .
- ^ К. Года; К.К. Циа; Б. Джалали (2009). «Последовательное усиленное изображение с кодированием во времени для наблюдения в реальном времени быстрых динамических явлений». Природа . 458 (7242): 1145–9. Бибкод : 2009Natur.458.1145G . дои : 10.1038/nature07980 . ПМИД 19407796 . S2CID 4415762 .
- ^ Джалали, Бахрам; Кейпвелл, Дейл; Года, Кейсуке; Циа, Кевин К. (10 мая 2010 г.). «Производительность серийного усиленного микроскопа с временным кодированием». Оптика Экспресс . 18 (10): 10016–10028. Бибкод : 2010OExpr..1810016T . дои : 10.1364/OE.18.010016 . hdl : 10722/91333 . ISSN 1094-4087 . ПМИД 20588855 . S2CID 8077381 .
- ^ Косасих, Феликс Утама; Дукати, Катерина (май 2018 г.). «Описание деградации перовскитных солнечных элементов с помощью электронной микроскопии in-situ и операндо» . Нано Энергия . 47 : 243–256. дои : 10.1016/j.nanoen.2018.02.055 . Архивировано из оригинала 26 января 2021 г. Проверено 28 июня 2019 г.
- ^ Перейти обратно: а б Х. М. Поллок и С. Г. Казарян, Микроспектроскопия в среднем инфракрасном диапазоне, в Энциклопедии аналитической химии (Роберт А. Мейерс, Эд, 1-26 (2014), John Wiley & Sons Ltd,
- ^ Перейти обратно: а б Поллок Хьюберт М (2014). «Микроспектроскопия в среднем инфракрасном диапазоне». Энциклопедия аналитической химии . стр. 1–26. дои : 10.1002/9780470027318.a5609.pub2 . ISBN 9780470027318 .
- ^ Х. М. Поллок и Д. А. Смит, Использование зондов ближнего поля для вибрационной спектроскопии и фототермической визуализации, в Справочнике по вибрационной спектроскопии, Дж. М. Чалмерс и П. Р. Гриффитс (редакторы), John Wiley & Sons Ltd, Vol. 2, стр. 1472 - 1492 (2002)
- ^ Кейльманн, Фриц; Хилленбранд, Райнер (15 апреля 2004 г.). Ричардс, Дэвид; Заяц, Анатолий (ред.). «Ближнепольная микроскопия по упругому рассеянию света на игле» . Философские труды Лондонского королевского общества. Серия А: Математические, физические и технические науки . 362 (1817): 787–805. дои : 10.1098/rsta.2003.1347 . ISSN 1364-503X . ПМИД 15306494 . S2CID 20211405 . Архивировано из оригинала 09.11.2020 . Проверено 2 ноября 2020 г.
- ^ Дуарте Ф.Дж. (2016). «Перестраиваемая лазерная микроскопия». В Дуарте Ф.Дж. (ред.). Приложения настраиваемого лазера (3-е изд.). Бока-Ратон: CRC Press . стр. 315–328. ISBN 9781482261066 .
- ^ Томас Дж.Л., Рудольф В. (2008). «Биологическая микроскопия ультракороткими лазерными импульсами». В Дуарте Ф.Дж. (ред.). Применение настраиваемых лазеров (2-е изд.). Бока-Ратон: CRC Press . стр. 245–80 . ISBN 978-1-4200-6009-6 .
- ^ Солем, Дж. К. (1983). «Рентгеновское исследование биологических образцов». Материалы Международной конференции по лазерам '83 : 635–640. ОСТИ 5998195 .
- ^ Солем, Дж. К. (1982). «Высокоинтенсивная рентгеновская голография: подход к получению снимков биологических образцов с высоким разрешением» . Технический отчет Лос-Аламосской национальной лаборатории LA-9508-MS . 83 : 23581. Бибкод : 1982STIN...8323581S . дои : 10.2172/7056325 . ОСТИ 7056325 . Архивировано из оригинала 04 августа 2020 г. Проверено 28 июня 2019 г.
- ^ Солем, Дж.К.; Болдуин, GC (1982). «Микроголография живых организмов». Наука . 218 (4569): 229–235. Бибкод : 1982Sci...218..229S . дои : 10.1126/science.218.4569.229 . ПМИД 17838608 . S2CID 32381820 .
- ^ Солем, Дж.К.; Чаплин, Г. Ф. (1984). «Рентгеновская биомикроголография». Оптическая инженерия . 23 (2): 193. Бибкод : 1984OptEn..23..193S . дои : 10.1117/12.7973410 .
- ^ Солем, Дж. К. (1985). «Микроголография». Энциклопедия науки и технологий Макгроу-Хилла .
- ^ Солем, Дж. К. (1984). «Рентгеновская голография биологических препаратов». Материалы девятого Международного конгресса по фотобиологии, Филадельфия, Пенсильвания, США, 3 июля 1984 г. (LA-UR-84-3340, CONF-840783-3): 19. OSTI 6314558 .
- ^ Солем, Дж. К. (1986). «Визуализация биологических образцов мягкими рентгеновскими лучами высокой интенсивности». Журнал Оптического общества Америки Б. 3 (11): 1551–1565. Бибкод : 1986JOSAB...3.1551S . дои : 10.1364/josab.3.001551 .
- ^ Хаддад, WS; Солем, Дж.К.; Каллен, Д.; Бойер, К.; Родос, СК (1987). «Описание теории и аппарата для цифровой реконструкции голограмм преобразования Фурье», Proceedings of Electronics Imaging '87, 2–5 ноября 1987 г., Бостон; Журнал электронных изображений (Институт графических коммуникаций, Бостон), с. 693.
- ^ Хаддад, штат Вашингтон; Каллен, Д.; Бойер, К.; Родос, СК; Солем, Дж.К.; Вайнштейн, Р.С. (1988). «Проектирование голографического микроскопа с преобразованием Фурье». Рентгеновская микроскопия II . Серия Спрингера по оптическим наукам. Том. 56. стр. 284–287. дои : 10.1007/978-3-540-39246-0_49 . ISBN 978-3-662-14490-9 .
- ^ Хаддад, штат Вашингтон; Солем, Дж.К.; Каллен, Д.; Бойер, К.; Родос, СК (1988). «Разработка голографического микроскопа с преобразованием Фурье, включающего цифровую реконструкцию изображения» . Материалы конференции CLEO '88 по лазерам и электрооптике, Анахайм, Калифорния, апрель 1988 г.; Оптическое общество Америки, Технический дайджест OSA . 7 : WS4. Архивировано из оригинала 2 февраля 2016 г. Проверено 13 января 2016 г.
- ^ Хаддад, штат Вашингтон; Каллен, Д.; Солем, Дж.К.; Бойер, К.; Родос, СК (1988). «Рентгеновский фурье-голографический микроскоп» . Материалы тематического совещания OSA по коротковолновому когерентному излучению: генерация и применение, 26–29 сентября 1988 г., Кейп-Код, Массачусетс, Фальконе, Р.; Кирз, Дж.; Ред. (Оптическое общество Америки, Вашингтон, округ Колумбия) : 284–289. Архивировано из оригинала 27 января 2016 г. Проверено 13 января 2016 г.
- ^ Солем, Дж.К.; Бойер, К.; Хаддад, штат Вашингтон; Родос, СК (1990). Просниц, Дональд (ред.). «Перспективы рентгеновской голографии с лазерами на свободных электронах». Лазеры на свободных электронах и их применение . Лазеры на свободных электронах и их применение. 1227 . Просниц, Д.; ред. ШПАЙ: 105–116. Бибкод : 1990SPIE.1227..105S . дои : 10.1117/12.18609 . S2CID 121807907 .
- ^ Хаддад, штат Вашингтон; Каллен, Д.; Солем, Дж.К.; Лонгворт, JW; Макферсон, Луизиана; Бойер, К.; Родос, СК (1991). «Голографический микроскоп с преобразованием Фурье». В Чанге, Винчи; Мильч, Джеймс Р. (ред.). Системы камер и входных сканеров . Том. 1448. стр. 81–88. Бибкод : 1991SPIE.1448...81H . дои : 10.1117/12.45347 . ПМИД 20733659 . S2CID 120679508 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Хаддад, штат Вашингтон; Каллен, Д.; Солем, Дж.К.; Лонгворт, Дж.; Макферсон, А.; Бойер, К.; Родос, СК (1992). «Голографический микроскоп с преобразованием Фурье». Прикладная оптика . 31 (24): 4973–4978. Бибкод : 1992ApOpt..31.4973H . дои : 10.1364/ao.31.004973 . ПМИД 20733659 .
- ^ Бойер, К.; Солем, Дж.К.; Лонгворт, Дж.; Борисов А.; Родос, СК (1996). «Биомедицинская трехмерная голографическая микровизуализация в видимом, ультрафиолетовом и рентгеновском диапазонах». Природная медицина . 2 (8): 939–941. дои : 10.1038/nm0896-939 . ПМИД 8705867 . S2CID 25231033 .
- ^ Белл, АГ (1880 г.). «О производстве и воспроизведении звука светом» . Американский научный журнал . с3-20 (118): 305–324. Бибкод : 1880AmJS...20..305B . дои : 10.2475/ajs.s3-20.118.305 . S2CID 130048089 . Архивировано из оригинала 27 ноября 2022 г. Проверено 28 июня 2019 г.
- ^ Яо, Дж.; Ван, Л.В. (2013). «Фотоакустическая микроскопия» . Лазерная фотоника Rev. 7 (5): 1–36. Бибкод : 2013ЛПРв....7..758Г . дои : 10.1002/lpor.201200060 . ПМЦ 3887369 . ПМИД 24416085 .
- ^ Лангер, Г.; Бухеггер, Б.; Якак, Дж.; Клар, Т.А.; Берер, Т. (2016). «Частотная фотоакустическая и флуоресцентная микроскопия» . Биомедицинская оптика Экспресс . 7 (7): 2692–702. дои : 10.1364/BOE.7.002692 . ПМЦ 4948622 . ПМИД 27446698 .
- ^ Котрлый М (август 2015 г.). «Новые возможности использования микроскопических методов в криминалистической сфере» . Труды по микроскопии и микроанализу . 21 (С3): 1365–1366. Бибкод : 2015MiMic..21S1365K . дои : 10.1017/S1431927615007618 .
- ^ Перейти обратно: а б Басу С., Миллетт-младший (1986). Электронная микроскопия в судебно-медицинской экспертизе, гигиене труда и окружающей среды . Нью-Йорк: Пленум Пресс.
Дальнейшее чтение
[ редактировать ]- Плута, Максимилиан (1988). Расширенная световая микроскопия, том. 1 Принципы и основные свойства . Эльзевир. ISBN 978-0-444-98939-0 .
- Плута, Максимилиан (1989). Расширенная световая микроскопия, том. 2 специализированных метода . Эльзевир. ISBN 978-0-444-98918-5 .
- Брэдбери, С.; Брейсгедл, Б. (1998). Введение в световую микроскопию . Научные издательства БИОС . ISBN 978-0-387-91515-9 .
- Иноуэ, Шинья (1986). Видеомикроскопия . Пленум Пресс. ISBN 978-0-306-42120-4 .
- Кремер, К.; Кремер, Т. (1978). «Соображения относительно лазерного сканирующего микроскопа с высоким разрешением и глубиной резкости» (PDF) . Микроскопика Акта . 81 (1): 31–44. ПМИД 713859 . Архивировано из оригинала (PDF) 4 марта 2016 г. Проверено 22 декабря 2009 г. Теоретические основы микроскопии 4Pi со сверхвысоким разрешением и конструкция конфокального лазерного сканирующего флуоресцентного микроскопа
- Уиллис, Рэндалл К. (2007). «Портреты жизни, по одной молекуле за раз» . Аналитическая химия . 79 (5): 1785–8. дои : 10.1021/ac0718795 . ПМИД 17375393 . , тематическая статья о субдифракционной микроскопии из журнала Analytical Chemistry от 1 марта 2007 г.
Внешние ссылки
[ редактировать ]Общий
[ редактировать ]- Словарь микроскопии , Общие термины, используемые в любительской световой микроскопии.
- Nikon MicroscopeU Обширная информация по световой микроскопии.
- микроскопии Olympus Ресурсный центр по
- Карл Цейсс «Микроскопия с самого начала» , пошаговое руководство по основам микроскопии.
- Микроскопия в деталях - ресурс со множеством иллюстраций, описывающих наиболее распространенные методы микроскопии.
- Манавату Микроскопия — первая известная среда для совместной работы в области микроскопии и анализа изображений.
- Глоссарий аудиомикроскопа
Техники
[ редактировать ]- Применение логометрической визуализации для микроскопов. Примеры логометрической визуализации на микроскопе.
- Интерактивная база данных флуоресцентных красителей и фильтров Carl Zeiss Интерактивная база данных флуоресцентных красителей и фильтров.
- Новые подходы к микроскопии Эрик Бетциг: За пределами Нобелевской премии. Новые подходы к микроскопии.


















