Общий синтез хинина

Полный синтез хинина препарата , , природного противомалярийного разрабатывался в течение 150 лет. Разработка синтетического хинина считается важной вехой в органической химии, хотя он никогда не производился промышленно в качестве заменителя природного хинина. Эта тема также вызвала некоторые разногласия: Гилберт Сторк опубликовал первый стереоселективный полный синтез хинина в 2001 году, тем самым поставив под сомнение более раннее утверждение Роберта Бернса Вудворда и Уильяма Деринга в 1944 году, утверждавших, что последние шаги, необходимые для преобразования их последнего Синтетический промежуточный продукт, хинотоксин, в хинин не сработал бы, если бы Вудворд и Деринг попытались провести эксперимент. Редакционная статья 2001 года, опубликованная в журнале Chemical & Engineering News , встала на сторону Сторка, но в конечном итоге спор был улажен раз и навсегда, когда Уильямс и его коллеги успешно повторили предложенное Вудвордом преобразование хинотоксина в хинин в 2007 году. [1]
Химическая структура
[ редактировать ]Ароматический компонент молекулы хинина представляет собой хинолин с метоксизаместителем . Аминный гидроксильную компонент имеет хинуклидиновый скелет, а метиленовый мостик между двумя компонентами имеет группу . Заместителем в положении 3 является винильная группа . Молекула оптически активна и имеет пять стереогенных центров (N1 и C4 составляют одну асимметричную единицу), что потенциально затрудняет синтез, поскольку она является одним из 16 стереоизомеров .
График общего синтеза хинина
[ редактировать ]- 1817 и Жозеф Кавенту впервые выделили хинин из хинного дерева : Пьер Жозеф Пеллетье .
- 1853 : Луи Пастер получает хинотоксин (или хиницин в более старой литературе) путем кислотно-катализируемой изомеризации хинина. [2]
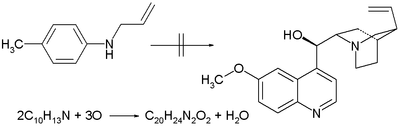
- 1856 : Сэр Уильям Генри Перкин предпринимает попытку синтеза хинина путем окисления N - аллилтолуидина, основываясь на ошибочном представлении о том, что два эквивалента этого соединения с химической формулой C 10 H 13 N плюс три эквивалента кислорода дают один эквивалент C 20 H 24 N 2. O 2 (химическая формула хинина) и один эквивалент воды. [3] Его окисление другими толуидинами ставит его на путь открытия мовеина . Коммерческое значение мовеина в конечном итоге привело к зарождению химической промышленности.
- 1907 : Поль Рабе установил правильную связность атомов. [4]
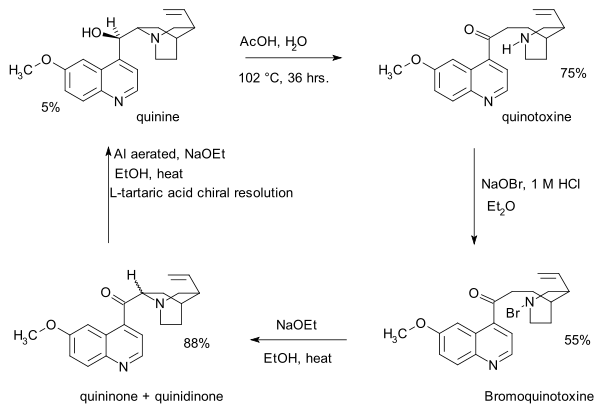
- 1918 : Пауль Рабе и Карл Киндлер синтезируют хинин из хинотоксина. [5] обращая химию Пастера. Отсутствие подробностей эксперимента в этой публикации станет серьезной проблемой в споре Сторка и Вудворда почти столетие спустя.

- Первым шагом в этой последовательности является присоединение гипобромита натрия к хинотоксину с образованием N -бромового промежуточного соединения, возможно, со структурой 2. Второй этап - органическое окисление этоксидом натрия в этаноле . Из-за основных условий исходный продукт хининон взаимопревращается с хинидиноном через общее енольное промежуточное соединение, и мутаротирование наблюдается . На третьем этапе кетоновую группу восстанавливают с помощью алюминиевого порошка и этоксида натрия в этаноле и можно идентифицировать хинин. Хинотоксин — первая молекула-передатчик в заявлении Вудворда/Дёринга.

- 1939 : Рабе и Киндлер повторно исследуют образец, оставшийся от их экспериментов 1918 года, идентифицируют и изолируют хинин (снова) вместе с диастереомерами хинидином , эпихинином и эпихинидином . [6]
- 1940 : Роберт Бернс Вудворд становится консультантом корпорации Polaroid по просьбе Эдвина Х. Лэнда . Хинин представляет интерес для Polaroid из-за его свойств поляризации света .
- 1943 : Прелог и Проштеник взаимно превращают аллилпиперидин , называемый гомомерохинен , и хинотоксин. [7] Гомомерохинен (вторая релейная молекула в заявлении Вудворда/Дёринга) получается в несколько стадий из биомолекулы цинхонина (родственной хинидину, но без метоксигруппы ):
- Ключевым этапом сборки хинотоксина является конденсация Кляйзена :
- 1944 : Роберт Бернс Вудворд и У. Э. Деринг сообщают о синтезе хинина. [8] начиная с 7- гидроксиизохинолина . Хотя название их одностраничной публикации — «Полный синтез хинина», как ни странно, это синтез не хинина, а синтеза предшественника гомомерохинена (рацемического), а затем на основе уже предоставленной Прелогом годом ранее работы по хинотоксину (энантиочистому после хирального разделения). ), что описано.

- Вудворд и Деринг утверждают, что Рабе в 1918 году уже доказал, что это соединение в конечном итоге дает хинин, но не повторяют работу Рабе. В этом проекте 27-летний доцент Вудворд является теоретиком, а постдок Деринг (26 лет) — настольным рабочим. По словам Уильяма, Боб умел вскипятить воду, но приготовить яйцо было бы непросто. [ нужна ссылка ] Поскольку многие природные ресурсы хинина были сосредоточены в удерживаемой врагом Голландской Ост-Индии , синтетический хинин стал многообещающей альтернативой для борьбы с малярией на поле боя, и оба мужчины мгновенно стали героями войны, попав в заголовки газет New York Times , Newsweek и Life .
- 1944 : Тогдашний 22-летний Гилберт Сторк пишет Вудворду, спрашивая, повторил ли он работу Рабе.
- 1945 : Вудворд и Деринг публикуют свою вторую длинную статью о хинине. [9] Один из двух рецензентов отклоняет рукопись (слишком много исторического материала, слишком много экспериментальных деталей и плохой литературный стиль с включением таких слов, как кратко и уместно ), но тем не менее она публикуется без изменений.
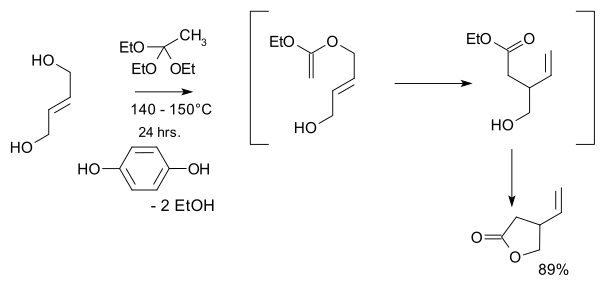
- 1974 : Кондо и Мори синтезируют рацемические виниловые гамма- лактоны , ключевой исходный материал в синтезе хинина Сторком в 2001 году. [10]
- Исходными материалами являются транс-2-бутен-1,4-диол и этилортоацетат , а ключевой стадией является перегруппировка Кляйзена.
- 1988 : Исибаши и Танигучи разделяют указанный лактон на энантиочистые соединения посредством хирального разделения : [11]

- В этом процессе рацемический лактон реагирует при аминолизе с ( S ) -метилбензиламином при помощи триэтилалюминия с образованием диастереомерной пары амидов , которые можно разделить с помощью колоночной хроматографии . S - энантиомер превращается обратно в S -лактон в две стадии путем гидролиза гидроксидом калия и этиленгликолем с последующим азеотропным замыканием кольца.
- 2001 : Гилберт Сторк публикует свой стереоселективный синтез хинина. [12] Он подвергает сомнению обоснованность утверждения Вудворда/Дёринга: «основание их характеристики утверждения Рабе как «установленного» неясно». М. Джейкобс, пишущий в The Chemical & Engineering News , столь же критичен. [13]
- 2007 : Исследователь Джеффри И. Симан в 30-страничном обзоре. [14] приходит к выводу, что полный синтез хинина Вудворда-Дёринга-Рабе-Киндлера является действительным достижением. Он отмечает, что Поль Рабе был чрезвычайно опытным химиком- алкалоидом , что у него было достаточно возможностей сравнить продукт реакции хинина с подлинными образцами и что описанная химия 1918 года была повторена Рабе, хотя и не с самим хинотоксином, но все же с близкородственными производными.
- 2008 : Смит и Уильямс вновь исследуют и подтверждают путь Рабе от d -хинотоксина к хинину. [15]
- 2018 : Нуно Маулид и его команда сообщают о полном синтезе хинина посредством активации C–H , включая аналоги с улучшенной противомалярийной активностью. [16]
Общий синтез хинина аиста
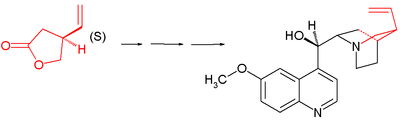
[ редактировать ]Синтез хинина Сторка начинается с хирального ( S )-4-винилбутиролактона 1 . Соединение получается путем хирального разделения , и фактически на последующих этапах все стереогенные центры устанавливаются на место путем хиральной индукции : последовательность не содержит асимметричных стадий.
 |  | |
| Синтез хинина аиста | Знакомство с C8 и азотом |
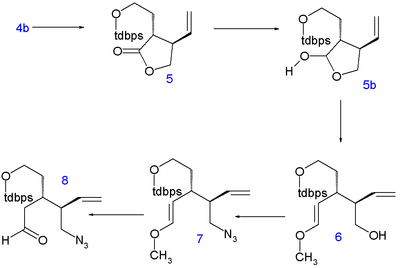
Лактон ( TBS раскрывается диэтиламином с образованием амида 2 , а его гидроксильная группа защищена трет - бутилдиметилсилиловым эфиром ) в 3 . Атомы C5 и C6 добавляются в виде , защищенного трет -бутилдифенилсилилом (TBDPS), защищенного иодоэтанола при нуклеофильном замещении кислого C4 диизопропиламидом лития (LDA) при температуре от -78 ° C до 4 с правильной стереохимией. Удаление силильной защитной группы с помощью п -толуолсульфоновой кислоты до спирта 4b и замыкание кольца азеотропной перегонкой возвращает соединение в лактон 5 (прямое алкилирование 1 встретило нераскрытые проблемы).
Затем лактон восстанавливают до лактола 5b с помощью диизобутилалюминийгидрида , и его высвобожденный альдегид реагирует по реакции Виттига с метоксиметилентрифенилфосфином (с выделением атома C8) с образованием енолового эфира 6 . Гидроксильная группа заменяется в реакции Мицунобу группой азидной с дифенилфосфорилазидом в 7 , а кислотный гидролиз дает азидоальдегид 8 .
 |  | |
| Закрытие первого кольца | Закрытие второго кольца |
Метильная в группа в 6-метокси-4-метилхинолине 9 является достаточно кислой для нуклеофильного присоединения ее аниона (по реакции с ЛДА ) к альдегидной группе в 8 с образованием 10 виде смеси эпимеров . Это не имеет значения для стереоконтроля, поскольку на следующем этапе спирт окисляется по Сверну до кетона 11 . с Реакция Штаудингера трифенилфосфином замыкает кольцо между кетоном и азидом до тетрагидропиридина 12 . Иминная борогидридом группа в этом соединении восстанавливается до амина 13 натрия стереоспецифичностью правильной с . Силильная защитная группа удаляется фтористым водородом до спирта 14 , а затем активируется как уходящая мезильная группа реакцией с мезилхлоридом в пиридине , что обеспечивает замыкание третьего кольца до 15 . На заключительном этапе гидроксильную группу C9 вводили путем окисления гидридом натрия , диметилсульфоксидом и кислородом с соотношением хинина к эпихинину 14:1.
Общий синтез формального хинина Вудворда – Деринга
[ редактировать ]Синтез Вудворда-Дёринга 1944 года начинается с 7-гидроксиизохинолина 3 для хинуклидинового скелета, что несколько противоречит здравому смыслу, поскольку происходит переход от стабильной гетероциклической ароматической системы к полностью насыщенному бициклическому кольцу. Это соединение (известное уже с 1895 г.) получают в два этапа.
 |  | |
| Синтез хинина Вудворда/Дёринга, часть I | Часть II |
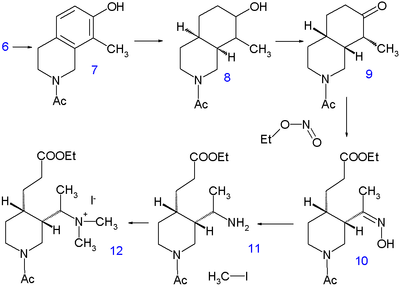
Первая стадия реакции представляет собой конденсации 1 3-гидроксибензальдегида с (формально) диацеталем аминоацетальдегида до реакцию имина 2 , а вторая стадия реакции представляет собой циклизацию в концентрированной серной кислоте . Затем изохинолин 3 алкилируют в результате другой конденсации формальдегидом и пиперидином и продукт выделяют в виде натриевой соли 4 .
 | |
| Синтез хинина Вудворда/Дёринга, часть III |
Гидрирование при 220 ° C в течение 10 часов в метаноле с метоксидом натрия высвобождает пиперидиновую группу и оставляет метильную группу в 5 , уже учтены все атомы углерода и азота. Второе гидрирование происходит на катализаторе Адамса в уксусной кислоте до тетрагидроизохинолина 6 . Дальнейшее гидрирование не происходит до тех пор, пока аминогруппа не ацилируется уксусным ангидридом в метаноле , но к этому времени 7 снова гидрируется никелем Ренея в этаноле при 150 °C под высоким давлением до декагидроизохинолина 8 . Смесь цис- и транс -изомеров затем окисляется хромовой кислотой в уксусной кислоте до кетона 9 . Только цис-изомер кристаллизуется и используется на следующей стадии реакции: раскрытие кольца алкилнитритом этилнитритом этилатом натрия в этаноле до 10 с вновь образованной сложноэфирной группой карбоновой кислоты и оксимной группой. Оксимная группа гидрируется до 11 платиной в , уксусной кислоте а алкилирование иодметаном амина дает четвертичную аммониевую соль 12 , а затем бетаин 13 после реакции с оксидом серебра .
хинина Винильную группу затем создают путем отщепления Гофмана гидроксидом натрия в воде при 140 ° C. Этот процесс сопровождается гидролизом выделяется не свободный амин, а мочевина 14 как эфирной, так и амидной группы, но при реакции с цианатом калия . На следующем этапе карбоновой кислоты группу этерифицируют этанолом, а группу мочевины заменяют бензоильной группой. Последней стадией является конденсация Кляйзена 15 дает с этилхининатом 16 , которая после кислотной обработки рацемический хинотоксин 17 . Желаемый энантиомер получают хиральным разделением с помощью хирального дибензоилового эфира винной кислоты . Превращение этого соединения в хинин основано на химии Рабе-Киндлера, обсуждавшейся в данный момент.
Внешние ссылки
[ редактировать ]- Общий синтез хинина @ SynArchive.com
- История хинина на Harvard.edu Link
Ссылки
[ редактировать ]- ^ Смит, Аарон К.; Уильямс, Роберт М. (15 февраля 2008 г.). «Покойся с миром Рабе: подтверждение превращения d-хинотоксина в хинин по методу Рабе-Киндлера: экспериментальное подтверждение формального полного синтеза хинина по методу Вудворда-Дёринга» . Angewandte Chemie, международное издание . 47 (9): 1736–1740. дои : 10.1002/anie.200705421 . ISSN 1433-7851 . ПМК 3085927 . ПМИД 18236503 .
- ^ Пастер, Л. Compt. возвращается. 1853 , 37, 110.
- ^ Перкин, WHJ Chem. Соц. 1896 , 69, 596
- ^ Рабе, П.; Акерман, Э.; Шнайдер, В. Бер. 1907 , 40, 3655
- ^ Рабе, П.; Киндлер, К. Chem. 1918 , 51, 466
- ^ П. Рабе, К. Киндлер, Бер. Немецкий. Chem. B 1939 , 72, 263–264.
- ^ Прошеник, М.; Прелог, В. ХелВ. хим. Акта 1943 , 26, 1965.
- ^ Полный синтез хинина Р.Б. Вудворд и WE Doering J. Am. хим. Соц. ; 1944 год ; 66(5), стр. 849–849; дои : 10.1021/ja01233a516
- ^ Полный синтез хинина Р.Б. Вудворд и WE Doering J. Am. хим. соц.; 1945 год ; 67(5), стр. 860–874; два : 10.1021/ja01221a051
- ^ СИНТЕЗ γ-ЛАКТОНОВ ПУТЕМ КОНДЕНСАЦИИ 2-АЛКЕН-1,4-ДИОЛОВ С ЭФИРАМИ ОРТОКАРБОНКОВЫХ ЭФИРОВ Киёси Кондо и Фумио Мори Chemistry Letters Vol.3 ( 1974 ), No.7, стр. 741-742 два : 10.1246/кл.1974.741
- ^ Синтез и абсолютная конфигурация ацеталевого лигнана (+)-фримаролина Фумито Исибаши и Эйдзи Танигучи. Бюллетень Химического общества Японии, том 61 ( 1988 ), № 12, стр. 4361-4366. два : 10.1246/bcsj.61.4361
- ^ Первый стереоселективный полный синтез хинина Гилберт Сторк, Децян Ню, А. Фудзимото, Эмиль Р. Кофт, Джеймс М. Балковец, Джеймс Р. Тата и Грегори Р. Дэйк Дж. Ам. хим. Соц. ; 2001 год ; 123(14), стр. 3239–3242; (Статья) два : 10.1021/ja004325r .
- ^ М. Джейкобс, Новости химии и техники , 2001 , 79 (7 мая), 5.
- ^ Обзор: Полный синтез хинина Вудворда-Деринга/Рэйба-Киндлера: установление рекорда Джеффри И. Симан Энджью. хим. Межд. Эд. 2007 , 46, 1378–1413 два : 10.1002/anie.200601551 ПМИД 17294412
- ^ Сообщение Покойся с миром Рабе: Подтверждение преобразования d -хинотоксина в хинин по методу Рабе-Киндлера: экспериментальное подтверждение формального полного синтеза хинина Вудворда-Дёринга Аарон К. Смит, Роберт М. Уильямс Angewandte Chemie International Edition 2008 , 47, 1736–1740 гг. два : 10.1002/anie.200705421
- ^ Активация C – H позволяет провести краткий общий синтез хинина и аналогов с повышенной противомалярийной активностью DH O'Donovan et al Angewandte Chemie International Edition, 2018 г. два : 10.1002/anie.201804551