Гексахлорфосфазен
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2,2,4,4,6,6-Гексахлор-1,3,5,2λ 5 ,4 мин. 5 ,6 л 5 -триазатрифосфинин | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.012.160 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| (NPCl 2 ) 3 | |
| Молярная масса | 347.64 g·mol −1 |
| Появление | бесцветное твердое вещество |
| Плотность | 1,98 г/мл при 25 °C |
| Температура плавления | От 112 до 114 ° C (от 234 до 237 ° F; от 385 до 387 К) |
| Точка кипения | разлагается (выше 167 °C) |
| 60 °C при 0,05 Торр | |
| разлагается | |
| Растворимость в четыреххлористом углероде |
|
| Растворимость в циклогексане |
|
| Растворимость в ксилоле |
|
| −149×10 −6 см 3 /моль | |
Показатель преломления ( n D ) | 1,62 (589 нм) |
| Структура | |
| орторомбический | |
| 62 (Пнма, Д 16 2 часа ) | |
| Д 3 часа | |
а = 13,87 Å, b = 12,83 Å, c = 6,09 Å | |
Формульные единицы ( Z ) | 4 |
| стул (слегка взъерошенный) | |
| 0 Д | |
| Термохимия | |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −812,4 кДж/моль |
Энтальпия испарения (Δ f H vap ) | 55,2 кДж/моль |
Энтальпия сублимации (Δ f H sublim ) | 76,2 кДж/моль |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | легкий раздражитель |
| СГС Маркировка : | |
 | |
| Опасность | |
| H314 | |
| P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P405 , P501 | |
| точка возгорания | Невоспламеняющийся |
| Родственные соединения | |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гексахлорфосфазен — неорганическое соединение с химической формулой ( N P Cl 2 ) 3 . Молекула имеет циклическую ненасыщенную основную цепь , состоящую из чередующихся атомов фосфора и азота , и ее можно рассматривать как тример гипотетического соединения. N≡PCl 2 (фосфазилдихлорид). Его классификация как фосфазена подчеркивает его связь с бензолом . [1] Существует большой академический интерес к этому соединению, связанному с связью фосфор-азот и реакционной способностью фосфора. [2] [3]
Время от времени сообщалось также о коммерческих или предлагаемых практических применениях с использованием гексахлорфосфазена в качестве химического вещества-прекурсора. [2] [4] Производные, представляющие заметный интерес, включают гексалкоксифосфазеновые смазочные материалы, полученные в результате нуклеофильного замещения гексахлорфосфазена алкоксидами . [4] или химически стойкие неорганические полимеры с желаемыми термическими и механическими свойствами, известные как полифосфазены, полученные полимеризацией гексахлорфосфазена . [2] [4]
Структура и характеристика
[ редактировать ]Длина связей и конформация
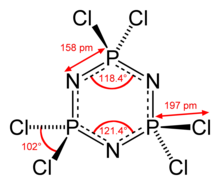
[ редактировать ]Гексахлорфосфазен представляет собой циклическую молекулу , содержащую Ядро P 3 N 3 с чередующимися атомами азота и фосфора и двумя дополнительными атомами хлора, связанными с каждым атомом фосфора. Молекула гексахлорфосфазена содержит шесть эквивалентных связей P–N, для которых соседние расстояния P–N составляют 157 пм . [1] [2] [5] Это характерно короче, чем ca . 177 пм связи P–N в валентно насыщенных аналогах фосфазана . [3]
Молекула обладает симметрией D3h , каждый фосфорный центр тетраэдрический с углом Cl–P–Cl 101°. [5]
The Кольцо P 3 N 3 в гексахлорфосфазене отклоняется от плоскостности и слегка гофрировано (см. конформацию кресла ). [2] Напротив, Кольцо P 3 N 3 у родственных разновидностей гексафторфосфазена полностью плоское. [2]
Методы характеристики
[ редактировать ]31 P-ЯМР- спектроскопия является обычным методом анализа гексахлорфосфазена и его реакций. [6] [7] [8] Гексахлорфосфазен демонстрирует одиночный резонанс при 20,6 м.д., поскольку все среды фосфора химически эквивалентны. [7] [8]
В нем ИК спектр 1370 и 1218 см. −1 колебательные полосы отнесены к участкам ν P–N . [7] [8] Остальные полосы встречаются при 860 и 500–600 см. −1 , отнесенные соответственно к кольцу и ν P–Cl . [8]
Гексахлорфосфазен и многие его производные были охарактеризованы методом рентгеновской кристаллографии монокристаллов . [2] [5]
Склеивание
[ редактировать ]
Ранние анализы
[ редактировать ]Циклофосфазены, такие как гексахлорфосфазен, отличаются заметной стабильностью и одинаковой длиной связи P–N, что во многих таких циклических молекулах предполагает делокализацию или даже ароматичность. Чтобы объяснить эти особенности, ранние модели связей, начиная с середины 1950-х годов, использовали делокализованную π-систему, возникающую в результате перекрытия N 2 p и P 3 d орбиталей . [2] [3]
Современные модели склеивания
[ редактировать ]Начиная с конца 1980-х годов более современные расчеты и отсутствие спектроскопических данных показывают, что вклад P 3 d незначителен, что опровергает более раннюю гипотезу. [3] Вместо этого общепринятой является модель разделения зарядов. [1] [3]
Согласно этому описанию связь P–N рассматривается как сильно поляризованная (между условными П + и Н − ), с достаточным ионным характером, чтобы обеспечить большую часть прочности связи. [1] [3]
Остальная часть (~ 15%) прочности связи может быть связана с отрицательным гиперконъюгирующим взаимодействием: N неподеленные пары могут жертвовать некоторую электронную плотность на π-принимающие σ* молекулярные орбитали на P. [3]
Синтез
[ редактировать ]О синтезе гексахлорфосфазена впервые сообщил фон Либих в 1834 году. В этом отчете он описывает эксперименты, проведенные с Вёлером . [9] Они обнаружили, что пентахлорид фосфора ( PCl 5 ) и аммиак ( NH 3 реагируют ) экзотермически с образованием нового вещества, которое можно промыть холодной водой для удаления хлорида аммония ( [NH 4 ]Cl ) побочный продукт. новое соединение содержало P , N и Cl Согласно элементному анализу , . Он был чувствителен к гидролизу горячей водой. [2]
Современные синтезы основаны на разработках Шенка и Рёмера, которые использовали хлорид аммония вместо аммиака и инертных хлорированных растворителей . Замена аммиака хлоридом аммония позволяет реакции протекать без сильной экзотермической реакции, связанной с NH3 / ПКл 5 . Типичными хлоруглеродными растворителями являются 1,1,2,2-тетрахлорэтан или хлорбензол , которые допускают побочный продукт хлористого водорода (HCl). Поскольку хлорид аммония нерастворим в хлорированных растворителях, его обработка облегчается. [10] [11] Для реакции в таких условиях применяется следующая стехиометрия :
- n [NH 4 ]Cl + n PCl 5 → (NPCl 2 ) n + n HCl
где n обычно может принимать значения 2 (димер тетрахлордифосфазен ), 3 (тример гексахлортрифосфазен) и 4 (тетрамер октахлортетрафосфазен ). [12]

Очистка сублимацией дает в основном тримеры и тетрамеры . Медленная сублимация в вакууме при температуре примерно 60 ° C дает чистый тример, не содержащий тетрамера. [6] Условия реакции, такие как температура, также могут быть настроены так, чтобы максимизировать выход тримера за счет других возможных продуктов; тем не менее коммерческие образцы гексахлорфосфазена обычно содержат заметные количества октахлортетрафосфазена, вплоть до 40%. [6]
Механизм формирования
[ редактировать ]Механизм вышеуказанной реакции не выяснен, но предполагается, что PCl 5 находится в ионной форме. [ПКл 4 ] + [ПКл 6 ] − (гексахлорфосфат тетрахлорфосфония(V)) и реакция протекает через нуклеофильную атаку [ПКл 4 ] + (тетрахлорфосфоний) путем НХ 3 (от [NH 4 ]Cl диссоциация ). [2] Удаление HCl ) приводит к (основного побочного продукта образованию реакционноспособного нуклеофильного промежуточного продукта.
- NH 3 + [PCl 4 ] + → HN=PCl 3 + HCl + H +
который посредством дальнейшей атаки [ПКл 4 ] + и последующее удаление HCl создает растущий ациклический промежуточный продукт.
- HN=PCl 3 + [PCl 4 ] + → [Cl 3 P-N=PCl 3 ] + + HCl
- NH 3 + [Cl 3 P-N=PCl 3 ] + → HN=PCl 2 −N=PCl 3 + HCl + H + , и т. д.
до тех пор, пока возможная внутримолекулярная атака не приведет к образованию одного из циклических олигомеров . [2]
Реакции
[ редактировать ]Замена в P
[ редактировать ]Гексахлорфосфазен легко реагирует с щелочных металлов алкоксидами и амидами . [1] [2]

Нуклеофильное центрам полизамещение фосфорным хлорида : алкоксидом протекает через замещение хлорида по отдельным [1]
- (NPCl 2 ) 3 + 3 NaOR → (NPCl(OR)) 3 + 3 NaCl
- (NPCl(OR)) 3 + 3 NaOR → (NP(OR) 2 ) 3 + 3 NaCl
Наблюдаемая региоселективность обусловлена комбинированными стерическими эффектами и π-бэкдонированием неподеленной пары кислорода (которое дезактивирует уже замещенные атомы P). [1] [2]
Полимеризация с раскрытием кольца
[ редактировать ]Нагревание гексахлорфосфазена до температуры ок . 250 °C вызывает полимеризацию. [1] [2] [4] [6] Тетрамер также полимеризуется таким же образом, хотя и медленнее. [4] Конверсия представляет собой тип полимеризации с раскрытием цикла (ROP). [6] [7] Установлено, что механизм ROP катализируется кислотами Льюиса , но в целом он не очень хорошо изучен. [7] Длительное нагревание полимера при более высоких температурах ( около 350 °C) приведет к деполимеризации . [2]
Структура неорганического хлорполимерного продукта ( Поли(дихлорфосфазен) ) представляет собой линейную – (N=P(-Cl) 2 -) n цепи, где n ~ 15000. [2] [4] Впервые он был обнаружен в конце 19 века, а его форма после сшивания цепи была названа «неорганическим каучуком» из-за его эластомерных свойств. [4]

Этот продукт полидихлорфосфазена является исходным материалом для широкого класса полимерных соединений, известных под общим названием полифосфазены . Замещение хлоридных групп другими нуклеофильными группами, особенно алкоксидами, как указано выше, дает многочисленные охарактеризованные производные. [2] [4] [6]
Основность Льюиса
[ редактировать ]Азотные центры гексахлорфосфазена являются слабоосновными, и было высказано предположение, что такое поведение основания Льюиса играет роль в механизме полимеризации. [7] В частности, сообщалось, что гексахлорфосфазен образует аддукты различной стехиометрии с кислотами Льюиса. AlCl 3 , АлБр 3 , GaCl3 , СО3 , ТаСl 5 , VOCl 3 , но нет изолируемого продукта с БСl 3 . [7]
Среди них лучше всего структурно охарактеризованы аддукты 1:1 с трихлоридом алюминия или с трихлоридом галлия; они обнаруживаются с атомом Al/Ga, связанным с N, и принимают более заметно искаженную конформацию кресла по сравнению со свободным гексахлорфосфазеном. [7] Аддукты также демонстрируют флюксиальное поведение в растворе при температурах до -60 ° C, что можно контролировать с помощью 15 Н и 31 П-ЯМР . [7]
Связывающий реагент
[ редактировать ]Гексахлорфосфазен также нашел применение в исследованиях, обеспечивая проведение реакций ароматического сочетания между пиридином и N , N -диалкиланилинами или индолом , в результате чего образуются 4,4'-замещенные производные фенилпиридина , которые, как предполагается, проходят через промежуточную соль циклофосфазена пиридиния. [6]
Соединение также можно использовать в качестве реагента для связывания пептидов для синтеза олигопептидов в хлороформе, хотя для этого применения тетрамер октахлортетрафосфазен обычно оказывается более эффективным. [6]
Фотохимическая деградация
[ редактировать ]И тример, и тетрамер в углеводородных растворах фотохимически реагируют, образуя прозрачные жидкости, идентифицированные как алкилзамещенные производные. (NPCl 2− x R x ) n , где n = 3, 4. [6] Такие реакции протекают при длительном УФ- облучении ( ртутной дуге ), не влияя на П н н н звенит . Твердые пленки тримера и тетрамера не претерпевают никаких химических изменений в таких условиях облучения. [6]
Приложения
[ редактировать ]Гексалкоксифосфазены (особенно арилокси- разновидности), образующиеся в результате нуклеофильного гексазамещения атомов P гексахлорфосфазена, привлекли интерес из-за их высокой термической и химической стабильности, а также низкой температуры стеклования . [4] Некоторые гексалкоксифосфазены (такие как производное гексафенокси) нашли коммерческое использование в качестве огнезащитных материалов и высокотемпературных смазок. [4]
Полифосфазены, полученные из полимеризованного гексахлорфосфазена ( поли(дихлорфосфазен) ), привлекли внимание в области неорганических полимеров . эластомерные термопластичные и свойства . Исследованы [2] [4] Некоторые из них кажутся многообещающими для будущего применения в качестве высокоэффективных материалов, образующих волокна или мембраны, поскольку они сочетают в себе прозрачность, гибкость основной цепи , настраиваемую гидрофильность или гидрофобность и различные другие желаемые свойства . [4]
Компоненты на основе полифосфазена использовались в уплотнительных кольцах , топливопроводах и амортизаторах , где полифосфазены придают огнестойкость, непроницаемость для масел и гибкость даже при очень низких температурах. [2]
Дальнейшее чтение
[ редактировать ]- Открытие циклофосфазенов: Либих-Велер, переписка, том. 1,63; Энн. Хим. (Либих), вып. 11 (1834), 146.
- Первые сообщения об их полимеризации: Г. Н. Стоукс (1895), О хлорнитридах фосфора . Американский химический журнал, том. 17, с. 275. Х. Н. Стоукс (1896), О триметафосфимовой кислоте и продуктах ее разложения. Американский химический журнал, том. 18 выпуск 8, с. 629.
- Пример синтеза гексалкоксифосфазена из гексахлорфосфазена и описание структуры: Олкок, Гарри Р.; Нго, Деннис С.; Парвез, Масуд; Уиттл, Роберт Р.; Бердсолл, Уильям Дж. (1 марта 1991 г.). «Синтез и строение циклических и короткоцепных линейных фосфазенов, несущих 4-фенилфенокси-боковые группы» . Журнал Американского химического общества . 113 (7): 2628–2634. дои : 10.1021/ja00007a041 . ISSN 0002-7863 .
- Новый синтез гексалкоксифосфазена, не начинающийся с гексахлорфосфазена: Йе, Чэнфэн; Чжан, Цзефу; Лю, Вэйминь (1 января 2002 г.). «Новый синтез гексазамещенных циклотрифосфазенов» . Синтетические коммуникации . 32 (2): 203–209. дои : 10.1081/SCC-120002003 . ISSN 0039-7911 . S2CID 97319633 .
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж Аллен, Кристофер В. (1 марта 1991 г.). «Регио- и стереохимический контроль в реакциях замещения циклофосфазенов» . Химические обзоры . 91 (2): 119–135. дои : 10.1021/cr00002a002 . ISSN 0009-2665 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Jump up to: а б с д и ж г час я Чаплин, Адриан Б.; Харрисон, Джон А.; Дайсон, Пол Дж. (1 ноября 2005 г.). «Возвращаясь к электронной структуре фосфазенов» . Неорганическая химия . 44 (23): 8407–8417. дои : 10.1021/ic0511266 . ISSN 0020-1669 . ПМИД 16270979 .
- ^ Jump up to: а б с д и ж г час я дж к л Марк, Дж. Э.; Олкок, HR; Уэст, Р. «Неорганические полимеры», Прентис Холл, Энглвуд, Нью-Джерси: 1992. ISBN 0-13-465881-7 .
- ^ Jump up to: а б с Бартлетт, Стюарт В.; Коулз, Саймон Дж.; Дэвис, Дэвид Б.; Херстхаус, Майкл Б.; и Бишоглу, Ханифе; Килич, Адем; Шоу, Роберт А.; Юн, Илькер (2006). «Структурные исследования фосфорно-азотистых соединений. 7. Связь между физическими свойствами, электронной плотностью, механизмами реакций и мотивами водородных связей производных N3P3Cl(6 - n)(NHBu t ) n» . Acta Crystallographica Раздел B: Структурная наука . 62 (2): 321–329. дои : 10.1107/S0108768106000851 . ПМИД 16552166 .
- ^ Jump up to: а б с д и ж г час я дж Олкок, HR (1972). фосфорно-азотистые соединения; циклические, линейные и высокомолекулярные системы . Нью-Йорк: Академическая пресса. ISBN 978-0-323-14751-4 . OCLC 838102247 .
- ^ Jump up to: а б с д и ж г час я Хестон, Эми Дж.; Панцнер, Мэтью Дж.; Янгс, Уайли Дж.; Тессье, Клэр А. (2005). «Кислотные аддукты Льюиса [PCl2N]3». Неорганическая химия . 44 (19): 6518–6520. дои : 10.1021/ic050974y . ПМИД 16156607 .
- ^ Jump up to: а б с д Дхиман, Ниша; Моханти, Паритош (28 октября 2019 г.). «Неорганически-органический гибридный материал с пиридиновым мостиком, обогащенный азотом и фосфором, для применения в суперконденсаторах» . Новый химический журнал . 43 (42): 16670–16675. дои : 10.1039/C9NJ03976G . ISSN 1369-9261 . S2CID 208761169 .
- ^ Й. Либих (1834). «Дополнение от редакции» . Энн. Фарм . 11 :139-150. дои : 10.1002/jlac.18340110202 .
- ^ Р. Клемент (1963). «Фосфонитрилхлориды». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 1. Нью-Йорк, Нью-Йорк: Академик Пресс. п. 575.
- ^ Нильсен, Моррис Л.; Крэнфорд, Гарланд (2007) [1960]. «Тримерный фосфонитрилхлорид и тетрамерный фосфонитрилхлорид». Неорганические синтезы . Неорганические синтезы. Том. 6. С. 94–97. дои : 10.1002/9780470132371.ch28 . ISBN 9780470132371 .
- ^ Холлеман, А.Ф.; Виберг, Э. «Неорганическая химия» Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5 .