экзофермент

Экзофермент , , или внеклеточный фермент представляет собой фермент , который секретируется клеткой и функционирует вне этой клетки . Экзоферменты производятся как прокариотическими , так и эукариотическими клетками и, как было показано, являются важнейшим компонентом многих биологических процессов . Чаще всего эти ферменты участвуют в расщеплении более крупных макромолекул . Распад этих более крупных макромолекул имеет решающее значение для того, чтобы их составляющие могли пройти через клеточную мембрану и войти в клетку. Для человека и других сложных организмов этот процесс лучше всего характеризуется пищеварительной системой , расщепляющей твердую пищу. [ 1 ] через экзоферменты. Небольшие молекулы, образующиеся в результате активности экзоферментов, проникают в клетки и используются для различных клеточных функций. Бактерии и грибы также производят экзоферменты для переваривания питательных веществ в окружающей среде , и эти организмы можно использовать для проведения лабораторных анализов для определения присутствия и функции таких экзоферментов. [ 2 ] Некоторые патогенные виды также используют экзоферменты в качестве факторов вирулентности, способствующих распространению этих болезнетворных микроорганизмов . [ 3 ] Помимо неотъемлемой роли в биологических системах, различные классы микробных экзоферментов использовались людьми с доисторических времен для таких разнообразных целей, как производство продуктов питания , биотоплива , текстильное производство и бумажная промышленность . [ 4 ] Другая важная роль, которую играют микробные экзоферменты, заключается в естественной экологии и биоремедиации наземных . и морских организмов [ 5 ] среды.
История
[ редактировать ]Доступна очень ограниченная информация об первоначальном открытии экзоферментов. Согласно словарю Мерриама-Вебстера , термин «экзофермент» впервые появился в английском языке в 1908 году. [ 6 ] Книга Горация Вернона «Внутриклеточные ферменты: курс лекций по физиологии» считается первой публикацией, в которой использовалось это слово в том году. [ 7 ] На основании книги можно предположить, что первыми известными экзоферментами были пепсин и трипсин , поскольку оба, как упоминает Вернон, были открыты учеными Брюйке и Кюне до 1908 года. [ 8 ]
Функция
[ редактировать ]У бактерий и грибов экзоферменты играют важную роль, позволяя организмам эффективно взаимодействовать с окружающей средой. Многие бактерии используют пищеварительные ферменты для расщепления питательных веществ в окружающей среде. После переваривания эти питательные вещества поступают в бактерию, где они используются для питания клеточных путей с помощью эндоферментов . [ 9 ]
Многие экзоферменты также используются в качестве факторов вирулентности . Патогены , как бактериальные, так и грибковые, могут использовать экзоферменты в качестве основного механизма, вызывающего заболевание . [ нужна ссылка ] Метаболическая активность экзоферментов позволяет бактериям проникать в организмы- хозяева , разрушая защитные внешние слои клеток-хозяев или некротизируя тела ткани более крупных организмов. [ 3 ] Многие грамотрицательные бактерии имеют инъекциономы или жгутикоподобные отростки, позволяющие напрямую доставлять вирулентный экзофермент в клетку-хозяина с использованием системы секреции третьего типа . [ 10 ] В любом случае патогены могут атаковать структуру и функцию клетки-хозяина, а также ее нуклеиновую ДНК. [ 11 ]
В эукариотических клетках экзоферменты производятся, как и любые другие ферменты , посредством синтеза белка и транспортируются секреторным путем . Пройдя через шероховатый эндоплазматический ретикулум , они проходят через аппарат Гольджи , где упаковываются в пузырьки и высвобождаются из клетки. [ 12 ] У человека большинство таких экзоферментов обнаруживаются в пищеварительной системе и используются для метаболического расщепления макронутриентов посредством гидролиза . Расщепление этих питательных веществ позволяет включить их в другие метаболические пути . [ 13 ]
Примеры экзоферментов как факторов вирулентности
[ редактировать ]Источник: [ 3 ]

Некротические ферменты
[ редактировать ]Некротические ферменты разрушают клетки и ткани. Одним из наиболее известных примеров является экзофермент, продуцируемый Streptococcus pyogenes , который вызывает некротический фасциит у людей.
Коагулаза
[ редактировать ]Связываясь с протромбином , коагулаза способствует свертыванию крови в клетке, в конечном итоге превращая фибриноген в фибрин . Бактерии, такие как Staphylococcus aureus, используют этот фермент для формирования слоя фибрина вокруг своих клеток для защиты от защитных механизмов хозяина .

Киназы
[ редактировать ]В отличие от коагулазы, киназы могут растворять тромбы. S. aureus также может вырабатывать стафилокиназу, что позволяет им растворять образующиеся сгустки и быстро диффундировать в организм хозяина в нужное время. [ 14 ]
Гиалуронидаза
[ редактировать ]Подобно коллагеназе, гиалуронидаза позволяет возбудителю проникнуть глубоко в ткани. Такие бактерии, как Clostridium, делают это, используя фермент для растворения коллагена и гиалуроновой кислоты , белка и сахаридов соответственно, которые скрепляют ткани.
Гемолизины
[ редактировать ]Гемолизины нацелены на эритроциты, иначе говоря, эритроциты . Атака и лизис этих клеток наносит вред организму-хозяину и обеспечивает микроорганизмы, такие как гриб Candida albicans , источником железа из лизированного гемоглобина . [ 15 ] Организмы могут быть альфа-гемолитическим , бета-гемолитическим или гамма -гемолитическим (негемолитическим).
Примеры пищеварительных экзоферментов
[ редактировать ]Амилазы
[ редактировать ]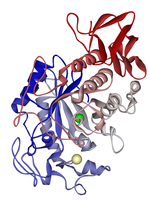
Амилазы — группа внеклеточных ферментов ( гликозидгидролаз катализирующих гидролиз крахмала ) , до мальтозы . Эти ферменты сгруппированы в три класса в зависимости от их аминокислотных последовательностей, механизма реакции, метода катализа и их структуры. [ 16 ] К различным классам амилаз относятся α-амилазы , β-амилазы и глюкоамилазы . α-амилазы гидролизуют крахмал путем случайного расщепления 1,4-ad-глюкозидных связей между звеньями глюкозы , β-амилазы расщепляют невосстанавливающие концы цепей компонентов крахмала, таких как амилоза , а глюкоамилазы гидролизуют молекулы глюкозы с концов амилозы и амилопектин . [ 17 ] Амилазы являются критически важными внеклеточными ферментами и встречаются у растений, животных и микроорганизмов . У человека амилазы секретируются поджелудочной железой и слюнными железами, причем оба источника фермента необходимы для полного гидролиза крахмала. [ 18 ]
Липопротеинлипаза
[ редактировать ]Липопротеинлипаза (ЛПЛ) — это тип пищеварительного фермента , который помогает регулировать поглощение триацилглицеринов из хиломикронов низкой плотности и других липопротеинов из жировых тканей организма. [ 19 ] Экзоферментативная функция позволяет ему расщеплять триацилглицерин на две свободные жирные кислоты и одну молекулу моноацилглицерина . ЛПЛ можно обнаружить в эндотелиальных клетках жировых тканей, таких как жировая , сердечная и мышечная . [ 19 ] Липопротеинлипаза подавляется высоким уровнем инсулина . [ 20 ] и регулируется высоким уровнем глюкагона и адреналина . [ 19 ]
Пектиназа
[ редактировать ]Пектиназы , также называемые пектолитическими ферментами , представляют собой класс экзоферментов, которые участвуют в расщеплении пектиновых веществ, особенно пектина . [ 21 ] Пектиназы можно разделить на две разные группы в зависимости от их действия против галактуроновой основы пектина: деэтерифицирующие и деполимеризующие. [ 22 ] Эти экзоферменты можно найти как в растениях, так и в микробных организмах, включая грибы и бактерии . [ 23 ] Пектиназы чаще всего используются для расщепления пектиновых элементов, содержащихся в растениях и продуктах растительного происхождения.
Пепсин
[ редактировать ]Открытый в 1836 году пепсин был одним из первых ферментов, отнесенных к экзоферментам. [ 8 ] Фермент сначала вырабатывается в неактивной форме пепсиногена главными клетками слизистой оболочки желудка . [ 24 ] По импульсу блуждающего нерва пепсиноген секретируется в желудок, где смешивается с соляной кислотой, образуя пепсин. [ 25 ] Будучи активным, пепсин расщепляет белки в таких продуктах, как молочные продукты , мясо и яйца . [ 24 ] Пепсин лучше всего действует при pH от желудочной кислоты 1,5 до 2,5 и деактивируется, когда кислота нейтрализуется до pH 7. [ 24 ]
Трипсин
[ редактировать ]также один из первых открытых экзоферментов, Трипсин, был назван в 1876 году, через сорок лет после пепсина. [ 26 ] Этот фермент отвечает за расщепление крупных глобулярных белков , и его активность специфична для расщепления С-концевых сторон аргинина и лизина аминокислотных остатков . [ 26 ] Это производное трипсиногена , неактивного предшественника, который вырабатывается в поджелудочной железе . [ 27 ] Секретируясь в тонкий кишечник , он смешивается с энтерокиназой , образуя активный трипсин. Из-за своей роли в тонком кишечнике трипсин работает при оптимальном pH 8,0. [ 28 ]
Бактериальные анализы
[ редактировать ]Выработку определенного пищеварительного экзофермента бактериальной клеткой можно оценить с помощью планшетных анализов . Бактерии распределяют по агару и оставляют инкубироваться . Выброс фермента в окрестности клетки вызывает распад макромолекулы на пластинке. Если реакция не происходит, это означает, что бактерия не создает экзофермент, способный взаимодействовать с окружающей средой. Если реакция все же происходит, становится ясно, что бактерия действительно обладает экзоферментом, и то, какая макромолекула гидролизуется, определяет ее идентичность. [ 2 ]
Амилаза
[ редактировать ]Амилаза расщепляет углеводы на моно- и дисахариды, поэтому крахмальный для этого анализа необходимо использовать агар. Как только бактерии попадают на агар, чашку заливают йодом . Поскольку йод связывается с крахмалом, но не с побочными продуктами его переваривания , на месте, где произошла амилазная реакция, появится чистая область. Bacillus subtilis — это бактерия, анализ на которую дает положительный результат, как показано на рисунке. [ 2 ]
Липаза
[ редактировать ]Анализы липазы проводятся с использованием липидного агара с красителем спиртового синего . Если у бактерий есть липаза, на агаре образуется четкая полоска, а краситель заполняет пробел, создавая темно-синий ореол вокруг очищенного участка. Staphylococcus epidermis дает положительный результат анализа на липазу. [ 2 ]
Биотехнологические и промышленные применения
[ редактировать ]Микробиологические источники экзоферментов, включая амилазы , протеазы , пектиназы, липазы , ксиланазы, целлюлазы и другие, используются для широкого спектра биотехнологических и промышленных целей, включая биотоплива производство , производство продуктов питания , производство бумаги, моющих средств и производство текстиля . [ 4 ] Оптимизация производства биотоплива находится в центре внимания исследователей в последние годы и сосредоточена на использовании микроорганизмов для преобразования биомассы в этанол . Ферментами, которые представляют особый интерес для производства этанола, являются целлобиогидролаза, которая солюбилизирует кристаллическую целлюлозу, и ксиланаза , которая гидролизует ксилан в ксилозу . [ 29 ] Одной из моделей производства биотоплива является использование смешанной популяции бактериальных штаммов или консорциума , которые способствуют расщеплению целлюлозных материалов на этанол путем секреции экзоферментов, таких как целлюлазы и лакказы. [ 29 ] Помимо важной роли, которую она играет в производстве биотоплива, ксиланаза используется в ряде других промышленных и биотехнологических приложений благодаря ее способности гидролизовать целлюлозу и гемицеллюлозу . Эти применения включают в себя переработку отходов сельского и лесного хозяйства, работу в качестве кормовой добавки, способствующей лучшему усвоению питательных веществ скотом, а также в качестве ингредиента при выпечке хлеба, улучшающего его рост и текстуру. [ 30 ]

Липазы являются одними из наиболее часто используемых экзоферментов в биотехнологии и промышленности . поскольку они обладают высокой избирательностью в своей активности, легко продуцируются и секретируются бактериями Липазы являются идеальными ферментами для этих целей , и грибами , их кристаллическая структура активности не требуются кофакторы хорошо охарактеризована, для их ферментативной и они не катализируют побочные реакции. реакции. [ 31 ] Область применения липаз включает производство биополимеров, производство косметических средств, использование в качестве гербицида и эффективного растворителя. [ 31 ] Однако, пожалуй, наиболее известным применением липазы в этой области является ее использование в производстве биодизельного топлива. В этой роли липазы используются для превращения растительного масла в метил- и другие короткоцепочечные спиртов эфиры посредством единой реакции переэтерификации . [ 32 ]
Целлюлазы , гемицеллюлазы и пектиназы представляют собой различные экзоферменты, которые используются в самых разных биотехнологических и промышленных приложениях. В пищевой промышленности эти экзоферменты используются при производстве фруктовых соков , фруктовых нектаров, фруктовых пюре, а также при экстракции оливкового масла и многих других. [ 33 ] Роль этих ферментов в пищевых продуктах заключается в частичном разрушении стенок растительных клеток и пектина . Помимо той роли, которую они играют в производстве продуктов питания , целлюлазы используются в текстильной промышленности для удаления излишков красителя с джинсовой ткани , смягчения хлопчатобумажных тканей и восстановления яркости цвета хлопчатобумажных тканей. [ 33 ] Целлюлазы и гемицеллюлазы (включая ксиланазы) также используются в бумажной и целлюлозной промышленности для удаления чернил с переработанных волокон , модификации грубой механической целлюлозы, а также для частичного или полного гидролиза волокон целлюлозы. [ 33 ] Целлюлазы и гемицеллюлазы используются в этих промышленных целях из-за их способности гидролизовать компоненты целлюлозы и гемицеллюлозы, содержащиеся в этих материалах.
Приложения для биоремедиации
[ редактировать ]
Биоремедиация — это процесс, при котором загрязнители или загрязняющие вещества из окружающей среды удаляются с помощью биологических организмов или их продуктов. Удаление этих часто опасных загрязняющих веществ в основном осуществляется с помощью встречающихся в природе или намеренно занесенных микроорганизмов , которые способны расщеплять или поглощать желаемые загрязняющие вещества. Типами загрязнителей, которые часто являются объектами стратегий биовосстановления, являются нефтепродукты (включая нефть и растворители ) и пестициды . [ 34 ] Помимо способности микроорганизмов переваривать и поглощать загрязняющие вещества, секретируемые ими экзоферменты играют важную роль во многих стратегиях биоремедиации. [ 35 ]
Было показано, что грибы являются жизнеспособными организмами для проведения биоремедиации и используются для обеззараживания ряда загрязняющих веществ, включая полициклические ароматические углеводороды (ПАУ), пестициды , синтетические красители , хлорфенолы , взрывчатые вещества , сырую нефть и многие другие. [ 36 ] Хотя грибы могут разрушать многие из этих загрязнителей внутриклеточно , они также выделяют многочисленные окислительные экзоферменты, которые действуют внеклеточно . Одним из важнейших аспектов грибов с точки зрения биоремедиации является то, что они выделяют эти окислительные экзоферменты из постоянно удлиняющихся кончиков гиф . [ 36 ] Лакказы являются важным окислительным ферментом, который выделяют грибы и используют кислород для окисления многих загрязняющих веществ. Некоторые из загрязняющих веществ, для очистки которых используются лакказы, включают содержащие сточные воды текстильной промышленности, загрязнители сточных вод (хлорфенолы, ПАУ и т. д.) и переработки угля серосодержащие соединения от красители . [ 36 ]
Бактерии также являются жизнеспособным источником экзоферментов, способных способствовать биоремедиации окружающей среды. Существует множество примеров использования бактерий для этой цели, и их экзоферменты охватывают множество различных классов бактериальных ферментов. Особый интерес в этой области представляют бактериальные гидролазы , поскольку они обладают специфичностью низкой субстратной и могут использоваться для борьбы с многочисленными загрязнителями, включая твердые отходы. [ 37 ] Пластиковые отходы, включая полиуретаны, особенно трудно разлагаются, но у грамотрицательной бактерии Comamonas acidovorans был обнаружен экзофермент , способный разлагать полиуретановые отходы в окружающей среде. [ 37 ] Бесклеточное использование микробных экзоферментов в качестве агентов биоремедиации также возможно, хотя их активность часто не столь надежна, и введение ферментов в определенные среды, такие как почва, является сложной задачей. [ 37 ] Помимо наземных микроорганизмов, морские бактерии и их экзоферменты демонстрируют потенциал в качестве кандидатов в области биоремедиации. Морские бактерии использовались, среди прочего, для удаления тяжелых металлов , разложения нефти и дизельного топлива , а также для удаления полиароматических углеводородов. [ 38 ]
Ссылки
[ редактировать ]- ^ Конг Ф., Сингх Р.П. (июнь 2008 г.). «Распад твердой пищи в желудке человека» . Журнал пищевой науки . 73 (5): Р67–80. дои : 10.1111/j.1750-3841.2008.00766.x . ПМИД 18577009 .
- ^ Jump up to: а б с д Робертс, К. «Экзоферменты» . Общественный колледж принца Джорджа. Архивировано из оригинала 13 июня 2013 года . Проверено 8 декабря 2013 г.
- ^ Jump up to: а б с Дубен-Энгелькирк, Пол Г. Энгелькирк, Джанет (2010). Микробиология Бертона для наук о здоровье (9-е изд.). Филадельфия: Wolters Kluwer Health/Lippincott Williams & Wilkins. стр. 173–174. ISBN 9781605476735 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Тиль, изд. Йоахим Райтнер, Волкер. Энциклопедия геобиологии . Дордрехт: Спрингер. стр. 355–359. ISBN 9781402092121 .
{{cite book}}:|first=имеет общее имя ( справка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Арности С (15 января 2011 г.). «Микробные внеклеточные ферменты и морской углеродный цикл». Ежегодный обзор морской науки . 3 (1): 401–25. Бибкод : 2011ARMS....3..401A . doi : 10.1146/annurev-marine-120709-142731 . ПМИД 21329211 .
- ^ «Мерриам-Вебстер» . Проверено 26 октября 2013 г.
- ^ «Лексик.us» . Проверено 26 октября 2013 г.
- ^ Jump up to: а б Вернон, Гораций. «Внутриклеточные ферменты: Курс лекций по физиологии» . Проверено 26 октября 2013 г.
- ^ Кайзер, Гэри. «Лаборатория 8: Идентификация бактерий посредством биохимического тестирования» . Лабораторное руководство Биол 230 . Архивировано из оригинала 11 декабря 2013 года . Проверено 9 декабря 2013 г.
- ^ Эрхардт М., Намба К., Хьюз К.Т. (ноябрь 2010 г.). «Бактериальные наномашины: жгутик и инъекционная сома III типа» . Перспективы Колд-Спринг-Харбор в биологии . 2 (11): а000299. doi : 10.1101/cshperspect.a000299 . ПМК 2964186 . ПМИД 20926516 .
- ^ Макгаффи Э.М., Фрайлик Дж.Э., Хазен-Мартин DJ, Винсент Т.С., Олсон Дж.К. (июль 1999 г.). «Дифференциальная чувствительность эпителиальных клеток человека к экзоферменту S Pseudomonas aeruginosa» . Инфекция и иммунитет . 67 (7): 3494–503. дои : 10.1128/IAI.67.7.3494-3503.1999 . ПМК 116536 . ПМИД 10377131 .
- ^ Лодиш, Харви (2008). Молекулярно-клеточная биология (6-е изд., [2-е изд.]. Изд.). Нью-Йорк [ua]: Фриман. ISBN 978-0716776017 .
- ^ Эндрюс, Лари. «Дополнительные ферменты для пищеварения» . Исследования в области здравоохранения и исцеления . Архивировано из оригинала 27 июля 2013 года . Проверено 9 декабря 2013 г.
- ^ Тодар, Кеннет. «Механизмы бактериальной патогенности» . Интернет-учебник по бактериологии Тодара . Кеннет Тодар, доктор философии . Проверено 12 декабря 2013 г.
- ^ Фаверо Д., Фурлането-Майя Л., Франса Э.Дж., Гоэс Х.П., Фурлането MC (февраль 2014 г.). «Продуцирование гемолитического фактора клиническими изолятами видов Candida». Современная микробиология . 68 (2): 161–6. дои : 10.1007/s00284-013-0459-6 . ПМИД 24048697 . S2CID 253807898 .
- ^ Шарма А., Сатьянараяна Т. (2013). «Микробные кислотостабильные альфа-амилазы: характеристики, генная инженерия и применение». Технологическая биохимия . 48 (2): 201–211. дои : 10.1016/j.procbio.2012.12.018 .
- ^ Пандей А., Нигам П., Соккол Ч.Р., Соккол В.Т., Сингх Д., Мохан Р. (2000). «Достижения в области микробных амилаз». Биотехнология. Прил. Биохим . 31 (2): 135–52. дои : 10.1042/ba19990073 . ПМИД 10744959 .
- ^ Пандол, Стивен (2010). «Экзокринная поджелудочная железа» . Серия коллоквиумов по физиологии интегрированных систем: от молекулы к функции . 3 (2). Морган и Клейпул Науки о жизни: 1–64. дои : 10.4199/C00026ED1V01Y201102ISP014 . ПМИД 21634067 . Проверено 25 ноября 2013 г.
- ^ Jump up to: а б с Мид-младший, Ирвин С.А., Рамджи Д.П. (декабрь 2002 г.). «Липопротеинлипаза: структура, функции, регуляция и роль в заболеваниях». Журнал молекулярной медицины . 80 (12): 753–69. дои : 10.1007/s00109-002-0384-9 . ПМИД 12483461 . S2CID 40089672 .
- ^ Киенс Б., Лителл Х., Микинес К.Дж., Рихтер Э.А. (октябрь 1989 г.). «Влияние инсулина и физических упражнений на активность мышечной липопротеинлипазы у человека и ее связь с действием инсулина» . Журнал клинических исследований . 84 (4): 1124–9. дои : 10.1172/JCI114275 . ПМК 329768 . ПМИД 2677048 .
- ^ Джаяни, Ранвир Сингх; Саксена, Шивалика; Гупта, Рина (1 сентября 2005 г.). «Микробные пектинолитические ферменты: обзор». Технологическая биохимия . 40 (9): 2931–2944. дои : 10.1016/j.procbio.2005.03.026 .
- ^ Алимардани-Тёй, Парисса; Генвор-Клэсс, Анжелика; Дюширон, Фрэнсис (1 августа 2011 г.). «Дрожжи: привлекательный источник пектиназ - от экспрессии генов до потенциального применения: обзор». Технологическая биохимия . 46 (8): 1525–1537. дои : 10.1016/j.procbio.2011.05.010 .
- ^ Гуммади, Сатьянараяна Н.; Панда, Т. (1 февраля 2003 г.). «Очистка и биохимические свойства микробных пектиназ - обзор». Технологическая биохимия . 38 (7): 987–996. дои : 10.1016/S0032-9592(02)00203-0 .
- ^ Jump up to: а б с «Британская энциклопедия» . Проверено 14 ноября 2013 г.
- ^ Гульдвог I, Берстад А (1981). «Физиологическая стимуляция секреции пепсина. Роль иннервации блуждающего нерва». Скандинавский журнал гастроэнтерологии . 16 (1): 17–25. ПМИД 6785873 .
- ^ Jump up to: а б Уортингтон, Кристал. «Трипсин» . Уортингтонская биохимическая корпорация . Проверено 26 ноября 2013 г.
- ^ «Трипсин» . Бесплатный словарь . Проверено 26 ноября 2013 г.
- ^ «Информация о продукте трипсина» . Уортингтонская биохимическая корпорация . Проверено 26 ноября 2013 г.
- ^ Jump up to: а б Альпер Х., Стефанопулос Г. (октябрь 2009 г.). «Разработка биотоплива: использование врожденной микробной способности или импорт биосинтетического потенциала?». Обзоры природы. Микробиология . 7 (10): 715–23. дои : 10.1038/nrmicro2186 . ПМИД 19756010 . S2CID 7785046 .
- ^ Джутуру В., Ву Дж.К. (1 ноября 2012 г.). «Микробные ксиланазы: техника, производство и промышленное применение». Достижения биотехнологии . 30 (6): 1219–27. doi : 10.1016/j.biotechadv.2011.11.006 . ПМИД 22138412 .
- ^ Jump up to: а б Йегер, Карл-Эрих; Торстен Эггерт (2002). «Липазы для биотехнологии». Современное мнение в области биотехнологии . 13 (4): 390–397. дои : 10.1016/s0958-1669(02)00341-5 . ПМИД 12323363 .
- ^ Фан X, Нихус X, Сандовал Г (2012). «Липазы как биокатализатор производства биодизеля». Липазы и фосфолипазы . Методы молекулярной биологии. Том. 861. стр. 471–83. дои : 10.1007/978-1-61779-600-5_27 . ISBN 978-1-61779-599-2 . ПМИД 22426735 .
- ^ Jump up to: а б с Бхат, МК (2000). «Целлюлазы и родственные ферменты в биотехнологии». Достижения биотехнологии . 18 (5): 355–383. CiteSeerX 10.1.1.461.2075 . дои : 10.1016/s0734-9750(00)00041-0 . ПМИД 14538100 .
- ^ «Руководство для граждан по биоремедиации» . Агентство по охране окружающей среды США. Сентябрь 2012 года . Проверено 5 декабря 2013 г.
- ^ Каригар К.С., Рао СС (2011). «Роль микробных ферментов в биоремедиации загрязнителей: обзор» . Ферментные исследования . 2011 : 1–11. дои : 10.4061/2011/805187 . ПМК 3168789 . ПМИД 21912739 .
- ^ Jump up to: а б с Хармс Х., Шлоссер Д., Вик Л.Я. (март 2011 г.). «Неиспользованный потенциал: использование грибов в биоремедиации опасных химикатов». Обзоры природы. Микробиология . 9 (3): 177–92. дои : 10.1038/nrmicro2519 . ПМИД 21297669 . S2CID 24676340 .
- ^ Jump up to: а б с Джанфреда, Лилиана; Рао, Мария А. (сентябрь 2004 г.). «Потенциал внеклеточных ферментов в реабилитации загрязненных почв: обзор». Ферментные и микробные технологии . 35 (4): 339–354. doi : 10.1016/j.enzmictec.2004.05.006 .
- ^ Дэш ХР, Мангвани Н., Чакраборти Дж., Кумари С., Дас С. (январь 2013 г.). «Морские бактерии: потенциальные кандидаты для усиленной биоремедиации». Прикладная микробиология и биотехнология . 97 (2): 561–71. дои : 10.1007/s00253-012-4584-0 . ПМИД 23212672 . S2CID 253773148 .

