Полный синтез таксола Вендера

Полный синтез таксола Вендера в органической химии описывает полный синтез таксола (один из шести на сегодняшний день), проведенный группой Пола Вендера из Стэнфордского университета, опубликованный в 1997 году. [1] [2] Этот синтез имеет много общего с полным синтезом таксола Холтона в том, что это линейный синтез, начинающийся с встречающегося в природе соединения с кольцевой структурой в порядке A, B, C, D. Усилие Вендера короче примерно на 10 шагов.
Сырьем для получения таксола этим путем являются вербенон , пренилбромид , аллилбромид , пропиоловая кислота , реактив Гилмана и соль Эшенмозера .
Синтез кольца AB
[ редактировать ]Синтез таксола начался с терпена вербенона 1 на схеме 1 , который является продуктом окисления встречающегося в природе α-пинена и образует кольцо A. Конструирование кольца B началось с отрыва протона подвесной метильной группы калия трет- бутоксидом (сопряженный анион образуется) с последующим нуклеофильным замещением атома брома в пренилбромиде с 2 образованием диена 3 . Озонолиз пренильной группы (более богатой электронами, чем внутренняя двойная связь) образовал альдегид 4 , который после изомеризации или фотоперегруппировки в хризантенон 5 вступал в реакцию с литиевой солью (через ЛДА ) этилового эфира пропиоловой кислоты 6 в нуклеофильное присоединение к спирту 7 . Это соединение не было выделено, а in situ триметилсилилхлоридом улавливалось в силиловый эфир 9 . На следующем этапе реагент Гилмана 8 является метилирующим реагентом при присоединении нуклеофильного конъюгата через алкиновую группу к кетоновой группе, в результате чего образуется спирт 10 . силилового эфира Защитную группу удаляли реакцией с уксусную кислоту до спирта 11 , который затем окисляли до кетона 12 с помощью RuCl 2 (PPh 3 ) 3 и NMO в качестве жертвенного катализатора . Ацилоиновая общий группа в 13 была введена KHMDS и оксазиридином Дэвиса (см. синтез Холтона Таксола для другого использования этой системы), а ее гидроксильная группа вместе со сложноэфирной группой была восстановлена литийалюминийгидридом до тетрола 14 . Наконец, первичную спиртовую группу защищали в виде трет -бутилдиметилсилилового эфира соответствующими силилхлоридом и имидазолом в триоле 15 .
 |
| Схема 1 |
|---|
Во второй части ( схема 2 ) процедуры по-прежнему ограничиваются кольцами А и В. К триолу 15 было добавлено больше защитных групп , поскольку реакция с ПФТС и 2-метоксипропеном дает ацетонид 16 . В этот момент двойная связь в кольце A была эпоксидирована с помощью m -CPBA и карбоната натрия до эпоксида 17 , а фрагментация Гроба (также присутствующая в работе Холтона), инициированная DABCO, открыла кольцевую систему AB в спирте 18 , которая не была изолирована. TIPS защищен как силиловый эфир 19 триизопропилсилилтрифлатом и но 2,6-лутидином . Положение C1 затем окислялось фосфитным эфиром P(OEt) 3 и сильным основанием KO t -Bu и кислородом до спирта 20 (стереохимия контролируется чашеобразным кольцом AB с гидроксилированием из беспрепятственного выпуклого направления), первичное Спиртовую группу снимали с помощью хлорида аммония в метаноле до диола 21 и два восстановления сначала с помощью NaBH 4 до триола 22 , а затем газообразного водорода и катализатора Крэбтри давали триол 23 . Эти позиции были защищены триметилсилилхлоридом. и пиридин до 24 , а затем трифосген до 25, чтобы облегчить окисление первичной спиртовой группы до альдегида 26 с помощью PCC .
 |
| Схема 2 |
|---|
Синтез C-кольца
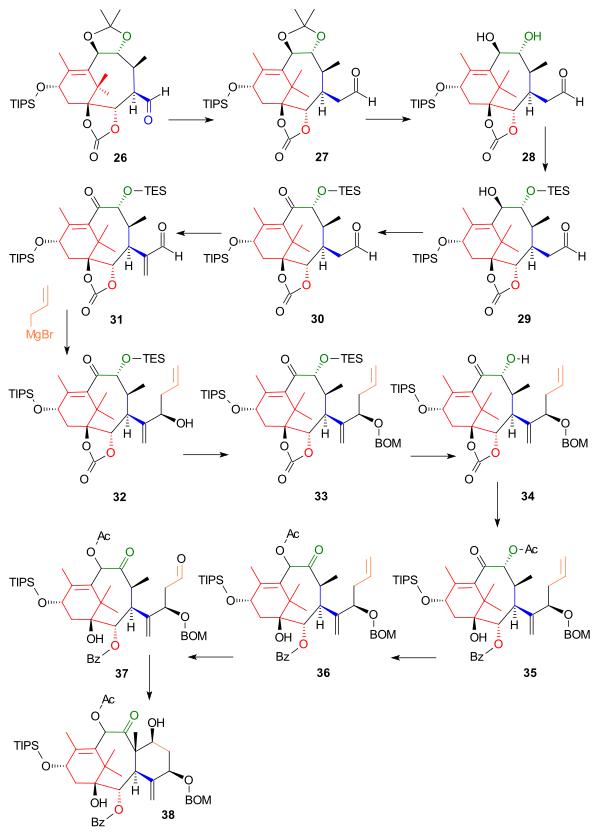
[ редактировать ]Следующая часть построила кольцо C, исходя из альдегида 26 , который был удлинен на один атом углерода до гомолога 27 в реакции Виттига с метоксиметилентрифенилфосфином ( схема 3 ). Ацетонидную группу удаляли разбавленной соляной кислотой и йодидом натрия в диоксане , а одну гидроксильную группу в полученном диоле 28 защищали в виде триэтилсилилового эфира (TES) 29 с помощью соответствующего силилхлорида и пиридина, что позволяло окислить оставшуюся гидроксильную группу до кетона. 30 с периодом Десс-Мартена . Реакция с солью Эшенмозера поместила метиленовую группу (C20 в каркасе таксола) в альфа-положение альдегида до 31 , а следующая реакция ввела (все еще отсутствующие) C6 и C7 в качестве реактива Гриньяра в аллилбромида нуклеофильном присоединении с помощью хлорид цинка(II) , который блокировал атаку Гриньяра на карбонатную группу, в спирт 32 . Вновь образовавшийся спирт защищали как эфир BOM 33 с помощью BOMCl и N,N-диизопропилэтиламина . После удаления защитной группы TES с фторид аммония , карбонатная группа в 34 превращалась в гидроксибензоатную группу под действием фениллития , а вторичный спирт в ацетат 35 посредством in situ реакции с уксусным ангидридом и ДМАП . На следующем этапе ацилоиновая группа меняла свои положения в результате реакции с триазабициклодеценом (другие аминные основания терпят неудачу), образуя 36 , а на заключительных стадиях замыкание кольца C осуществлялось озонолизом по аллильной группе до 37 и альдольной реакцией с 4-пирролидинопиридином. до 38 .
 |
| Схема 3 |
|---|
Синтез D-кольца
[ редактировать ]Заключительная часть посвящена построению оксетанового кольца D, начиная с защиты спиртовой группы в 38 ( Схема 4 ). в виде TROC спирта 39 с 2,2,2-трихлорэтилхлорформиатом и пиридином . Группа OBOM была заменена группой брома в три стадии: снятие защиты до 40 с помощью соляной кислоты и йодида натрия , мезилирование до 41 с помощью мезилхлорида , DMAP и пиридина и нуклеофильное замещение с инверсией конфигурации с бромидом лития в бромид 42 . Поскольку окисление алкеновой группы до диола 43 четырехокисью осмия сопровождалось нежелательной миграцией бензоатной стадию завершили имидазолом 44 группы, эту . Потребовались две дополнительные контрмеры: повторная защита диола в виде карбонатного эфира 45 с помощью трифосгена и удаление бензоатной группы (KCN) до спирта 46 для подготовки фактического замыкания кольца до оксетана 47 с помощью N,N-диизопропилэтиламина . На заключительных этапах третичный спирт был ацилирован в 48 , группа TIPS удалена в 49 и бензоатная группа вновь введена в 50 .
Добавление хвоста лактама Оджима 51 подробно не раскрыто, но в конечном итоге таксол 52 был образован в несколько стадий, аналогичных другим попыткам.
 |
| Схема 4 |
|---|
Внешние ссылки
[ редактировать ]- Синтез таксола Вендера @ SynArchive.com
- Кружка Wender Taxol: Ссылка
См. также
[ редактировать ]- Общий синтез паклитаксела
- Полный синтез таксола Данишефского
- Общий синтез Холтона Таксола
- Полный синтез таксола Куваджима
- Полный синтез таксола Мукаямы
- Николау Таксол полный синтез
Ссылки
[ редактировать ]- ^ Пиненовый путь к таксанам. 5. Стереоконтролируемый синтез универсального предшественника таксана Пол А. Вендер и др. Дж. Ам. хим. Соц. ; 1997 год ; 119(11) стр. 2755 - 2756; (Коммуникация) дои : 10.1021/ja9635387
- ^ Пиненовый путь к таксанам. 6. Краткий стереоконтролируемый синтез таксола Вендер, Пенсильвания и др. Дж. Ам. хим. Соц. ; (Коммуникация); 1997 год ; 119(11); 2757-2758. дои : 10.1021/ja963539z