Синтаза аминолевулиновой кислоты
| 5-аминолевулинатсинтаза | |||
|---|---|---|---|
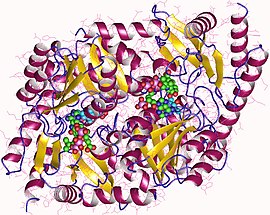 Димер синтазы аминолевулиновой кислоты, Rhodobacter capsulatus | |||
| Идентификаторы | |||
| Номер ЕС. | 2.3.1.37 | ||
| Номер CAS. | 9037-14-3 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
Синтаза аминолевулиновой кислоты ( ALA-синтаза , ALAS или синтаза дельта-аминолевулиновой кислоты ) представляет собой фермент ( EC 2.3.1.37 ), который катализирует синтез δ-аминолевулиновой кислоты (АЛК), первого общего предшественника в биосинтезе всех тетрапирролов, таких как гемы. , кобаламины и хлорофиллы. [ 1 ] Реакция следующая:
- сукцинил-КоА + глицин δ-аминолевулиновая кислота + КоА + СО 2
Этот фермент экспрессируется у всех нерастительных эукариот и у протеобактерий α-класса, а реакцию, которую он катализирует, иногда называют путем Шемина для образования АЛК. [ 2 ] Другие организмы производят АЛК через три ферментных пути, известных как путь C5. АЛК синтезируется путем конденсации глицина и сукцинил-КоА . У человека транскрипция ALA-синтазы жестко контролируется присутствием Fe. 2+ -связывающие элементы, чтобы предотвратить накопление промежуточных порфиринов в отсутствие железа. В организме существуют две формы синтазы ALA. Одна форма экспрессируется в клетках-предшественниках эритроцитов ( ALAS2 ), тогда как другая ( ALAS1 ) экспрессируется повсеместно по всему организму. Форма эритроцитов кодируется геном на хромосоме X, тогда как другая форма кодируется геном на хромосоме 3.
Заболевание Х-сцепленная сидеробластная анемия вызвано мутациями гена АЛК-синтазы на Х-хромосоме, тогда как не известно ни одного заболевания, вызванного мутациями в другом гене. Недавно было показано, что мутации с усилением функции в гене эритроид-специфической АЛК-синтазы вызывают ранее неизвестную форму порфирии, известную как Х-сцепленная доминантная протопорфирия.
Структура и свойства фермента
[ редактировать ]PLP-зависимые ферменты широко распространены, поскольку они необходимы для преобразования аминокислот в другие ресурсы. [ 1 ] ALAS представляет собой гомодимер с субъединицами одинакового размера, а активные центры, состоящие из боковых цепей аминокислот, таких как аргинин, треонин и лизин, находятся на границе раздела субъединиц. [ 1 ] Белок, извлеченный из сфероидов R., содержит 1600 крат и весит около 80 000 дальтон. [ 3 ] Ферментативная активность варьируется для разных источников фермента. [ 3 ]
Механизм реакции
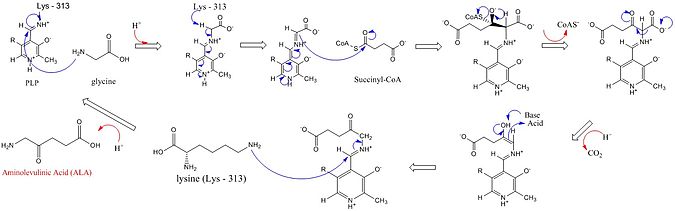
[ редактировать ]Активные центры ALAS используют три ключевые боковые цепи аминокислот: Arg-85, Thr-430 и Lys-313. Хотя было идентифицировано, что эти три аминокислоты позволяют протекать этой реакции, они были бы неактивны без добавления кофактора пиридоксаль-5'-фосфата (PLP), роль которого в этом синтезе подробно показана на изображении ниже. Прежде чем реакция может начаться, кофактор PLP связывается с боковой цепью лизина, образуя основание Шиффа, которое способствует атаке глицинового субстрата. [ 4 ] [ 5 ] [ 6 ] [ 7 ] Лизин действует как основная основа в этом механизме. [ 1 ] [ 8 ] В детальном механизме реакции добавляемые атомы гидроксония происходят из различных остатков, которые образуют водородные связи, облегчающие синтез АЛК. [ 1 ] АЛК-синтаза удаляет карбоксильную группу глицина и КоА из сукцинил-КоА посредством его простетической группы пиридоксальфосфата (производного витамина В6), образуя δ-аминолевулиновую кислоту (dALA), названную так потому, что аминогруппа находится на четвертом месте. атом углерода в молекуле. Этот механизм реакции особенно уникален по сравнению с другими ферментами, которые используют кофактор PLP, поскольку глицин первоначально депротонируется высококонсервативным лизином активного центра, что приводит к конденсации с сукцинил-КоА и потере КоА. Протонирование карбонильной группы интермедиата гистидином активного центра приводит к потере карбоксильной группы. Последний промежуточный продукт наконец репротонируется с образованием АЛК. Диссоциация АЛК от фермента является стадией, лимитирующей скорость ферментативной реакции, и было показано, что она зависит от медленного конформационного изменения фермента. Функция пиридоксальфосфата заключается в облегчении удаления водорода за счет использования электрофильного пиридиниевого кольца в качестве стока электронов.
Расположение этого фермента в биологических системах указывает на обратную связь, которую он может получать. АЛК-синтаза обнаружена в бактериях, дрожжах, печени птиц и млекопитающих, клетках крови и костном мозге. В клетках животных этот фермент находится в митохондриях. [ 3 ] Поскольку фермент, по-видимому, расположен вблизи источника сукцинил-КоА, а конец пути гема указывает на то, что начальная и конечная точки биосинтеза гема служат обратной связью для АЛК-синтазы. [ 3 ] Синтаза АЛК также ингибируется гемином и глюкозой . [ 9 ]

Биологическая функция
[ редактировать ]ALAS1 и ALAS2 катализируют первый этап процесса синтеза гема. Это первый необратимый шаг, который также ограничивает скорость. Это означает, что начало образования гемов является очень преднамеренным и зависит от множества областей обратной связи. Например, два субстрата, оксалоацетат и глицин, в высокой степени продуцируются и используются в других важных биологических процессах, таких как гликолиз и цикл ТСА. Изображение ниже иллюстрирует путь синтеза гема и роль, которую играет ALAS.

Актуальность заболевания
[ редактировать ]Дефицит синтазы аминолевулиновой кислоты приводит к отсутствию способности создавать гем, поскольку его задача — катализировать первый этап этого процесса. Эти недостатки часто являются результатом генетической мутации, которая может привести к различным заболеваниям. Одним из таких заболеваний является Х-сцепленная сидеробластная анемия, приводящая к появлению эритроцитов в костном мозге. [ 10 ] Это заболевание связано конкретно с мутациями в генах, кодирующих ALAS2. [ 10 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Хантер, Грегори А.; Феррейра, Глория К. (ноябрь 2011 г.). «Молекулярная энзимология 5-аминолевулинатсинтазы, контролера биосинтеза гема» . Biochimica et Biophysical Acta (BBA) - Белки и протеомика 1814 (11): 1467–1 дои : 10.1016/j.bbapap.2010.12.015 . ПМК 3090494 . ПМИД 21215825 .
- ^ Шемин, Дэвид; Риттенберг, Д. (18 июня 1945 г.). «Использование глицина для синтеза порфирина». Журнал биологической химии . 159 : 567–568.
- ^ Jump up to: а б с д Бил, С.И. (июнь 1978 г.). «δ-аминолевулиновая кислота в растениях: ее биосинтез, регуляция и роль в развитии пластид». Ежегодный обзор физиологии растений . 29 (1): 95–120. дои : 10.1146/annurev.pp.29.060178.000523 .
- ^ «АЛК-синтаза» . флиппер и нувола . Туринский университет . Проверено 10 марта 2016 г.
- ^ Шулинг-Джордан, Питер М.; Аль-Дайхан, Юг; Алексеев Дмитрий; Бакстер, Роберт Л.; Боттомли, Сильвия С.; Кахари, И.Дональд; Рой, Ипсита ; Сарвар, Мухаммед; Сойер, Линдси; Ван, Шу-Фен (апрель 2003 г.). «Синтаза 5-аминолевулиновой кислоты: механизм, мутации и медицина». Биохим Биофиз Акта . 1647 (1–2): 361–6. дои : 10.1016/s1570-9639(03) 00095-5 ПМИД 12686158 .
- ^ Цой, Х (июль 2004 г.). «Клонирование, экспрессия и характеристика синтазы 5-аминолевулиновой кислоты из Rhodopseudomonas palustris KUGB306» . Письма FEMS по микробиологии . 236 (2): 175–181. дои : 10.1016/j.femsle.2004.05.048 . ПМИД 15251194 .
- ^ Феррейра, Глория К.; Ним, Питер Дж.; Дэйли, Гарри А. (ноябрь 1993 г.). «Биосинтез гема в системах млекопитающих: свидетельства связи Шиффового основания между пиридоксаль-5'-фосфатным кофактором и остатком лизина в 5-аминолевулинатсинтазе» . Белковая наука . 2 (11): 1959–1965. дои : 10.1002/pro.5560021117 . ПМК 2142290 . PMID 8268805 .
- ^ Хантер, Грегори А.; Феррейра, Глория К. (март 1999 г.). «Лизин-313 5-аминолевулинатсинтазы действует как общее основание при образовании промежуточных продуктов хиноноидной реакции». Биохимия . 38 (12): 3711–3718. дои : 10.1021/bi982390w . ПМИД 10090759 .
- ^ Досс М., Сиксель-Дитрих Ф., Версполь Ф. (1985). « Эффект глюкозы» и функция ограничения скорости уропорфириногенсинтазы на метаболизм порфиринов в культуре гепатоцитов: взаимосвязь с острыми печеночными порфириями у человека» (PDF) . J Clin Chem Clin Biochem . 23 (9): 505–13. дои : 10.1515/cclm.1985.23.9.505 . ПМИД 4067519 .
- ^ Jump up to: а б Аджиока, Ричард С.; Филлипс, Джон Д.; Кушнер, Джеймс П. (июль 2006 г.). «Биосинтез гема у млекопитающих» . Биохимия и биофизика Acta (BBA) - Исследования молекулярных клеток . 1763 (7): 723–736. дои : 10.1016/j.bbamcr.2006.05.005 . ПМИД 16839620 .
Внешние ссылки
[ редактировать ]- NIH
- Абу-Фарха М., Найлз Дж., Уиллмор В. (2005). «Эритроид-специфический белок 5-аминолевулинатсинтазы стабилизируется за счет низкого содержания кислорода и протеасомного ингибирования». Биохимия Клеточная Биол . 83 (5): 620–30. дои : 10.1139/o05-045 . ПМИД 16234850 .
- Шемин, Д; Риттенберг, Д. (1945). «Использование глицина для синтеза порфирина». Ж. Биол. Хим . 159 : 567–8.
- СИДЕРОБЛАСТИЧЕСКИЕ АНЕМИИ - дефектная болезнь ALAS-2