NADPH -оксидаза
| NAD (P) Hксидаза | |||
|---|---|---|---|
| Идентификаторы | |||
| ЕС №. | 1.6.3.1 | ||
| CAS №. | 77106-92-4 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| |||
| RERIR REDUCTASE | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | NADPH -оксидаза | ||
| Pfam | PF01794 | ||
| InterPro | IPR013130 | ||
| TCDB | 5.b.1 | ||
| OPM Суперсемейство | 464 | ||
| OPM белок | 5 Текст05 | ||
| |||
NADPH- оксидаза (никотинамид аденин-динуклеотидфосфатсидаза) представляет собой мембрановый ферментный комплекс, который обращается к внеклеточному пространству. Его можно найти в плазматической мембране, а также в мембранах фагосом, используемых нейтрофильными лейкоцитами для охвата микроорганизмов. Человеческие изоформы каталитического компонента комплекса включают NOX1 , NOX2 , NOX3 , NOX4 , NOX5 , DUOX1 и DUOX2 . [ 1 ]
Реакция
[ редактировать ]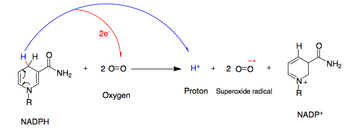
NADPH -оксидаза катализирует продукцию супероксидного свободного радикала, перенося один электрон в кислород из NADPH . [ 2 ]
- Nadph + 2o 2 ↔ nadp + + 2o - 2 + h +
Типы
[ редактировать ]У млекопитающих NADPH -оксидаза обнаружена в двух типах: один в лейкоцитах (нейтрофильные), а другой в сосудистых клетках, различающийся в биохимической структуре и функциях. [ 3 ] Нейтрофильная NADPH -оксидаза продуцирует супероксид практически мгновенно, тогда как сосудистый фермент продуцирует супероксид в минуты до часа. [ 4 ] Более того, в лейкоцитах, супероксид, было обнаружено, переносит электроны через мембрану в внеклеточный кислород, в то время как в сосудистых клетках радикальный анион, по -видимому, высвобождается в основном внутриклеточно. [ 5 ] [ 6 ]
Нейтрофильный тип
[ редактировать ]Изоформа, обнаруженная в нейтрофилах, состоит из шести субъединиц. Эти субъединицы:
- Rho GTPase , обычно Rac1 или Rac2 (RAC означает связанный с Rho C3 Botulinum Toxin Substrate)
- Пять субъединиц фагоцитарной оксидазы:
- GP91 поток ( NOX2 )
- P22 поток ( Cyba )
- P40 поток ( NCF4 )
- P47 поток ( NCF1 )
- P67 поток ( NCF2 )
Сосудистый тип
[ редактировать ]Существует несколько сосудистых изоформ комплекса, которые используют паралогию субъединицы NOX2:
Тип щитовидной железы
[ редактировать ]Есть еще два паралога субъединицы NOX2 в щитовидной железе:
Структура
[ редактировать ]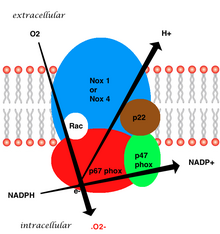
Вся структура мембранного сосудистого фермента состоит из пяти частей: двух цитозольных субъединиц (p47phox и p67phox), цитохрома B558, который состоит из GP91PHOX, P22phox и небольшого G-белка. [ 3 ] Генерация супероксида в сосудистых NADPH происходит путем одноэлектронного восстановления кислорода через субъединицу GP91PHOX, используя снижение NADPH в качестве донора электронов. Небольшой G-белок несет важную роль в активации оксидазы путем переключения между GDP-связанными (неактивными) и GTP-связанными (активными) формами. [ 8 ]
Биологическая функция
[ редактировать ]NADPH оксидазы (NOXES) являются одним из основных источников клеточных реактивных форм кислорода (ROS) , и они по -прежнему находятся в центре обширного исследовательского интереса из -за их исключительной функции при продуцировании АФК в нормальных физиологических условиях. Комплекс NADPH -оксидазы в состоянии покоя при нормальных обстоятельствах, но активируется для сборки в мембранах во время дыхательного взрыва . Активированная NADPH -оксидаза генерирует супероксид, который играет роли в иммунном ответе животных и передаче сигналов растений. [ 9 ]
Супероксид может быть получен в фагосомах , которые проглатывали бактерии и грибы , или его можно продуцировать за пределами клетки. [ 10 ] В макрофагах супероксид убивает бактерии и грибы по механизмам, которые еще не до конца понятны. [ 11 ] [ 12 ] Супероксид спонтанно насмевает, образуя перекись, которая затем протонируется для получения перекиси водорода. Мнения поляризованы относительно того, как оксидаза убивает микробы в нейтрофилах. С одной стороны, считается, что перекись водорода действует как субстрат для миелопероксидазы для получения гипохлористой кислоты. [ 13 ] Это также может инактивировать критические метаболические ферменты, инициировать перекисное окисление липидов , повреждение кластеров железа-сульфура , [ 14 ] и освобождают окислительно-активное железо, которое позволяет генерировать неизбирательных окислителей, таких как гидроксильный радикал. [ 12 ] Альтернативный взгляд заключается в том, что оксидаза повышает рН в вакуоле до примерно 9,0, что оптимально для нейтральных протеаз, которые дегранулируют из цитоплазматических гранул (где они неактивны при pH ~ 5,5) и перекачивают калий в вакуоль, который солюбилизирует Ферменты, и именно активированные протеазы убивают и переваривают микробы. [ 15 ]
У насекомых у Noxes были прояснены некоторые функции. Члтойпамоты имеют три типа NOx (NOX4-ART, членистоногие специфические P22-фокс-независимые NOX4 и два кальций-зависимые ферменты, DUOX). [ 16 ] [ 17 ] [ 18 ] В кишечнике DUOX-зависимая Продукция АФК из стимулированной бактерий слизистой оболочки меланогастера является важным механизмом убийства патогенов. [ 19 ] и может увеличить дефекацию как защитный ответ. [ 20 ] В Aedes aegypti Duox участвует в контроле кишечной микробиоты. [ 21 ] Rhodnius prolixus имеет Duox, активированный кальция, который участвует в упрочнении яичной скорлупы, [ 22 ] и NOX5, который участвует в контроле подвижности кишечника и пищеварения крови. [ 23 ] [ 24 ]
Регулирование
[ редактировать ]Тщательная регуляция активности NADPH -оксидазы имеет решающее значение для поддержания здорового уровня АФК в организме. Фермент является дремотным в покоящихся клетках, но быстро активируется несколькими стимулами, включая бактериальные продукты и цитокины. [ 25 ] Сосудистые NADPH -оксидазы регулируются множеством гормонов и факторов, которые, как известно, являются важными игроками в ремоделировании сосудов и болезнях. К ним относятся тромбин , фактор роста, полученный из тромбоцитов (PDGF), фактор некроза опухоли (TNFA), лактозилцерамид , интерлейкин-1 и окисленный ЛПНП . [ 26 ] Это также стимулируется агонистами и арахидоновой кислотой . [ 26 ] И наоборот, сборка комплекса может быть ингибирована апоцинином и дифениленом иодонием . Апоцинин снижает индуцированное гриппом воспаление легких у мышей in vivo и может иметь клинические преимущества при лечении гриппа. [ 27 ]
ANG-1 запускает NOX2, NOX4 и митохондрии, чтобы высвобождать АФК и что АФК, полученные из этих источников, играют четкую роль в регуляции сигнального пути ANG-1/TIE 2 и проангиогенных реакций. [ 28 ]
Патология
[ редактировать ]Супероксиды имеют решающее значение для убийства иностранных бактерий в организме человека. Следовательно, недостаточная активность может привести к повышению восприимчивости к организмам, таким как каталаза-позитивные микробы, и чрезмерная активность может привести к окислительному стрессу и повреждению клеток.
Чрезмерная продукция АФК в сосудистых клетках вызывает многие формы сердечно -сосудистых заболеваний, включая гипертонию , атеросклероз , инфаркт миокарда и ишемический инсульт . [ 29 ] Атеросклероз вызван накоплением макрофагов, содержащих холестерин ( пенные клетки ) в стенках артерии (в интиме ). АФК, продуцируемый NADPH -оксидазой, активирует фермент, который заставляет макрофаги прилипать к стенке артерии (путем полимеризации актиновых волокон). Этот процесс уравновешен ингибиторами NADPH -оксидазы и антиоксидантами. Дисбаланс в пользу АФК вызывает атеросклероз. Исследования in vitro обнаружили, что ингибиторы NADPH-оксидазы апоцинина и дифенилентеноониум, наряду с антиоксидантами N-ацетилцистеином и ресвератролом, деполимеризовали актин, сломали адгезии и позволяли мигрировать FOAM-клеток мигрировать из интимы. [ 30 ] [ 31 ]
Одно исследование предполагает роль NADPH -оксидазы в индуцированной кетамином потерь экспрессии нейронального парвальбумина и GAD67 . [ 32 ] Подобная потеря наблюдается при шизофрении , и результаты могут указывать на NADPH -оксидазу как возможный игрок в патофизиологии заболевания. [ 33 ] Нитро -синий тетразолий используется в диагностическом тесте, в частности, для хронического гранулематозного заболевания, заболевания, при котором существует дефект в NADPH -оксидазе; Следовательно, фагоцит не может сделать реактивные формы кислорода или радикалы, необходимые для убийства бактерий, что приводит к тому, что бактерии процветают в фагоците. Чем выше синяя оценка, тем лучше ячейка при производстве реактивных форм кислорода.
Также было показано, что NADPH-оксидаза играет роль в механизме, который индуцирует образование SFLT-1 , белка, который деактивирует определенные проангиогенные факторы, которые играют роль в развитии плаценты, облегчая образование реактивных видов кислорода, вида кислорода, виды кислорода, виды кислорода, виды кислорода, виды кислорода, виды кислорода, виды кислорода, виды кислорода, виды кислорода, формирование вида реактивного кислорода реактивных видов кислорода , . которые являются подозреваемыми посредниками в формировании SFLT-1. Эти эффекты частично ответственны за индукцию преэклампсии у беременных женщин [ 34 ]
Мутации
[ редактировать ]Мутации в генах субъединиц NADPH -оксидазы вызывают несколько хронических гранулематозных заболеваний (CGD), характеризующихся чрезвычайной восприимчивостью к инфекции. [ 26 ] К ним относятся:
- Х-сцепленное хроническое гранулематозное заболевание (CGD)
- Аутосомно-рецессивный цитохром B-отрицательный CGD
- Аутосомно-рецессивный цитохром B-положительный CGD-тип I типа I
- Аутосомно-рецессивный цитохром B-положительный CGD тип II .
При этих заболеваниях клетки имеют низкую способность к фагоцитозу, и возникают постоянные бактериальные инфекции. Общие области инфицированных клеток являются обычными гранулемами. Аналогичное расстройство, называемое синдромом иммунодефицита нейтрофилов, связано с мутацией в Rac2, также частью комплекса.
Торможение
[ редактировать ]NADPH -оксидаза может быть ингибирована апоцинином , оксидом азота (NO) и дифениленом йодонием . Апоцинин действует, предотвращая сборку субъединиц NADPH -оксидазы. Апоцинин снижает индуцированное гриппом воспаление легких у мышей in vivo и может иметь клинические преимущества при лечении гриппа. [ 27 ]
Ингибирование NADPH -оксидазы не блокирует источник окислительного стресса в сосудистой сети. Таким образом, никакие донорские препараты ( нитровазодилататоры ) не использовались в течение более века для лечения коронарной болезни артерий , гипертонии и сердечной недостаточности путем предотвращения избыточного супероксида от ухудшения здоровых сосудистых клеток. [ 3 ]
Более продвинутые ингибиторы NADPH-оксидазы включают GKT-831 (ранее GKT137831 ), двойной ингибитор изоформ NOX4 и NOX1 [ 35 ] который был запатентован в 2007 году. [ 36 ] Соединение было первоначально разработано для идиопатического легочного фиброза и получено лекарств для сирот обозначение FDA и EMA в конце 2010 года. [ 37 ]
Ссылки
[ редактировать ]- ^ Sahoo S, Meijles DN, Pagano PJ (март 2016 г.). «NADPH оксидазы: ключевые модуляторы при старении и возрастных сердечно-сосудистых заболеваниях?» Полем Клиническая наука . 130 (5): 317–335. doi : 10.1042/cs20150087 . PMC 4818578 . PMID 26814203 .
- ^ Panday A, Sahoo Mk, Osorio D, Batra S (январь 2015 г.). «NADPH оксидазы: обзор от структуры к врожденным патологии, связанным с иммунитетом» . Клеточная и молекулярная иммунология . 12 (1): 5–23. doi : 10.1038/cmi.2014.89 . PMC 4654378 . PMID 25263488 .
- ^ Jump up to: а беременный в Dauling GJ, Selemidis S, Jiang F (март 2005 г.). «Механизмы подавления NADPH -оксидазы в сосудистой стенке» . Воспоминания DO Instintuto Oswaldo Cruz . 100 (Suppl 1): 97–103. doi : 10.1590/s0074-02762005000900016 . HDL : 1807/8204 . PMID 15962105 .
- ^ Pagano PJ, Chanock SJ, Siwik DA, Colucci WS, Clark JK (август 1998). «Ангиотензин II индуцирует экспрессию мРНК p67phox и генерацию супероксида NADPH в фибробластах аортальной аорты кролика» . Гипертония . 32 (2): 331–337. doi : 10.1161/01.hyp.32.2.331 . PMID 9719063 .
- ^ Griendling KK, Minieri CA, Ollerenshaw JD, Александр RW (июнь 1994 г.). «Ангиотензин II стимулирует активность NADH и NADPH -оксидазы в культивируемых клетках гладких мышц сосудов» . Исследование циркуляции . 74 (6): 1141–1148. doi : 10.1161/01.res.74.6.1141 . PMID 8187280 .
- ^ Зафари А.М., Ушио-Фукай М., Акерс М., Инь К, Шах А., Харрисон Д.Г. и др. (Сентябрь 1998). «Роль H2O2, полученного из NADH/NADPH, в индуцированной ангиотензином II, сосудистой гипертрофии» . Гипертония . 32 (3): 488–495. doi : 10.1161/01.hyp.32.3.488 . PMID 9740615 .
- ^ Херб М (февраль 2024 г.). «NADPH OXIDASE 3: за пределами тихого уха» . Антиоксиданты . 13 (2). doi : 10.3390/antiox13020219 . PMC 10886416 .
- ^ Heyworth PG, Knaus UG, Settleman J, Curnutte JT, Bokoch GM (ноябрь 1993 г.). «Регуляция активности NADPH -оксидазы с помощью RAC GTPase, активирующего белок (S)» . Молекулярная биология клетки . 4 (11): 1217–1223. doi : 10.1091/mbc.4.11.1217 . PMC 275755 . PMID 8305740 .
- ^ Шарма, Паллави; Джа, Амбудж Бхушан; Дубей, Рама Шанкер; Пессаракли, Мохаммед (2012-04-24). «Реактивные формы кислорода, окислительное повреждение и антиоксидационный механизм защиты у растений в стрессовых условиях» . Журнал ботаники . 2012 : 1–26. doi : 10.1155/2012/217037 . ISSN 2090-0120 .
- ^ Herb M, Gluschko A, Wiegmann K, Farid A, Wolf A, Umermöhlen O, et al. (Февраль 2019 г.). «Митохондриальные реактивные формы кислорода позволяют провоспалительную передачу сигналов посредством дисульфидной связи Nemo» . Наука сигнализация . 12 (568): EAAR5926. doi : 10.1126/scisignal.aar5926 . PMID 30755476 .
- ^ Herb M, Schramm M (февраль 2021 г.). «Функции АФК в макрофагах и антимикробном иммунитете» . Антиоксиданты . 10 (2): 313. doi : 10.3390/antiox10020313 . PMC 7923022 . PMID 33669824 .
- ^ Jump up to: а беременный Slauch JM (май 2011 г.). «Как окислительный взрыв макрофагов убивает бактерии? Все еще открытый вопрос» . Молекулярная микробиология . 80 (3): 580–583. doi : 10.1111/j.1365-2958.2011.07612.x . PMC 3109634 . PMID 21375590 .
- ^ Klebanoff SJ, Kettle AJ, Rosen H, Winterbourn CC, Nauseef Wm (февраль 2013 г.). «Миелопероксидаза: защитник фронта от фагоцитозированных микроорганизмов» . Журнал биологии лейкоцитов . 93 (2): 185–198. doi : 10.1189/jlb.0712349 . PMC 3545676 . PMID 23066164 .
- ^ Джаман О., Овертен Ф.В., Имлей Дж.А. (октябрь 2004 г.). «Ремонт окисленных кластеров железа-мульчарного суста в Эшерихии Коли» . Журнал биологической химии . 279 (43): 44590–44599. doi : 10.1074/jbc.m406487200 . PMID 15308657 .
- ^ Levine AP, Segal AW (август 2016 г.). «NADPH -оксидаза и микробное убийство нейтрофилами с особым акцентом на предложенную антимикробную роль миелопероксидазы в фагоцитарной вакуоле» . Микробиологический спектр . 4 (4). doi : 10.1128/microbiolspec.mchd-0018-2015 . PMID 27726789 .
- ^ Гандара А.С., Торрес А., Бахия А.С., Оливейра П.Л., Шама Р (март 2017 г.). «Эволюционное происхождение и функция NOX4-Art, специфичной для членистоногих NADPH-оксидазы» . BMC Эволюционная биология . 17 (1): 92. Bibcode : 2017bmcee..17 ... 92G . doi : 10.1186/s12862-017-0940-0 . PMC 5372347 . PMID 28356077 .
- ^ Kawahara T, Quinn MT, Lambeth JD (июль 2007 г.). «Молекулярная эволюция семейства ферментов NADPH-оксидазы, генерирующей кислород,» . BMC Эволюционная биология . 7 (1): 109. Bibcode : 2007bmcee ... 7..109K . doi : 10.1186/1471-2148-7-109 . PMC 1940245 . PMID 17612411 .
- ^ Гандара, Ана Кэролайн П.; Oliveira, Pedro L. (2023), Pick, Edgar (ed.), «NADPH оксидазы в членистоногие» , NADPH Oxidasases Revisited: от функции к структуре , CHAM: Springer International Publishing, стр. 477–488, doi : 10.1007/978 -3-031-23752-2_28 , ISBN 978-3-031-23751-5 Получено 2023-10-19
- ^ Ha Em, Oh Ct, Bae YS, Lee WJ (ноябрь 2005 г.). «Прямая роль двойной оксидазы в иммунитете кишечника Drosophila». Наука . 310 (5749): 847–850. Bibcode : 2005sci ... 310..847H . doi : 10.1126/science.1117311 . PMID 16272120 . S2CID 12476863 .
- ^ Du EJ, Ahn TJ, Kwon I, Lee JH, Park JH, Park SH, et al. (Январь 2016). Мигель-Алияга I (ред.). «TRPA1 регулирует дефекацию пищевых патогенов под контролем пути Duox» . PLOS Genetics . 12 (1): E1005773. doi : 10.1371/journal.pgen.1005773 . PMC 4699737 . PMID 26726767 .
- ^ Oliveira JH, Gonçalves RL, Lara FA, Dias FA, Gandara AC, Menna-Barreto RF, et al. (Март 2011 г.). Schneider DS (ред.). «Гем, полученный из крови, снижает уровень АФК в средней кишке Aedes aegypti и допускает пролиферацию кишечной микробиоты» . PLO -патогены . 7 (3): E1001320. doi : 10.1371/journal.ppat.1001320 . PMC 3060171 . PMID 21445237 .
- ^ Диас Ф.А., Гандара А.С., Кейроз-Баррос Ф.Г., Оливейра Р.Л., Соргинан М.Х., Браза Г.Р., Оливейра П.Л. (декабрь 2013). «Активность яичника с двойной оксидазой (DUOX) необходима для укрепления яичной скорлупы насекомых и гидроизоляции» . Журнал биологической химии . 288 (49): 35058–35067. Doi : 10.1074/jbc.m113.522201 . PMC 3853258 . PMID 24174530 .
- ^ Montezano AC, De Lucca Camargo L, Persson P, Rios FJ, Harvey AP, Anagnostopoulou A, et al. (Июнь 2018 г.). «NADPH-оксидаза 5 представляет собой изоформу NOX проконтроктильной NOX и точка перекрестного разговора для кальциевых и окислительно-восстановительных передач сигналов в сосудистой функции» . Журнал Американской кардиологической ассоциации . 7 (12). doi : 10.1161/jaha.118.009388 . PMC 6220544 . PMID 29907654 .
- ^ Gandara AC, Dias FA, De Lemos PC, Stiebler R, BombaCa AC, Menna-Barreto R, Oliveira PL (2021-02-25). « Урат и NOX5 контролируют расщепление крови у гематофагозного насекомых Rhodnius prolixus » . Границы в физиологии . 12 : 633093. DOI : 10.3389/fphys.2021.633093 . PMC 7947236 . PMID 33716782 .
- ^ Geiszt M (июль 2006 г.). «NADPHксидазы: новые дети на блоке» . Сердечно -сосудистые исследования . 71 (2): 289–299. doi : 10.1016/j.cardiores.2006.05.004 . PMID 16765921 .
- ^ Jump up to: а беременный в Griendling KK, Sorescu D, Ushio-Fukai M (март 2000 г.). «NAD (P) Hксидаза: роль в сердечно -сосудистой биологии и болезнях» . Исследование циркуляции . 86 (5): 494–501. doi : 10.1161/01.res.86.5.494 . PMID 10720409 .
- ^ Jump up to: а беременный Vlahos R, Stambas J, Bozinovski S, Broughton BR, Drummond GR, Selemidis S (февраль 2011 г.). «Ингибирование активности NOX2 оксидазы улучшает воспаление легкого гриппа А» . PLO -патогены . 7 (2): E1001271. doi : 10.1371/journal.ppat.1001271 . PMC 3033375 . PMID 21304882 .
- ^ Harel S, Mayaki D, Sanchez V, Hussain SN (май 2017). «NOX2, NOX4 и митохондриальные активные формы кислорода способствуют передаче сигналов ангиопоэтина-1 и ангиогенных реакциям в эндотелиальных клетках». Сосудистая фармакология . 92 : 22–32. doi : 10.1016/j.vph.2017.03.002 . PMID 28351775 .
- ^ Wattanapitayakul SK, Bauer JA (февраль 2001 г.). «Окислительные пути при сердечно -сосудистых заболеваниях: роли, механизмы и терапевтические последствия». Фармакология и терапия . 89 (2): 187–206. doi : 10.1016/s0163-7258 (00) 00114-5 . PMID 11316520 .
- ^ Park YM, Febbraio M, Silverstein RL (январь 2009 г.). «CD36 модулирует миграцию макрофагов мыши и человека в ответ на окисленный ЛПНП и может способствовать захвату макрофагов в артериальной интиме» . Журнал клинических исследований . 119 (1): 136–145. doi : 10.1172/jci35535 . PMC 2613464 . PMID 19065049 .
- ^ Curtiss LK (март 2009 г.). "Реверсирование атеросклероза?". Новая Англия Журнал медицины . 360 (11): 1144–1146. doi : 10.1056/nejmcibr0810383 . PMID 19279347 .
- ^ Беренс М.М., Али С.С., Дао Д.Н., Лусеро Дж., Шехтман Г., Квик К.Л., Дуган Л.Л. (декабрь 2007 г.). «Индуцированная кетамином потеря фенотипа быстрорастущих интернейронов опосредуется NADPH-оксидазой». Наука . 318 (5856): 1645–1647. Bibcode : 2007sci ... 318.1645b . doi : 10.1126/science.1148045 . PMID 18063801 . S2CID 41932041 .
- ^ Том Фаган. Связывает ли окислительное стресс NMDA и ГАМК -гипотезы о шизофрении? Архивировано 2007-12-30 на исследовательском форуме Wayback Machine Schizophrenia. 09 декабря 2007 г.
- ^ Huang QT, Zhang M, Zhong M, Yu YH, Liang WZ, Hang LL, et al. (Декабрь 2013). «Усовершенствованные конечные продукты гликирования в виде молекулы вверх по течению запускают продукцию SFLT-1, вызванную ROS, при экстравиллических трофобластах: новый мост между окислительным стрессом и преэклампсией». Плацента . 34 (12): 1177–1182. doi : 10.1016/j.placenta.2013.09.017 . PMID 24144948 .
- ^ Aoyama T, Paik YH, Watanabe S, Laleu B, Gaggini F, Fioraso-Cartier L, et al. (Декабрь 2012 г.). «Никотинамид аденин -динуклеотидфосфатсидаза при экспериментальном фиброзе печени: GKT137831 как новый потенциальный терапевтический агент» . Гепатология . 56 (6): 2316–2327. doi : 10.1002/hep.25938 . PMC 3493679 . PMID 22806357 .
- ^ «Espacenet - библиографические данные» . Worldwide.espacenet.com . Получено 2017-05-04 .
- ^ «FDA предоставление GenkyOtex Orphan Drug Advation of GKT137831 для IPF - GenkyOtex SA» Pauahosting.co.nz . Получено 2017-05-04 . [ Постоянная мертвая ссылка ]
Внешние ссылки
[ редактировать ]- NADPH+оксидаза в Национальной библиотеке Медицинской библиотеки Медицинской библиотеки медицинских заголовков (Mesh)
- EC 1.6.3.1