Метилированная ДНК-белок-цистеин-метилтрансфераза
| МГМТ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | МГМТ , Мгмт, AGT, AI267024, Агат, О-6-метилгуанин-ДНК-метилтрансфераза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 156569 ; МГИ : 96977 ; Гомологен : 31089 ; GeneCards : MGMT ; ОМА : МГМТ – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер ЕС | 2.1.1.63 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Метилированная ДНК-протеин-цистеин-метилтрансфераза (MGMT) , также известная как O 6 -алкилгуанин ДНК-алкилтрансфераза AGT — белок , который у человека кодируется MGMT геном . [ 5 ] [ 6 ] MGMT имеет решающее значение для стабильности генома. Он восстанавливает естественно возникшие мутагенные повреждения ДНК O. 6 -метилгуанин возвращается в гуанин и предотвращает несоответствие и ошибки во время репликации и транскрипции ДНК . Соответственно, потеря MGMT увеличивает канцерогенный риск у мышей после воздействия алкилирующих агентов . [ 7 ] Двумя бактериальными изоферментами являются Ada и Ogt .
Функция и механизм
[ редактировать ]| ' 6 -алкилгуанин ДНК-алкилтрансфераза' | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 2.1.1.63 | ||
| Номер CAS. | 77271-19-3 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
Хотя алкилирующие мутагены преимущественно модифицируют гуаниновое основание в положении N7, O 6 -алкилгуанин является основным канцерогенным повреждением ДНК . Этот аддукт ДНК удаляется репарирующим белком O. 6 -алкилгуанин-ДНК-алкилтрансфераза по механизму S N 2 . Этот белок не является настоящим ферментом, поскольку он удаляет алкильную группу из очага поражения в ходе стехиометрической реакции, и активный фермент не регенерируется после его алкилирования (так называемый суицидный фермент ). Метильный акцепторный остаток в белке представляет собой цистеин . [ 8 ]
- Деметилирование 6-О-метилгуанозина в гуанозин
Клиническое значение
[ редактировать ]У пациентов с глиобластомой , тяжелым типом опухоли головного мозга, лекарство от рака темозоломид более эффективно у пациентов с метилированием гена промотора . [ 9 ] В целом, в моделях клинического прогнозирования метилирование MGMT связано с длительной выживаемостью пациентов. [ 10 ] Для проверки статуса метилирования промотора MGMT в клинических условиях методы на основе ДНК, такие как специфическая для метилирования полимеразная цепная реакция (МС-ПЦР) или пиросеквенирование, предпочтительнее иммуногистохимических анализов или анализов на основе РНК. [ 11 ]
У пациентов с опухолями гипофиза MGMT может предсказать клинический и радиологический ответ на лечение темозоломидом. В этом контексте статус MGMT оптимально оценивается с помощью иммуногистохимии, при этом ожидается, что опухоли с истощением MGMT продемонстрируют ответ. [ 12 ] Статус метилирования промотора (MGMT) не предсказывает ответ на темозоломид, поскольку при опухолях гипофиза промотор почти всегда неметилирован. [ 13 ]
MGMT Также было показано, что является полезным инструментом, повышающим эффективность генной терапии. Используя двухкомпонентный вектор, состоящий из представляющего интерес трансгена и MGMT , можно использовать селекцию лекарств in vivo для отбора успешно трансдуцированных клеток. [ 14 ]
Мутагены в окружающей среде, [ 15 ] в табачном дыме, [ 16 ] еда, [ 17 ] а также эндогенные продукты обмена веществ [ 18 ] генерируют реактивные электрофильные виды, которые алкилируют или специфически метилируют ДНК, образуя 6-O-метилгуанин (m6G).
В 1985 году Ярош резюмировал раннюю работу, в которой было установлено, что m6G является алкилированным основанием ДНК, которое является наиболее мутагенным и канцерогенным. [ 19 ] В 1994 г. Расули-Ниа и др. [ 20 ] в ДНК индуцируется примерно одна мутация показали, что на каждые восемь нерепарированных m6G . Мутации могут вызвать прогрессирование рака в результате естественного отбора. [ нужна ссылка ]
Выражение при раке
[ редактировать ]| Тип рака | Частота дефицита при раке | Частота дефекта соседнего поля |
|---|---|---|
| шейный [ 21 ] | 61% | 39% |
| Колоректальный | 40%-90% [ 22 ] [ 23 ] [ 24 ] [ 25 ] [ 26 ] | 11%-34% [ 22 ] [ 23 ] |
| Колоректальный с микросателлитной нестабильностью [ 27 ] | 70% | 60% |
| Аденокарцинома пищевода | 71%-79% [ 28 ] [ 29 ] | 89% [ 29 ] |
| Плоскоклеточный рак пищевода | 38%-96% [ 28 ] [ 30 ] [ 31 ] | 65% [ 31 ] |
| Глиобластома из-за метилирования промотора | 44%-59% [ 32 ] [ 33 ] | |
| Плоскоклеточный рак головы и шеи | 54% [ 34 ] | |
| Гепатоцеллюлярная карцинома (связанная с вирусом гепатита С) [ 35 ] | 68% | 65% |
| Гортань | 54%-61% [ 36 ] [ 37 ] | 38% [ 37 ] |
| Желудок | 32%-88% [ 38 ] [ 39 ] | 17%-78% [ 38 ] [ 39 ] |
| Щитовидная железа [ 40 ] | 87% |
Эпигенетическая репрессия
[ редактировать ]Лишь небольшая часть спорадических видов рака с дефицитом репарации ДНК имеет мутацию в гене репарации ДНК. Тем не менее, большинство спорадических видов рака с дефицитом репарации ДНК имеют одно или несколько эпигенетических изменений, которые снижают или подавляют экспрессию генов репарации ДНК. Например, в исследовании 113 случаев последовательного колоректального рака только четыре имели миссенс-мутацию в гене репарации ДНК MGMT , в то время как у большинства наблюдалось снижение экспрессии MGMT из-за метилирования области промотора MGMT ( эпигенетическое изменение). [ 41 ]
MGMT может быть эпигенетически подавлен несколькими способами. [ 42 ] Когда экспрессия MGMT подавляется при раке, это часто происходит из-за метилирования его промоторной области. [ 42 ] Однако экспрессия также может быть подавлена диметилированием лизина 9 гистона 3. [ 43 ] или путем сверхэкспрессии ряда микроРНК, включая миР-181d, миР-767-3p и миР-603. [ 42 ] [ 44 ] [ 45 ]
MGMT (О-6-метилгуанин-ДНК-метилтрансфераза) является важным биомаркером рака, поскольку он участвует в восстановлении повреждений ДНК и часто подавляется или инактивируется в раковых клетках. Утрата функции MGMT приводит к более высокой частоте мутаций, способствующих образованию и прогрессированию опухолей. Наличие или отсутствие экспрессии MGMT в образце рака может указывать на реакцию пациента на алкилирующую химиотерапию, которая является распространенным методом лечения определенных типов рака. Следовательно, MGMT можно использовать в качестве прогностического маркера для прогнозирования вероятности ответа на лечение и для выбора подходящей терапии. В настоящее время разрабатывается ряд устройств для мониторинга статуса метилирования MGMT. [ 46 ]
Недостаток полевых дефектов
[ редактировать ]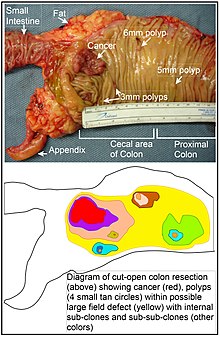
Дефект поля представляет собой область или «поле» эпителия, которое было обусловлено эпигенетическими изменениями и/или мутациями, предрасполагающими его к развитию рака. Дефект поля иллюстрируется на фотографии и диаграмме сегмента толстой кишки с раком толстой кишки и четырьмя небольшими полипами в той же области. Как отметил Рубин: «Подавляющее большинство исследований рака было проведено на четко определенных опухолях in vivo или на отдельных неопластических очагах in vitro. [ 47 ] Тем не менее, есть доказательства того, что более 80% соматических мутаций, обнаруженных в колоректальных опухолях человека с мутаторным фенотипом, возникают до начала терминальной клональной экспансии». [ 48 ] Аналогично, Фогельштейн и др. [ 49 ] отмечают, что более половины соматических мутаций, выявленных в опухолях, возникали в предопухолевой фазе (в поле дефекта), во время роста внешне нормальных клеток.
В таблице выше недостатки MGMT были отмечены в полевых дефектах (гистологически нормальных тканях), окружающих большинство раковых опухолей. Если MGMT эпигенетически снижен или подавлен, это вряд ли даст селективное преимущество стволовым клеткам. Однако снижение или отсутствие экспрессии MGMT может привести к увеличению частоты мутаций, и один или несколько мутировавших генов могут обеспечить клетке селективное преимущество. с дефицитом экспрессии Ген MGMT может затем использоваться как избирательно нейтральный или слегка вредный ген пассажира (автостопщика), когда мутировавшая стволовая клетка генерирует расширенный клон. Продолжающееся присутствие клона с эпигенетически репрессированным MGMT будет продолжать генерировать дальнейшие мутации, некоторые из которых могут привести к опухоли.
Дефицит с экзогенным повреждением
[ редактировать ]Дефицита MGMT может быть недостаточно, чтобы вызвать прогрессирование рака. У мышей с гомозиготной мутацией в MGMT не развивалось больше раковых заболеваний, чем у мышей дикого типа, когда их выращивали без стресса. [ 50 ] Однако стрессовое лечение мышей азоксиметаном и сульфатом декстрана вызывало более четырех опухолей толстой кишки на мышь с мутацией MGMT, но менее одной опухоли на мышь дикого типа. [ 51 ]
Репрессия в координации с другими генами репарации ДНК
[ редактировать ]При раке часто обнаруживается одновременное подавление нескольких генов репарации ДНК. [ 52 ] В одном примере с участием MGMT Jiang et al. [ 53 ] провели исследование, в котором они оценили экспрессию мРНК 27 генов репарации ДНК в 40 астроцитомах по сравнению с нормальными тканями мозга у людей, не страдающих астроцитомой. Среди 27 оцененных генов репарации ДНК 13 генов репарации ДНК, MGMT, NTHL1 , OGG1 , SMUG1 , ERCC1, ERCC2 , ERCC3 , ERCC4 , MLH1 , MLH3 , RAD50 , XRCC4 и XRCC5, были значительно снижены во всех трех степенях (II). , III и IV) астроцитом. Репрессия этих 13 генов как в астроцитомах более низкой, так и в более высокой степени позволяет предположить, что они могут быть важны как на ранних, так и на поздних стадиях астроцитомы. В другом примере Kitajima et al. [ 54 ] обнаружили, что иммунореактивность в отношении экспрессии MGMT и MLH1 тесно коррелирует в 135 образцах рака желудка, а потеря MGMT и hMLH1, по-видимому, синхронно ускоряется во время прогрессирования опухоли.
Недостаточная экспрессия нескольких генов репарации ДНК часто обнаруживается при раке. [ 52 ] и может способствовать возникновению тысяч мутаций, обычно встречающихся при раке (см. Частота мутаций при раке ).
Взаимодействия
[ редактировать ]ТО 6 Было показано, что -метилгуанин-ДНК-метилтрансфераза взаимодействует с рецептором эстрогена альфа . [ 55 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000170430 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000054612 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Тано К., Шиота С., Кольер Дж., Фут Р.С., Митра С. (январь 1990 г.). «Выделение и структурная характеристика клона кДНК, кодирующего белок репарации ДНК человека для O6-алкилгуанина» . Учеб. Натл. акад. наук. США . 87 (2): 686–90. Бибкод : 1990PNAS...87..686T . дои : 10.1073/pnas.87.2.686 . ПМК 53330 . ПМИД 2405387 .
- ^ Натараджан А.Т., Вермюлен С., Дарруди Ф., Валентайн М.Б., Брент Т.П., Митра С., Тано К. (январь 1992 г.). «Хромосомная локализация гена O6-метилгуанин-ДНК-метилтрансферазы человека (MGMT) путем гибридизации in situ». Мутагенез . 7 (1): 83–5. дои : 10.1093/mutage/7.1.83 . ПМИД 1635460 .
- ^ Сираиси А., Сакуми К., Секигути М. (октябрь 2000 г.). «Повышенная чувствительность к химиотерапевтическим алкилирующим агентам мышей с дефицитом метилтрансферазы репарации ДНК» . Канцерогенез . 21 (10): 1879–83. дои : 10.1093/carcin/21.10.1879 . ПМИД 11023546 .
- ^ Кайна Б., Кристманн М., Науманн С., Роос В.П. (август 2007 г.). «MGMT: ключевой узел в борьбе с генотоксичностью, канцерогенностью и апоптозом, вызванным алкилирующими агентами». Восстановление ДНК (Амст.) . 6 (8): 1079–99. дои : 10.1016/j.dnarep.2007.03.008 . ПМИД 17485253 .
- ^ Хеги М.Э., Дизеренс АС, Горлия Т., Хаму М.Ф., де Триболе Н., Веллер М., Крос Дж.М., Хайнфеллнер Дж.А., Мейсон В., Мариани Л., Бромберг Дж.Е., Хау П., Мириманофф Р.О., Кернкросс Дж.Г., Янзер Р.К., Ступп Р. (2005) ). «Подавление гена MGMT и польза темозоломида при глиобластоме» . Н. англ. Дж. Мед . 352 (10): 997–1003. doi : 10.1056/NEJMoa043331 . ПМИД 15758010 .
- ^ Моленаар Р.Дж., Вербаан Д., Ламба С., Занон С., Юкен Дж.В., Бутс-Спренгер Ш., Весселинг П., Хулсебос Т.Дж., Троост Д., ван Тилборг А.А., Леенстра С., Вандертоп В.П., Барделли А. , ван Ноорден С.Дж., Бликер Ф.Е. (2014) ). «Сочетание мутаций IDH1 и статуса метилирования MGMT предсказывает выживаемость при глиобластоме лучше, чем только IDH1 или MGMT» . Нейроонкология . 16 (9): 1263–73. дои : 10.1093/neuonc/nou005 . ПМК 4136888 . ПМИД 24510240 .
- ^ Пройссер, М .; Янзер, Чарльз Р.; Фельсберг, Дж.; Райфенбергер, Г.; Хаму, МФ; Дизеренс, AC; Ступп, Р.; Горлия, Т.; Марози, К.; Хайнцль, Х.; Хайнфелльнер, Дж.А.; Хеги, М. (октябрь 2008 г.). «Имногистохимия анти-O6-метилгуанин-метилтрансферазы (MGMT) при мультиформной глиобластоме: изменчивость наблюдателя и отсутствие связи с выживаемостью пациентов препятствуют ее использованию в качестве клинического биомаркера» . Мозговая патология . 18 (4): 520–532. дои : 10.1111/j.1750-3639.2008.00153.x . ПМК 8095504 . ПМИД 18400046 . S2CID 21167901 .
- ^ МакКормак, А. (2022). «Темозоломид при агрессивных опухолях гипофиза и карциномах гипофиза» . Лучшие практики и исследования. Клиническая эндокринология и обмен веществ . 36 (6): 101713. doi : 10.1016/j.beem.2022.101713 . ПМИД 36274026 . S2CID 252941246 .
- ^ Буш, З.М.; Лонгтайн, Дж.А.; Каннингем, Т.; Шифф, Д.; Джейн-младший, JA; Вэнс, ML; Торнер, Миссури; Лоус-младший, скорая помощь; Лопес, МБ (2010). «Лечение темозоломидом агрессивных опухолей гипофиза: корреляция клинических результатов с метилированием и экспрессией промотора O (6)-метилгуанин метилтрансферазы (MGMT)» . Журнал клинической эндокринологии и метаболизма . 95 (11): Е280-90. дои : 10.1210/jc.2010-0441 . ПМЦ 5393383 . ПМИД 20668043 .
- ^ Чанг А.Х., Стефан М.Т., Лисовски Л., Саделен М. (2008). «Доставка эритроид-специфического человеческого фактора IX из выбранных in vivo гемопоэтических стволовых клеток после немиелоаблативного кондиционирования у мышей с гемофилией B» . Мол. Там . 16 (10): 1745–52. дои : 10.1038/mt.2008.161 . ПМЦ 2658893 . ПМИД 18682698 .
- ^ Барч Х., Монтесано Р. (1984). «Значение нитрозаминов для рака человека» . Канцерогенез . 5 (11): 1381–93. дои : 10.1093/carcin/5.11.1381 . ПМИД 6386215 .
- ^ Кристманн М., Кайна Б. (2012). «О (6)-метилгуанин-ДНК-метилтрансфераза (MGMT): влияние на риск рака в ответ на табачный дым». Мутат. Рез . 736 (1–2): 64–74. дои : 10.1016/j.mrfmmm.2011.06.004 . ПМИД 21708177 .
- ^ Фарер Дж., Кайна Б. (2013). «О6-метилгуанин-ДНК-метилтрансфераза в защите от N-нитрозосоединений и колоректального рака» . Канцерогенез . 34 (11): 2435–42. дои : 10.1093/carcin/bgt275 . ПМИД 23929436 .
- ^ Де Бонт Р., ван Ларебеке Н. (2004). «Эндогенные повреждения ДНК у человека: обзор количественных данных» . Мутагенез . 19 (3): 169–85. дои : 10.1093/mutage/geh025 . ПМИД 15123782 .
- ^ Ярош Д.Б. (1985). «Роль О6-метилгуанин-ДНК-метилтрансферазы в выживании клеток, мутагенезе и канцерогенезе» . Мутат. Рез . 145 (1–2): 1–16. дои : 10.1016/0167-8817(85)90034-3 . ПМИД 3883145 .
- ^ Расули-Ниа А., Сибхат-Улла, Мирзаянс Р., Патерсон М.С., Дэй РС (1994). «О количественной взаимосвязи между остатками О6-метилгуанина в геномной ДНК и образованием сестринских хроматидных обменов, мутациями и летальными событиями в линии опухолевых клеток Мер-человека». Мутат. Рез . 314 (2): 99–113. дои : 10.1016/0921-8777(94)90074-4 . ПМИД 7510369 .
- ^ Илиопулос Д., Ойконому П., Мессинис И., Цезу А. (2009). «Корреляция гиперметилирования промотора в генах hTERT, DAPK и MGMT с прогрессированием онкогенеза шейки матки» . Онкол. Представитель . 22 (1): 199–204. дои : 10.3892/or_00000425 . ПМИД 19513524 .
- ^ Перейти обратно: а б Шен Л., Кондо Ю., Рознер Г.Л., Сяо Л., Эрнандес Н.С., Вилайтонг Дж., Хулихан П.С., Крауз Р.С., Прасад А.Р., Эйнспар Дж.Г., Бакмайер Дж., Альбертс Д.С., Гамильтон С.Р., Исса Дж.П. (2005). «Метилирование промотора MGMT и дефект поля при спорадическом колоректальном раке» . Дж. Натл. Онкологический институт . 97 (18): 1330–8. дои : 10.1093/jnci/dji275 . ПМИД 16174854 .
- ^ Перейти обратно: а б Ли К.Х., Ли Дж.С., Нам Дж.Х., Чой С., Ли MC, Пак К.С., Джунг С.В., Ли Дж.Х. (2011). «Статус метилирования промотора генов hMLH1, hMSH2 и MGMT при колоректальном раке, связанном с последовательностью аденома-карцинома». Архивная хирургия Лангенбекса . 396 (7): 1017–26. дои : 10.1007/s00423-011-0812-9 . ПМИД 21706233 . S2CID 8069716 .
- ^ Псофаки В., Калогера С., Цамбурас Н., Стефану Д., Цианос Е., Сефериадис К., Колиос Г. (2010). «Статус метилирования промотора hMLH1, MGMT и CDKN2A/p16 при колоректальных аденомах» . Мир Дж. Гастроэнтерол . 16 (28): 3553–60. дои : 10.3748/wjg.v16.i28.3553 . ПМК 2909555 . ПМИД 20653064 .
- ^ Амату А, Сарторе-Бьянки А, Моутинью С, Белотти А, Бенкардино К, Кирико Г, Кассингена А, Рускони Ф, Эспозито А, Никелатти М, Эстеллер М, Сиена С (2013). «Гиперметилирование промоторного CpG-островка фермента репарации ДНК MGMT предсказывает клинический ответ на дакарбазин в исследовании фазы II метастатического колоректального рака» . Клин. Рак Рез . 19 (8): 2265–72. дои : 10.1158/1078-0432.CCR-12-3518 . ПМИД 23422094 .
- ^ Мокаррам П., Замани М., Кавусипур С., Нагибальхоссайни Ф., Ираджи С., Моради Сараби М., Хоссейни С.В. (2013). «Различные закономерности метилирования ДНК двух различных областей промотора O6-метилгуанин-ДНК-метилтрансферазы (O6-MGMT) при колоректальном раке». Мол. Биол. Представитель . 40 (5): 3851–7. дои : 10.1007/s11033-012-2465-3 . ПМИД 23271133 . S2CID 18733871 .
- ^ Сврчек М, Бухард О, Колас К, Куле Ф, Дюмон С, Массауди И, Ламри А, Хамелен Р, Коснес Дж, Оливейра К, Серука Р, Гауб М.П., Легрен М, Коллура А, Ласколс О, Тирет Е, Флежу Ж.Ф. , Дюваль А. (2010). «Толерантность к метилированию из-за дефекта поля O6-метилгуанин-ДНК-метилтрансферазы (MGMT) в слизистой оболочке толстой кишки: начальный этап в развитии колоректального рака с дефицитом репарации несоответствия». Гут . 59 (11): 1516–26. дои : 10.1136/gut.2009.194787 . ПМИД 20947886 . S2CID 206950452 .
- ^ Перейти обратно: а б Хасина Р., Сурати М., Кавада И., Ариф К., Кэри ГБ, Кантети Р., Хусейн А.Н., Фергюсон М.К., Вокес Э.Э., Виллафлор В.М., Салгия Р. (2013). «Метилирование метилтрансферазы О-6-метилгуанин-дезоксирибонуклеиновой кислоты усиливает ответ на лечение темозоломидом при раке пищевода» . Дж. Карциног . 12:20 . дои : 10.4103/1477-3163.120632 . ПМЦ 3853796 . ПМИД 24319345 .
- ^ Перейти обратно: а б Кюстер Д., Эль-Рифай В., Пэн Д., Рюммеле П., Крокель И., Петерс Б., Москалюк К.А., Столте М., Монкемюллер К., Мейер Ф., Шульц Х.У., Хартманн А., Росснер А., Шнайдер-Сток Р. (2009). «Замалчивание экспрессии MGMT путем гиперметилирования промотора в последовательности метаплазия-дисплазия-карцинома пищевода Барретта» . Рак Летт . 275 (1): 117–26. дои : 10.1016/j.canlet.2008.10.009 . ПМК 4028828 . ПМИД 19027227 .
- ^ Лин ZQ, Ли П, Ге МХ, Ху Ф.Дж., Фанг С.Х., Донг З.М., Мао В.М. (2011). «Аберрантное метилирование различных генов репарации ДНК демонстрирует особую прогностическую ценность для рака пищевода». Копать. Дис. Наука . 56 (10): 2992–3004. дои : 10.1007/s10620-011-1774-z . ПМИД 21674174 . S2CID 22913110 .
- ^ Перейти обратно: а б Су Ю, Инь Л, Лю Р, Шэн Дж, Ян М, Ван Ю, Пан Е, Го В, Пу Ю, Чжан Дж, Лян Г (2014). «Статус метилирования промотора MGMT, hMSH2 и hMLH1 и его связь с экспрессией соответствующего белка и мутациями TP53 при плоскоклеточном раке пищевода человека». Мед. Онкол . 31 (2): 784. doi : 10.1007/s12032-013-0784-4 . ПМИД 24366688 . S2CID 22746140 .
- ^ Моранди Л., Франчески Э., де Биасе Д., Маруччи Г., Тосони А., Эрмани М., Пессион А., Таллини Г., Брандес А. (2010). «Анализ метилирования промотора O6-метилгуанин-ДНК-метилтрансферазы при глиобластоме: обнаружение с помощью количественной ПЦР на основе заблокированных нуклеиновых кислот с использованием импринтированного гена (SNURF) в качестве эталона» . БМК Рак . 10:48 . дои : 10.1186/1471-2407-10-48 . ПМЦ 2843669 . ПМИД 20167086 .
- ^ Куильен В., Лавеню А., Караян-Тапон Л., Карпентье С., Лабюссьер М., Лесимпле Т., Шино О., Вагер М., Оннорат Дж., Сайкали С., Фина Ф., Сансон М., Фигарелла-Брэнгер Д. (2012). «Сравнительная оценка 5 методов (специфическая для метилирования полимеразная цепная реакция, MethyLight, пиросеквенирование, чувствительное к метилированию плавление высокого разрешения и иммуногистохимия) для анализа О6-метилгуанин-ДНК-метилтранферазы в серии из 100 пациентов с глиобластомой» . Рак . 118 (17): 4201–11. дои : 10.1002/cncr.27392 . ПМИД 22294349 . S2CID 8145409 .
- ^ Кусимпелас Д., Понгсапич В., Генрих У., Манн С., Манн В.Дж., Бригер Дж. (2012). «Метилирование промотора генов-супрессоров опухолей MGMT, MLH1 и RASSF1A при плоскоклеточном раке головы и шеи: фармакологическое деметилирование генома снижает пролиферацию клеток плоскоклеточного рака головы и шеи» . Онкол. Представитель . 27 (4): 1135–41. дои : 10.3892/или.2012.1624 . ПМЦ 3583513 . ПМИД 22246327 .
- ^ Зекри А.Р., Бахнаси А.А., Шоаб Ф.Е., Мохамед В.С., Эль-Дахшан Д.Х., Али Ф.Т., Сабри ГМ, Дасгупта Н., Дауд СС (2014). «Метилирование нескольких генов при гепатоцеллюлярной карциноме, связанной с вирусом гепатита С» . J Adv Рез . 5 (1): 27–40. дои : 10.1016/j.jare.2012.11.002 . ПМК 4294722 . ПМИД 25685469 .
- ^ Пьерини С., Йорданов С.Х., Миткова А.В., Чалаков И.Ю., Мельничаров М.Б., Кунев К.В., Митев В.И., Канева Р.П., Горанова Т.Е. (2014). «Гиперметилирование промотора генов CDKN2A, MGMT, MLH1 и DAPK при плоскоклеточном раке гортани и их связь с клиническими профилями пациентов». Голова Шея . 36 (8): 1103–8. дои : 10.1002/hed.23413 . ПМИД 23804521 . S2CID 11916790 .
- ^ Перейти обратно: а б Палущак Ю., Мисяк П., Вежбицка М., Возняк А., Баер-Дубовска В. (2011). «Частое гиперметилирование DAPK, RARbeta, MGMT, RASSF1A и FHIT при плоскоклеточном раке гортани и прилегающей нормальной слизистой оболочке». Оральный онкол . 47 (2): 104–7. doi : 10.1016/j.oraloncology.2010.11.006 . ПМИД 21147548 .
- ^ Перейти обратно: а б Цзинь Дж, Се Л, Се Ч, Чжоу Ю. Ф. (2014). «Аберрантное метилирование ДНК генов MGMT и hMLH1 в прогнозировании рака желудка» . Жене. Мол. Рез . 13 (2): 4140–5. doi : 10.4238/2014.30.9 мая . ПМИД 24938706 .
- ^ Перейти обратно: а б Цзоу XP, Чжан Б, Чжан XQ, Чен М, Цао Дж, Лю WJ (2009). «Промоторное гиперметилирование нескольких генов при ранней аденокарциноме желудка и предраковых поражениях». Хм. Патол . 40 (11): 1534–42. дои : 10.1016/j.humpath.2009.01.029 . ПМИД 19695681 .
- ^ Мохтар М, Кондо К, Намура Т, Али А.Х., Фудзита Ю, Такаи С, Такизава Х, Накагава Ю, Тоба Х, Кадзюра К, Ёсида М, Каваками Г, Сакияма С, Тангоку А (2014). «Профили метилирования и экспрессии гена MGMT в эпителиальных опухолях тимуса». легких Рак 83 (2): 279–87. дои : 10.1016/j.lungcan.2013.12.004 . ПМИД 24388682 .
- ^ Хэлфорд С., Роуэн А., Сойер Э., Талбот I, Томлинсон I (июнь 2005 г.). «О (6)-метилгуанин метилтрансфераза при колоректальном раке: обнаружение мутаций, потеря экспрессии и слабая связь с переходами G: C> A: T» . Гут . 54 (6): 797–802. дои : 10.1136/gut.2004.059535 . ПМЦ 1774551 . ПМИД 15888787 .
- ^ Перейти обратно: а б с Кабрини Дж., Фаббри Э., Ло Нигро С., Дечекки М.С., Гамбари Р. (2015). «Регуляция экспрессии О6-метилгуанин-ДНК-метилтрансферазы и лечение глиобластомы (Обзор)» . Межд. Дж. Онкол . 47 (2): 417–28. дои : 10.3892/ijo.2015.3026 . ПМК 4501657 . ПМИД 26035292 .
- ^ Накагавати Т , Соэдзима Х , Урано Т , Чжао В , Хигасимото К , Сато Й , Мацукура С , Кудо С , Китадзима Й , Харада Х , Фурукава К , Мацузаки Х , Эми М , Накабеппу Й , Миядзаки К , Секигути М , Мукаи Т (2003). «Эффект подавления гиперметилирования островков CpG и модификаций гистонов на экспрессию гена O6-метилгуанин-ДНК-метилтрансферазы (MGMT) при раке человека». Онкоген . 22 (55): 8835–44. дои : 10.1038/sj.onc.1207183 . ПМИД 14647440 .
- ^ Кушваха Д., Рамакришнан В., Нг К., Стид Т., Нгуен Т., Футалан Д., Акерс Дж.С., Саркария Дж., Цзян Т., Чоудхури Д., Картер Б.С., Чен CC (2014). «Полногеномный скрининг миРНК выявил миР-603 как миРНК, регулирующую MGMT в глиобластомах» . Онкотаргет . 5 (12): 4026–39. doi : 10.18632/oncotarget.1974 . ПМК 4147303 . ПМИД 24994119 .
- ^ Чжан В., Чжан Дж., Ходли К., Кушваха Д., Рамакришнан В., Ли С., Кан С., Ю Ю, Цзян С., Сун С.В., Цзян Т., Чен CC (2012). «МиР-181d: прогнозирующий биомаркер глиобластомы, который подавляет экспрессию MGMT» . Нейроонкология . 14 (6): 712–9. дои : 10.1093/neuonc/nos089 . ПМЦ 3367855 . ПМИД 22570426 .
- ^ Джахин М., Фенек-Салерно Б., Мозер Н., Георгиу П., Фланаган Дж., Тумазу К., ... и Калофону М. (ноябрь 2021 г.). Обнаружение статуса метилирования MGMT с использованием метода изотермической амплификации, совместимого с Lab-on-Chip. В 2021 г. состоится 43-я ежегодная международная конференция Общества инженерии в медицине и биологии IEEE (EMBC) (стр. 7385-7389). IEEE. doi:10.1109/EMBC46164.2021.9630776 .
- ^ Рубин Х (март 2011 г.). «Поля и канцеризация полей: предопухолевые источники рака: бессимптомные гиперпластические поля являются предшественниками неоплазии, и их прогрессирование в опухоли можно отследить по плотности насыщения в культуре». Биоэссе . 33 (3): 224–31. doi : 10.1002/bies.201000067 . ПМИД 21254148 . S2CID 44981539 .
- ^ Цао Дж.Л., Ятабе Ю., Саловаара Р., Ярвинен Х.Дж., Меклин Дж.П., Аалтонен Л.А., Тавари С., Шибата Д. (февраль 2000 г.). «Генетическая реконструкция историй отдельных колоректальных опухолей» . Учеб. Натл. акад. наук. США . 97 (3): 1236–41. Бибкод : 2000PNAS...97.1236T . дои : 10.1073/pnas.97.3.1236 . ПМК 15581 . ПМИД 10655514 .
- ^ Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинцлер К.В. (март 2013 г.). «Пейзажи генома рака» . Наука . 339 (6127): 1546–58. Бибкод : 2013Sci...339.1546V . дои : 10.1126/science.1235122 . ПМК 3749880 . ПМИД 23539594 .
- ^ Мейра Л.Б., Кальво Дж.А., Шах Д., Клапач Дж., Мороски-Эркул К.А., Бронсон Р.Т., Самсон Л.Д. (2014). «Ремонт эндогенных повреждений оснований ДНК модулирует продолжительность жизни мышей» . Восстановление ДНК (Амст.) . 21 : 78–86. дои : 10.1016/j.dnarep.2014.05.012 . ПМЦ 4125484 . ПМИД 24994062 .
- ^ Вирц С., Нагель Г., Эшкинд Л., Нейрат М.Ф., Самсон Л.Д., Кайна Б. (2010). «И эксцизионная репарация оснований, и О6-метилгуанин-ДНК-метилтрансфераза защищают от канцерогенеза толстой кишки, вызванного метилированием» . Канцерогенез . 31 (12): 2111–7. дои : 10.1093/carcin/bgq174 . ПМЦ 2994278 . ПМИД 20732909 .
- ^ Перейти обратно: а б Бернштейн С., Бернштейн Х. (2015). «Эпигенетическое снижение репарации ДНК при прогрессировании рака желудочно-кишечного тракта» . World J Гастроинтест Онкол . 7 (5): 30–46. дои : 10.4251/wjgo.v7.i5.30 . ПМЦ 4434036 . ПМИД 25987950 .
- ^ Цзян Цз, Ху Дж, Ли Х, Цзян Ю, Чжоу В, Лу Д (2006). «Анализ экспрессии 27 генов репарации ДНК в астроцитоме с помощью массива TaqMan низкой плотности». Неврология. Летт . 409 (2): 112–7. дои : 10.1016/j.neulet.2006.09.038 . ПМИД 17034947 . S2CID 54278905 .
- ^ Китадзима Ю., Миядзаки К., Мацукура С., Танака М., Секигути М. (2003). «Потеря экспрессии ферментов репарации ДНК MGMT, hMLH1 и hMSH2 во время прогрессирования опухоли при раке желудка» . Рак желудка . 6 (2): 86–95. дои : 10.1007/s10120-003-0213-z . ПМИД 12861399 .
- ^ Тео АК, О ХК, Али РБ, Ли БФ (октябрь 2001 г.). «Модифицированный фермент репарации ДНК человека О (6)-метилгуанин-ДНК-метилтрансфераза является негативным регулятором транскрипции, опосредованной рецептором эстрогена, при повреждении ДНК алкилированием» . Мол. Клетка. Биол . 21 (20): 7105–14. дои : 10.1128/MCB.21.20.7105-7114.2001 . ПМК 99886 . ПМИД 11564893 .
Дальнейшее чтение
[ редактировать ]- Маргисон Г.П., Повей А.С., Кайна Б., Сантибаньес Кореф М.Ф. (2003). «Вариабельность и регуляция О6-алкилгуанин-ДНК-алкилтрансферазы» . Канцерогенез . 24 (4): 625–35. дои : 10.1093/carcin/bgg005 . ПМИД 12727789 .