Гидроксипролин
| |
| Имена | |
|---|---|
| Имя IUPAC
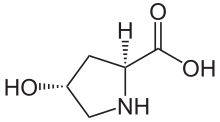
(2 с , 4 р ) -4-гидроксипирролидин-2-карбоновая кислота
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Chemspider | |
| Echa Infocard | 100.000.084 |
| Сетка | Гидроксипролин |
PubChem CID
|
|
| НЕКОТОРЫЙ | |
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| C 5 H 9 N O 3 | |
| Молярная масса | 131.131 g·mol −1 |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
(2 S , 4 R ) -4-гидроксипролин , или L- гидроксипролин ( C 5 H 9 O 3 N ), является аминокислотой , сокращенной как Hyp или O , например , в банке данных белка .
Структура и открытие
[ редактировать ]В 1902 году Герман Эмиль Фишер выделял гидроксипролин из гидролизованного желатина . В 1905 году Герман Лейхс синтезировал расическую смесь 4-гидроксипролина. [ 1 ]
Гидроксипролин отличается от пролина из -за присутствия гидроксильной (OH) группы, прикрепленной к атому гамма -углерода.
Производство и функция
[ редактировать ]Гидроксипролин продуцируется гидроксилированием аминокислотного пролина ферментом пролил-гидроксилазы после синтеза белка (как посттрансляционная модификация ). Катализируемая фермент реакция происходит в просвете эндоплазматической ретикулумы . Хотя он не включается непосредственно в белки, гидроксипролин содержит примерно 4% всех аминокислот, обнаруженных в тканях животных, что более семи других аминокислот, которые трансляционно включены. [ 2 ]
Животные
[ редактировать ]Коллаген
[ редактировать ]Гидроксипролин является основным компонентом протеинового коллагена , [ 3 ] содержит примерно 13,5% коллагена млекопитающих. Гидроксипролин и пролин играют ключевые роли стабильности коллагена. [ 4 ] Они разрешают резкую скручивание коллагеновой спирали. [ 5 ] В каноническом коллагеном Xaa-yaa-Gly триада (где XAA и YAA представляют собой любую аминокислоту), пролин, занимающий позицию YAA, гидроксилируется, чтобы получить последовательность XAA-hyp-Gly. коллагена Эта модификация остатка пролина увеличивает стабильность тройной спирали . Первоначально было предложено, что стабилизация была вызвана молекулами воды, образующими водородную связь, связывающую пролил-гидроксильные группы и карбонильные группы основной цепочки. [ 6 ] Впоследствии было показано, что увеличение стабильности происходит в первую очередь благодаря стереоэлектронным эффектам и что гидратация остатков гидроксипролина обеспечивает незначительную дополнительную стабильность. [ 7 ]
Не коллаген
[ редактировать ]Гидроксипролин обнаружен в нескольких белках, кроме коллагена. По этой причине содержание гидроксипролина использовалось в качестве индикатора для определения коллагена и/или желатина . Тем не менее, белки млекопитающих эластин и Argonaute 2 имеют коллагеноподобные домены, в которых образуется гидроксипролин. У некоторых улиток ядов, конотоксинов , содержат гидроксипролин, но не имеют коллагеноподобных последовательностей. [ 2 ]
Было показано, что гидроксилирование пролина участвует в нацеливании в альфа-субъединице , индуцируемого гипоксией (HIF) ( HIF-1 , на деградацию путем протеолиза . При нормоксии (нормальные условия кислорода) EGLN1 [1] белок гидроксилирует пролин в положении 564 альфа HIF-1, что обеспечивает убиквитилирование фон Хиппель-Линдау-супрессором (PVHL) и последующим нацеливанием для разложения протеазом . [ 8 ]
Растения
[ редактировать ]Гидроксипролиновые гликопротеины (HRGP) также обнаруживаются в клеточных стенках растений . [ 9 ] Эти гидроксипролины служат точками прикрепления для цепочек гликана , которые добавляются в качестве посттрансляционных модификаций . [ 9 ]
Клиническое значение
[ редактировать ]пролина Гидроксилирование требует аскорбиновой кислоты ( витамин С ). первые эффекты (борьба с десен и волосы) отсутствия аскорбиновой кислоты у людей связаны с результирующим дефектом в гидроксилировании пролина коллагена остатков Наиболее очевидные , с пониженной стабильностью молекулы коллагена, вызывая цирку .
Повышенные уровни гидроксипролина в сыворотке и моче также были продемонстрированы при болезни Педжета . [ 10 ]
Другие гидроксипролины
[ редактировать ]Другие гидроксипролины также существуют в природе. Наиболее заметными являются 2,3- цис- , 3,4- транс -и 3,4-дигидроксипролин, который происходит в диатомовых клеток клеточных стенках [ 11 ] и постуляются, чтобы играть роль в осаждении кремнезема . Гидроксипролин также обнаружен в стенах оомицетов , грибных протистах, связанных с диатомогами. [ 12 ] (2 с , 4 с ) -цис -4-гидроксипролин обнаружен в токсичных циклических пептидах из аманит грибов ( например , фаллоидина ). [ 13 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ RHA Plimmer (1912) [1908]. RHA Plimmer; FG Hopkins (ред.). Химический состав белков . Монографии по биохимии. Тол. Часть I. Анализ (2 -е изд.). Лондон: Longmans, Green and Co. p. 132 . Получено 18 января 2010 года .
- ^ Подпрыгнуть до: а беременный Горрес, Келли Л.; Рейнс, Рональд Т. (апрель 2010 г.). «Пролил 4-гидроксилаза» . Критические обзоры биохимии и молекулярной биологии . 45 (2): 106–124. doi : 10.3109/10409231003627991 . PMC 2841224 . PMID 20199358 .
- ^ Szpak, Paul (2011). «Химия и ультраструктура рыб: последствия для тафономии и стабильного анализа изотопов» . Журнал археологической науки . 38 (12): 3358–3372. doi : 10.1016/j.jas.2011.07.022 .
- ^ Нельсон, Д.Л. и Кокс, М.М. (2005) Принципы биохимии Лехнингера, 4 -е издание, WH Freeman and Company, Нью -Йорк.
- ^ Brinckmann, J., Notbohm, H. and Müller, PK (2005) Коллаген, темы в текущей химии 247, Springer, Berlin.
- ^ Белла, J; Итон, м; Бродский, б; Берман, HM (1994). «Кристаллическая и молекулярная структура коллагеноподобного пептида при разрешении 1,9». Наука . 266 (5182): 75–81. doi : 10.1126/science.7695699 . PMID 7695699 .
- ^ Котч, FW; Гуезэй, ИА; Рейнс, RT (2008). «Стабилизация тройной спирали коллагена путем О-метилирования остатков гидроксипролина» . Журнал Американского химического общества . 130 (10): 2952–2953. doi : 10.1021/ja800225k . PMC 2802593 . PMID 18271593 .
- ^ Jaakkola, P.; Крот, доктор; Tian, YM; Уилсон, Мичиган; Gielbert, J.; Гаскелл, SJ; Кригшайм, Ав; Hebestreit, HF; и др. (2001). «Нацеливание HIF-Alpha на убиквитилирование фон-Хиппель-Линдау с помощью O2-регулируемого пролил-гидроксилирования» . Наука . 292 (5516): 468–72. Bibcode : 2001sci ... 292..468j . doi : 10.1126/science.1059796 . PMID 11292861 . S2CID 20914281 .
- ^ Подпрыгнуть до: а беременный Кассаб, Глэдис I (1998). «Белки растительной клеточной стенки». Ежегодный обзор физиологии растений и молекулярной биологии растений . 49 : 281–309. doi : 10.1146/annurev.arplant.49.1.281 . PMID 15012236 .
- ^ «Учебник из ортопедии» . В то время как онлайн . 22 июля 2020 года.
- ^ Накаджима, Т.; Вулкани, BE (1969). «3,4-дигидроксипролин: новая аминокислота в клеточных стенках диатомовых клеток». Наука . 164 (3886): 1400–1401. Bibcode : 1969sci ... 164.1400n . doi : 10.1126/science.164.3886.1400 . PMID 5783709 . S2CID 23673503 .
- ^ Alexopoulos, CJ, Mims CW и Blackwell, M. (1996). Вступительная микология (4 -е изд.). Нью -Йорк: Джон Уайли и сыновья. С. 687–688. ISBN 978-0-471-52229-4 .
{{cite book}}: Cs1 maint: несколько имен: список авторов ( ссылка ) - ^ Wieland, T. (1986). Пептиды ядовитых грибов аманиты . Спрингер.