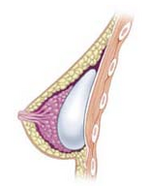
Грудной имплантат
| Грудной имплантат | |
|---|---|
| Duration: 17 seconds. Видео врача, размечающего грудь для имплантатов | |
| Специальность | Пластическая хирургия |
Грудной имплантат — это протез, человека используемый для изменения размера, формы и контура груди . В реконструктивно- пластической хирургии грудные имплантаты могут быть установлены для восстановления естественного вида груди после мастэктомии , для исправления врожденных дефектов и деформаций грудной стенки или, с косметической точки зрения, для увеличения внешнего вида груди посредством операции по увеличению груди .
Осложнения установки имплантатов могут включать боль в груди , сыпь, изменения кожи, инфекцию, разрыв, косметические изменения груди, такие как асимметрия и твердость, а также скопление жидкости вокруг груди. [1]
Редким осложнением, связанным с имплантатами с текстурированной поверхностью и имплантатами, покрытыми пеной из полиуретана, является тип лимфомы (рак иммунной системы), известный как анапластическая крупноклеточная лимфома, связанная с грудным имплантатом (BIA-ALCL). [2]
Существует четыре основных типа грудных имплантатов в зависимости от материала наполнителя: физиологический раствор, силиконовый гель, структурированный и композитный наполнитель. Солевой имплантат имеет эластомерную силиконовую оболочку, заполняемую стерильным физиологическим раствором во время операции ; силиконовый имплантат имеет эластомерную силиконовую оболочку, предварительно заполненную вязким силиконовым гелем; в структурированных имплантатах используются вложенные друг в друга эластомерные силиконовые оболочки и два просвета, заполненных физиологическим раствором; а имплантаты альтернативного состава содержали различные наполнители, такие как гидрогель, соевое масло или полипропиленовая нить . [ нужна ссылка ]
В хирургической практике при реконструкции груди устройство расширителя тканей представляет собой временный протез молочной железы, используемый для формирования и установки кармана для будущего постоянного грудного имплантата. Для коррекции дефектов и деформаций молочной железы у мужчин грудной имплантат представляет собой протез груди, используемый для реконструкции и эстетического восстановления грудной стенки мужчины (см.: Гинекомастия и мастопексия ). [ нужна ссылка ]
Использование
[ редактировать ]
Процедура маммопластики для установки грудных имплантатов преследует три цели:
- первичная реконструкция: замена тканей молочной железы, поврежденных травмой ( тупая , проникающая , взрывная ), заболеванием ( рак молочной железы ) и нарушением анатомического развития ( туберозная деформация груди ).
- ревизия и реконструкция: для пересмотра (исправления) результата предыдущей операции по реконструкции груди.
- Первичное увеличение: эстетическое увеличение размера, формы и ощущения груди.
Время в операционной после мастэктомии при реконструкции груди и операции по увеличению груди определяется применяемой процедурой, типом разрезов, грудным имплантатом (тип и материалы) и грудным расположением кармана имплантата.
Недавние исследования показали, что маммографию не следует проводить с большей частотой, чем при обычной процедуре, у пациентов, перенесших операцию на груди, включая установку грудных имплантатов, увеличение груди, мастопексию и уменьшение груди. [3]
Психология
[ редактировать ]Пациенткой по увеличению груди обычно является молодая женщина, профиль личности которой указывает на психологическое беспокойство по поводу ее внешности и телесного образа себя , а также историю того, как она подвергалась критике (поддразниваниям) по поводу эстетики ее личности. [4] Исследования «Проблемы образа тела у пациентов, сделавших операцию по увеличению груди» (2003 г.) [ нужна полная цитата ] и дисморфическое расстройство тела и косметическая хирургия (2006) [ нужна полная цитата ] сообщили, что женщина, перенесшая операцию по увеличению груди, также проходила психотерапию , страдала от низкой самооценки , часто страдала психологической депрессией , пыталась покончить жизнь самоубийством и страдала дисморфией тела , типом психического заболевания.
Послеоперационные опросы пациентов о психическом здоровье и качестве жизни показали улучшение физического здоровья, внешнего вида, социальной жизни, уверенности в себе, самооценки и удовлетворительного сексуального функционирования . Кроме того, женщины сообщили о долгосрочном удовлетворении результатами имплантации груди; некоторые, несмотря на наличие медицинских осложнений, потребовавших хирургического вмешательства, корректирующего или эстетического. Аналогичным образом, в Дании 8% пациентов по увеличению груди перед операцией были госпитализированы в психиатрическую больницу. [5] [6] [7] [8] [9] [10] [11] [12] [13] [14]
В 2008 году продольное исследование « Избыточная смертность от самоубийств и других внешних причин смерти среди женщин с косметическими имплантатами груди» (2007) показало, что женщины, которые хотели установить грудные имплантаты, почти в 3 раза чаще совершают самоубийство, чем женщины, которые не стремились к груди. имплантаты. По сравнению со стандартным уровнем самоубийств среди женщин среди населения в целом, уровень самоубийств среди женщин с увеличенной грудью оставался постоянным до 10 лет после имплантации, однако через 11 лет он увеличился в 4,5 раза, и, таким образом, сохранялся до 19-летнего возраста, а затем увеличился в 6 раз через 20 лет после имплантации. Более того, помимо риска самоубийства, женщины с грудными имплантатами также сталкиваются с утроенным риском смерти от алкоголизма и злоупотребления рецептурными и легкими наркотиками. [15] [16] Хотя семь исследований статистически связали увеличение груди у женщин с более высоким уровнем самоубийств, исследование показывает, что операция по увеличению груди не увеличивает уровень смертности; и что, в первую очередь, именно женщины, склонные к психопатологии , с большей вероятностью подвергнутся процедуре увеличения груди . [17] [18] [19] [20] [21] [22]
В исследовании «Влияние маммопластики по увеличению груди на самооценку и сексуальность: количественный анализ» (2007) сообщалось, что женщины объяснили улучшение своей самооценки , самооценки и повышенное удовлетворительное сексуальное функционирование перенесшими операцию по увеличению груди; В когорте в возрасте 21–57 лет среднее послеоперационное повышение самооценки варьировалось от 20,7 до 24,9 баллов по 30-балльной шкале самооценки Розенберга женщины на 78,6% , данные которого подтверждают увеличение либидо по сравнению с ее предоперационный уровень либидо. [23] женщины Поэтому, прежде чем согласиться на какую-либо операцию, пластический хирург оценивает и учитывает психическое здоровье , чтобы определить, могут ли грудные имплантаты положительно повлиять на ее самооценку и сексуальное функционирование .
Осложнения
[ редактировать ]Пластическая хирургическая установка грудных имплантатов, как для реконструкции груди , так и для эстетических целей , представляет те же риски для здоровья, что и хирургическое вмешательство , такие как неблагоприятная реакция на анестезию , гематома (послеоперационное кровотечение), поздняя гематома (послеоперационное кровотечение после операции). 6 месяцев и более), [24] серома (скопление жидкости), разрушение места разреза (раневая инфекция). Осложнения, характерные для увеличения груди, включают боль в груди, изменение чувствительности, нарушение функции грудного вскармливания, видимые морщины, асимметрию, истончение ткани молочной железы и симмастию , «хлебное выпадение» бюста, которое нарушает естественную плоскость между грудями. Специфические методы лечения осложнений, связанных с постоянными грудными имплантатами — капсулярной контрактуры и разрыва капсулы — включают периодический МРТ- мониторинг и физические осмотры. Кроме того, осложнения и повторные операции, связанные с операцией по имплантации и расширителями тканей (заполнителями имплантатов во время операции), могут вызвать неблагоприятное рубцевание примерно у 6–7 процентов пациентов. [25] [26] [27] По статистике , 20 процентам женщин, перенесших косметическую имплантацию, и 50 процентам женщин, перенесших имплантацию реконструкции груди, потребовалась их эксплантация (хирургическое удаление) через 10 лет. [28]
Безопасность
[ редактировать ]В 1990-х годах в нескольких отчетах были рассмотрены несколько исследований, оценивающих повышенный риск системных и аутоиммунных заболеваний среди женщин с грудными имплантатами. На тот момент был сделан вывод, что нет никаких доказательств, устанавливающих причинно-следственную связь между имплантацией силиконовых грудных имплантатов и любым типом заболевания. [29] [30] Однако в отчете Института медицины отмечается, что в этих более ранних исследованиях участвовало слишком мало женщин, чтобы окончательно оценить влияние на эти редкие заболевания. [29] Кроме того, во многие исследования включались женщины, у которых грудные имплантаты были установлены всего несколько месяцев, что было бы слишком рано для развития диагностированного аутоиммунного заболевания. В последние годы крупные эпидемиологические исследования сообщили о клинически и статистически значимом росте некоторых из этих заболеваний. В исследовании Ватада и его коллег, опубликованном в 2018 году, сравнивались и изучались медицинские записи более чем 24 000 женщин с грудными имплантатами и более чем 98 000 «соответствующих контрольных групп», у которых не было грудных имплантатов, но которые имели очень схожие демографические характеристики. [31] Исследование выявило статистически значимое общее увеличение числа диагностированных аутоиммунных или ревматических заболеваний на 22%. Наибольшее увеличение числа диагнозов у женщин с грудными имплантатами наблюдалось при синдроме Шегрена , рассеянном склерозе (РС) и саркоидозе, каждый из которых был на 58–98% выше у женщин с грудными имплантатами. Этот анализ был основан на израильских женщинах с грудными имплантатами, что подтверждено медицинскими записями, а анализ заболеваний был основан на диагнозах, поставленных после того, как женщинам были установлены грудные имплантаты, которые были включены в медицинские записи в течение 20 лет наблюдения. [31]
Опубликованное исследование женщин США с аналогичными результатами было опубликовано в 2019 году Коронеосом и его коллегами из Медицинского центра доктора медицины Андерсона. [32] Данные были основаны на двух исследованиях, в которых в общей сложности приняли участие почти 100 000 женщин с грудными имплантатами, но многие из них выбыли из исследования в течение нескольких лет после операции по установке грудных имплантатов. Тем не менее, среди женщин, участвовавших в исследовании в течение как минимум двух лет, исследователи сообщили о 800-процентном увеличении заболеваемости синдромом Шегрена, 700-процентном увеличении заболеваемости склеродермией и почти 600-процентном увеличении заболеваемости ревматоидным артритом среди женщин с грудными имплантатами по сравнению с общей популяцией женщины того же возраста и демографии.
Недавнее исследование женщин, которые сообщили об аутоиммунных и других системных симптомах, но у которых не было диагностировано аутоиммунное заболевание, оценивало, изменились ли симптомы у женщин после удаления имплантатов. Исследование эффективности операции по эксплантации у женщин с заболеванием грудных имплантатов, проведенное в 2020 году, показало, что почти все из 750 женщин, перенесших операцию по эксплантации, сообщили о значительном улучшении своего здоровья в течение месяца после операции. Исследователи сосредоточили внимание на следующих симптомах: выпадение волос, потеря памяти, сухость глаз и/или помутнение зрения, онемение или покалывание в конечностях, хроническая усталость, боль в суставах, сыпь, боль в груди, непереносимость пищи, гриппоподобные симптомы и затрудненное дыхание. . Те же авторы также опубликовали исследование о влиянии удаления грудного имплантата на затрудненное дыхание и обнаружили статистически значимое улучшение общепризнанных объективных показателей функции легких после операции по эксплантации. [33]
| Год | Страна | Группа системного обзора | Выводы |
|---|---|---|---|
| 1991–93 | Великобритания | Независимая экспертная консультативная группа (IEAG) | Не было обнаружено никаких доказательств повышенного риска заболеваний соединительной ткани у пациентов, перенесших установку грудных имплантатов из силиконового геля, и не было причин для изменения практики или политики грудных имплантатов в Великобритании. |
| 1996 | Соединенные Штаты | Институт медицины США (МОМ) [34] | Не было «достаточно доказательств связи использования грудных имплантатов, наполненных силиконовым гелем или физиологическим раствором, с определенным заболеванием соединительной ткани». |
| 1996 | Франция | Национальное агентство медицинского развития и оценки (ANDEM) [35] | Французский оригинал: «Мы не наблюдали связи или другой аутоиммунной патологии, которая могла бы быть прямо или косвенно вызвана наличием грудного имплантата, в частности, изготовленного из силиконового геля...». Английский перевод: «Мы не наблюдали, чтобы заболевания соединительной ткани были прямо или косвенно связаны с наличием грудного имплантата, в частности силиконового геля...». |
| 1997 | Австралия | Комитет по оценке терапевтических устройств (TDEC) | «Современная высококачественная литература предполагает, что нет никакой связи между грудными имплантатами и синдромами, подобными заболеваниям соединительной ткани (атипичными заболеваниями соединительной ткани)». [36] |
| 1998 | Германия | Федеральный институт медицины и медицинских изделий | Сообщается, что «силиконовые грудные имплантаты не вызывают аутоиммунных заболеваний или ревматических заболеваний и не оказывают вредного воздействия на беременность, способность к грудному вскармливанию или здоровье детей, находящихся на грудном вскармливании. Никаких научных доказательств существования аллергии на силикон не существует». , отравление силиконом, атипичные силиконовые заболевания или новая силиконовая болезнь». [37] |
| 2000 | Соединенные Штаты | Проверка по решению федерального суда [38] | «Нет доказательств связи между… грудными имплантатами, наполненными силиконовым гелем, и любым из отдельных ЗСТ, всеми определенными ЗСТ в совокупности или другими аутоиммунными или ревматическими заболеваниями». |
| 2000 | Евросоюз | Европейский комитет по обеспечению качества и медицинскому оборудованию в пластической хирургии (EQUAM) | «Дополнительные медицинские исследования не продемонстрировали какой-либо связи между грудными имплантатами, наполненными силиконовым гелем, и традиционными аутоиммунными заболеваниями или заболеваниями соединительной ткани, раком или какими-либо другими злокачественными заболеваниями... EQUAM продолжает полагать, что не существует научных доказательств того, что аллергия на силикон , силиконовая интоксикация, атипичная болезнь или «новая силиконовая болезнь». [39] |
| 2001 | Великобритания | Независимая обзорная группа Великобритании (UK-IRG) | «Нет никаких доказательств связи с аномальным иммунным ответом или типичными или атипичными заболеваниями или синдромами соединительной ткани». [40] |
| 2001 | Соединенные Штаты | Назначенная судом проверка Национальной научной комиссии [41] | Комиссия оценила установленные и недифференцированные заболевания соединительной ткани (ЗСТ) и пришла к выводу, что между грудными имплантатами и этими ЗСТ нет причинно-следственной связи. |
| 2003 | Испания | Оценка возможностей науки и технологий (STOA) | В отчете STOA Комитету по петициям Европейского парламента сообщается, что имеющиеся научные данные не содержат убедительных причинно-следственных доказательств, связывающих SBI [силиконовые грудные имплантаты] с тяжелыми заболеваниями, например, раком молочной железы и заболеваниями соединительной ткани. [42] |
| 2009 | Евросоюз | Группа Международного комитета по обеспечению качества, медицинским технологиям и устройствам в пластической хирургии (IQUAM) | В консенсусном заявлении конференции Transatlantic Innovations (апрель 2009 г.) указано, что дополнительные медицинские исследования не выявили связи между грудными имплантатами, наполненными силиконовым гелем, и карциномой или какими-либо метаболическими, иммунными или аллергическими расстройствами. [43] |
Разрыв имплантата
[ редактировать ]
Поскольку грудной имплантат представляет собой медицинское изделие класса III с ограниченным сроком службы, основными факторами риска разрушения являются его возраст и конструкция; тем не менее, устройство грудного имплантата может сохранять свою механическую целостность в организме женщины на протяжении десятилетий. [44] Когда грудной имплантат с физиологическим раствором разрывается, протекает и опорожняется, он быстро сдувается и, таким образом, может быть легко эксплантирован (удален хирургическим путем). В некоторых случаях разрыв имплантата с солевым раствором может привести к инфекции, вызванной бактериями или плесенью, находившимися внутри имплантата, хотя это случается редко. [45] В последующем отчете « Грудные имплантаты, наполненные физиологическим раствором Natrelle: проспективное 10-летнее исследование» (2009 г.) указано, что уровень разрыва-дефляции составляет 3–5 процентов через 3 года после имплантации и 7–10 процентов разрыва-дефляции. показатели через 10 лет после имплантации. [46] В исследовании 4761 пациентки, перенесшей аугментационную маммопластику, Айзенберг сообщил, что переполнение грудных имплантатов солевым раствором на 10-13% значительно снижает частоту разрыва-дефляции до 1,83% через 8 лет после имплантации. [47]

Когда силиконовый грудной имплантат разрывается, он обычно не сдувается, однако из него вытекает гель-наполнитель, который может мигрировать в карман имплантата; следовательно, внутрикапсулярный разрыв (утечка внутри капсулы) может стать экстракапсулярным разрывом (утечка вне капсулы), и каждый случай разрешается путем эксплантации. Хотя вытекший силиконовый гель-наполнитель может мигрировать из тканей грудной клетки в другие части тела женщины, большинство клинических осложнений ограничивается областями груди и подмышек , обычно проявляясь в виде гранулем (воспалительных узелков) и подмышечной лимфаденопатии (увеличения лимфатических узлов в подмышках). область). [48] [49] [50]
Предполагаемые механизмы разрыва грудного имплантата:
- повреждение во время имплантации
- повреждение во время (других) хирургических процедур
- химическое разрушение оболочки грудного имплантата
- травмы ( тупая травма , проникающая травма , взрывная травма )
- механическое давление при традиционном маммографическом исследовании груди [51]
Разрыв силиконового имплантата можно оценить с помощью магнитно-резонансной томографии; Судя по долгосрочным данным МРТ однопросветных грудных имплантатов, в европейской литературе о грудных имплантатах из силиконового геля второго поколения (дизайн 1970-х годов) сообщается о частоте разрывов бесшумных устройств в 8–15 процентов через 10 лет после имплантации ( 15–30% больных). [52] [53] [54] [55]
В исследовании «Безопасность и эффективность имплантатов Mentor’s MemoryGel в течение 6 лет» (2009 г.), которое представляло собой ответвление основных клинических испытаний FDA США на пациентах, перенесших первичную операцию по увеличению груди , сообщалось о низкой частоте разрывов устройств — 1,1 процента через 6 лет после операции. -имплантация. [56] Первая серия МРТ- оценок силиконовых грудных имплантатов с густым гелем-наполнителем показала, что частота разрывов устройства составляет 1 процент или менее при среднем 6-летнем возрасте устройства. [57] По статистике, мануальный осмотр (пальпация) женщины недостаточен для точной оценки разрыва грудного имплантата. В исследовании « Диагностика разрыва силиконового грудного имплантата: клинические данные по сравнению с результатами магнитно-резонансной томографии» (2005 г.) сообщается, что у бессимптомных пациентов только 30 процентов разорванных грудных имплантатов точно пальпируются и обнаруживаются опытным пластическим хирургом. , тогда как МРТ-исследования точно выявили 86 процентов разрывов грудных имплантатов. [58] Поэтому FDA США рекомендовало проводить плановые МРТ-обследования в качестве скрининга «тихого разрыва», начиная с 3-летнего периода после имплантации, а затем каждые два года. [25] Тем не менее, за пределами США, медицинские учреждения других стран не одобрили рутинный МРТ-скрининг и вместо него предложили, чтобы такое радиологическое обследование было предназначено для двух целей: (i) для женщин с подозрением на разрыв грудного имплантата; и (ii) для подтверждения маммографических и ультразвуковых исследований, которые указывают на наличие разорвавшегося грудного имплантата. [59]
Кроме того, в исследовании «Влияние ошибок в дизайне исследования на диагностическую точность магнитно-резонансной томографии для обнаружения разрывов силиконовых грудных имплантатов: метаанализ» (2011) сообщается, что скрининговые МРТ молочных желез у бессимптомных женщин могут переоценивать частоту разрывов грудных имплантатов. [60] При этом Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США подчеркнуло, что «грудные имплантаты не являются устройством на всю жизнь. Чем дольше женщина носит грудные имплантаты, наполненные силиконовым гелем, тем больше вероятность, что у нее возникнут осложнения». [61]
Капсульная контрактура
[ редактировать ]организма человека Иммунный ответ на хирургически установленный инородный предмет — грудной имплантат, кардиостимулятор , ортопедический протез — заключается в инкапсуляции его капсулами рубцовой ткани из плотно сплетенных коллагеновых волокон, чтобы сохранить целостность организма путем изоляции инородного объекта, и поэтому терпим его присутствие. Капсулярная контрактура , которую следует отличать от нормальной капсульной ткани, возникает, когда капсула из коллагеновых волокон утолщается и сжимает грудной имплантат; это болезненное осложнение , которое может привести к деформации либо грудного имплантата, либо груди, либо того и другого. Капсулярную контрактуру диагностируют при визуальном и физикальном осмотре в зависимости от возрастающей степени тяжести по шкале Бейкера: I степень по Бейкеру, II степень по Бейкеру, III степень по Бейкеру и IV степень по Бейкеру.

Причина капсулярной контрактуры неизвестна, но к частым факторам возникновения относятся бактериальная контаминация, разрыв оболочки устройства, утечка наполнителя и гематома . Процедуры хирургической имплантации, которые снизили частоту капсулярной контрактуры, включают подмышечную установку, использование грудных имплантатов с текстурированной поверхностью (с полиуретановым покрытием); [62] [63] [64] ограниченное предоперационное обращение с имплантатами, ограниченный контакт с кожей грудной клетки кармана имплантата перед установкой грудного имплантата и орошение реципиентного участка растворами тройного антибиотика. [65] [66]
Коррекция капсулярной контрактуры может потребовать открытой капсулотомии (хирургического освобождения) капсулы из коллагеновых волокон или удаления и, возможно, замены грудного имплантата. Кроме того, при лечении капсулярной контрактуры закрытая капсулотомия (разрушение посредством внешних манипуляций) когда-то была обычным методом лечения твердой капсулы, но в настоящее время является нежелательным методом, поскольку она может привести к разрыву грудного имплантата. Нехирургические методы лечения капсул из коллагеновых волокон включают массаж, внешнюю ультразвуковую терапию, ингибиторы лейкотриеновых путей, такие как зафирлукаст (Аколат) или монтелукаст (Сингуляр), а также терапию импульсным электромагнитным полем (PEMFT). [67] [68] [69] [70]
Ремонтные и ревизионные операции
[ редактировать ]Когда пациентка недовольна результатом аугментационной маммопластики; или когда возникают технические или медицинские осложнения; или из-за ограниченного срока службы грудных имплантатов, вероятно, ей может потребоваться замена грудных имплантатов. Общие показания к ревизионной хирургии включают серьезные и незначительные медицинские осложнения, капсулярную контрактуру , разрыв оболочки и дефляцию устройства. [51] Частота ревизий была выше у пациентов с реконструкцией груди из-за постмастэктомических изменений мягких тканей и кожной оболочки груди, а также анатомических границ груди, особенно у женщин, получавших адъювантную внешнюю лучевую терапию . [51] Кроме того, помимо реконструкции груди, пациентки с раком молочной железы обычно подвергаются ревизионной хирургии сосково-ареолярного комплекса (NAC) и процедурам симметрии на противоположной груди, чтобы создать бюст естественного вида, размера, формы и ощущения. Тщательное соответствие типа и размера грудных имплантатов характеристикам мягких тканей грудной клетки пациента снижает частоту повторных операций. При соответствующем подборе тканей, выборе имплантата и правильной технике имплантации частота повторных операций составила 3 процента через 7 лет по сравнению с частотой повторных операций в 20 процентов через 3 года, как сообщает Управление по контролю за продуктами и лекарствами США. [71] [72]
Системное заболевание
[ редактировать ]
В 1990-х годах национальные министерства здравоохранения перечисленных стран рассмотрели соответствующие исследования причинно-следственных связей между грудными имплантатами из силиконового геля и системными и диагностированными аутоиммунными заболеваниями и раком молочной железы. [73] [38] [74] Исследование, проведенное исследователями из Национального института здравоохранения США, сообщило о росте заболеваемости четырьмя типами рака среди женщин с грудными имплантатами по сравнению с другими пациентами пластической хирургии того же возраста и схожими демографическими особенностями и привычками в отношении здоровья. [17] Этот рост заболеваемости раком был смягчен, но не исчез, когда исследователи наблюдали за женщинами в течение еще 5 лет, с увеличением заболеваемости раком головного мозга на 43% и раком органов дыхания на 63% по сравнению с другими пациентами, перенесшими пластическую операцию. [75] Исследование Watad et al. оценили медицинские записи более чем 24 000 женщин с грудными имплантатами по сравнению с более чем 98 000 женщинами с такими же демографическими характеристиками, у которых не было грудных имплантатов. Исследователи обнаружили статистически значимое 22-процентное увеличение числа диагностированных заболеваний, а для синдрома Шегрена , рассеянного склероза и саркоидоза этот показатель увеличился более чем на 60%. [31] Изучив эту проблему, в 2021 году FDA США пересмотрело свои «предупреждения о черном ящике» в отношении грудных имплантатов, чтобы признать связь между грудными имплантатами и системными аутоиммунными, ревматологическими и неврологическими симптомами, заявив: «Пациенты, получающие грудные имплантаты, сообщали о различных системных заболеваниях. такие симптомы, как боль в суставах, мышечные боли, спутанность сознания, хроническая усталость, аутоиммунные заболевания и другие. Индивидуальный риск развития этих симптомов у пациентов не установлен. Некоторые пациенты сообщают о полном исчезновении симптомов при удалении имплантатов без замены». [76]
В исследовании 2021 года, проведенном врачами клиники Кливленда, изучались последствия удаления грудных имплантатов у женщин с грудными имплантатами, которые сообщали о затрудненном дыхании или стеснении в груди; это один из симптомов, связанных с заболеванием грудного имплантата . [33] В ходе исследования были обследованы пациентки с грудными имплантатами, сообщившие о проблемах с дыханием, и сравнивались их оценки по 6 тестам функции легких до и после удаления имплантатов и рубцовых капсул. Исследователи сообщили, что 74% пациентов сообщили о значительных улучшениях как минимум по 3 тестам функции легких. В самоотчетах все участники исследования сообщили, что их дыхание улучшилось после операции по имплантации.
Платиновая токсичность
[ редактировать ]Платина является катализатором, используемым при изготовлении полимерных оболочек силиконовых имплантатов и других силиконовых устройств, используемых в медицине. В литературе указано, что небольшое количество платины вымывается (утекает) из этих имплантатов и присутствует в окружающих тканях. FDA проанализировало доступные исследования из медицинской литературы по платине и грудным имплантатам в 2002 году и пришло к выводу, что существует мало доказательств токсичности платины у пациентов с имплантатами. [77] Несколько лет спустя FDA пересмотрело это исследование и дополнительную литературу, подтвердив предыдущие выводы о том, что платиновые катализаторы, используемые в имплантатах, вероятно, не ионизируются и, следовательно, не представляют риска для женщин. [78]
Анапластическая крупноклеточная лимфома
[ редактировать ]FDA установило, что грудные имплантаты могут быть связаны с редкой формой рака, называемой анапластической крупноклеточной лимфомой (АККЛ), которая, по мнению некоторых экспертов, связана с хроническим бактериальным воспалением. [79] Подобные явления ALCL наблюдались и при использовании других типов медицинских имплантатов, включая порты сосудистого доступа, ортопедические имплантаты бедра и имплантаты челюсти (ВНЧС). Причинно-следственная связь между грудными имплантатами и ALCL была окончательно установлена в декабре 2013 года, когда исследователи из Онкологического центра доктора медицины Андерсона опубликовали исследование 60 женщин с грудными имплантатами, у которых был диагностирован ALCL в груди. В 2015 году пластические хирурги опубликовали статью с обзором 37 статей в литературе о 79 пациентах и собрали еще 94 незарегистрированных случая, в результате чего у 173 женщин с грудными имплантатами развилась ALCL груди. Они пришли к выводу, что «АЛКЛ, связанная с грудным имплантатом, представляет собой новое проявление лимфомы, специфичной для конкретного участка и материала, возникающей в определенном месте рубца, представляющей широкий спектр разнообразных характеристик и предполагающей многофакторную причину». Они заявили, что «не было предпочтения физиологическому раствору или силиконовому наполнению, а также косметическим или реконструктивным показаниям». Если история имплантации была известна, пациент получил по крайней мере одно устройство с текстурированной поверхностью. В 2016 году Всемирная организация здравоохранения (ВОЗ) официально признала BIA-ALCL. [80]
По состоянию на апрель 2022 года FDA получило 1130 глобальных отчетов о медицинских устройствах (MDR) BIA-ALCL, включая 59 случаев смерти. [81] Поскольку считалось, что АККЛ диагностируется только у 1 женщины из полумиллиона, 60 женщин — это гораздо большее число, чем можно было ожидать. Исследователи отметили, что BIA-ALCL может быть фатальным. [82] цитологические исследования и тест на маркер CD30 Если у женщин с имплантатами наблюдается отсроченный отек или скопление жидкости, рекомендуется провести . Американское общество пластической хирургии (ASPS) заявляет: «CD30 является основным диагностическим тестом, который необходимо проводить на жидкости серомы, поскольку рутинная патология или окрашивание H&E часто могут пропустить диагноз». [83] Диагностика и лечение АККЛ, связанной с грудными имплантатами, теперь соответствуют стандартным рекомендациям, установленным Национальной комплексной онкологической сетью. [84]
текущий пожизненный риск BIA-ALCL в США неизвестен, но оценки варьируются от одной на 70 000 до одной на 500 000 женщин с грудными имплантатами По данным Онкологического центра доктора медицинских наук Андерсона, . [85] Страны с реестрами грудных имплантатов имеют лучшие данные о рисках BIA-ALCL. Например, по состоянию на октябрь 2020 года Управление терапевтических товаров Австралии и Новой Зеландии сообщило о «риске 1:3345 для Allergan Biocell и риске 1:86029 для Mentor Siltex». [83] AВ США оценки риска BIA-ALCL в текстурированных имплантатах колеблются от 1,79 на 1000 (1 женщина с BIA-ALCL на 559 имплантатов) до 2,82 на 1000 (1 женщина на 355 имплантатов) [2]. По состоянию на апрель 2022 года FDA сообщило о 1130 отчетах о медицинских устройствах (MDR) BIA-ALCL. Из этих МЛУ 59 женщин умерли. FDA заявляет, что 798 из 1130 MDR по BIA-ALCL включали текстурированные грудные имплантаты, 37 MDR включали имплантаты с гладкой поверхностью, а в 295 MDR не указывалось, были ли имплантаты текстурированными или гладкими. [81] В некоторых случаях женщины, у которых развился BIA-ALCL после гладких грудных имплантатов, до установки имплантатов имели текстурированные расширители. У большинства пациентов BIA-ALCL поражала только одну грудь, и только у 8 пациентов был диагностирован двусторонний BIA-ALCL. По данным FDA, наиболее частым симптомом BIA-ALCL была серома, за которой следовали отек и боль в груди, капсулярная контрактура и образование или уплотнение вокруг имплантата. Более того, 84 процента зарегистрированных имплантатов были изготовлены компанией Allergan, крупнейшим производителем грудных имплантатов на тот момент. [81]
Исследование, проведенное в онкологическом центре Memorial Sloan Kettering среди женщин, перенесших профилактическую мастэктомию, показало, что у 1 из 355 женщин впоследствии был диагностирован BIA-ALCL. [86] Почти у всех этих женщин были биоклеточные имплантаты и экспандеры Allergan. Эти сообщения убедительно свидетельствуют о том, что BIA-ALCL развивается преимущественно у пациентов с текстурированными имплантатами или экспандерами. Однако во всех случаях многие исследователи подозревают, что BIA-ALCL является недостаточно распознаваемым, неправильно диагностируемым и недостаточно сообщаемым осложнением грудных имплантатов.
ASPS и Фонд пластической хирургии (PSF) сотрудничали с FDA для изучения этого состояния и при этом создали Реестр пациентов и результаты лечения грудных имплантатов и этиологии и эпидемиологии анапластической крупноклеточной лимфомы (ПРОФИЛЬ). FDA США настоятельно рекомендует всем врачам сообщать о случаях в PROFILE, чтобы лучше понять роль грудных имплантатов при ALCL и ведении этого заболевания. [87]
Другие лимфомы и плоскоклеточный рак
[ редактировать ]В сентябре 2022 года FDA объявило новую информацию о других типах рака, связанных с грудными имплантатами, на основе отчетов о медицинских устройствах (MDR) о случаях пациентов с плоскоклеточным раком или различными лимфомами, обнаруженными в рубцовой ткани вокруг грудных имплантатов. Агентство сообщило о 10 случаях MDR, связанных с плоскоклеточным раком, обнаруженным в рубцовой ткани капсулы, и о 12 MDR, связанных с различными лимфомами, также в рубцовой ткани вокруг грудных имплантатов. Эти новые случаи не совпадают со случаями BIA-ALCL. SCC и другие лимфомы были обнаружены в имплантатах с гладкой и текстурированной поверхностью, а также в имплантатах, наполненных силиконовым гелем и физиологическим раствором. Пациенты, сообщившие о симптомах, указывали на отек, боль, шишки и изменения на коже. По состоянию на 2022 год ни уровень заболеваемости, ни распространенность неизвестны. [88]
Хирургические процедуры
[ редактировать ]Типы разрезов
[ редактировать ]Установка грудного имплантата осуществляется с помощью пяти типов хирургических разрезов:
- Инфрамаммарный разрез: разрез инфрамаммарной складки (естественной складки под грудью), который обеспечивает максимальный доступ для точного рассечения тканей и установки грудных имплантатов. Это предпочтительный хирургический метод установки силиконово-гелевых имплантатов, поскольку он лучше обнажает границу между тканью молочной железы и грудной мышцей ; тем не менее, имплантация IMF может привести к образованию более толстых и немного более заметных хирургических шрамов .
- Периареолярный: пограничный разрез по периферии ареолы , который обеспечивает оптимальный доступ, когда требуется корректировка положения IMF или когда мастопексия (подтяжка груди) включена в процедуру первичной маммопластики . При периареолярном размещении разрез делается вокруг медиальной половины (нижней половины) окружности ареолы. Имплантаты из силиконового геля может быть сложно установить через периареолярный разрез из-за короткого пятисантиметрового разреза (около 5,0 см) необходимого разреза. С эстетической точки зрения, поскольку шрамы находятся на границе ареолы (периферии), они обычно менее заметны, чем шрамы от разреза IMF у женщин со светлопигментированными ареолами; по сравнению с рубцами от разрезов кожи модифицированный эпителий ареол менее склонен к (приподнятым) гипертрофическим рубцам.
- Трансаксиллярный: разрез, сделанный в подмышечной впадине (подмышке), от которого диссекционный туннель проходит медиально, для установки имплантатов тупо или с помощью эндоскопа (видеомикрокамеры с подсветкой), без образования видимых шрамов на самой груди; тем не менее, это, скорее всего, приведет к нижней асимметрии положения имплантата-устройства. Таким образом, хирургическая ревизия трансаксиллярных грудных имплантатов обычно требует либо разреза IMF, либо периареолярного разреза.
- Трансумбиликально: транспупочное увеличение груди ( ТУБА ) — менее распространенный метод установки имплантата, при котором разрез делается на уровне пупка ( пупка ), а туннели для рассечения выходят вверх, к бюсту. Подход TUBA позволяет установить грудные имплантаты, не оставляя видимых шрамов на самой груди; но делает соответствующее рассечение и установку устройств более технически сложными. Процедура ТУБА выполняется тупо – без визуальной помощи эндоскопа – и не подходит для установки (предварительно заполненных) силиконовых гелевых имплантатов из-за большой вероятности повреждения эластомерной силиконовой оболочки грудного имплантата во время его ручного введения через отверстие. короткий (~ 2,0 см) разрез на пупке, а также потому, что предварительно заполненные силиконовые гелевые имплантаты несжимаемы и не могут быть вставлены через такой маленький разрез. [89]
- Трансабдоминально: как и в процедуре TUBA, при трансабдоминопластике увеличения груди (TABA) грудные имплантаты туннелируются сверху от разреза на брюшной полости в тупо рассеченные карманы для имплантатов, в то время как пациентка одновременно подвергается абдоминопластике . [90]
Размещение имплантационного кармана
[ редактировать ]Пять хирургических подходов к установке грудного имплантата в карман имплантата часто описываются в анатомическом отношении к большой грудной мышце .
- Субжелезистый: грудной имплантат устанавливается в ретромаммарное пространство , между тканью молочной железы (молочной железой) и большой грудной мышцей (большой мышцей груди), что максимально приближается к плоскости нормальной ткани молочной железы и дает наиболее эстетические результаты. . Тем не менее, у женщин с тонкими мягкими тканями грудной клетки в субжелезистом положении с большей вероятностью будут видны рябь и морщины подлежащего имплантата. Более того, частота возникновения капсулярной контрактуры несколько выше при субжелезистой имплантации.
- Субфасциальный: грудной имплантат устанавливается под фасцию мышцы большой грудной ; субфасциальная позиция является вариантом субжелезистой позиции грудного имплантата. [91] Обсуждаются технические преимущества субфасциальной техники имплантации-кармана; Сторонники хирургии сообщают, что слой фасциальной ткани обеспечивает большее покрытие имплантата и лучше сохраняет свое положение. [92]
- Субпекторально (двойная плоскость): грудной имплантат устанавливается под большую грудную мышцу после того, как хирург освобождает нижние мышечные крепления, с частичным рассечением поджелезистой плоскости или без него. В результате верхний полюс имплантата частично находится под большой грудной мышцей, а нижний полюс имплантата находится в субжелезистой плоскости. Эта техника имплантации обеспечивает максимальное покрытие верхнего полюса имплантата, в то же время позволяя расширить нижний полюс имплантата; однако «анимационная деформация», движение имплантатов в субпекторальной плоскости может быть у некоторых пациентов чрезмерным. [93]
- Субмускулярно: грудной имплантат устанавливается под большую грудную мышцу , не освобождая нижнее начало самой мышцы. Полного мышечного охвата имплантата можно добиться, высвободив латеральные мышцы грудной стенки — либо зубчатую мышцу , либо малую грудную мышцу , либо обе — и пришив их или их к большой грудной мышце. В операциях по реконструкции груди подход подмышечной имплантации обеспечивает максимальное покрытие грудных имплантатов. Этот метод редко используется в косметической хирургии из-за высокого риска анимационных деформаций.
- Препекторальный или подкожный: при реконструкции груди после мастэктомии с сохранением кожи или кожи и сосков имплантат размещается над большой грудной мышцей, не рассекая ее, так что имплантат непосредственно заполняет объем удаленной молочной железы. . Чтобы избежать капсулярной контрактуры, имплантат часто покрывают спереди или полностью сеткой из биоматериала , биологического или синтетического.
Послеоперационное восстановление
[ редактировать ]рубцы Хирургические после маммопластики по увеличению груди развиваются примерно через 6 недель после операции и исчезают в течение нескольких месяцев. В зависимости от физической активности, необходимой женщине в повседневной жизни, пациентка, проводящая операцию по увеличению груди, обычно возобновляет свою нормальную жизнь через 1 неделю после операции. Более того, у женщин, чьи грудные имплантаты были установлены под грудными мышцами (подмышечное размещение), обычно наблюдается более длительное и немного более болезненное выздоровление из-за заживления разрезов на грудных мышцах. Обычно она не занимается спортом и не занимается тяжелой физической деятельностью в течение примерно 6 недель. Во время первоначального послеоперационного восстановления женщине рекомендуется регулярно тренировать (сгибать и двигать) руку, чтобы облегчить боль и дискомфорт; при необходимости постоянные обезболивающие катетеры могут облегчить боль. [94] [95] Более того, значительное улучшение выздоровления пациентов стало результатом усовершенствованных методов имплантации грудных устройств (подмышечных, поджелезистых), которые позволяют 95 процентам женщин возобновить нормальную жизнь через 24 часа после процедуры без повязок, дренажа жидкости, обезболивающих насосов и катетеров. , медицинские бюстгальтеры или наркотические обезболивающие. [96] [97] [98] [99]
Типы
[ редактировать ]

Сегодня существует три типа грудных имплантатов, обычно используемых для маммопластики , реконструкции груди и увеличения груди : процедур [100]
- солевой имплантат, наполненный стерильным физиологическим раствором .
- силиконовый имплантат, наполненный вязким силиконовым гелем.
- структурированные имплантаты с использованием вложенных эластомерных силиконовых оболочек и двух просветов, заполненных физиологическим раствором.
Четвертый тип имплантатов, композитные (или альтернативные композитные) имплантаты, в основном снят с производства. В этих типах использовались такие наполнители, как соевое масло и полипропиленовая нить. Другие материалы, снятые с производства, включают бычий хрящ, териленовую шерсть, измельченную резину, силистическую резину и тефлон-силиконовые протезы. [101]
Солевые имплантаты
[ редактировать ]Солевой грудной имплантат, наполненный физиологическим раствором (соленая вода биологической концентрации 0,90 % по массе с содержанием NaCl , около 300 мОсм /л), был впервые изготовлен компанией Laboratoires Arion во Франции и был представлен для использования в качестве грудного протезное имплантата. медицинское устройство , выпущенное в 1964 году. Современные модели грудных имплантатов с солевым раствором производятся с более толстыми оболочками, вулканизированными при комнатной температуре (RTV) из силиконового эластомера . Исследование In vitro «Дефляция предварительно заполненных солевыми имплантатами груди» (2006) показало, что скорость дефляции (утечки наполнителя) предварительно заполненного солевым имплантатом груди сделала его протезом второго выбора для корректирующей хирургии груди. [102] Тем не менее, в 1990-х годах грудной имплантат с солевым раствором был наиболее распространенным протезом , используемым при операциях по увеличению груди в Соединенных Штатах, из-за ограничений FDA США на имплантацию грудных имплантатов, наполненных силиконом, за пределами клинических исследований. Грудные имплантаты с солевым раствором не пользуются особой популярностью в остальном мире и занимают незначительную долю рынка.
Технической целью технологии солевых имплантатов была физически менее инвазивная хирургическая техника установки пустого грудного имплантата через меньший хирургический разрез. [103] В хирургической практике после установки пустых грудных имплантатов в карманы для имплантатов пластический хирург затем наполняет каждое устройство физиологическим раствором , и, поскольку требуемые разрезы для введения короткие и маленькие, результирующие шрамы от разрезов будут все меньше и короче. чем обычные хирургические шрамы от длинных разрезов, необходимых для установки предварительно заполненных силиконовых гелевых имплантатов.
По сравнению с результатами, достигнутыми с помощью грудного имплантата из силиконового геля, солевой имплант может дать приемлемые результаты: увеличение размера груди, более гладкий контур полушария и реалистичная текстура; тем не менее, это, скорее всего, вызовет косметические проблемы, такие как рябь и сморщивание кожи оболочки груди, ускоренное растяжение нижнего полюса груди, а также технические проблемы, такие как присутствие имплантата, заметное на глаз и на ощупь. . Возникновение таких косметических проблем более вероятно у женщин с очень небольшим количеством ткани молочной железы , а также у женщин, которым требуется после мастэктомии реконструкция груди ; таким образом, имплантат из силиконового геля является технически совершенным протезным устройством для увеличения и реконструкции груди . В случае женщины с большим количеством ткани молочной железы, для которой подмышечная установка является рекомендуемым хирургическим подходом, грудные имплантаты с солевым раствором могут дать эстетический результат, очень похожий на тот, который дают силиконовые грудные имплантаты. [104] [105] Ультразвуковое обследование и исследования результатов показали, что солевые и силиконовые грудные имплантаты выглядят и ощущаются одинаково. [106]
Силиконовые гелевые имплантаты
[ редактировать ]В медицинского оборудования технологии существует пять поколений силиконовых грудных имплантатов, каждое из которых определяется общими методами изготовления моделей. [ нужна ссылка ]
Современный протез груди был изобретен в 1961 году американскими пластическими хирургами Томасом Кронином и Фрэнком Героу и произведен корпорацией Dow Corning ; Со временем первая увеличивающая маммопластика была выполнена в 1962 году.
Первое поколение
[ редактировать ]Имплантат Кронина-Героу, модель протеза 1963 года, представлял собой мешочек-конверт из силиконовой резины, имеющий форму капли, заполненный вязким силиконовым гелем. Чтобы уменьшить вращение установленного грудного имплантата о грудную стенку, протез модели 1963 года прикреплялся к карману имплантата с помощью застежки-застежки из материала лавсан ( полиэтилентерефталат ), которая крепилась к задней части оболочки грудного имплантата. . [107]
Второе поколение
[ редактировать ]В 1970-х годах производители представили второе поколение протезов с грудными имплантатами, в которых были усовершенствованы функциональные и эстетические усовершенствования технологии:
- Первыми технологическими разработками были более тонкая оболочка устройства и гель-наполнитель из низкокогезионного силикона, которые улучшили функциональность и правдоподобие (размер, внешний вид и текстуру) грудного имплантата из силиконового геля. Тем не менее, в клинической практике грудные имплантаты второго поколения оказались хрупкими и чаще встречались. [ написание? ] разрыва оболочки и утечки наполнителя («кровотечение силиконового геля») через неповрежденную оболочку устройства. Последовавшее за этим увеличение частоты медицинских осложнений (например, капсулярной контрактуры дефектной продукции ) спровоцировало групповые иски о со стороны правительства США против корпорации Dow Corning и других производителей грудных протезов.
- второй технологической разработкой стало пенополиуретановое покрытие оболочки грудного имплантата; покрытие снизило частоту капсулярной контрактуры , вызывая воспалительную реакцию , которая препятствовала образованию капсулы из волокнистой коллагеновой ткани вокруг грудного имплантата. Тем не менее, несмотря на эту профилактическую меру, медицинское использование грудных имплантатов с полиуретановым покрытием было на короткое время прекращено из-за потенциального риска для здоровья, создаваемого 2,4-толуилендиамином (ТДА), канцерогенным побочным продуктом химического распада полиуретана. В исследованиях на животных было доказано, что пенопластовое покрытие грудного имплантата вызывает рак печени и кожи. [108]
- Изучив медицинские данные, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов вызванный TDA, США пришло к выводу, что рак молочной железы, представляет бесконечно малый риск для здоровья женщин с грудными имплантатами, и не оправдывает юридическое требование от врачей объяснять этот вопрос своим пациентам. В настоящее время грудные имплантаты с полиуретановым покрытием продолжают использоваться в практике пластической хирургии в Европе и Южной Америке; и ни один производитель не запросил одобрения FDA на продажу таких грудных имплантатов в медицинских целях в США. [109]
- Третьей технологической разработкой стало устройство грудного имплантата с двумя просветами, двухполый протез, состоящий из силиконового грудного имплантата, находящегося внутри грудного имплантата с солевым раствором. Двойная техническая цель заключалась в следующем: (i) косметические преимущества силиконового геля (внутренний просвет), заключенного в солевой раствор (внешний просвет); (ii) устройство грудного имплантата, объем которого можно регулировать после операции. Тем не менее, у более сложной конструкции двухпросветного грудного имплантата частота отказов устройства выше, чем у однопросветных грудных имплантатов. Современные версии устройств грудных имплантатов второго поколения (представленные в 1984 году) представляют собой модели грудных имплантатов «Becker Expandable», которые в основном используются для реконструкции груди .
Третье и четвертое поколения
[ редактировать ]В 1980-х годах модели третьего и четвертого поколений устройств грудных имплантатов представляли собой последовательные достижения в технологии производства, такие как оболочки с эластомерным покрытием, которые уменьшали кровотечение из геля (утечку наполнителя), и более толстый наполнитель (с повышенной когезией). гель. С социологической точки зрения производители протезов груди затем проектировали и изготавливали анатомические модели (натуральная грудь) и модели формы (круглые, конические), которые реалистично соответствовали типам груди и телосложения женщин. Конические модели грудных имплантатов имеют однородную текстурированную поверхность, что уменьшает вращение протеза внутри кармана имплантата; Круглые модели грудных имплантатов доступны с гладкой и текстурированной поверхностью.
Пятое поколение
[ редактировать ]С середины 1990-х годов пятое поколение силиконово-гелевых грудных имплантатов изготавливается из высокопрочного, высококогезионного силиконового геля, который практически исключает случаи утечки наполнителя («растекание силиконового геля») и миграцию силиконового наполнителя. из кармана имплантата в другие части тела женщины. Эти имплантаты обычно называют «грудными имплантатами мармеладного мишки» из-за их твердой, податливой консистенции, напоминающей мармеладные конфеты. В исследованиях « Опыт использования анатомического мягкого когезивного силиконового гелевого протеза в косметической и реконструктивной хирургии грудных имплантатов» (2004 г.) и «Когезивный силиконовый гель грудных имплантатов в эстетической и реконструктивной хирургии груди» (2005 г.) сообщалось о низкой частоте возникновения капсулярной контрактуры и разрыва оболочки устройства; и более высокие показатели улучшения медицинской безопасности и технической эффективности, чем у устройств грудных имплантатов раннего поколения. [110] [111] [112]
Грудное вскармливание
[ редактировать ]
Наличие грудных имплантатов в настоящее время не является противопоказанием к грудному вскармливанию, и USFDA не признает никаких доказательств того, что эта практика может представлять проблемы для здоровья грудного ребенка.
Женщины с грудными имплантатами могут испытывать функциональные трудности с грудным вскармливанием; Процедуры маммопластики с периареолярными разрезами особенно часто вызывают трудности с грудным вскармливанием. Операция также может повредить молочные протоки и нервы в области соска и ареолы. [113] [114] [115]
Функциональные трудности грудного вскармливания возникают, если хирург перерезал молочные протоки или основные нервы, иннервирующие грудь, или если молочные железы были повреждены иным образом. Повреждение молочных протоков и нервов встречается чаще, если разрезы затрагивают ткани возле соска. Молочные железы чаще всего поражаются поджелезистыми имплантатами (под железой), а также грудными имплантатами большого размера, которые пережимают молочные протоки и затрудняют отток молока. Грудные имплантаты небольшого размера и подмышечная имплантация вызывают меньше проблем с функцией груди; однако невозможно предсказать, сможет ли женщина, перенесшая увеличение груди, успешно кормить грудью, поскольку некоторые женщины могут кормить грудью после периареолярных разрезов и субжелезистого размещения, а некоторые не могут после увеличения с использованием субмускулярных и других типов хирургические разрезы. [115]
Маммография
[ редактировать ]
Наличие рентгенологически непрозрачных грудных имплантатов (физраствора или силикона) может повлиять на рентгенографическую чувствительность маммографа , то есть на изображении может не быть видно каких-либо опухолей. В этом случае требуется маммография в режиме Эклунда, чтобы убедиться в наличии или отсутствии раковой опухоли, при которой грудной имплантат вручную смещается к грудной стенке, а грудь вытягивается вперед, чтобы маммограф мог визуализировать больший объем. внутренних тканей; тем не менее, примерно одна треть ткани молочной железы остается неадекватно визуализируемой, что приводит к увеличению частоты маммографии с ложноотрицательными результатами. [116] [117]
рака молочной железы Исследования «Рак в увеличенной груди: диагностика и прогноз» (1993) и «Рак молочной железы после увеличивающей маммопластики» (2001) у женщин с протезами с грудными имплантатами не выявили существенных различий в стадии заболевания на момент постановки диагноза рака; прогнозы одинаковы в обеих группах женщин, при этом пациенты с аугментацией имеют меньший риск последующего рецидива рака или смерти. [118] [119] И наоборот, использование имплантатов для реконструкции груди после по поводу рака молочной железы, мастэктомии по-видимому, не оказывает отрицательного влияния на частоту смертности от рака. [120] Тот факт, что у пациентов с грудными имплантатами чаще диагностируются пальпируемые, но не более крупные опухоли, указывает на то, что опухоли одинакового размера могут легче пальпироваться у пациентов с увеличенной грудью, что может компенсировать искаженные изображения маммограммы. [121] Легкая пальпация опухоли(-й) рака молочной железы является следствием истончения ткани молочной железы в результате сжатия, что априори присуще меньшим размерам груди (поскольку они имеют меньший объем ткани), и тому, что имплантат служит рентгеноконтрастной основой, на которой раковую опухоль можно дифференцировать. [122]

Грудной имплантат не имеет клинического значения при лампэктомии по сохранению груди у женщин, у которых после процедуры имплантации развился рак молочной железы, а также грудной имплантат не мешает внешнему лучевому лечению (ДЛТ); более того, после лечения часто возникает фиброз тканей молочной железы и, как следствие, увеличивается частота капсулярных контрактур . [123] Имеются предварительные данные о том, что женщины, перенесшие увеличение груди, имеют худший прогноз рака молочной железы. [124] Использование имплантатов для реконструкции груди после по поводу рака молочной железы мастэктомии , по-видимому, не оказывает отрицательного влияния на смертность от рака. [120] [125]
Было зарегистрировано множество случаев других побочных эффектов маммографии у женщин с грудными имплантатами; разрывы, возникающие в результате давления на грудной имплантат, составляют большинство этих случаев. [126] Сжатие также может привести к боли или усугубить уже имеющуюся боль в груди. [126]
История
[ редактировать ]
19 век
[ редактировать ]С конца девятнадцатого века грудные имплантаты использовались для хирургического увеличения размера (объема), изменения формы (контура) и улучшения ощущения (тактичности) женской груди. В 1895 году хирург Винченц Черни пациента осуществил самую раннюю установку грудного имплантата, используя аутологичную жировую ткань , полученную из доброкачественной поясничного отдела липомы , для устранения асимметрии груди, из которой он удалил опухоль. [127] В 1889 году хирург Роберт Герсуни экспериментировал с инъекциями парафина , получив катастрофические результаты из-за распада парафина на более мелкие тела после процедуры. [128]
20 век
[ редактировать ]С первой половины ХХ века в качестве наполнителей грудных имплантатов врачи использовали и другие вещества — слоновую кость , стеклянные шарики, молотую резину , бычий хрящ , териленовую шерсть , гуттаперчу , дикору, полиэтиленовую крошку, ивалон ( поливиниловый спирт — формальдегидная полимерная губка). , полиэтиленовый мешочек с Ивалоном, пенополиэфирная губка (Этерон), полоски полиэтиленовой ленты (Полистан), скрученные в клубок, полиэстер (пенополиуритановая губка) Силастикан, тефлон-силиконовые протезы. [129]
В середине двадцатого века Мортон И. Берсон в 1945 году и Жак Малиниак в 1950 году каждый выполнили увеличение груди с помощью лоскута, вращая ткань грудной стенки пациента в грудь, чтобы увеличить ее объем. Кроме того, на протяжении 1950-х и 1960-х годов пластические хирурги использовали синтетические наполнители, в том числе инъекции силикона , которые получили около 50 000 женщин, в результате чего развились силиконовые гранулемы и уплотнение груди, что потребовало лечения мастэктомией . [130] В 1961 году американские пластические хирурги Томас Кронин и Фрэнк Героу и корпорация Dow Corning разработали первый силиконовый протез груди, наполненный силиконовым гелем; со временем первая увеличивающая маммопластика была выполнена в 1962 году с использованием имплантата Кронина-Героу, модели протеза 1963 года . в медицинское устройство 1964 году. [102]
одобрение FDA
[ редактировать ]В 1988 году, через двадцать шесть лет после появления в 1962 году грудных имплантатов, наполненных силиконовым гелем, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) исследовало отказы грудных имплантатов и последующие осложнения и переклассифицировало устройства грудных имплантатов в медицинские устройства класса III. и требовали от производителей документальных данных, подтверждающих безопасность и эффективность их грудных имплантатов. [131] В 1992 году FDA наложило мораторий на грудные имплантаты из силиконового геля в США, поскольку не было «недостаточно информации, чтобы продемонстрировать, что грудные имплантаты безопасны и эффективны». после мастэктомии Тем не менее, медицинский доступ к устройствам грудных имплантатов с силиконовым гелем продолжался для клинических исследований реконструкции груди , коррекции врожденных деформаций и замены разорвавшихся имплантатов из силиконового геля. FDA потребовало от производителей данных клинических испытаний и разрешило им предоставлять грудные имплантаты пациентам, которым была произведена операция по увеличению груди , для статистических исследований, требуемых Управлением по контролю за продуктами и лекарствами США. [131] В середине 1992 года FDA одобрило дополнительный протокол исследования имплантатов, наполненных силиконовым гелем, для пациентов, перенесших реконструкцию груди, а также для пациентов, перенесших повторную операцию. Также в 1992 году корпорация Dow Corning , производитель силиконовых изделий и грудных имплантатов, объявила о прекращении производства пяти силиконов , пригодных для имплантатов , но продолжила производство 45 других силиконовых материалов медицинского назначения - три года спустя, в 1995 году, компания Dow Корпорация Corning обанкротилась , когда столкнулась с крупными коллективными исками по поводу различных заболеваний. [131]
- В 1997 году Министерство здравоохранения и социальных служб США (HHS) поручило Институту медицины (IOM) Национальной академии наук США (NAS) исследовать потенциальные риски операционных и послеоперационных осложнений в результате установки силиконовой груди. имплантаты. В обзоре безопасности и эффективности грудных имплантатов, наполненных силиконовым гелем, проведенном МОМ, сообщается, что «факты свидетельствуют о том, что заболевания или состояния, такие как заболевания соединительной ткани , рак , неврологические заболевания или другие системные жалобы или состояния, больше не встречаются у женщин с грудных имплантатов, чем у женщин без имплантатов», последующие исследования и системный обзор не выявили причинной связи между силиконовыми грудными имплантатами и заболеванием. [131]

- В 1998 году FDA США одобрило протоколы дополнительных исследований имплантатов, наполненных силиконовым гелем, только для пациентов, перенесших реконструкцию груди, и для пациентов, перенесших ревизионную операцию; а также одобрил исследование корпорации Dow Corning по освобождению от исследовательских устройств (IDE) для грудных имплантатов из силиконового геля для ограниченного числа пациентов, перенесших операции по увеличению, реконструкции и ревизии груди. [131]
- В 1999 году Институт медицины опубликовал исследование « Безопасность силиконовых грудных имплантатов» (1999), в котором не было обнаружено доказательств того, что устройства грудных имплантатов, наполненные физиологическим раствором и силиконовым гелем, вызывают системные проблемы со здоровьем; что их использование не представляет новых рисков для здоровья или безопасности; и что местные осложнения являются «основной проблемой безопасности при использовании силиконовых грудных имплантатов» при различении обычных и местных медицинских осложнений и системных проблем со здоровьем». [131] [132] [133]
- В 2000 году FDA одобрило предпродажную заявку на одобрение грудных имплантатов с солевым раствором (PMA), содержащую данные о типе и частоте местных медицинских осложнений, с которыми столкнулись пациенты, перенесшие операцию на груди. [134] «Несмотря на осложнения, с которыми столкнулись некоторые женщины, большинство из тех женщин, которые все еще участвуют в исследованиях Inamed Corporation и Mentor Corporation , спустя три года сообщили, что довольны своими имплантатами». [131] Предварительные разрешения были выданы на увеличение груди для женщин старше 18 лет и для женщин, нуждающихся в реконструкции груди . [135] [136]
- В 2006 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США сняло ограничения на использование грудных имплантатов из силиконового геля для реконструкции груди и увеличивающей маммопластики для корпораций Inamed и Mentor Corporation. Тем не менее, одобрение было обусловлено согласием на мониторинг FDA, завершением 10-летних исследований женщин, у которых уже были грудные имплантаты, и завершением второго, 10-летнего исследования безопасности грудных имплантатов. у 40 000 других женщин. [137] FDA предупредило общественность, что грудные имплантаты действительно несут в себе медицинские риски, и рекомендовало женщинам, которые проходят операцию по увеличению груди , периодически проходить МРТ- обследование на наличие признаков разрыва оболочки или утечки наполнителя, или того и другого; и распорядился предоставить пациентам, перенесшим операцию на груди, подробные информационные брошюры, объясняющие медицинские риски использования грудных имплантатов из силиконового геля. [131]
- В марте 2019 года FDA провело открытое заседание своей Консультативной группы по устройствам для общей и пластической хирургии, чтобы обсудить вопросы безопасности силиконовых и солевых грудных имплантатов, включая BIA-ALCL и болезни грудных имплантатов. [138] Одной из основных тем этой публичной встречи были доказательства того, что текстурированные грудные имплантаты Allergan BIOCELL относятся к типу грудных имплантатов, наиболее вероятно вызывающих BIA-ALCL. После заседания комитета FDA потребовало, чтобы компания Allergan отозвала свои текстурированные грудные имплантаты и расширители тканей BIOCELL, и в июле 2019 года компания Allergan сняла с рынка текстурированные имплантаты и расширители тканей BIOCELL. Впоследствии компания Allergan объявила, что свяжется со всеми клиентами, купившими ее продукцию, чтобы убедиться, что они знают об отзыве. [139]
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США установило возрастные рамки для женщин, желающих установить грудные имплантаты; для реконструкции груди женщинам всех возрастов были одобрены имплантаты, наполненные силиконовым гелем, и имплантаты, наполненные физиологическим раствором; для увеличения груди солевые имплантаты разрешены женщинам от 18 лет и старше; силиконовые имплантаты были одобрены для женщин от 22 лет и старше. [140] Поскольку каждое устройство грудного имплантата влечет за собой разные медицинские риски, минимальный возраст пациента для грудных имплантатов с солевым раствором отличается от минимального возраста пациента для силиконовых грудных имплантатов - из-за риска утечки наполнителя и риска бесшумного разрыва оболочки; таким образом, периодические скрининговые МРТ- обследования являются рекомендуемой послеоперационной последующей терапией для пациента. [140] В других странах, в Европе и Океании, политика национальных министерств здравоохранения в области грудных имплантатов не одобряет периодический МРТ-скрининг бессимптомных пациентов, но предполагает, что собственно пальпация - с ультразвуковым скринингом или без него - будет достаточной послеоперационной терапией для большинства пациентов.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Риски и осложнения грудных имплантатов» . FDA . 21 октября 2019 года . Проверено 30 октября 2019 г.
- ^ Лох-Уилкинсон, Анна; Бит, Кеннет Дж; Магнуссон, Марк Р.; Кутер, Родни; Шоу, Карен; Френч, Джеймс; Викери, Карен; Принс, Х. Майлз; Дева, Ананд К. (13 июля 2020 г.). «Анапластическая крупноклеточная лимфома, связанная с грудным имплантатом, в Австралии: продольное исследование имплантата и других связанных с ним факторов риска» . Журнал эстетической хирургии . 40 (8): 838–846. дои : 10.1093/asj/sjz333 . ISSN 1090-820X .
- ^ Американское общество пластических хирургов (24 апреля 2014 г.), «Пять вопросов, которые должны задать врачи и пациенты» , « Выбирая мудро : инициатива Фонда ABIM» , Американское общество пластических хирургов, заархивировано из оригинала 19 июля 2014 г. , получено 25 июля 2014 г.
- ^ Бринтон Л.А., Браун С.Л., Колтон Т., Бурич М.К., Любин Дж. (2000). «Характеристики популяции женщин с грудными имплантатами по сравнению с женщинами, обращающимися за другими видами пластической хирургии» . Пластическая и реконструктивная хирургия . 105 (3): 919–927. дои : 10.1097/00006534-200003000-00014 . ПМИД 10724251 . S2CID 32599107 .
- ^ Якобсен П.Х., Хёльмих Л.Р., Маклафлин Дж.К., Йохансен С., Олсен Дж.Х., Кьёллер К., Фриис С. (2004). «Смертность и самоубийства среди датских женщин с косметическими грудными имплантатами». Арх. Стажер. Мед . 164 (22): 2450–5. дои : 10.1001/archinte.164.22.2450 . ПМИД 15596635 .
- ^ Янг В.Л., Немечек-младший, Немечек Д.А. (1994). «Эффективность увеличения груди: увеличение размера груди, удовлетворенность пациентов и психологические эффекты». Пластическая и реконструктивная хирургия . 94 (декабрь): 958–969. дои : 10.1097/00006534-199412000-00009 . ПМИД 7972484 . S2CID 753343 .
- ^ Креранд К.Э., Франклин М.Э., Сарвер Д.Б. (2006). «Дисморфическое расстройство тела и косметическая хирургия». Пластическая и реконструктивная хирургия . 118 (июль): 167–180е. дои : 10.1097/01.prs.0000242500.28431.24 . ПМИД 17102719 . S2CID 8925060 .
- ^ Сарвер Д.Б., ЛаРосса Д., Бартлетт С.П., Лоу Д.В., Баки Л.П., Уитакер Л.А. (2003). «Проблемы с изображением тела пациентов, сделавших операцию по увеличению груди». Пластическая и реконструктивная хирургия . 112 (июль): 83–90. дои : 10.1097/01.PRS.0000066005.07796.51 . ПМИД 12832880 . S2CID 45574374 .
- ^ Чахрауи К., Данино А., Фрашбуа С., Клерк А.С., Малка Г. (2006). «Эстетическая хирургия и качество жизни до и через четыре месяца после операции». Журнал долгосрочных эффектов медицинских имплантатов . 51 (3): 207–210. дои : 10.1016/j.anplas.2005.07.010 . ПМИД 16181718 .
- ^ Cash TF, Duel LA, Perkins LL (2002). «Психосоциальные результаты увеличения груди для женщин с помощью имплантатов, наполненных силиконовым гелем: двухлетнее проспективное исследование». Пластическая и реконструктивная хирургия . 109 (май): 2112–2121. дои : 10.1097/00006534-200205000-00049 . ПМИД 11994621 .
- ^ Фигероа-Хаас CL (2007). «Влияние маммопластики по увеличению груди на самооценку и сексуальность: количественный анализ». Сестринское дело в пластической хирургии . 27 (март): 16–36. дои : 10.1097/01.PSN.0000264159.30505.c9 . ПМИД 17356451 . S2CID 23169107 .
- ^ «Важная информация для женщин об увеличении груди с помощью имплантатов, наполненных силиконовым гелем Inamed» (PDF) . Управление по контролю за продуктами и лекарствами . 2006. Архивировано из оригинала (PDF) 3 января 2007 г.
- ^ Долан, Эрик В. (06 октября 2023 г.). «Согласно новому исследованию, грудные имплантаты положительно влияют на женскую сексуальность» . ПсиПост . Проверено 9 октября 2023 г.
- ^ Гендель Н., Кордрей Т., Гутьеррес Дж., Дженсен Дж.А. (2006). «Долгосрочное исследование результатов, осложнений и удовлетворенности пациентов грудными имплантатами». Пластическая и реконструктивная хирургия . 117 (март): 757–767. дои : 10.1097/01.prs.0000201457.00772.1d . ПМИД 16525261 . S2CID 15228702 .
- ^ «Грудные имплантаты связаны с самоубийством в исследовании» . Рейтер . 8 августа 2007 г. Архивировано из оригинала 21 декабря 2008 г.
- ^ Мэннинг А. (6 августа 2007 г.). «Грудные имплантаты связаны с более высоким уровнем самоубийств» . США сегодня . Архивировано из оригинала 18 марта 2011 г. Проверено 26 апреля 2010 г.
- ^ Jump up to: а б Бринтон Л.А., Любин Дж.Х., Бурич М.К., Колтон Т., Браун С.Л., Гувер Р.Н. (2001). «Риск рака в других местах, кроме груди, после увеличивающей маммопластики» . Энн Эпидемиол . 11 (4): 248–256. дои : 10.1016/s1047-2797(00)00223-4 . ПМИД 11306343 .
- ^ Кут В.К., Питерс П.Х., Гранат Ф., Гробби Д.Е., Найрен О. (2003). «Общая смертность и смертность от конкретных причин среди шведских женщин с косметическими грудными имплантатами: проспективное исследование» . БМЖ . 326 (7388): 527–8. дои : 10.1136/bmj.326.7388.527 . ПМЦ 150462 . ПМИД 12623911 .
- ^ Пуккала Э., Кулмала И., Хови С.Л., Хемминки Э., Кескимяки И., Пакканен М., Липворт Л., Бойс Дж.Д., Маклафлин Дж.К. (2003). «Причины смерти финских женщин с косметическими грудными имплантатами, 1971–2001 гг.». Энн Пласт Хирург . 51 (4): 339–42, обсуждение 343–4. дои : 10.1097/01.sap.0000080407.97677.A5 . ПМИД 14520056 . S2CID 34929987 .
- ^ Вильнев П.Дж., Холовати Э.Дж., Бриссон Дж., Се Л., Угнат А.М., Латулипп Л., Мао Ю. (2006). «Смертность канадских женщин с косметическими грудными имплантатами». Являюсь. Дж. Эпидемиол . 164 (4): 334–41. дои : 10.1093/aje/kwj214 . ПМИД 16777929 .
- ^ Бринтон Л.А., Любин Дж.Х., Мюррей MC, Колтон Т., Гувер Р.Н. (2006). «Уровни смертности среди пациентов, подвергшихся аугментационной маммопластике: обновленная информация» . Эпидемиология . 17 (2): 162–9. дои : 10.1097/01.ede.0000197056.84629.19 . ПМИД 16477256 . S2CID 22285852 .
- ^ Национальная статистика процедур пластической хирургии, 2006. Арлингтон-Хайтс, Иллинойс, Американское общество пластических хирургов, 2007.
- ^ «Пластическая хирургия помогает повысить самооценку» . Psych Central.com . Архивировано из оригинала 19 июня 2010 г.
- ^ Гриппаудо Ф.Р., Ренци Л., Константино Б., Лонго Б., Сантанелли Ф. (2013). «Поздняя односторонняя гематома после реконструкции груди с помощью имплантатов: описание случая и обзор литературы» . Эстетический хирургический журнал . 33 (6): 830–834. дои : 10.1177/1090820X13496249 . ПМИД 23864111 .
- ^ Jump up to: а б «Важная информация для женщин об увеличении груди с помощью силиконовых грудных имплантатов INAMED» (PDF) . Управление по контролю за продуктами и лекарствами . 03.11.2006. Архивировано из оригинала (PDF) 3 января 2007 г. Проверено 4 мая 2007 г.
- ^ «Важная информация для пациентов, проходящих операцию по увеличению груди, об имплантатах груди Mentor MemoryGel, наполненных силиконовым гелем» (PDF) . 03.11.2006. Архивировано из оригинала (PDF) 16 октября 2014 года . Проверено 11 октября 2014 г.
- ^ «Хирургия грудных имплантатов с использованием физиологического раствора: принятие обоснованного решения (Mentor Corporation)» . Справочник FDA для потребителей грудных имплантатов – 2004 г. 13 января 2004 г. Архивировано из оригинала 26 ноября 2006 г. Проверено 4 мая 2007 г.
- ^ «РЕЛИЗ НОВОСТЕЙ FDA» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 3 ноября 2011 г. Проверено 9 ноября 2011 г.
- ^ Jump up to: а б Даймонд BA; Халка Б.С.; Керквлит Н.И.; Тагвелл П. «Силиконовые грудные имплантаты в связи с заболеваниями соединительной ткани и иммунологической дисфункцией: отчет Национальной научной комиссии достопочтенному Сэму К. Пойнтеру-младшему, судье-координатору федерального многоокружного судебного процесса по грудным имплантатам». 1998.
- ^ Яновский, ЕС; Куппер, LL; Халка, Б.С. (16 марта 2000 г.). «Метаанализ связи между силиконовыми грудными имплантатами и риском заболеваний соединительной ткани» . Медицинский журнал Новой Англии . 342 (11): 781–790. дои : 10.1056/NEJM200003163421105 . ISSN 0028-4793 . ПМИД 10717013 .
- ^ Jump up to: а б с Ватад, А.; Розенберг, В.; Тиозано, С.; Коэн Терверт, JW; Явне, Ю.; Шенфельд, Ю.; Шалев В.; Чодик, Г.; Амиталь, Х. (2018). «Силиконовые грудные имплантаты и риск аутоиммунных/ревматических заболеваний: анализ из реальной жизни» . Int J Epidemiol . 47 (6): 1846–1854. дои : 10.1093/ije/dyy217 . ПМИД 30329056 .
- ^ Коронеос, Кристофер Дж.; Селбер, Джесси С.; Оффодил, Анаез К.; Батлер, Чарльз Э.; Клеменс, Марк В. (январь 2019 г.). «Исследования после одобрения грудных имплантатов FDA США: долгосрочные результаты у 99 993 пациентов». Анналы хирургии . 269 (1): 30–36. doi : 10.1097/SLA.0000000000002990 . ISSN 1528-1140 . ПМИД 30222598 . S2CID 52284936 .
- ^ Jump up to: а б Ви, Корин Э. (июнь 2021 г.). «Объективное влияние удаления грудного имплантата и капсулэктомии на функцию легких» . Пластическая и реконструктивная хирургия – Global Open . 9 (6): e3636. дои : 10.1097/GOX.0000000000003636 . S2CID 235801794 .
- ^ Бринтон Л.А., Мэлоун К.Э., Коутс Р.Дж., Шенберг Дж.Б., Суонсон К.А., Далинг Дж.Р., Стэнфорд Дж.Л. (1996). «Увеличение и уменьшение груди: результаты исследования «случай-контроль» рака молочной железы» . Пластическая и реконструктивная хирургия . 97 (2): 269–275. дои : 10.1097/00006534-199602000-00001 . ПМИД 8559808 . S2CID 29456173 .
- ^ Бенадиба Л. (2004). «Histoire des protheses mammaires» (на французском языке). Архивировано из оригинала 29 января 2015 года . Проверено 12 октября 2015 г.
- ^ Информационный буклет о грудных имплантатах (PDF) (4-е изд.). Канберра: Австралийское Содружество. 2001. ISBN 0642735794 . Архивировано из оригинала (PDF) 1 января 2007 г. Проверено 29 декабря 2006 г.
- ^ «Немецкое общество сенологов, Декларация консенсуса по безопасности силиконовых имплантатов груди». 24 сентября 1998 г.
- ^ Jump up to: а б Яновский ЕС, Куппер Л.Л., Хулка Б.С. (2000). «Метаанализ связи между силиконовыми грудными имплантатами и риском заболеваний соединительной ткани» . Медицинский журнал Новой Англии . 342 (11): 781–790. дои : 10.1056/NEJM200003163421105 . ПМИД 10717013 .
- ^ [1] Архивировано 27 декабря 2005 г., в Wayback Machine.
- ^ [2] Архивировано 23 июня 2006 г. в Wayback Machine.
- ^ Тагвелл П., Уэллс Г., Петерсон Дж., Уэлч В., Пейдж Дж., Дэвисон С., Макгоуэн Дж., Рамрот Д., Ши Б. (2001). «Вызывают ли силиконовые грудные имплантаты ревматологические заболевания? Систематический обзор назначенной судом Национальной научной комиссии». Ревмирующий артрит . 44 (11): 2477–84. doi : 10.1002/1529-0131(200111)44:11<2477::AID-ART427>3.0.CO;2-Q . ПМИД 11710703 .
- ^ Горгохо Л., Гонсалес Дж., Висбаум В., Мартин-Морено Дж. (30 мая 2003 г.). Риски для здоровья, связанные с силиконовыми имплантатами в целом, с особым вниманием к грудным имплантатам (PDF) (Отчет). Архивировано из оригинала (PDF) 29 августа 2003 г. Проверено 28 января 2019 г.
- ^ Нойханн-Лоренц С., Феделес Дж., Эйзенман-Кляйн М., Кинни Б., Каннингем Б.Л. (2001). «Восьмое заявление о консенсусной позиции IQUAM: Трансатлантические инновации, апрель 2009 г.». Пластическая и реконструктивная хирургия . 127 (3): 1368–1375. дои : 10.1097/PRS.0b013e318206312e . ПМИД 21364439 . S2CID 29112694 .
- ^ Браун С.Л., Миддлтон М.С., Берг В.А., Су М.С., Пеннелло Дж. (2000). «Распространенность разрывов грудных имплантатов из силиконового геля, выявленная при МРТ среди женщин в Бирмингеме, штат Алабама». Американский журнал рентгенологии . 175 (4): 1057–1064. дои : 10.2214/ajr.175.4.1751057 . ПМИД 11000165 .
- ^ «Риски и осложнения грудных имплантатов» . Управление по контролю за продуктами и лекарствами США. 28 сентября 2020 г. Проверено 14 октября 2021 г.
- ^ Уокер П.С., Уоллс Б., Мерфи Д.К. (2009). «Грудные имплантаты Natrelle, наполненные физиологическим раствором: проспективное 10-летнее исследование». Журнал эстетической хирургии . 29 (1): 19–25. дои : 10.1016/j.asj.2008.10.001 . ПМИД 19233001 .
- ^ Айзенберг, ТС (2021). «Снижает ли переполнение гладких надувных грудных имплантатов, наполненных физиологическим раствором, скорость дефляции? Опыт работы с 4761 пациентом, подвергшимся увеличивающей маммопластике» . Эстетическая пластическая хирургия . 45 (5): 1991–1999. дои : 10.1007/s00266-021-02198-3 . ПМЦ 8481168 . ПМИД 33712871 .
- ^ Хёльмих Л.Р., Вейборг И.М., Конрад С., Слеттинг С., Хойер-Мадсен М., Фризек Дж.П., Маклафлин Дж.К., Кьёллер К., Виик А., Фриис С. (2004). «Невылеченный разрыв силиконового имплантата молочной железы». Пластическая и реконструктивная хирургия . 114 (1): 204–214. дои : 10.1097/01.PRS.0000128821.87939.B5 . ПМИД 15220594 . S2CID 25947224 .
- ^ Кацин В.Е., Сентено Дж.А., Фэн Л.Дж., Кили М., Маллик Ф.Г. (2001). «Патология лимфатических узлов у пациентов с грудными имплантатами: гистологическая и спектроскопическая оценка» . Американский журнал хирургической патологии . 29 (4): 506–11. дои : 10.1097/01.pas.0000155145.60670.e4 . ПМИД 15767806 . S2CID 31982669 . Архивировано из оригинала 24 мая 2009 года.
- ^ «Исследование разрыва грудных имплантатов, наполненных силиконовым гелем (компонент МРТ)» . Справочник FDA для потребителей грудных имплантатов – 2004 г. 22 мая 2000 г. Архивировано из оригинала 9 июня 2007 г. Проверено 4 мая 2007 г.
- ^ Jump up to: а б с «Местные осложнения» . Справочник FDA для потребителей грудных имплантатов – 2004 г. 8 июня 2004 г. Архивировано из оригинала 13 мая 2007 г. Проверено 4 мая 2007 г.
- ^ МРТ разорвавшегося силиконового грудного имплантата. Архивировано 26 сентября 2013 г. в Wayback Machine 5 апреля 2013 г.
- ^ Хёльмих Л.Р., Фриис С., Фризек Дж.П., Вейборг И.М., Конрад С., Слеттинг С., Кьёллер К., Маклафлин Дж.К., Олсен Дж.Х. (2003). «Частота разрыва силиконового имплантата груди». Арх. Сург . 138 (7): 801–806. дои : 10.1001/archsurg.138.7.801 . ПМИД 12860765 .
- ^ Хеден П., Нава М.Б., ван Тетеринг Дж.П., Магалон Дж., Фури ле Р., Бреннер Р.Дж., Линдси Л.Е., Мерфи Д.К., Уокер П.С. (2006). «Распространенность разрывов силиконовых грудных имплантатов Inamed». Пластическая и реконструктивная хирургия . 118 (2): 303–308. дои : 10.1097/01.prs.0000233471.58039.30 . ПМИД 16874191 . S2CID 30442865 .
- ^ «Краткое описание клинических проблем FDA (документ MS Word)» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 8 марта 2008 г.
- ^ Каннингем Б., МакКью Дж. (2009). «Безопасность и эффективность имплантатов Mentor's MemoryGel через 6 лет». Пластическая и реконструктивная хирургия . 33 (3): 440–444. дои : 10.1007/s00266-009-9364-6 . ПМИД 19437068 . S2CID 25722841 .
- ^ Хеден П., Боне Б., Мерфи Д.К., Сликтон А., Уокер П.С. (2006). «Когезивные силиконовые грудные имплантаты Style 410: безопасность и эффективность через 5–9 лет после имплантации». Пластическая и реконструктивная хирургия . 118 (6): 1281–1287. дои : 10.1097/01.prs.0000239457.17721.5d . ПМИД 17051096 . S2CID 34380204 .
- ^ Хёльмих Л.Р., Фризек Дж.П., Кьёллер К., Брейтинг В.Б., Йоргенсен А., Краг С., Маклафлин Дж.К. (2005). «Диагностика разрыва силиконового грудного имплантата: клинические данные по сравнению с данными магнитно-резонансной томографии». Анналы пластической хирургии . 54 (6): 583–589. дои : 10.1097/01.sap.0000164470.76432.4f . ПМИД 15900139 . S2CID 39525474 .
- ^ «Экспертно-консультативная группа по грудным имплантатам: протокол заседаний» . ЗдоровьеКанада. 29 сентября 2005 г. Архивировано из оригинала 07.11.2007 . Проверено 4 мая 2007 г.
- ^ Сонг Дж.В., Ким Х.М., Белфи Л.Т., Чунг К.С. (2011). «Влияние ошибок в дизайне исследования на диагностическую точность магнитно-резонансной томографии для обнаружения разрывов силиконовых имплантатов молочной железы: метаанализ» . Пластическая и реконструктивная хирургия . 127 (3): 1029–1044. дои : 10.1097/PRS.0b013e3182043630 . ПМК 3080104 . ПМИД 21364405 .
- ^ АФП (18 сентября 2011 г.). «Грудные имплантаты безопасны, но не на всю жизнь: эксперты США» . Независимый . Архивировано из оригинала 3 августа 2016 года.
- ^ Барнсли ГП, Сигурдсон Л.Д., Барнсли СЭ (2006). «Грудные имплантаты с текстурированной поверхностью в предотвращении капсулярной контрактуры у пациентов с увеличением груди: метаанализ рандомизированных контролируемых исследований». Пластическая и реконструктивная хирургия . 117 (7): 2182–2190. дои : 10.1097/01.prs.0000218184.47372.d5 . ПМИД 16772915 . S2CID 35420582 .
- ^ Вонг Ч., Сэмюэл М., Тан Б.К., Сонг С (2006). «Капсулярная контрактура при субжелезистом увеличении груди с помощью текстурированных и гладких грудных имплантатов: систематический обзор». Пластическая и реконструктивная хирургия . 118 (5): 1224–1236. дои : 10.1097/01.prs.0000237013.50283.d2 . ПМИД 17016195 . S2CID 29643167 .
- ^ Гендель Н., Гутьеррес Дж. (май 2006 г.). «Долгосрочная безопасность и эффективность грудных имплантатов, покрытых пеной из полиуретана» . Журнал эстетической хирургии . 26 (3): 265–274. дои : 10.1016/j.asj.2006.04.001 . ПМИД 19338905 .
- ^ Младик Р.А. (1993). « Бесконтактная» методика субмышечного увеличения груди солевым раствором». Журнал эстетической хирургии . 17 (3): 183–192. дои : 10.1007/BF00636260 . ПМИД 8213311 . S2CID 39767802 .
- ^ Адамс В.П., Риос Дж.Л., Смит С.Дж. (2006). «Улучшение результатов лечения пациентов при эстетической и реконструктивной хирургии груди с использованием тройного антибиотика для ирригации груди: шестилетнее проспективное клиническое исследование». Пластическая и реконструктивная хирургия . 117 (1): 30–6. дои : 10.1097/01.prs.0000185671.51993.7e . ПМИД 16404244 . S2CID 35238465 .
- ^ Планас Дж., Сервелли В., Планас Г. (2001). «Пятилетний опыт ультразвукового лечения контрактур молочной железы». Эстетическая пластическая хирургия . 25 (2): 89–93. дои : 10.1007/s002660010102 . ПМИД 11349308 . S2CID 2784003 .
- ^ Шлезингер С.Л., Элленбоген Р., Девинь М.Н., Свехлак С., Хек Р. (2002). «Зафирлукаст (Акколат): новый метод лечения капсулярной контрактуры» . Эстетический пласт. Сург . 22 (4): 329–36. дои : 10.1067/май.2002.126753 . ПМИД 19331987 .
- ^ Скудери Н., Маццокки М., Фиорамонти П., Бистони Г. (2006). «Влияние зафирлукаста на капсулярную контрактуру: предварительный отчет». Эстетический пласт. Сург . 30 (5): 513–520. дои : 10.1007/s00266-006-0038-3 . ПМИД 16977359 . S2CID 251008 .
- ^ Сильвер Н (1982). «Уменьшение капсулярной контрактуры с помощью двухэтапной аугментационной маммопластики и импульсной электромагнитной энергии (Диапульсная терапия)». Пластическая и реконструктивная хирургия . 69 (5): 802–805. дои : 10.1097/00006534-198205000-00013 . ПМИД 7071225 . S2CID 8451166 .
- ^ Теббетс Дж. Б. (октябрь 2006 г.). «Критерии Out Point для удаления грудного имплантата без замены и критерии минимизации повторных операций после увеличения груди». Пластическая и реконструктивная хирургия . 114 (5): 1258–1262. doi : 10.1097/01.prs.0000136802.91357.cf . ПМИД 15457046 .
- ^ Теббетс Дж. Б. (декабрь 2006 г.). «Достижение нулевого процента повторных операций через 3 года в исследовании предварительного одобрения увеличивающей маммопластики с 50 последовательными случаями». Пластическая и реконструктивная хирургия . 118 (6): 1453–7. дои : 10.1097/01.prs.0000239602.99867.07 . ПМИД 17051118 . S2CID 27630646 .
- ^ Брейтинг В.Б., Хёльмих Л.Р., Брандт Б., Фризек Дж.П., Вольтерс М.С., Кьёллер К., Маклафлин Дж.К., Вийк А., Фриис С. (2004). «Долгосрочное состояние здоровья датских женщин с силиконовыми грудными имплантатами». Пластическая и реконструктивная хирургия . 114 (1): 217–226. дои : 10.1097/01.PRS.0000128823.77637.8A . ПМИД 15220596 . S2CID 20584928 .
- ^ Григг, Марта; Бондюран, Стюарт (2000). «Отчет об исследовании Медицинского института» . Информация для женщин о безопасности силиконовых грудных имплантатов – через NCBI.
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Бринтон, Луизиана (2006). «Смертность среди пациентов, перенесших аугментационную маммопластику: обновленная информация» . Эпидемиология . 17 (2): 162–169. дои : 10.1097/01.ede.0000197056.84629.19 . ПМИД 16477256 . S2CID 22285852 .
- ^ «Маркировка одобренных грудных имплантатов» . Управление по контролю за продуктами и лекарствами США . 3 декабря 2021 г. Архивировано из оригинала 11 сентября 2019 г. Проверено 19 января 2022 г.
- ^ Арепалли С.Р., Безабе С., Браун С.Л. (2002). «Аллергическая реакция на платину в силиконовых грудных имплантатах». Журнал долгосрочных эффектов медицинских имплантатов . 12 (4): 299–306. doi : 10.1615/jlongtermeffmedimplants.v12.i4.80 . ПМИД 12627791 .
- ^ «Информация FDA о платине в силиконовых грудных имплантатах» . Управление по контролю за продуктами и лекарствами США. 16 июня 2006 г. Архивировано из оригинала 15 июля 2006 г.
- ^ Канцелярия комиссара. «Предупреждения по безопасности для медицинских изделий для человека — грудные имплантаты: обновленная информация — анапластическая крупноклеточная лимфома, связанная с грудным имплантатом (BIA-ALCL)» . www.fda.gov . Архивировано из оригинала 28 апреля 2018 года . Проверено 28 апреля 2018 г.
- ^ Свердлов, Стивен Х.; Кампо, Элиас; Пилери, Стефано А.; Харрис, Нэнси Ли; Штейн, Харальд; Зиберт, Райнер; Адвани, Ранджана; Гильмини, Микеле; Саллес, Жиль А.; Зеленец, Андрей Д.; Джаффе, Элейн С. (19 мая 2016 г.). «Пересмотр классификации лимфоидных новообразований Всемирной организации здравоохранения 2016 г.» . Кровь . 127 (20): 2375–2390. дои : 10.1182/blood-2016-01-643569 . ISSN 0006-4971 . ПМЦ 4874220 . ПМИД 26980727 .
- ^ Jump up to: а б с «Грудные имплантаты — отчеты о медицинских устройствах при анапластической крупноклеточной лимфоме, связанной с грудными имплантатами» . www.fda.gov . 20 августа 2020 г. Проверено 18 августа 2021 г.
- ^ Миранда Р.Н., Аладили Т.Н., Принц Х.М., Канагал-Шаманна Р., де Йонг Д., Фаяд Л.Е. и др. (январь 2014 г.). «Анапластическая крупноклеточная лимфома, связанная с грудным имплантатом: долгосрочное наблюдение за 60 пациентами» . Журнал клинической онкологии . 32 (2): 114–20. дои : 10.1200/JCO.2013.52.7911 . ПМК 4062709 . ПМИД 24323027 .
- ^ Jump up to: а б Клеменс, Марк. « Анапластическая крупноклеточная лимфома, связанная с имплантатом молочной железы (BIA-ALCL). Архивировано 26 марта 2017 г. в Wayback Machine » (2017).
- ^ Клеменс М.В., Хорвиц С.М. (март 2017 г.). «Консенсусные рекомендации NCCN по диагностике и лечению анапластической крупноклеточной лимфомы, связанной с грудными имплантатами» . Журнал эстетической хирургии . 37 (3): 285–289. дои : 10.1093/asj/sjw259 . ПМИД 28184418 .
- ^ «Факты ALCL, связанные с имплантатами | Фонд доктора медицины Андерсона» . www.mdanderson.org . Архивировано из оригинала 9 декабря 2017 г. Проверено 8 декабря 2017 г.
- ^ Кордейру, Питер (20 января 2020 г.). «Риск развития анапластической крупноклеточной лимфомы, связанной с грудным имплантатом (BIA-ALCL), в когорте из 3546 женщин, проспективно наблюдаемых в течение длительного времени после реконструкции с использованием текстурированных грудных имплантатов» . J Plast Reconstr Aesthet Surg . 73 (5): 841–846. дои : 10.1016/j.bjps.2019.11.064 . ПМЦ 7247945 . ПМИД 32008941 .
- ^ «ALCL, связанный с грудными имплантатами: ПРОФИЛЬ | Фонд пластической хирургии» . www.thepsf.org . Архивировано из оригинала 7 мая 2017 г. Проверено 25 апреля 2017 г.
- ^ «Грудные имплантаты: отчеты о плоскоклеточном раке и различных лимфомах в капсулах вокруг имплантатов: сообщение FDA о безопасности» . Управление по контролю за продуктами и лекарствами США . 8 сентября 2022 г.
- ^ Джонсон Г.В., Крист Дж.Е. (1993). «Эндоскопическое увеличение груди: трансумбиликальная установка грудных имплантатов, наполненных физиологическим раствором». Пластическая и реконструктивная хирургия . 92 (5): 801–8. дои : 10.1097/00006534-199392050-00004 . ПМИД 8415961 .
- ^ Уоллах С.Г. (2004). «Максимальное использование разреза при абдоминопластике». Пластическая и реконструктивная хирургия . 113 (1): 411–417. дои : 10.1097/01.PRS.0000091422.11191.1A . ПМИД 14707667 . S2CID 44430032 .
- ^ Граф Р.М., Бернардес А., Риппель Р., Араужо Л.Р., Дамасио Р.К., Ауэрсвальд А. (2003). «Субфасциальный грудной имплантат: новая процедура». Пластическая и реконструктивная хирургия . 111 (2): 904–908. дои : 10.1097/01.PRS.0000041601.59651.15 . ПМИД 12560720 .
- ^ Теббетс Дж. Б. (2004). «Обеспечивает ли фасция дополнительное и значимое прикрытие грудного имплантата?». Пластическая и реконструктивная хирургия . 113 (2): 777–779. дои : 10.1097/01.PRS.0000104516.13465.96 . ПМИД 14758271 .
- ^ Теббетс Дж. Б. (2002). «Система выбора грудных имплантатов на основе характеристик тканей пациента и динамики имплантат-мягкие ткани». Пластическая и реконструктивная хирургия . 109 (4): 1396–1409. дои : 10.1097/00006534-200204010-00030 . ПМИД 11964998 .
- ^ Пачик П.Т., Нельсон К.Э., Вернер С. (2008). «Контроль боли при увеличивающей маммопластике: безопасность и эффективность постоянных катетеров у 644 последовательных пациентов» . Эстет Сург Дж . 28 (3): 279–84. дои : 10.1016/j.asj.2008.02.001 . ПМИД 19083538 .
- ^ Пачик П.Т., Нельсон К.Э., Вернер С. (2008). «Контроль боли при увеличивающей маммопластике с использованием постоянных катетеров у 687 последовательных пациентов: анализ данных». Эстет Сург Дж . 28 (6): 631–41. дои : 10.1016/j.asj.2008.09.001 . ПМИД 19083591 . S2CID 13441800 .
- ^ Теббетс Дж. Б. (2002). «Система выбора грудных имплантатов на основе характеристик тканей пациента и динамики имплантат-мягкие ткани». Пласт. Реконстр. Сург . 109 (4): 1396–409, обсуждение 1410–5. дои : 10.1097/00006534-200204010-00030 . ПМИД 11964998 .
- ^ Теббетс Дж.Б., Адамс В.П. (2005). «Пять важнейших решений по увеличению груди с использованием пяти измерений за 5 минут: процесс поддержки принятия решений «дай пять»». Пласт. Реконстр. Сург . 116 (7): 2005–16. дои : 10.1097/01.prs.0000191163.19379.63 . ПМИД 16327616 . S2CID 11180810 .
- ^ Теббетс Дж. Б. (2002). «Достижение предсказуемого 24-часового возвращения к нормальной деятельности после увеличения груди: часть I. Совершенствование методов с использованием принципов исследования движения и времени». Пласт. Реконстр. Сург . 109 (1): 273–90, обсуждение 291–2. дои : 10.1097/00006534-200201000-00044 . ПМИД 11786826 . S2CID 26419990 .
- ^ Теббетс Дж. Б. (2002). «Достижение предсказуемого 24-часового возвращения к нормальной деятельности после увеличения груди: Часть II. Подготовка пациента, усовершенствованные хирургические методы и инструменты». Пласт. Реконстр. Сург . 109 (1): 293–305, обсуждение 306–7. дои : 10.1097/00006534-200201000-00046 . ПМИД 11786828 . S2CID 21392313 .
- ^ «Выбор грудных имплантатов» (Интернет) . Миннеаполис Пластическая хирургия, ООО. Архивировано из оригинала 24 ноября 2016 года . Проверено 23 ноября 2016 г.
- ^ Заннис Дж (2017). Сказки для Тальякоцци: взгляд на современную пластическую хирургию изнутри . АвторДом. ISBN 9781524659073 . Проверено 7 июня 2019 г.
- ^ Jump up to: а б Стивенс В.Г., Хирш Э.М., Стокер Д.А., Коэн Р. (2006). «Дефляция in vitro предварительно заполненных солевым раствором грудных имплантатов». Пластическая и реконструктивная хирургия . 118 (2): 347–349. дои : 10.1097/01.prs.0000227674.65284.80 . ПМИД 16874200 . S2CID 41156555 .
- ^ Арион Х.Г. (1965). «Ретромаммарный протез». Отчеты Французского общества гинекологии . 5 .
- ^ Айзенберг Т.С. (2009). «Имплантаты из силиконового геля вернулись — и что?». Американский журнал косметической хирургии . 26 : 5–7. дои : 10.1177/074880680902600103 . S2CID 136191732 .
- ^ Айзенберг Т.С. (2022). «Недооцененный солевой грудной имплантат». Эстетическая пластическая хирургия . 47 (2): 897–900. дои : 10.1007/s00266-022-03106-z . ПМИД 36131136 . S2CID 252437143 .
- ^ Суонсон Э (2020). «Проспективное исследование имплантатов из физиологического раствора и силиконового геля для субпекторального увеличения груди» . Пластическая и реконструктивная хирургия . 8 (6): e2882. дои : 10.1097/GOX.0000000000002882 . ПМЦ 7339341 . ПМИД 32766047 .
- ^ Кронин Т.Д., Героу Ф.Дж. (1963). «Аугментационная маммопластика: новый протез, обеспечивающий естественное ощущение». Отрывок из серии международных конгрессов Medica . 66:41 .
- ^ Луу Х.М., Хаттер Дж.К., Бушар Х.Ф. (1998). «Физиологически обоснованная фармакокинетическая модель 2,4-толуилендиамина, выщелоченного из грудных имплантатов, покрытых полиуретановой пеной» . Перспектива здоровья окружающей среды . 106 (7): 393–400. дои : 10.2307/3434066 . JSTOR 3434066 . ПМЦ 1533137 . ПМИД 9637796 .
- ^ Хестер Т.Р., Теббетс Дж.Б., Максвелл Г.П. (2001). «Протез молочной железы с полиуретановым покрытием: факты и вымысел (II): взгляд назад и взгляд вперед». Клиническая пластическая хирургия . 28 (3): 579–86. дои : 10.1016/S0094-1298(20)32397-X . ПМИД 11471963 .
- ^ Браун М.Х., Шенкер Р., Сильвер С.А. (2005). «Грудные имплантаты из когезионного силиконового геля в эстетической и реконструктивной хирургии груди». Пластическая и реконструктивная хирургия . 116 (3): 768–779, обсуждение 779–1. дои : 10.1097/01.prs.0000176259.66948.e7 . ПМИД 16141814 . S2CID 35392851 .
- ^ Фрусторфер Б.Х., Ходжсон Э.Л., Малата К.М. (2004). «Ранний опыт использования анатомических мягких когезивных силиконовых гелевых протезов в косметической и реконструктивной хирургии грудных имплантатов». Анналы пластической хирургии . 53 (6): 536–542. дои : 10.1097/01.sap.0000134508.43550.6f . ПМИД 15602249 . S2CID 24661896 .
- ^ Хеден П., Джернбек Дж., Хобер М. (2001). «Увеличение груди с помощью имплантатов из анатомического когезивного геля: крупнейший в мире текущий опыт». Клиники пластической хирургии . 28 (3): 531–552. дои : 10.1016/S0094-1298(20)32393-2 . ПМИД 11471959 .
- ^ Грудное вскармливание после операции на груди. Архивировано 30 декабря 2010 г. в Wayback Machine , Лига Ла-Лече, содержит ссылки.
- ^ Грудное вскармливание и грудные имплантаты. Архивировано 31 декабря 2010 г. в Wayback Machine , Избранная библиография, апрель 2003 г., LLLI Центр информации о грудном вскармливании.
- ^ Jump up to: а б Неорганическое молоко: может ли Кендра Уилкинсон кормить ребенка грудью, даже если у нее есть имплантаты? Архивировано 25 января 2010 г. в Wayback Machine , Кристофер Бим, Slate.com , 11 декабря 2009 г.
- ^ Гендель Н., Сильверстайн М.Дж., Гамагами П., Дженсен Дж.А., Коллинз А. (1992). «Факторы, влияющие на маммографическую визуализацию груди после аугментационной маммопластики». ДЖАМА . 268 (14): 1913–1917. дои : 10.1001/jama.268.14.1913 . ПМИД 1404718 .
- ^ О'Киф-младший, Уилкинсон Дж.М., Спур К.М. (июнь 2020 г.). «Современная практика маммографии увеличенной груди в Австралии» . Журнал медицинских радиационных наук . 67 (2): 102–110. дои : 10.1002/jmrs.374 . ПМЦ 7276184 . ПМИД 31981297 .
- ^ Кларк С.П., Питерс Г.Н., О'Брайен К.М. (1993). «Рак увеличенной груди: диагностика и прогноз» . Рак . 72 (7): 2170–4. doi : 10.1002/1097-0142(19931001)72:7<2170::AID-CNCR2820720717>3.0.CO;2-1 . PMID 8374874 .
- ^ Скиннер К.А., Зильберман Х., Догерти В., Гамагами П., Вайсман Дж., Спосто Р., Сильверстайн М.Дж. (2001). «Рак молочной железы после аугментационной маммопластики». Энн Сург Онкол . 8 (2): 138–44. дои : 10.1007/s10434-001-0138-x . ПМИД 11258778 . S2CID 26010159 .
- ^ Jump up to: а б Ле ГМ, О'Мэлли КД, Глейзер С.Л., Линч К.Ф., Стэнфорд Дж.Л., Киган Т.Х., Вест Д.В. (2005). «Грудные имплантаты после мастэктомии у женщин с раком молочной железы на ранней стадии: распространенность и влияние на выживаемость» . Рак молочной железы . 7 (2): Р184–93. дои : 10.1186/bcr974 . ПМЦ 1064128 . ПМИД 15743498 .
- ^ Гендель Н., Сильверштейн М.Дж. (2006). «Диагностика и прогноз рака молочной железы у аугментированных женщин». Пластическая и реконструктивная хирургия . 118 (3): 587–93. дои : 10.1097/01.prs.0000233038.47009.04 . ПМИД 16932162 . S2CID 36277679 .
- ^ Каннингем Б. (2006). «Диагностика и прогноз рака молочной железы у аугментированных женщин. Дискуссия». Пластическая и реконструктивная хирургия . 118 (3): 594–595. дои : 10.1097/01.prs.0000233047.87102.8e . S2CID 220562548 .
- ^ Шварц Г.Ф., Веронези У., Клаф К.Б., Диксон Дж.М., Фентиман И.С., Хейванг-Кёбруннер С.Х., Холланд Р., Хьюз К.С., Мансел Р.Э., Марголезе Р., Мендельсон Э.Б., Оливото И.А., Палаццо Дж.П., Солин Л.Дж. (2006). «Консенсусная конференция по сохранению груди». Журнал Американского колледжа хирургов . 203 (2): 198–207. doi : 10.1016/j.jamcollsurg.2006.04.009 . ПМИД 16864033 .
- ^ Лавин Э., Холовати Э.Дж., Пан С.Ю., Вильнёв П.Дж., Джонсон К.С., Фергюссон Д.А. и др. (апрель 2013 г.). «Выявление рака молочной железы и выживаемость среди женщин с косметическими грудными имплантатами: систематический обзор и метаанализ наблюдательных исследований» . БМЖ . 346 (1 апреля 29): ф2399. дои : 10.1136/bmj.f2399 . ПМИД 23637132 .
- ^ Хван Э.С., Лихтенштайн Д.Ю., Гомес С.Л., Фаубл Б., Кларк Калифорния (апрель 2013 г.). «Выживаемость после лампэктомии и мастэктомии при инвазивном раке молочной железы на ранней стадии: влияние возраста и статуса гормональных рецепторов» . Рак . 119 (7): 1402–11. дои : 10.1002/cncr.27795 . ПМК 3604076 . ПМИД 23359049 .
- ^ Jump up to: а б «Нежелательные явления при грудном имплантате во время маммографии» . Федеральное управление по лекарственным средствам . 18 января 2018 г. Архивировано из оригинала 19 сентября 2020 г.
- ^ Черни V (1895). «Пластическая замена оболочки молочной железы липомой». Центральный журнал хирургии . 27:72 .
- ^ Глиценштейн Дж. (апрель 2007 г.). «[Первые «наполнители», вазелин и парафин. От чуда к катастрофе]». Анналы пластической и эстетической хирургии . 52 (2): 157–61. дои : 10.1016/j.anplas.2006.05.003 . ПМИД 16860452 .
- ^ Комитет Института медицины (США) по безопасности силиконовых грудных имплантатов, Бондурант С., Эрнстер В., Хердман Р. и др. (Комитет по безопасности силиконовых грудных имплантатов) (1999). Бондюран С., Эрнстер В., Хердман Р. (ред.). Безопасность силиконовых грудных имплантатов . Институт медицины. п. 21. дои : 10.17226/9602 . ISBN 0-309-06532-1 . ПМИД 20669503 . Архивировано из оригинала 13 марта 2007 г.
- ^ Андерсон Н. (1997). «Судебная наука: уроки спора о силиконовых грудных имплантатах». Обзор права Нью-Йоркской юридической школы . 41 (2): 401–07.
- ^ Jump up to: а б с д и ж г час «Справочник FDA для потребителей грудных имплантатов – 2004 г.» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 17 сентября 2008 года.
- ^ Комитет Медицинского института (США) по безопасности силиконовых грудных имплантатов, Бондюрант С., Эрнстер В., Хердман Р. (1999). Безопасность силиконовых грудных имплантатов - Пресса национальных академий . дои : 10.17226/9602 . ISBN 978-0-309-15740-7 . ПМИД 20669503 .
{{cite book}}:|work=игнорируется ( помогите ) - ^ Григг М., Бондюрант С., Эрнстер В.Л., Хердман Р. (2000). Григг М., Бондюрант С., Эрнстер В.Л., Хердман Р. (ред.). Информация для женщин о безопасности силиконовых грудных имплантатов — The National Academies Press . дои : 10.17226/9618 . ISBN 978-0-309-06593-1 . ПМИД 20669498 .
{{cite book}}:|work=игнорируется ( помогите ) - ^ «Исследование FDA» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 13 января 2008 года.
- ^ «Одобрение FDA» . FDA.gov . Архивировано из оригинала 30 марта 2009 года . Проверено 28 апреля 2018 г.
- ^ «Одобрение FDA» . FDA.gov . Архивировано из оригинала 26 мая 2009 года . Проверено 28 апреля 2018 г.
- ^ «FDA одобрило грудные имплантаты, наполненные силиконовым гелем» . FDA. Архивировано из оригинала 26 июля 2008 г. Проверено 1 июля 2008 г.
- ^ «25–26 марта 2019 г.: Объявление о заседании комиссии по устройствам для общей и пластической хирургии Консультативного комитета по медицинским приборам» . Управление по контролю за продуктами и лекарствами США . 25 апреля 2019 г.
- ^ «FDA просит компанию Allergan добровольно отозвать с рынка текстурированные грудные имплантаты Natrelle BIOCELL и расширители тканей для защиты пациентов: сообщение FDA о безопасности» . Управление по контролю за продуктами и лекарствами США . 1 июня 2020 г.
- ^ Jump up to: а б «Вопросы и ответы о грудных имплантатах» . Управление по контролю за продуктами и лекарствами США. Октябрь 2010 г. Архивировано из оригинала 12 ноября 2010 г.