Ингибитор металлопротеазы
Ингибиторы металлопротеаз представляют собой клеточные ингибиторы матриксных металлопротеиназ (ММП). [ 1 ] ММП принадлежат к семейству цинк -зависимых нейтральных эндопептидаз . [ 2 ] Эти ферменты обладают способностью разрушать соединительную ткань . Экспрессия ММП увеличивается при различных патологических состояниях, таких как воспалительные состояния, метаболические заболевания костей, раковая инвазия, метастазирование и ангиогенез . Примерами заболеваний являются пародонтит , гепатит , гломерулонефрит , атеросклероз , эмфизема , астма , аутоиммунные нарушения кожи и фотостарение кожи, ревматоидный артрит , остеоартрит , рассеянный склероз , болезнь Альцгеймера , хронические язвы, инволюция матки, дефекты эпителия роговицы , резорбция кости и прогрессирование опухоли. и метастазы. [ 2 ] [ 3 ] Благодаря роли ММП в патологических состояниях ингибиторы ММП могут иметь терапевтический потенциал. [ 3 ] Несколько других белков обладают аналогичным ингибирующим действием, однако ни один из них не является столь эффективным (нетрины, усилитель С-концевой протеиназы проколлагена (PCPE), индуцирующий реверсию богатый цистеином белок с мотивами Казала (RECK) и ингибитор пути тканевого фактора (TFPI-2)). Они могут обладать и другой биологической активностью, которая еще полностью не охарактеризована. [ 4 ]
Ингибиторы ММП можно в широком смысле разделить на несинтетические (например, эндогенные ) и синтетические . [ 2 ] Было идентифицировано несколько мощных ингибиторов ММП, включая гидроксиматы, тиолы , карбамоилфосфонаты , гидроксимочевины , гидразины , β-лактамы , квадратные кислоты и азотистые лиганды. [ 5 ]
Существует три класса обычно ингибиторов металлопротеиназ . используемых
- In vitro ЭДТА , 1,10 -фенантролин и другие хелатирующие соединения снижают концентрацию металла до такой степени, что металл удаляется из фермента активного центра .
- Классические ингибиторы замка и ключа, такие как фосфорамидон и бестатин, прочно связываются, приближая переходное состояние гидролиза пептида, предотвращая его действие на другие субстраты.
- белковые ингибиторы, такие как α2- макроглобулин, действуют на металлопротеиназы. Известно, что
История
[ редактировать ]Ингибиторы ММП первого поколения были основаны на структуре молекулы коллагена . Эта группа ингибиторов содержит группу гидроксамата цинка (-CONHOH), которая связывает атом в активном центре фермента ММП. [ 6 ] Первыми ингибиторами ММП, которые были протестированы на пациентах, были Иломастат и Батимастат , ингибиторы ММП на основе гидроксамата. [ 6 ] [ 7 ] Однако ни одно из соединений не показало хорошей биодоступности при пероральном приеме . [ 6 ]
На сегодняшний день Периостат (действующее вещество — гиклат доксициклина) является единственным ингибитором ММП, одобренным Управлением по контролю за продуктами и лекарствами США (FDA). Применяется для лечения пародонтита. Другие ингибиторы ММП продемонстрировали серьезные побочные эффекты в ходе доклинических испытаний . Эти побочные эффекты вызваны недостаточной селективностью . Большинство ингибиторов ММП не способны воздействовать на определенные ММП, связанные с конкретными патологическими состояниями . Вместо этого они ингибируют несколько ММП, некоторые из которых обладают защитными функциями или не связаны с патологией. [ 5 ]
ММП считаются многообещающими мишенями для терапии рака. Доклинические исследования по изучению эффективности подавления ММП на моделях опухолей были обнадеживающими. После этих результатов были проведены клинические исследования, но они оказались разочаровывающими. Недавние исследования показали, что ММП могут играть даже парадоксальную роль в прогрессировании опухоли. ММП, по-видимому, обладают эффектами, способствующими развитию опухолей, а также эффектами, подавляющими опухоль, в зависимости от различных контекстов. [ 8 ]
Механизм действия
[ редактировать ]
Большинство ингибиторов ММП являются хелатирующими агентами . Ингибитор связывается с цинком в активном центре фермента, тем самым блокируя его активность. Возможны и другие механизмы ингибитора. [ 1 ]
α2-макроглобулин (α2M) представляет собой ингибитор протеазы , ингибирующий активированные MMP. α2M и ММП образуют комплекс , который способен инактивировать ММП. [ 9 ]
ММП связаны с поверхностью клетки или связаны с внеклеточным матриксом , что предотвращает их диффузию и удерживает ММП под контролем клетки. Одним из механизмов ингибирования активности ММП является вытеснение ферментов из их рецепторов . золота Соли связываются с сайтом тяжелого металла, отличным от цинксодержащего активного центра, который ингибирует их активность. Активность ММП можно снизить путем связывания с сайтом расщепления на субстрате, например катехине . [ 1 ]
две молекулярные ответственны За сродство особенности большинства ингибиторов ММП . Один представляет собой хелатирующий фрагмент , который взаимодействует с ионом цинка, а другой представляет собой гидрофобное продолжение каталитического сайта, которое выступает в карман S1' (группа P1') металлопротеиназы. Структурные различия ММП заключаются в основном на стороне S1', и модифицируя группу P1', можно развить селективность ингибитора. [ 10 ]
Разработка лекарств
[ редактировать ]В следующих разделах будут описаны различные потенциальные ингибиторы ММП, включая информацию об их разработке, взаимосвязи структура-активность и фармакокинетике.
Новаторские структуры гидроксамата
[ редактировать ]Ингибиторы ММП первого поколения были основаны на структуре молекулы коллагена. В конструкции этих ингибиторов основная белковая основа коллагена сохраняется, но амидная связь заменяется цинксвязывающей группой. [ 11 ] Эта группа ингибиторов содержит группу гидроксамата (-CONHOH), которая связывает атом цинка в активном центре фермента ММП, поэтому эту группу называют «ингибиторами ММП на основе гидроксамата». [ 6 ] Пример можно увидеть в маримастате , ингибиторе первого поколения, который имеет структуру основной цепи и боковой цепи, аналогичную коллагену.

Иломастат и батимастат были первыми двумя ингибиторами ММП, протестированными на пациентах. Оба они представляют собой ингибиторы ММП на основе гидроксамата и имеют схожую общую структуру.

Ингибиторы ММП на основе гидроксамата демонстрируют превосходную противораковую активность в опухолевых клетках, но клинические характеристики этих соединений оказались разочаровывающими. Фактором, способствующим этому разочарованию, было то, что они являются ингибиторами широкого спектра действия многих подтипов MMP, которые во многих случаях могут также ингибировать членов семейства протеаз ADAM. они вызывали дозолимитирующую мышечную и скелетную боль. Когда они были испытаны на пациентах , у ряда пациентов [ 5 ] [ 7 ] Только когда структуры ингибиторов ММП смогут быть скорректированы для придания селективности и устранения токсичности , они смогут достичь клинического эффекта при химиотерапии рака. [ 7 ]
Ингибиторы нового поколения на основе гидроксаматов
[ редактировать ]За новаторскими ингибиторами на основе гидроксаматов последовал набор молекул «нового поколения», включающих замещенный арил , сульфонамид и гидроксамата цинксвязывающую группу .

В MMI-270 также имеется заместитель аминокислотного типа на углероде, который является α-по отношению к гидроксамату, наряду с боковой цепью сульфонамида (который, как позже было показано, не нужен). Гидроксамат N-арилсульфонил-α-аминокислоты MMI-270 имитирует сукцинатный мотив маримастата. Ципемастат , который был разработан как 1 , -3 и -9 для лечения ревматоидного ингибитор коллагеназы MMP - и остеоартрита , также имеет сукцинатный мотив маримастата. Клинические испытания препарата были прекращены досрочно.
MMI-166 имеет N-арилсульфонил-α-аминокарбоксилатную цинксвязывающую группу, отличную от группы, связывающей гидроксамат-цинк, наблюдаемой в MMI-270 и ципемастате. Он также имеет триарильное замещение, которого нет в других структурах. ABT-770 и Приномастат также имеют арильное замещение. В ABT-770 два фенильных кольца соединены напрямую, а в Приномастате два фенильных кольца соединены атомом кислорода , образуя дифениловый эфир . Эти три перестановки направляют SAR от MMP-1 к «глубоким карманным» MMP, таким как желатиназы . ABT-770 проявляет противораковую активность на животных моделях, но легко метаболизируется до аминного метаболита , вызывающего фосфолипидоз . MMI-166 продемонстрировал противораковую активность на многочисленных моделях животных, но данные о его клинической эффективности отсутствуют. Приномастат, с другой стороны, является одним из наиболее изученных ингибиторов ММП. Он показал отличную доклиническую противораковую эффективность на животных , но постоянным ограничением этих гидроксаматов (в частности, Приномастата) является метаболизм лекарств, включая потерю цинксвязывающей группы гидроксамата.

За этими ингибиторами последовала следующая группа ингибиторов на основе гидроксамата, которые направлены на подавление метаболизма, минимизацию ингибирующей активности MMP-1 и контроль селективности подтипа с помощью структурного дизайна. Тетрагидропиран стерический в RS-130830 вводит блок , подавляющий метаболизм, что могло бы решить проблему, обнаруженную ингибиторами предыдущего поколения. Результаты клинической оценки пока не разглашаются. 239796-97-5 обладает улучшенными свойствами селективности к ADME и MMP-1 и демонстрирует превосходную эффективность при пероральном приеме на модели остеоартрита на животных. Однако терапевтическими целями этих ингибиторов не является рак, как это было в случае большинства ингибиторов ММП. [ 7 ]
Ингибиторы нового поколения на основе тиолов
[ редактировать ]
Ребимастат представляет собой ингибитор ММП широкого спектра действия с тиол- цинк-связывающей группой. Он обладает биодоступностью при пероральном приеме и является непептидным миметиком коллагена. Ребимастат обладает некоторой селективностью, поскольку не подавляет все функции ММП. Металлопротеиназы, которые высвобождают TNF-альфа , TNF-II, L-селектин , IL-1-RII и IL-6 , например, не ингибируются Ребимастатом.
В I фазе клинических исследований не наблюдалось признаков дозозависимой совместной токсичности и стабилизации заболевания. Артралгия была отмечена на ранних стадиях исследований рака молочной железы II фазы , что было связано с токсичностью ингибитора ММП. Ребимастат использовался при лечении паклитакселом / карбоплатином в III фазе. Результаты исследования показали более высокую частоту побочных реакций без увеличения выживаемости.

Клинические испытания таномастата , альфа-((фенилтио)метил)карбоксилата, показали аналогичные результаты. Он показал хорошую устойчивость к заболеванию и переносимость в исследованиях солидных опухолей фазы I и хорошую переносимость при распространенном раке в сочетании с этопозидом . Однако его эффективность не оказалась достаточной. Таномастат показал значительную гепатотоксичность при лечении рака в сочетании с цисплатином и этопозидом, хотя при лечении доксорубицином он показал хорошую переносимость и снижение токсичности 5-фторурацилом и лейковорином .
Многие соединения тиол-цинк-связывающих групп обладают хорошей растворимостью в воде и стабильны на воздухе в плазме , и эти группы будут продолжены в разработке ингибиторов ММП. [ 7 ]
Ингибиторы на основе пиримидина
[ редактировать ]
Ro 28-2653 обладает высокой селективностью в отношении ММП-2 , ММП-9 и мембранного типа 1 ( МТ-1 )-ММП. Это противоопухолевое и антиангиогенное средство с биодоступностью при пероральном приеме. Ингибирование TACE и MMP-1 связано с побочными эффектами на опорно-двигательный аппарат, наблюдаемыми у ингибиторов гидроксаматной металлопротеиназы, но это соединение щадит ферменты. [ 12 ] Было показано, что он уменьшает рост опухоли при раке носа у крыс, а также простаты рака в культурах клеток . Соединение оказывает лишь умеренное воздействие на жировую ткань мышей и не оказывает никакого влияния на суставы. На основании этого делается вывод, что класс ингибиторов с меньшей вероятностью вызывает нервно-мышечные побочные эффекты. В активном центре структуры находится пиримидинтриона хелат , а фенильная и пиперидинильная части занимают S1' и S2' связывающие карманы ММП-8 .
Соединение 556052-30-3 аналогично Ro 28-2653, но включает боковую цепь 4-((2-метилхинолин-4-ил)метокси)фенила, которая является селективной по ТАСЕ.
5-(спиропирролидин-5-ил)пиримидинтрион представляет собой соединение под названием 848773-43-3, которое является мощным ингибитором ММП-2, ММП-9 и ММП-13, которое щадит ММП-1 и ТАСЕ.
Заместив 1,3,4-оксадиазол-2-илгетероарил на C-4' сегмента дифенилового эфира для достижения селективности MMP-13 по сравнению с MMP MT-1, получили соединение 420121-84-2. Соединение имеет IC 50 (половина максимальной ингибирующей концентрации) 1 нМ для ММП-13.
Радиоактивные I125 пиримидинтрионы, имеющие аналогичную структуру, были созданы для использования при атеросклерозе с повышенным уровнем MMP-9 и раке с повышенным уровнем MMP-2 и MMP-9.
Этот класс ингибиторов ММП легко синтезировать , и он достаточно эффективен для клинической оценки.


Соединение 544678-85 является новейшим ингибитором на основе пиримидина. Это соединение представляет собой пиримидин-4,6-дикарбоксамид, который очень эффективен и селективен в отношении MMP-13. Соединение имеет петлю специфичности, которая находится внутри кармана S1', а его 3-метил-4-фторгруппа находится достаточно близко к цинку, чтобы изменить водную структуру. Эти соединения обладают хорошей биодоступностью при пероральном приеме и свойствами, которые делают их хорошими кандидатами на роль ингибиторов подтипа заболеваний, связанных с ММП-13, и будущих разработок. [ 7 ]
Пиримидиндикарбоксамиды . являются высокоселективными ингибиторами ММП-13 В S1'-кармане MMP-13 имеется боковой S1'-карман, уникальный для матриксной металлопротеазы. Пиримидиндикарбоксамиды связываются с этим боковым карманом, что увеличивает селективность. Роль MMP-13 заключается в расщеплении фибриллярного коллагена при нейтральном pH , а более высокие уровни мРНК MMP-13 обнаруживаются при карциноме молочной железы и остеоартрите суставов.
Пример ингибитора пиримидиндикарбоксамида на изображении не взаимодействует с каталитическим ионом цинка, а скорее связывается с боковым карманом S1'. [ 10 ] Одно пиридиловое плечо расположено у входа в карман S1', а другое пиридиловое плечо проходит через карман S1' в боковой карман. [ 13 ]
Ингибиторы на основе гидроксипирона
[ редактировать ]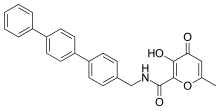
Мощные и селективные ингибиторы ММП-3 были разработаны с использованием гидроксипирона в качестве группы, связывающей цинк. Присоединение арильного остова ко 2-положению пиронового кольца позволило добиться большей селективности. В гидроксипироновом кольце доступны три положения для прикрепления основных цепей: положение 2-, 5- и 6-. [ 14 ]
Ингибиторы ММП на основе гидроксипирона структурно соответствуют пиримидинтрионам. Недавним ингибитором является соединение 3-гидроксипиран-4-он под номером 868368-30-3. Он селективен к ММП-3 , и его 0,0- бидентатная хелатная хелатация цинка является структурной частью, которая, как предполагается, отвечает за распознавание ММП . [ 7 ]
Ингибиторы на основе фосфора
[ редактировать ]
Исследование ингибиторов ММП с фосфора цинксвязывающими группами на основе было сосредоточено на α-бифенилсульфониламинофосфонатах. Эти ингибиторы связываются через два атома кислорода фосфоната. Были разработаны фосфонатные ингибиторы, которые проявляют селективность в отношении ММП-8 по сравнению с другими ММП. Селективные ингибиторы ММП-8 могут быть полезны при лечении острых заболеваний печени и рассеянного склероза. [ 15 ] Сообщалось, что фосфиновые ингибиторы ММП воздействуют на ММП-11 и ММП-13. MMP-13 играет роль в хряща деградации при остеоартрите. Эти фосфинатные ингибиторы ММП содержат фенильные сегменты, которые, как полагают, отвечают за селективность по отношению к ММП-13. Фосфиновая группа этих ингибиторов (R 1 Р 2 (O)OH) связывается как лиганд цинка. Р 1 и Р 2 заместители влияют на эффективность ингибирования. [ 7 ]
Разработаны фосфинатные ингибиторы, показавшие высокую селективность в отношении ММП-11. производные Наилучшую селективность показали на основе фенильных колец. MMP-11 может быть полезной мишенью для онкогенеза при раке молочной железы.

Ингибиторы на основе фосфора с карбамоилфосфонатными цинксвязывающими группами не связывают два кислорода фосфоната. Карбамоилфосфонатные группы цинка связывают Zn 2+ через кислород фосфоната и кислород альфа -карбонила в фосфонат. Это связывание образует 5-членное хелатное кольцо, похожее на связывание гидроксамовой кислоты.
Амидная связь карбамоилфосфоната обеспечивает донор водородной связи для взаимодействий с белками , а амидная группа обладает способностью отдавать электроны , что обеспечивает сильный Zn. 2+ хелатирование.
Связывающие группы карбамоилфосфоната цинка имеют суммарный отрицательный заряд , который препятствует проникновению этих ингибиторов в клетки и ограничивает их проникновение во внеклеточное пространство. Такое предотвращение проникновения в клетки способствует низкой токсичности этих ингибиторов. Ингибиторы с карбамоилфосфонатной цинксвязывающей группой являются селективными в отношении ММП-2 . ММП-2 может быть полезной мишенью для опухолевой инвазии и ангиогенеза . Был разработан ингибитор карбамоилфосфоната, который влияет на ММП-2 и ММП-9, не затрагивая другие ММП. Это соединение показало ингибирующую активность в отношении клеточной инвазии и колонизации опухоли . В исследованиях in vivo этот ингибитор показал эффективность при пероральном приеме и введении в брюшную полость (внутрибрюшинно). Он демонстрирует медленную абсорбцию , быстрое выведение и низкую биодоступность при пероральном приеме . Длительное всасывание способствует устойчивой эффективности. Ингибиторы с карбамоилфосфонатными цинксвязывающими группами растворимы в воде при физиологическом pH. [ 15 ]
Ингибиторы на основе тетрациклина
[ редактировать ]
Тетрациклины — это антибиотики , которые также проявляют ингибирующую активность в отношении ММП. Они хелатируют Zn 2+ ион, тем самым ингибируя активность ММП. Считается, что тетрациклины также влияют на экспрессию ММП и протеолитическую активность. [ 16 ]
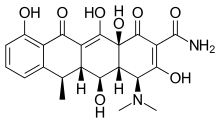
Доксициклин — это полусинтетический тетрациклин, который изучался для применения в стоматологии и медицине. его влияние на такие заболевания, как пародонтит и рак. Было исследовано [ 2 ] Доксициклин всасывается практически полностью, биодоступность в среднем составляет около 95% и снижается на 20% при одновременном приеме с пищей. Объем его распределения составляет 50–80 л (0,7 л/кг). Связывание с белками составляет 82–93 %. Выводится с мочой и калом. Доксициклин доступен в пероральной и внутривенной форме. [ 17 ] Доксициклин проявлял ингибирующую активность в отношении ММП-2 и ММП-9. [ 2 ] Экспрессия и активность ММП-2 и ММП-9 часто повышены при раке человека. Повышенная экспрессия и активность коррелируют с поздней стадией опухоли, увеличением метастазов и прогнозом . [ 8 ]
Химически модифицированные тетрациклины (CMT) были разработаны для изучения их ингибирующего потенциала. Большинство исследований тетрациклинов и ШМТ показали, что они могут ингибировать активность ММП.

Было продемонстрировано, что один ШМТ, называемый COL-3 или метастат, является мощным ингибитором ММП. COL-3 имеет тетрациклиновый каркас, незамещенный в положениях C4–C9. [ 16 ]
Преимущества ШМТ перед обычными тетрациклинами заключаются в том, что хроническое применение не приводит к желудочно-кишечной токсичности, а более высокие уровни в плазме могут быть достигнуты в течение длительного периода времени, что снижает частоту введения .
Фармакокинетика COL - 3 изучалась на крысах. COL-3 медленно всасывается из желудочно-кишечного тракта. 3% выводится через мочевыводящие пути , а 55–66% выводится с калом. Препарат липофильностью высокой обладает и способен преодолевать гематоэнцефалический барьер в более высоких дозах. COL-3 накапливается в более высоких концентрациях в сердца тканях и яичках .
В клинических исследованиях было показано, что связывание с белками плазмы высокое (~94,5%). Большая часть COL-3 связывается с сывороточным альбумином . [ 2 ]
Эндогенные ингибиторы
[ редактировать ]Активность ММП регулируется на различных уровнях, например, с помощью эндогенных ингибиторов, таких как α2-макроглобулин, и тканевых ингибиторов металлопротеиназ (ТИМП). [ 18 ]
α2-макроглобулин регулирует широкий спектр протеаз , тогда как ТИМП являются более специфическими эндогенными ингибиторами ММП.
α2-макроглобулин — это распространенный белок плазмы, который действует в тканевых жидкостях. [ 8 ] плазмы Гликопротеин состоит из четырех субъединиц. [ 19 ] α2-макроглобулин не ингибирует активацию ММП или самих ММП. [ 8 ] Он захватывает протеиназы, такие как ММП, и образует с ними комплекс . [ 19 ] Комплекс эндоцитозируется и очищается белком, родственным рецептору липопротеинов низкой плотности . [ 8 ]
У человека обнаружено 4 различных ТИМП. Они представляют собой секретируемые белки с низкой молекулярной массой . ТИМП нековалентно связываются с активным центром ММП. [ 18 ] Считается, что изменения уровней ТИМП играют роль в патологических состояниях, связанных с несбалансированной активностью ММП. [ 19 ] ТИМП состоят из 184-194 аминокислот. Эти ингибиторы подразделяются на два домена: N-концевой и C-концевой . [ 19 ] N-концевые области четырех ТИМП имеют общую структуру. Все они содержат двенадцать остатков цистеина , образующих шесть дисульфидных связей . Эти связи имеют решающее значение для конформации N-конца и его ингибирующей MMP активности. С-концы ТИМП отличаются друг от друга. [ 8 ] N-концевая субъединица способна ингибировать ММП. Форма молекулы ТИМП вписывается в активный центр ММП. ТИМП контактирует с каталитической щелью ММП так же, как и субстрат. ТИМП ингибируют все ММП, кроме ТИМП-1 , который не ингибирует МТ-1-ММП. [ 19 ]
Существуют некоторые различия в ингибирующих предпочтениях ТИМП. Например, ТИМП-1 способствует ингибированию ММП-9. Другими примерами являются ТИМП-2 и ТИМП-4 , которые являются более мощными ингибиторами ММП-2, чем ингибиторы ММП-9. [ 8 ]
ТИМП потенциально могут быть полезны против таких заболеваний, как сердечно-сосудистые заболевания и рак. Применение ТИМП в качестве терапевтического инструмента посредством генной терапии или прямого применения белков все еще находится на ранних стадиях разработки.
Предпочтительно ингибировать специфические MPP, которые играют роль в патологических состояниях. Поскольку ТИМП ингибируют несколько ММП, желательно разработать инженерные ТИМП с измененной специфичностью. [ 19 ]
Текущий статус
[ редактировать ]Основной целью разработки ингибиторов ММП является селективность. Ожидается, что нацеливание на конкретные ММП повысит эффективность и предотвратит побочные эффекты , такие как скелетно-мышечный синдром (МСС). [ 15 ] Трехмерные структуры ингибиторов ММП дают возможность понять структурные взаимосвязи селективности. Высокопроизводительный скрининг также может повысить шансы обнаружения ингибиторов с высокой селективностью. [ 13 ]
См. также
[ редактировать ]- Матриксная металлопротеиназа
- Ингибиторы ММП
- Коллаген
- Рак
- Пародонтит
- Артрит
- Ревматоидный артрит
- Остеоартрит
- Тетрациклин
- Периостат
Ссылки
[ редактировать ]- ^ Jump up to: а б с Фредерик, В. (1999). «Ингибирование матриксных металлопротеиназ: от юрского периода до третьего тысячелетия». Энн, Нью-Йоркская академия наук . 878 (1): 388–403. Бибкод : 1999NYASA.878..388W . дои : 10.1111/j.1749-6632.1999.tb07697.x . ПМИД 10415743 . S2CID 29467651 .
- ^ Jump up to: а б с д и ж Ачарья, MR; Вениц, Дж.; Фигг, В.Д.; Спарребум, А. (2004). «Химически модифицированные тетрациклины как ингибиторы матриксных металлопротеиназ». Обновления по лекарственной устойчивости . 7 (3): 195–208. дои : 10.1016/j.drup.2004.04.002 . ПМИД 15296861 .
- ^ Jump up to: а б Уиттакер, Марк; Эйскоу, Эндрю (2001). «Матричные металлопротеиназы и их ингибиторы - современное состояние и будущие проблемы». Клеточные передачи . 17 (1): 3–14.
- ^ Бейкер, Эндрю; Дилан Р. Эдвардс; Джиллиан Мерфи (октябрь 2002 г.). «Ингибиторы металлопротеиназ: биологическое действие и терапевтические возможности» . J Cell Sci . 115 (19): 3719–3727. дои : 10.1242/jcs.00063 . ПМИД 12235282 .
- ^ Jump up to: а б с Даррант, доктор медицинских наук; де Оливейра, CAF; Маккаммон, Дж.А. (2011). «Ингибиторы металлопротеиназ типов 2 и 3 на основе пиронов могут действовать как конформационно-селективные ингибиторы» . Химическая биология и дизайн лекарств . 78 (2): 191–198. дои : 10.1111/j.1747-0285.2011.01148.x . ПМК 3135671 . ПМИД 21609408 .
- ^ Jump up to: а б с д Браун, П.Д. (1997). «Ингибиторы матриксных металлопротеиназ в лечении рака». Медицинская онкология . 14 (1): 1–10. дои : 10.1007/BF02990939 . ПМИД 9232605 . S2CID 23756350 .
- ^ Jump up to: а б с д и ж г час Фишер, Дж. Ф.; Мобашеры, С. (2006). «Последние достижения в разработке ингибиторов ММП» . Раковые метастазы Rev. 25 (1): 115–136. дои : 10.1007/s10555-006-7894-9 . ПМИД 16680577 .
- ^ Jump up to: а б с д и ж г Хуа, Х.; Ли, М.; Луо, Т; Инь, Ю.; Цзян, Ю (2011). «Матричные металлопротеиназы в опухолегенезе: развивающаяся парадигма» . Клеточные и молекулярные науки о жизни . 68 (23): 3853–3868. дои : 10.1007/s00018-011-0763-x . ПМЦ 11114831 . ПМИД 21744247 . S2CID 5987143 .
- ^ Чен, Дж.; Чу, Ю.; Цао, Дж.; Ван, В.; Лю, Дж.; Ван, Дж. (2011). «Влияние токсина Т-2 и селена на экспрессию хондроцитами матриксных металлопротеиназ (MMP-1, MMP-13), α2-макроглобулина (α2M) и TIMP». Токсикология in vitro . 25 (2): 492–499. дои : 10.1016/j.tiv.2010.12.001 . ПМИД 21144892 .
- ^ Jump up to: а б Энгель, КК; Пирар, Б.; Шимански, С.; Кирш, Р.; Хаберманн, Дж.; Клинглер, О.; Вендт, КУ (2005). «Структурная основа высокоселективного ингибирования MMP-13» . Химия и биология . 12 (2): 181–189. doi : 10.1016/j.chembiol.2004.11.014 . ПМИД 15734645 .
- ^ Уиттакер, М.; Флойд, компакт-диск; Браун, П.; Гиринг, AJH (1999). «Разработка и терапевтическое применение ингибиторов матриксных металлопротеиназ». хим. Преподобный . 99 (9): 2735–2776. дои : 10.1021/cr9804543 . ПМИД 11749499 .
- ^ Макуа, Э.; Сунни, Невада; Деви, Л.; Оливье, Ф.; Франкенн, Ф.; Крелл, Х.В.; Ноэль, А. (2004). «Противоинвазивная, противоопухолевая и антиангиогенная эффективность производного пиримидин-2,4,6-триона, перорально активного и селективного ингибитора матриксных металлопротеиназ» . Клин Рак Рес . 10 (12): 4038–4047. дои : 10.1158/1078-0432.ccr-04-0125 . ПМИД 15217936 .
- ^ Jump up to: а б Пирар, Б. (2007). «Понимание структурных детерминант селективного ингибирования матриксных металлопротеиназ». Открытие наркотиков сегодня . 12 (15–16): 640–646. дои : 10.1016/j.drudis.2007.06.003 . ПМИД 17706545 .
- ^ Ян, Ю.-Л.; Миллер, Монтана; Цао, Ю.; Коэн, С.М. (2009). «Синтез ингибиторов матричных металлопротеиназ на основе гидроксипирона и гидрокситиопирона: развитие взаимосвязи структура-активность» . Письма по биоорганической и медицинской химии . 19 (7): 1970–1976. дои : 10.1016/j.bmcl.2009.02.044 . ПМЦ 2833267 . ПМИД 19261472 .
- ^ Jump up to: а б с Якобсен, Дж. А.; Майор Журден, JL; Миллер, Монтана; Коэн, С.М. (2010). «Связывать цинк или не связывать цинк: исследование инновационных подходов к улучшению ингибирования металлопротеиназ». Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1803 (1): 72–94. дои : 10.1016/j.bbamcr.2009.08.006 . ПМИД 19712708 .
- ^ Jump up to: а б Закери, Б.; Райт, Джорджия (2008). «Химическая биология тетрациклиновых антибиотиков». Биохимия и клеточная биология . 86 (2): 124–136. дои : 10.1139/o08-002 . ПМИД 18443626 .
- ^ Агву, КН; Макгоуэн, А. (2006). «Фармакокинетика и фармакодинамика тетрациклинов, включая глицилциклины» . Журнал антимикробной химиотерапии . 58 (2): 256–265. дои : 10.1093/jac/dkl224 . ПМИД 16816396 .
- ^ Jump up to: а б Рундхауг, JE (2003). «Матриксные металлопротеиназы, ангиогенез и рак». Клин Рак Рес . 9 (2): 551–554. ПМИД 12576417 .
- ^ Jump up to: а б с д и ж Нагасе, Х.; Виссе, Р.; Мерфи, Дж. (2006). «Структура и функции матриксных металлопротеиназ и ТИМП» . Сердечно-сосудистые исследования . 69 (3): 562–573. дои : 10.1016/j.cardiores.2005.12.002 . ПМИД 16405877 .