болезнь Альцгеймера
Эту статью необходимо обновить . ( март 2021 г. ) |
Болезнь Альцгеймера ( БА ) — нейродегенеративное заболевание , которое обычно начинается медленно и постепенно ухудшается. [2] и является причиной 60–70% случаев деменции . [2] [15] Наиболее распространенным ранним симптомом являются трудности с запоминанием недавних событий . [1] По мере прогрессирования заболевания симптомы могут включать проблемы с речью , дезориентацию (в том числе легко потеряться), перепады настроения , потерю мотивации , пренебрежение собой и поведенческие проблемы . [2] Когда состояние человека ухудшается, он часто уходит из семьи и общества . [16] Постепенно функции организма утрачиваются, что в конечном итоге приводит к смерти. Хотя скорость прогрессирования может варьироваться, средняя продолжительность жизни после постановки диагноза составляет от трех до двенадцати лет. [11] [12] [13]
Причина болезни Альцгеймера плохо изучена. [16] Существует множество экологических и генетических факторов риска, связанных с его развитием. Самый сильный генетический фактор риска связан аллелем аполипопротеина Е. с [17] [18] в анамнезе Другие факторы риска включают травмы головы , клиническую депрессию и высокое кровяное давление . [1] Прогресс болезни неправильного сворачивания белков в значительной степени связан с амилоидными бляшками , нейрофибриллярными клубками и потерей нейрональных связей в головном мозге . [19] Вероятный диагноз основывается на истории болезни и когнитивных тестах , а также медицинских визуализациях и анализах крови, чтобы исключить другие возможные причины. [8] [20] Первоначальные симптомы часто ошибочно принимают за нормальное старение мозга . [16] исследование тканей головного мозга Для установления точного диагноза необходимо , но оно может быть проведено только после смерти . [21] [22]
Никакое лечение не может остановить или обратить вспять его прогрессирование, хотя некоторые из них могут временно улучшить симптомы. [2] Здоровое питание, физическая активность и социальная активность , как правило, полезны при старении и могут помочь снизить риск снижения когнитивных функций и болезни Альцгеймера. [19] Пострадавшие люди становятся все более зависимыми от помощи других, что часто становится бременем для лиц, осуществляющих уход . [23] Давление может включать социальные, психологические, физические и экономические элементы. [23] Программы упражнений могут быть полезны в повседневной жизни и потенциально могут улучшить результаты. [24] Поведенческие проблемы или психозы, вызванные деменцией, иногда лечат антипсихотиками , но это повышает риск ранней смерти. [25] [26]
По состоянию на 2020 год во всем мире насчитывалось около 50 миллионов человек с болезнью Альцгеймера. [14] Чаще всего оно начинается у людей старше 65 лет, хотя до 10% случаев имеют раннее начало и поражают людей в возрасте от 30 до середины 60 лет. [27] [4] Им страдают около 6% людей 65 лет и старше. [16] и женщины чаще, чем мужчины. [28] Заболевание названо в честь немецкого психиатра и патологоанатома Алоиса Альцгеймера , впервые описавшего его в 1906 году. [29] Финансовое бремя болезни Альцгеймера для общества велико, его ежегодные глобальные затраты оцениваются в 1 триллион долларов США . [14] Он занимает седьмое место среди основных причин смертности в мире. [30]
Признаки и симптомы
Течение болезни Альцгеймера обычно описывают в три стадии с прогрессирующим характером когнитивных и функциональных нарушений . [31] [27] Три стадии описываются как ранние или легкие, средние или умеренные и поздние или тяжелые. [31] Известно, что заболевание поражает гиппокамп , отвечающий за память , и это ответственно за первые симптомы ухудшения памяти. По мере прогрессирования заболевания увеличивается и степень нарушения памяти. [19]
Первые симптомы

Первые симптомы часто ошибочно связывают со старением или стрессом . [32] Детальное нейропсихологическое тестирование может выявить легкие когнитивные нарушения за восемь лет до того, как человек будет соответствовать клиническим критериям диагностики болезни Альцгеймера. [33] Эти ранние симптомы могут повлиять на самые сложные действия в повседневной жизни . [34] Наиболее заметным недостатком является кратковременная потеря памяти, которая проявляется в трудностях запоминания недавно изученных фактов и неспособности усваивать новую информацию. [33]
Незначительные проблемы с исполнительными функциями внимания (памяти значений и взаимосвязей понятий) также могут быть , планирования , гибкости и абстрактного мышления или нарушения семантической памяти симптомами ранних стадий болезни Альцгеймера. [33] На этой стадии можно наблюдать апатию и депрессию, при этом апатия остается наиболее стойким симптомом на протяжении всего течения заболевания. [35] [36] Легкие когнитивные нарушения (MCI) часто оказываются переходной стадией между нормальным старением и деменцией . MCI может проявляться различными симптомами, и когда потеря памяти является преобладающим симптомом, это называется амнестическим MCI и часто рассматривается как продромальная стадия болезни Альцгеймера. [37] Амнезия MCI с вероятностью более 90% связана с болезнью Альцгеймера. [38]
Ранняя стадия
У людей с болезнью Альцгеймера возрастающее ухудшение способности к обучению и памяти в конечном итоге приводит к окончательному диагнозу. В небольшом проценте случаев трудности с речью, исполнительными функциями, восприятием ( агнозия ) или выполнением движений ( апраксия ) более выражены, чем проблемы с памятью. [39] Болезнь Альцгеймера не влияет одинаково на все возможности памяти. Затрагиваются старые воспоминания о жизни человека ( эпизодическая память ), усвоенные факты ( семантическая память ) и имплицитная память (память тела о том, как что-то делать, например, как есть вилкой или как пить из стакана). в меньшей степени, чем новые факты или воспоминания. [40] [41]
Языковые проблемы в основном характеризуются сокращением словарного запаса и снижением беглости слов , что приводит к общему обеднению устной и письменной речи . [39] [42] На этой стадии человек с болезнью Альцгеймера обычно способен адекватно передавать основные идеи. [39] [42] [43] При выполнении задач мелкой моторики, таких как письмо, рисование или одевание, определенные трудности с координацией движений и планированием ( апраксия ), но они обычно остаются незамеченными. могут присутствовать [39] По мере прогрессирования заболевания люди с болезнью Альцгеймера часто могут продолжать выполнять многие задачи самостоятельно, но могут нуждаться в помощи или присмотре при выполнении наиболее когнитивно требовательных действий. [39]
Средняя стадия
Прогрессирующее ухудшение в конечном итоге препятствует независимости, поскольку субъекты не могут выполнять большинство повседневных действий. [39] Речевые трудности проявляются из-за неспособности вспомнить словарный запас , что приводит к частым неправильным заменам слов ( парафазиям ). Навыки чтения и письма также постепенно утрачиваются. [39] [43] С течением времени сложные двигательные последовательности становятся менее скоординированными, а болезнь Альцгеймера прогрессирует, поэтому риск падения увеличивается. [39] На этом этапе ухудшаются проблемы с памятью, и человек может не узнавать близких родственников. [39] Долговременная память , которая раньше была неповрежденной, ухудшается. [39]
Поведенческие и нервно-психические изменения становятся более распространенными. Распространенными проявлениями являются блуждание , раздражительность и эмоциональная лабильность , приводящие к плачу, вспышкам непреднамеренной агрессии или сопротивлению уходу. [39] Также может появиться закат . [44] Примерно у 30% людей с болезнью Альцгеймера развиваются иллюзорные ошибочные идентификации и другие бредовые симптомы. [39] Субъекты также теряют понимание процесса и ограничений своего заболевания ( анозогнозия ). [39] Может развиться недержание мочи . [39] Эти симптомы создают стресс для родственников и лиц, осуществляющих уход, который можно уменьшить, переведя человека из дома для ухода в другие учреждения длительного ухода . [39] [45]
Поздняя стадия

На заключительной стадии, известной как поздняя или тяжелая стадия, наблюдается полная зависимость от лиц, осуществляющих уход. [19] [31] [39] Язык сводится к простым фразам или даже отдельным словам, что в конечном итоге приводит к полной потере речи. [39] [43] Несмотря на потерю вербальных языковых способностей, люди часто могут понимать и возвращать эмоциональные сигналы. Хотя агрессивность все еще может присутствовать, крайняя апатия и истощение гораздо более распространенными симптомами являются . Люди с болезнью Альцгеймера в конечном итоге не смогут самостоятельно выполнять даже самые простые задачи; мышечная масса и подвижность ухудшаются до такой степени, что они прикованы к постели и не могут питаться самостоятельно. Причиной смерти обычно является внешний фактор, например, инфекция пролежней или пневмония , а не само заболевание. [39] В некоторых случаях непосредственно перед смертью возникает парадоксальная ясность ума , при которой происходит неожиданное восстановление ясности ума. [46]
Причины
Считается, что болезнь Альцгеймера возникает, когда аномальное количество бета-амилоида (Aβ), накапливающееся внеклеточно в виде амилоидных бляшек и тау-белков или внутриклеточно в виде нейрофибриллярных клубков , образуется в головном мозге, влияя на функционирование и связь нейронов, что приводит к прогрессирующей потере функции мозга. . [47] [48] Эта измененная способность к выведению белка зависит от возраста и регулируется холестерином в мозге. [49] и связан с другими нейродегенеративными заболеваниями. [50] [51]
Причина большинства случаев болезни Альцгеймера до сих пор неизвестна. [14] за исключением 1–2% случаев, когда были выявлены детерминированные генетические различия. [17] Несколько конкурирующих гипотез пытаются объяснить основную причину; наиболее преобладающей гипотезой является гипотеза бета-амилоида (Aβ). [14]
Самая старая гипотеза, на которой основано большинство медикаментозных методов лечения, — это холинергическая гипотеза , которая предполагает, что болезнь Альцгеймера вызвана снижением синтеза нейромедиатора ацетилхолина . [14] Потеря холинергических нейронов, наблюдаемая в лимбической системе и коре головного мозга, является ключевым моментом в прогрессировании болезни Альцгеймера. [37] 1991 года Гипотеза амилоида постулировала, что внеклеточные отложения бета-амилоида (Aβ) являются основной причиной заболевания. [52] [53] Подтверждением этого постулата является расположение гена белка-предшественника амилоида (АРР) на хромосоме 21 , а также тот факт, что люди с трисомией 21 (синдром Дауна), имеющие дополнительную копию гена, почти всегда проявляют по крайней мере самые ранние симптомы. болезни Альцгеймера к 40 годам. [10] Специфическая изоформа аполипопротеина APOE4 является основным генетическим фактором риска болезни Альцгеймера. [15] Хотя аполипопротеины усиливают расщепление бета-амилоида, некоторые изоформы не очень эффективны для этой задачи (например, APOE4), что приводит к избыточному накоплению амилоида в мозге. [54]
Генетический
Позднее начало
В 70% случаев болезнь Альцгеймера с поздним началом передается по наследству . [55] [56] Генетические модели 2020 года предсказывают болезнь Альцгеймера с точностью 90%. [57] Большинство случаев болезни Альцгеймера не являются семейными , поэтому их называют спорадической болезнью Альцгеймера. [ нужна медицинская ссылка ] Большинство случаев спорадической болезни Альцгеймера имеют позднее начало и развиваются после 65 лет. [58]
Самым сильным генетическим фактором риска спорадической болезни Альцгеймера является APOEε4 . [18] APOEε4 является одним из четырех аллелей аполипопротеина Е (APOE). АРОЕ играет важную роль в липидсвязывающих белках в липопротеиновых частицах, а аллель ε4 нарушает эту функцию. [59] От 40 до 80% людей с болезнью Альцгеймера обладают хотя бы одним аллелем APOEε4. [60] Аллель APOEε4 увеличивает риск заболевания в три раза у гетерозигот и в 15 раз у гомозигот . [61] Как и многие болезни человека, воздействие окружающей среды и генетические модификаторы приводят к неполной пенетрантности . Например, у нигерийских людей йоруба не выявлена взаимосвязь между дозой APOEε4 и заболеваемостью или возрастом начала болезни Альцгеймера, наблюдаемой в других популяциях людей. [62] [63]
Раннее начало
Только 1–2% случаев болезни Альцгеймера наследуются по аутосомно-доминантному типу, поскольку болезнь Альцгеймера очень полигенна. Когда заболевание вызвано аутосомно-доминантными вариантами, оно известно как семейная болезнь Альцгеймера с ранним началом , которая встречается реже и имеет более быструю скорость прогрессирования. [17] Менее 5% спорадических случаев болезни Альцгеймера имеют более раннее начало. [17] а болезнь Альцгеймера с ранним началом примерно в 90% передается по наследству. [55] [56] ФАД обычно подразумевает, что заболевание затронуло несколько человек в одном или нескольких поколениях. [ нужна медицинская ссылка ] [64]
Раннее начало семейной болезни Альцгеймера может быть связано с мутациями в одном из трех генов: кодирующих белок-предшественник бета-амилоида (APP) и пресенилины PSEN1 и PSEN2 . [38] Большинство мутаций в генах APP и пресенилина увеличивают выработку небольшого белка, называемого бета-амилоидом (Aβ)42, который является основным компонентом амилоидных бляшек . [65] Некоторые мутации просто изменяют соотношение между Aβ42 и другими основными формами, особенно Aβ40, без увеличения уровней Aβ42 в мозге. [66] Двумя другими генами, связанными с аутосомно-доминантной болезнью Альцгеймера, являются ABCA7 и SORL1 . [67]
Аллели гена TREM2 связаны с повышенным риском развития болезни Альцгеймера в три-пять раз. [68]
Было обнаружено, что японская родословная семейной болезни Альцгеймера связана с делеционной мутацией кодона 693 АРР. [69] Об этой мутации и ее связи с болезнью Альцгеймера впервые сообщили в 2008 году. [70] и известна как мутация Осаки. Только гомозиготы с этой мутацией имеют повышенный риск развития болезни Альцгеймера. Эта мутация ускоряет олигомеризацию Aβ, но белки не образуют амилоидные фибриллы, которые агрегируются в амилоидные бляшки, что позволяет предположить, что причиной этого заболевания может быть олигомеризация Aβ, а не фибриллы. Мыши, экспрессирующие эту мутацию, имеют все обычные патологии болезни Альцгеймера. [71]
Гипотезы
Бета-амилоид и тау-белок

Гипотеза тау предполагает, что аномалии тау-белка инициируют каскад заболеваний. [53] В этой модели гиперфосфорилированный тау начинает спариваться с другими нитями тау в виде парных спиральных нитей . В конце концов, они образуют нейрофибриллярные клубки внутри тел нервных клеток. [72] Когда это происходит, микротрубочки клетки, распадаются, разрушая структуру цитоскелета что разрушает транспортную систему нейрона. [73]
Ряд исследований связывают неправильно свернутые белки бета-амилоида и тау-амилоида с патологией болезни Альцгеймера, поскольку они вызывают окислительный стресс , который приводит к нейровоспалению . [74] Это хроническое воспаление также характерно для других нейродегенеративных заболеваний, включая болезнь Паркинсона и БАС . [75] Инфекции спирохетами также связаны с деменцией. [14] Повреждения ДНК накапливаются в мозге при болезни Альцгеймера; активные формы кислорода могут быть основным источником повреждения ДНК. [76]
Спать
Нарушения сна рассматриваются как возможный фактор риска воспаления при болезни Альцгеймера. [77] Ранее нарушение сна рассматривалось только как следствие болезни Альцгеймера, но по состоянию на 2020 г. [update]Накопленные данные позволяют предположить, что эта связь может быть двунаправленной . [78]
Токсичность металлов, курение, нейровоспаление и загрязнение воздуха
Клеточный гомеостаз биометаллов , таких как ионная медь, железо и цинк, нарушается при болезни Альцгеймера, хотя остается неясным, вызвано ли это изменениями в белках или вызывает их. [14] [79] Курение является значимым фактором риска развития болезни Альцгеймера. [1] Системные маркеры врожденной иммунной системы являются факторами риска болезни Альцгеймера с поздним началом. [80] Воздействие загрязнения воздуха может быть фактором, способствующим развитию болезни Альцгеймера. [14]
Другие гипотезы
Retrogenesis is a medical hypothesis that just as the fetus goes through a process of neurodevelopment beginning with neurulation and ending with myelination, the brains of people with Alzheimer's disease go through a reverse neurodegeneration process starting with demyelination and death of axons (white matter) and ending with the death of grey matter.[81] Likewise the hypothesis is, that as infants go through states of cognitive development, people with Alzheimer's disease go through the reverse process of progressive cognitive impairment.[82]
The association with celiac disease is unclear, with a 2019 study finding no increase in dementia overall in those with CD, while a 2018 review found an association with several types of dementia including Alzheimer's disease.[83][84]
According to one theory, dysfunction of oligodendrocytes and their associated myelin during aging contributes to axon damage, which in turn generates in amyloid production and tau hyper-phosphorylation.[85][86]
Studies have shown a potential link between infection with certain viruses and developing Alzheimer's disease later in life.[87] Notably, a large scale study conducted on 6,245,282 patients has shown an increased risk of developing Alzheimer's disease following COVID-19 infection in cognitively normal individuals over 65.[88]
Pathophysiology

Neuropathology
Alzheimer's disease is characterised by loss of neurons and synapses in the cerebral cortex and certain subcortical regions. This loss results in gross atrophy of the affected regions, including degeneration in the temporal lobe and parietal lobe, and parts of the frontal cortex and cingulate gyrus.[89] Degeneration is also present in brainstem nuclei particularly the locus coeruleus in the pons.[90] Studies using MRI and PET have documented reductions in the size of specific brain regions in people with Alzheimer's disease as they progressed from mild cognitive impairment to Alzheimer's disease, and in comparison with similar images from healthy older adults.[91][92]
Both Aβ plaques and neurofibrillary tangles are clearly visible by microscopy in brains of those with Alzheimer's disease,[93] especially in the hippocampus.[94] However, Alzheimer's disease may occur without neurofibrillary tangles in the neocortex.[95] Plaques are dense, mostly insoluble deposits of beta-amyloid peptide and cellular material outside and around neurons. Tangles (neurofibrillary tangles) are aggregates of the microtubule-associated protein tau which has become hyperphosphorylated and accumulate inside the cells themselves. Although many older individuals develop some plaques and tangles as a consequence of aging, the brains of people with Alzheimer's disease have a greater number of them in specific brain regions such as the temporal lobe.[96] Lewy bodies are not rare in the brains of people with Alzheimer's disease.[97]
Biochemistry
Alzheimer's disease has been identified as a protein misfolding disease, a proteopathy, caused by the accumulation of abnormally folded amyloid beta protein into amyloid plaques, and tau protein into neurofibrillary tangles in the brain.[98] Plaques are made up of small peptides, 39–43 amino acids in length, called amyloid beta (Aβ). Amyloid beta is a fragment from the larger amyloid-beta precursor protein (APP) a transmembrane protein that penetrates the neuron's membrane. APP is critical to neuron growth, survival, and post-injury repair.[99][100] In Alzheimer's disease, gamma secretase and beta secretase act together in a proteolytic process which causes APP to be divided into smaller fragments.[101] One of these fragments gives rise to fibrils of amyloid beta, which then form clumps that deposit outside neurons in dense formations known as amyloid plaques.[93][102]
Alzheimer's disease is also considered a tauopathy due to abnormal aggregation of the tau protein. Every neuron has a cytoskeleton, an internal support structure partly made up of structures called microtubules. These microtubules act like tracks, guiding nutrients and molecules from the body of the cell to the ends of the axon and back. A protein called tau stabilises the microtubules when phosphorylated, and is therefore called a microtubule-associated protein. In Alzheimer's disease, tau undergoes chemical changes, becoming hyperphosphorylated; it then begins to pair with other threads, creating neurofibrillary tangles and disintegrating the neuron's transport system.[103] Pathogenic tau can also cause neuronal death through transposable element dysregulation.[104] Necroptosis has also been reported as a mechanism of cell death in brain cells affected with tau tangles.[105][106]
Disease mechanism
Exactly how disturbances of production and aggregation of the beta-amyloid peptide give rise to the pathology of Alzheimer's disease is not known.[107][108] The amyloid hypothesis traditionally points to the accumulation of beta-amyloid peptides as the central event triggering neuron degeneration. Accumulation of aggregated amyloid fibrils, which are believed to be the toxic form of the protein responsible for disrupting the cell's calcium ion homeostasis, induces programmed cell death (apoptosis).[109] It is also known that Aβ selectively builds up in the mitochondria in the cells of Alzheimer's-affected brains, and it also inhibits certain enzyme functions and the utilisation of glucose by neurons.[110]
Iron dyshomeostasis is linked to disease progression, an iron-dependent form of regulated cell death called ferroptosis could be involved. Products of lipid peroxidation are also elevated in AD brain compared with controls.[111]
Various inflammatory processes and cytokines may also have a role in the pathology of Alzheimer's disease. Inflammation is a general marker of tissue damage in any disease, and may be either secondary to tissue damage in Alzheimer's disease or a marker of an immunological response.[112] There is increasing evidence of a strong interaction between the neurons and the immunological mechanisms in the brain. Obesity and systemic inflammation may interfere with immunological processes which promote disease progression.[113]
Alterations in the distribution of different neurotrophic factors and in the expression of their receptors such as the brain-derived neurotrophic factor (BDNF) have been described in Alzheimer's disease.[114][115]
Diagnosis

Alzheimer's disease (AD) can only be definitively diagnosed with autopsy findings; in the absence of autopsy, clinical diagnoses of AD are "possible" or "probable", based on other findings.[21][22][116] Up to 23% of those clinically diagnosed with AD may be misdiagnosed and may have pathology suggestive of another condition with symptoms that mimic those of AD.[22]
AD is usually clinically diagnosed based on the person's medical history, history from relatives, and behavioral observations. The presence of characteristic neurological and neuropsychological features and the absence of alternative conditions supports the diagnosis.[needs update][117][118] Advanced medical imaging with computed tomography (CT) or magnetic resonance imaging (MRI), and with single-photon emission computed tomography (SPECT) or positron emission tomography (PET), can be used to help exclude other cerebral pathology or subtypes of dementia.[119] Moreover, it may predict conversion from prodromal stages (mild cognitive impairment) to Alzheimer's disease.[120] FDA-approved radiopharmaceutical diagnostic agents used in PET for Alzheimer's disease are florbetapir (2012), flutemetamol (2013), florbetaben (2014), and flortaucipir (2020).[121] Because many insurance companies in the United States do not cover this procedure, its use in clinical practice is largely limited to clinical trials as of 2018[update].[122]
Assessment of intellectual functioning including memory testing can further characterise the state of the disease.[1] Medical organizations have created diagnostic criteria to ease and standardise the diagnostic process for practising physicians. Definitive diagnosis can only be confirmed with post-mortem evaluations when brain material is available and can be examined histologically for senile plaques and neurofibrillary tangles.[122][123]
Criteria
There are three sets of criteria for the clinical diagnoses of the spectrum of Alzheimer's disease: the 2013 fifth edition of the Diagnostic and Statistical Manual of Mental Disorders (DSM-5); the National Institute on Aging-Alzheimer's Association (NIA-AA) definition as revised in 2011; and the International Working Group criteria as revised in 2010.[38][122] Three broad time periods, which can span decades, define the progression of Alzheimer's disease from the preclinical phase, to mild cognitive impairment (MCI), followed by Alzheimer's disease dementia.[124]
Eight intellectual domains are most commonly impaired in AD—memory, language, perceptual skills, attention, motor skills, orientation, problem solving and executive functional abilities, as listed in the fourth text revision of the DSM (DSM-IV-TR).[125]
The DSM-5 defines criteria for probable or possible Alzheimer's for both major and mild neurocognitive disorder.[126][127][116] Major or mild neurocognitive disorder must be present along with at least one cognitive deficit for a diagnosis of either probable or possible AD.[126][128] For major neurocognitive disorder due to Alzheimer's disease, probable Alzheimer's disease can be diagnosed if the individual has genetic evidence of Alzheimer's[129] or if two or more acquired cognitive deficits, and a functional disability that is not from another disorder, are present.[130] Otherwise, possible Alzheimer's disease can be diagnosed as the diagnosis follows an atypical route.[131] For mild neurocognitive disorder due to Alzheimer's, probable Alzheimer's disease can be diagnosed if there is genetic evidence, whereas possible Alzheimer's disease can be met if all of the following are present: no genetic evidence, decline in both learning and memory, two or more cognitive deficits, and a functional disability not from another disorder.[126][132]
The NIA-AA criteria are used mainly in research rather than in clinical assessments.[133] They define Alzheimer's disease through three major stages: preclinical, mild cognitive impairment (MCI), and Alzheimer's dementia.[134][135] Diagnosis in the preclinical stage is complex and focuses on asymptomatic individuals;[135][136] the latter two stages describe individuals experiencing symptoms.[135] The core clinical criteria for MCI is used along with identification of biomarkers,[137] predominantly those for neuronal injury (mainly tau-related) and amyloid beta deposition.[133][135] The core clinical criteria itself rests on the presence of cognitive impairment[135] without the presence of comorbidities.[138][139] The third stage is divided into probable and possible Alzheimer's disease dementia.[139] In probable Alzheimer's disease dementia there is steady impairment of cognition over time and a memory-related or non-memory-related cognitive dysfunction.[139] In possible Alzheimer's disease dementia, another causal disease such as cerebrovascular disease is present.[139]
Techniques

Neuropsychological tests including cognitive tests such as the mini–mental state examination (MMSE), the Montreal Cognitive Assessment (MoCA) and the Mini-Cog are widely used to aid in diagnosis of the cognitive impairments in AD.[140] These tests may not always be accurate, as they lack sensitivity to mild cognitive impairment, and can be biased by language or attention problems;[140] more comprehensive test arrays are necessary for high reliability of results, particularly in the earliest stages of the disease.[141][142]
Further neurological examinations are crucial in the differential diagnosis of Alzheimer's disease and other diseases.[32] Interviews with family members are used in assessment; caregivers can supply important information on daily living abilities and on the decrease in the person's mental function.[143] A caregiver's viewpoint is particularly important, since a person with Alzheimer's disease is commonly unaware of their deficits.[144] Many times, families have difficulties in the detection of initial dementia symptoms and may not communicate accurate information to a physician.[145]
Supplemental testing can rule out other potentially treatable diagnoses and help avoid misdiagnoses.[146] Common supplemental tests include blood tests, thyroid function tests, as well as tests to assess vitamin B12 levels, rule out neurosyphilis and rule out metabolic problems (including tests for kidney function, electrolyte levels and for diabetes).[146] MRI or CT scans might also be used to rule out other potential causes of the symptoms – including tumors or strokes.[140] Delirium and depression can be common among individuals and are important to rule out.[147]
Psychological tests for depression are used, since depression can either be concurrent with Alzheimer's disease (see Depression of Alzheimer disease), an early sign of cognitive impairment,[148] or even the cause.[149][150]
Due to low accuracy, the C-PIB-PET scan is not recommended as an early diagnostic tool or for predicting the development of Alzheimer's disease when people show signs of mild cognitive impairment (MCI).[151] The use of 18F-FDG PET scans, as a single test, to identify people who may develop Alzheimer's disease is not supported by evidence.[152]
Prevention

There are no disease-modifying treatments available to cure Alzheimer's disease and because of this, AD research has focused on interventions to prevent the onset and progression.[153] There is no evidence that supports any particular measure in preventing Alzheimer's,[1] and studies of measures to prevent the onset or progression have produced inconsistent results. Epidemiological studies have proposed relationships between an individual's likelihood of developing AD and modifiable factors, such as medications, lifestyle, and diet. There are some challenges in determining whether interventions for Alzheimer's disease act as a primary prevention method, preventing the disease itself, or a secondary prevention method, identifying the early stages of the disease.[154] These challenges include duration of intervention, different stages of disease at which intervention begins, and lack of standardization of inclusion criteria regarding biomarkers specific for Alzheimer's disease.[154] Further research is needed to determine factors that can help prevent Alzheimer's disease.[154]
Medication
Cardiovascular risk factors, such as hypercholesterolaemia, hypertension, diabetes, and smoking, are associated with a higher risk of onset and worsened course of AD.[155][156] The use of statins to lower cholesterol may be of benefit in Alzheimer's.[157] Antihypertensive and antidiabetic medications in individuals without overt cognitive impairment may decrease the risk of dementia by influencing cerebrovascular pathology.[1][158] More research is needed to examine the relationship with Alzheimer's disease specifically; clarification of the direct role medications play versus other concurrent lifestyle changes (diet, exercise, smoking) is needed.[1]
Depression is associated with an increased risk for Alzheimer's disease; management with antidepressants may provide a preventative measure.[5]
Historically, long-term usage of non-steroidal anti-inflammatory drugs (NSAIDs) were thought to be associated with a reduced likelihood of developing Alzheimer's disease as it reduces inflammation; however, NSAIDs do not appear to be useful as a treatment.[122] Additionally, because women have a higher incidence of Alzheimer's disease than men, it was once thought that estrogen deficiency during menopause was a risk factor. However, there is a lack of evidence to show that hormone replacement therapy (HRT) in menopause decreases risk of cognitive decline.[159]
Lifestyle
Certain lifestyle activities, such as physical and cognitive exercises, higher education and occupational attainment, cigarette smoking, stress, sleep, and the management of other comorbidities, including diabetes and hypertension, may affect the risk of developing Alzheimer's.[5]
Physical exercise is associated with a decreased rate of dementia,[6] and is effective in reducing symptom severity in those with AD.[160] Memory and cognitive functions can be improved with aerobic exercises including brisk walking three times weekly for forty minutes.[161] It may also induce neuroplasticity of the brain.[162] Participating in mental exercises, such as reading, crossword puzzles, and chess have shown a potential to be preventative.[5] Meeting the WHO recommendations for physical activity is associated with a lower risk of AD.[163]
Higher education and occupational attainment, and participation in leisure activities, contribute to a reduced risk of developing Alzheimer's,[7] or of delaying the onset of symptoms. This is compatible with the cognitive reserve theory, which states that some life experiences result in more efficient neural functioning providing the individual a cognitive reserve that delays the onset of dementia manifestations.[7] Education delays the onset of Alzheimer's disease syndrome without changing the duration of the disease.[164]
Cessation in smoking may reduce risk of developing Alzheimer's' disease, specifically in those who carry APOE ɛ4 allele.[165][5] The increased oxidative stress caused by smoking results in downstream inflammatory or neurodegenerative processes that may increase risk of developing AD.[166] Avoidance of smoking, counseling and pharmacotherapies to quit smoking are used, and avoidance of environmental tobacco smoke is recommended.[5]
Alzheimer's disease is associated with sleep disorders but the precise relationship is unclear.[167][168] It was once thought that as people get older, the risk of developing sleep disorders and AD independently increase, but research is examining whether sleep disorders may increase the prevalence of AD.[167] One theory is that the mechanisms to increase clearance of toxic substances, including Aβ, are active during sleep.[167][169] With decreased sleep, a person is increasing Aβ production and decreasing Aβ clearance, resulting in Aβ accumulation.[170][167][168] Receiving adequate sleep (approximately 7–8 hours) every night has become a potential lifestyle intervention to prevent the development of AD.[5]
Stress is a risk factor for the development of Alzheimer's.[5] The mechanism by which stress predisposes someone to development of Alzheimer's is unclear, but it is suggested that lifetime stressors may affect a person's epigenome, leading to an overexpression or under expression of specific genes.[171] Although the relationship of stress and Alzheimer's is unclear, strategies to reduce stress and relax the mind may be helpful strategies in preventing the progression or Alzheimer's disease.[172] Meditation, for instance, is a helpful lifestyle change to support cognition and well-being, though further research is needed to assess long-term effects.[162]
Management
There is no cure for Alzheimer's disease;[173] available treatments offer relatively small symptomatic benefits but remain palliative in nature.[14][174] Treatments can be divided into pharmaceutical, psychosocial, and caregiving.
Pharmaceutical


Medications used to treat the cognitive symptons of Alzheimer's disease rather than the underlying cause include: four acetylcholinesterase inhibitors (tacrine, rivastigmine, galantamine, and donepezil) and memantine, an NMDA receptor antagonist. The acetylcholinesterase inhibitors are intended for those with mild to severe Alzheimer's, whereas memantine is intended for those with moderate or severe Alzheimer's disease.[122] The benefit from their use is small.[175][176][177][15]
Reduction in the activity of the cholinergic neurons is a well-known feature of Alzheimer's disease.[178] Acetylcholinesterase inhibitors are employed to reduce the rate at which acetylcholine (ACh) is broken down, thereby increasing the concentration of ACh in the brain and combating the loss of ACh caused by the death of cholinergic neurons.[179] There is evidence for the efficacy of these medications in mild to moderate Alzheimer's disease,[180][175] and some evidence for their use in the advanced stage.[175] The use of these drugs in mild cognitive impairment has not shown any effect in a delay of the onset of Alzheimer's disease.[181] The most common side effects are nausea and vomiting, both of which are linked to cholinergic excess. These side effects arise in approximately 10–20% of users, are mild to moderate in severity, and can be managed by slowly adjusting medication doses.[182] Less common secondary effects include muscle cramps, decreased heart rate (bradycardia), decreased appetite and weight, and increased gastric acid production.[180]
Glutamate is an excitatory neurotransmitter of the nervous system, although excessive amounts in the brain can lead to cell death through a process called excitotoxicity which consists of the overstimulation of glutamate receptors. Excitotoxicity occurs not only in Alzheimer's disease, but also in other neurological diseases such as Parkinson's disease and multiple sclerosis.[183] Memantine is a noncompetitive NMDA receptor antagonist first used as an anti-influenza agent. It acts on the glutamatergic system by blocking NMDA receptors and inhibiting their overstimulation by glutamate.[183][184] Memantine has been shown to have a small benefit in the treatment of moderate to severe Alzheimer's disease.[185] Reported adverse events with memantine are infrequent and mild, including hallucinations, confusion, dizziness, headache and fatigue.[186][187] The combination of memantine and donepezil[188] has been shown to be "of statistically significant but clinically marginal effectiveness".[189]
An extract of Ginkgo biloba known as EGb 761 has been used for treating Alzheimer's and other neuropsychiatric disorders.[190] Its use is approved throughout Europe.[191] The World Federation of Biological Psychiatry guidelines lists EGb 761 with the same weight of evidence (level B) given to acetylcholinesterase inhibitors and memantine. EGb 761 is the only one that showed improvement of symptoms in both Alzheimer's disease and vascular dementia. EGb 761 may have a role either on its own or as an add-on if other therapies prove ineffective.[190] A 2016 review concluded that the quality of evidence from clinical trials on Ginkgo biloba has been insufficient to warrant its use for treating Alzheimer's disease.[192]
Atypical antipsychotics are modestly useful in reducing aggression and psychosis in people with Alzheimer's disease, but their advantages are offset by serious adverse effects, such as stroke, movement difficulties or cognitive decline.[193] When used in the long-term, they have been shown to associate with increased mortality.[194] Stopping antipsychotic use in this group of people appears to be safe.[195]
Psychosocial
Psychosocial interventions are used as an adjunct to pharmaceutical treatment and can be classified within behavior-, emotion-, cognition- or stimulation-oriented approaches.[needs update][196]
Behavioral interventions attempt to identify and reduce the antecedents and consequences of problem behaviors. This approach has not shown success in improving overall functioning,[197] but can help to reduce some specific problem behaviors, such as incontinence.[198] There is a lack of high quality data on the effectiveness of these techniques in other behavior problems such as wandering.[199][200] Music therapy is effective in reducing behavioral and psychological symptoms.[201]
Emotion-oriented interventions include reminiscence therapy, validation therapy, supportive psychotherapy, sensory integration, also called snoezelen, and simulated presence therapy. A Cochrane review has found no evidence that this is effective.[202] Reminiscence therapy (RT) involves the discussion of past experiences individually or in group, many times with the aid of photographs, household items, music and sound recordings, or other familiar items from the past. A 2018 review of the effectiveness of RT found that effects were inconsistent, small in size and of doubtful clinical significance, and varied by setting.[203] Simulated presence therapy (SPT) is based on attachment theories and involves playing a recording with voices of the closest relatives of the person with Alzheimer's disease. There is partial evidence indicating that SPT may reduce challenging behaviors.[204]
The aim of cognition-oriented treatments, which include reality orientation and cognitive retraining, is the reduction of cognitive deficits. Reality orientation consists of the presentation of information about time, place, or person to ease the understanding of the person about its surroundings and his or her place in them. On the other hand, cognitive retraining tries to improve impaired capacities by exercising mental abilities. Both have shown some efficacy improving cognitive capacities.[205]
Stimulation-oriented treatments include art, music and pet therapies, exercise, and any other kind of recreational activities. Stimulation has modest support for improving behavior, mood, and, to a lesser extent, function. Nevertheless, as important as these effects are, the main support for the use of stimulation therapies is the change in the person's routine.[196]
Caregiving
Since Alzheimer's has no cure and it gradually renders people incapable of tending to their own needs, caregiving is essentially the treatment and must be carefully managed over the course of the disease.
During the early and moderate stages, modifications to the living environment and lifestyle can increase safety and reduce caretaker burden.[206][207] Examples of such modifications are the adherence to simplified routines, the placing of safety locks, the labeling of household items to cue the person with the disease or the use of modified daily life objects.[196][208][209] If eating becomes problematic, food will need to be prepared in smaller pieces or even puréed.[210] When swallowing difficulties arise, the use of feeding tubes may be required. In such cases, the medical efficacy and ethics of continuing feeding is an important consideration of the caregivers and family members.[211][212] The use of physical restraints is rarely indicated in any stage of the disease, although there are situations when they are necessary to prevent harm to the person with Alzheimer's disease or their caregivers.[196]
During the final stages of the disease, treatment is centred on relieving discomfort until death, often with the help of hospice.[213]
Diet
Diet may be a modifiable risk factor for the development of Alzheimer's disease. The Mediterranean diet, and the DASH diet are both associated with less cognitive decline. A different approach has been to incorporate elements of both of these diets into one known as the MIND diet.[214] Studies of individual dietary components, minerals and supplements are conflicting as to whether they prevent AD or cognitive decline.[214]
Prognosis
The early stages of Alzheimer's disease are difficult to diagnose. A definitive diagnosis is usually made once cognitive impairment compromises daily living activities, although the person may still be living independently. The symptoms will progress from mild cognitive problems, such as memory loss through increasing stages of cognitive and non-cognitive disturbances, eliminating any possibility of independent living, especially in the late stages of the disease.[39]
Life expectancy of people with Alzheimer's disease is reduced.[215] The normal life expectancy for 60 to 70 years old is 23 to 15 years; for 90 years old it is 4.5 years.[216] Following Alzheimer's disease diagnosis it ranges from 7 to 10 years for those in their 60s and early 70s (a loss of 13 to 8 years), to only about 3 years or less (a loss of 1.5 years) for those in their 90s.[215]
Fewer than 3% of people live more than fourteen years after diagnosis.[217] Disease features significantly associated with reduced survival are an increased severity of cognitive impairment, decreased functional level, disturbances in the neurological examination, history of falls, malnutrition, dehydration and weight loss.[3] Other coincident diseases such as heart problems, diabetes, or history of alcohol abuse are also related with shortened survival.[218][219][220] While the earlier the age at onset the higher the total survival years, life expectancy is particularly reduced when compared to the healthy population among those who are younger.[221] Men have a less favourable survival prognosis than women.[needs update][217][222]
Aspiration pneumonia is the most frequent immediate cause of death brought by Alzheimer's disease.[3] While the reasons behind the lower prevalence of cancer in Alzheimer's patients remain unclear, some researchers hypothesize that biological mechanisms shared by both diseases might play a role. However, this requires further investigation.[223]
Epidemiology
Two main measures are used in epidemiological studies: incidence and prevalence. Incidence is the number of new cases per unit of person-time at risk (usually number of new cases per thousand person-years); while prevalence is the total number of cases of the disease in the population at any given time.
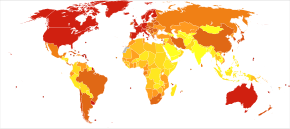
Regarding incidence, cohort longitudinal studies (studies where a disease-free population is followed over the years) provide rates between 10 and 15 per thousand person-years for all dementias and 5–8 for Alzheimer's disease,[224][225] which means that half of new dementia cases each year are Alzheimer's disease. Advancing age is a primary risk factor for the disease and incidence rates are not equal for all ages: every 5 years after the age of 65, the risk of acquiring the disease approximately doubles, increasing from 3 to as much as 69 per thousand person years.[224][225] Females with Alzheimer's disease are more common than males, but this difference is likely due to women's longer life spans. When adjusted for age, both sexes are affected by Alzheimer's at equal rates.[15] In the United States, the risk of dying from Alzheimer's disease in 2010 was 26% higher among the non-Hispanic white population than among the non-Hispanic black population, and the Hispanic population had a 30% lower risk than the non-Hispanic white population.[226] However, much Alzheimer's research remains to be done in minority groups, such as the African American, East Asian and Hispanic/Latino populations.[227][228] Studies have shown that these groups are underrepresented in clinical trials and do not have the same risk of developing Alzheimer's when carrying certain genetic risk factors (i.e. APOE4), compared to their caucasian counterparts.[228][229][230]
The prevalence of Alzheimer's disease in populations is dependent upon factors including incidence and survival. Since the incidence of Alzheimer's disease increases with age, prevalence depends on the mean age of the population for which prevalence is given. In the United States in 2020, Alzheimer's dementia prevalence was estimated to be 5.3% for those in the 60–74 age group, with the rate increasing to 13.8% in the 74–84 group and to 34.6% in those greater than 85.[231] Prevalence rates in some less developed regions around the globe are lower.[232][233] As the incidence and prevalence are steadily increasing, the prevalence itself is projected to triple by 2050.[clarification needed][234] As of 2020, 50 million people globally have AD, with this number expected to increase to 152 million by 2050.[14]
History

The ancient Greek and Roman philosophers and physicians associated old age with increasing dementia.[29] It was not until 1901 that German psychiatrist Alois Alzheimer identified the first case of what became known as Alzheimer's disease, named after him, in a fifty-year-old woman he called Auguste D. He followed her case until she died in 1906 when he first reported publicly on it.[235] During the next five years, eleven similar cases were reported in the medical literature, some of them already using the term Alzheimer's disease.[29] The disease was first described as a distinctive disease by Emil Kraepelin after suppressing some of the clinical (delusions and hallucinations) and pathological features (arteriosclerotic changes) contained in the original report of Auguste D.[236] He included Alzheimer's disease, also named presenile dementia by Kraepelin, as a subtype of senile dementia in the eighth edition of his Textbook of Psychiatry, published on 15 July, 1910.[237]
For most of the 20th century, the diagnosis of Alzheimer's disease was reserved for individuals between the ages of 45 and 65 who developed symptoms of dementia. The terminology changed after 1977 when a conference on Alzheimer's disease concluded that the clinical and pathological manifestations of presenile and senile dementia were almost identical, although the authors also added that this did not rule out the possibility that they had different causes.[238] This eventually led to the diagnosis of Alzheimer's disease independent of age.[239] The term senile dementia of the Alzheimer type (SDAT) was used for a time to describe the condition in those over 65, with classical Alzheimer's disease being used to describe those who were younger. Eventually, the term Alzheimer's disease was formally adopted in medical nomenclature to describe individuals of all ages with a characteristic common symptom pattern, disease course, and neuropathology.[240]
The National Institute of Neurological and Communicative Disorders and Stroke (NINCDS) and the Alzheimer's Disease and Related Disorders Association (ADRDA, now known as the Alzheimer's Association) established the most commonly used NINCDS-ADRDA Alzheimer's Criteria for diagnosis in 1984,[241] extensively updated in 2007.[242][146] These criteria require that the presence of cognitive impairment, and a suspected dementia syndrome, be confirmed by neuropsychological testing for a clinical diagnosis of possible or probable Alzheimer's disease. A histopathologic confirmation including a microscopic examination of brain tissue is required for a definitive diagnosis. Good statistical reliability and validity have been shown between the diagnostic criteria and definitive histopathological confirmation.[243]
Society and culture
Social costs
Dementia, and specifically Alzheimer's disease, may be among the most costly diseases for societies worldwide.[244] As populations age, these costs will probably increase and become an important social problem and economic burden.[245] Costs associated with AD include direct and indirect medical costs, which vary between countries depending on social care for a person with AD.[244][246][247] Direct costs include doctor visits, hospital care, medical treatments, nursing home care, specialized equipment, and household expenses.[244][245] Indirect costs include the cost of informal care and the loss in productivity of informal caregivers.[245]
In the United States as of 2019[update], informal (family) care is estimated to constitute nearly three-fourths of caregiving for people with AD at a cost of US$234 billion per year and approximately 18.5 billion hours of care.[244] The cost to society worldwide to care for individuals with AD is projected to increase nearly ten-fold, and reach about US$9.1 trillion by 2050.[246]
Costs for those with more severe dementia or behavioral disturbances are higher and are related to the additional caregiving time to provide physical care.[247]
Caregiving burden
This section needs to be updated. (February 2022) |
Individuals with Alzheimer's will require assistance in their lifetime, and care will most likely come in the form of a full-time caregiver which is often a role that is taken on by the spouse or a close relative. Caregiving tends to include physical and emotional burdens as well as time and financial strain at times on the person administering the aid.[248][249] Alzheimer's disease is known for placing a great burden on caregivers which includes social, psychological, physical, or economic aspects.[23][250][251] Home care is usually preferred by both those people with Alzheimer's disease as well as their families.[252] This option also delays or eliminates the need for more professional and costly levels of care.[252][253] Nevertheless, two-thirds of nursing home residents have dementias.[196]
Dementia caregivers are subject to high rates of physical and mental disorders.[254] Factors associated with greater psychosocial problems of the primary caregivers include having an affected person at home, the carer being a spouse, demanding behaviors of the cared person such as depression, behavioral disturbances, hallucinations, sleep problems or walking disruptions and social isolation.[255][256] Regarding economic problems, family caregivers often give up time from work to spend 47 hours per week on average with the person with Alzheimer's disease, while the costs of caring for them are high. Direct and indirect costs of caring for somebody with Alzheimer's average between $18,000 and $77,500 per year in the United States, depending on the study.[257][249]
Cognitive behavioral therapy and the teaching of coping strategies either individually or in group have demonstrated their efficacy in improving caregivers' psychological health.[23][258]
Media
Alzheimer's disease has been portrayed in films such as: Iris (2001), based on John Bayley's memoir of his wife Iris Murdoch;[259] The Notebook (2004), based on Nicholas Sparks's 1996 novel of the same name;[260] A Moment to Remember (2004); Thanmathra (2005);[261] Memories of Tomorrow (Ashita no Kioku) (2006), based on Hiroshi Ogiwara's novel of the same name;[262] Away from Her (2006), based on Alice Munro's short story The Bear Came over the Mountain;[263] Still Alice (2014), about a Columbia University professor who has early onset Alzheimer's disease, based on Lisa Genova's 2007 novel of the same name and featuring Julianne Moore in the title role. Documentaries on Alzheimer's disease include Malcolm and Barbara: A Love Story (1999) and Malcolm and Barbara: Love's Farewell (2007), both featuring Malcolm Pointon.[264][265][266]
Alzheimer's disease has also been portrayed in music by English musician the Caretaker in releases such as Persistent Repetition of Phrases (2008), An Empty Bliss Beyond This World (2011), and Everywhere at the End of Time (2016–2019).[267][268][269] Paintings depicting the disorder include the late works by American artist William Utermohlen, who drew self-portraits from 1995 to 2000 as an experiment of showing his disease through art.[270][271]
Research directions
Antibodies may have the ability to alter the disease course by targeting amyloid beta with immunotherapy medications such as donanemab, aducanumab, and lecanemab.[272][273][274] Aducanumab was approved by the US Food and Drug Administration (FDA) in 2021, using the accelerated approval process, although the approval generated controversy and more evidence is needed to address administration, safety, and effectiveness.[275][276][277][278] It has less effectiveness in people who already had severe Alzheimer's symptoms.[279] Lecanemab was approved via the FDA accelerated approval process,[280][281][282] and was converted to traditional approval in July 2023, after further testing, along with the addition of a boxed warning about amyloid-related imaging abnormalities.[283][284] Donanemab was approved by the FDA in July 2024.[285] Anti-amyloid drugs also cause brain shrinkage.[286]
Specific medications that may reduce the risk or progression of Alzheimer's disease have been studied.[287] The research trials investigating medications generally impact Aβ plaques, inflammation, APOE, neurotransmitter receptors, neurogenesis, growth factors or hormones.[287][288][289]
Machine learning algorithms with electronic health records are being studied as a way to predict Alzheimer's disease earlier.[290]
References
- ^ Jump up to: a b c d e f g h i j k Knopman DS, Amieva H, Petersen RC, Chételat G, Holtzman DM, Hyman BT, et al. (May 2021). "Alzheimer disease". Nature Reviews Disease Primers. 7 (1): 33. doi:10.1038/s41572-021-00269-y. PMC 8574196. PMID 33986301.
- ^ Jump up to: a b c d e f "Dementia Fact sheet". World Health Organization. 15 March 2023. Retrieved 10 July 2023.
- ^ Jump up to: a b c "Ask the Doctors - What is the cause of death in Alzheimer's disease?". www.uclahealth.org. Retrieved 18 March 2024.
- ^ Jump up to: a b Mendez MF (November 2012). "Early-onset Alzheimer's disease: nonamnestic subtypes and type 2 AD". Archives of Medical Research. 43 (8): 677–685. doi:10.1016/j.arcmed.2012.11.009. PMC 3532551. PMID 23178565.
- ^ Jump up to: a b c d e f g h i Yu JT, Xu W, Tan CC, Andrieu S, Suckling J, Evangelou E, et al. (November 2020). "Evidence-based prevention of Alzheimer's disease: systematic review and meta-analysis of 243 observational prospective studies and 153 randomised controlled trials". Journal of Neurology, Neurosurgery, and Psychiatry. 91 (11): 1201–1209. doi:10.1136/jnnp-2019-321913. PMC 7569385. PMID 32690803.
- ^ Jump up to: a b Cheng ST (September 2016). "Cognitive Reserve and the Prevention of Dementia: the Role of Physical and Cognitive Activities". Current Psychiatry Reports (Review). 18 (9): 85. doi:10.1007/s11920-016-0721-2. PMC 4969323. PMID 27481112.
- ^ Jump up to: a b c Viña J, Sanz-Ros J (October 2018). "Alzheimer's disease: Only prevention makes sense". European Journal of Clinical Investigation (Review). 48 (10): e13005. doi:10.1111/eci.13005. PMID 30028503. S2CID 51703879.
- ^ Jump up to: a b "Dementia diagnosis and assessment" (PDF). National Institute for Health and Care Excellence (NICE). Archived from the original (PDF) on 5 December 2014. Retrieved 30 November 2014.
- ^ Gomperts SN (April 2016). "Lewy Body Dementias: Dementia With Lewy Bodies and Parkinson Disease Dementia". Continuum (Review). 22 (2 Dementia): 435–463. doi:10.1212/CON.0000000000000309. ISSN 1080-2371. PMC 5390937. PMID 27042903.
- ^ Jump up to: a b Lott IT, Head E (March 2019). "Dementia in Down syndrome: unique insights for Alzheimer disease research". Nat Rev Neurol. 15 (3): 135–147. doi:10.1038/s41582-018-0132-6. PMC 8061428. PMID 30733618.
- ^ Jump up to: a b c "How Alzheimer's drugs help manage symptoms". Mayo Clinic. 30 August 2023. Retrieved 19 March 2024.
- ^ Jump up to: a b Schaffert J, LoBue C, Hynan LS, Hart J, Rossetti H, Carlew AR, et al. (2022). "Predictors of Life Expectancy in Autopsy-Confirmed Alzheimer's Disease". Journal of Alzheimer's Disease. 86 (1): 271–281. doi:10.3233/JAD-215200. PMC 8966055. PMID 35034898.
- ^ Jump up to: a b Todd S, Barr S, Roberts M, Passmore AP (November 2013). "Survival in dementia and predictors of mortality: a review". International Journal of Geriatric Psychiatry. 28 (11): 1109–1124. doi:10.1002/gps.3946. PMID 23526458.
- ^ Jump up to: a b c d e f g h i j k Breijyeh Z, Karaman R (December 2020). "Comprehensive Review on Alzheimer's Disease: Causes and Treatment". Molecules (Review). 25 (24): 5789. doi:10.3390/molecules25245789. PMC 7764106. PMID 33302541.
- ^ Jump up to: a b c d Simon RP, Greenberg DA, Aminoff MJ (2018). Clinical neurology (Tenth ed.). [New York]: McGraw Hill. p. 111. ISBN 978-1-259-86173-4. OCLC 1012400314.
- ^ Jump up to: a b c d Burns A, Iliffe S (February 2009). "Alzheimer's disease". BMJ. 338: b158. doi:10.1136/bmj.b158. PMID 19196745. S2CID 8570146.
- ^ Jump up to: a b c d Long JM, Holtzman DM (October 2019). "Alzheimer Disease: An Update on Pathobiology and Treatment Strategies". Cell. 179 (2): 312–339. doi:10.1016/j.cell.2019.09.001. PMC 6778042. PMID 31564456.
- ^ Jump up to: a b "Study reveals how APOE4 gene may increase risk for dementia". National Institute on Aging. 16 March 2021. Archived from the original on 17 March 2021. Retrieved 17 March 2021.
- ^ Jump up to: a b c d "Alzheimer's Disease Fact Sheet". National Institute on Aging. Archived from the original on 23 March 2022. Retrieved 23 March 2022.
- ^ Dementia: assessment, management and support for people living with dementia and their carers (Report). National Institute for Health and Care Excellence (NICE). 20 June 2018. NG97. Retrieved 8 July 2023.
- ^ Jump up to: a b Khan S, Barve KH, Kumar MS (2020). "Recent Advancements in Pathogenesis, Diagnostics and Treatment of Alzheimer's Disease". Curr Neuropharmacol. 18 (11): 1106–1125. doi:10.2174/1570159X18666200528142429. PMC 7709159. PMID 32484110.
- ^ Jump up to: a b c Gauthreaux K, Bonnett TA, Besser LM, Brenowitz WD, Teylan M, Mock C, et al. (May 2020). "Concordance of Clinical Alzheimer Diagnosis and Neuropathological Features at Autopsy". Journal of Neuropathology and Experimental Neurology. 79 (5): 465–473. doi:10.1093/jnen/nlaa014. PMC 7160616. PMID 32186726.
- ^ Jump up to: a b c d Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J (July 2007). "Systematic review of information and support interventions for caregivers of people with dementia". BMC Geriatrics. 7: 18. doi:10.1186/1471-2318-7-18. PMC 1951962. PMID 17662119.
- ^ Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S (April 2015). "Exercise programs for people with dementia". The Cochrane Database of Systematic Reviews (Submitted manuscript). 132 (4): CD006489. doi:10.1002/14651858.CD006489.pub4. PMC 9426996. PMID 25874613.
- ^ "Low-dose antipsychotics in people with dementia". National Institute for Health and Care Excellence (NICE). Archived from the original on 5 December 2014. Retrieved 29 November 2014.
- ^ "Information for Healthcare Professionals: Conventional Antipsychotics". US Food and Drug Administration. 16 June 2008. Archived from the original on 29 November 2014. Retrieved 29 November 2014.
- ^ Jump up to: a b "Alzheimer's Disease Fact Sheet". National Institute on Aging. Archived from the original on 24 January 2021. Retrieved 25 January 2021.
- ^ Zhu D, Montagne A, Zhao Z (June 2021). "Alzheimer's pathogenic mechanisms and underlying sex difference". Cell Mol Life Sci. 78 (11): 4907–4920. doi:10.1007/s00018-021-03830-w. PMC 8720296. PMID 33844047.
- ^ Jump up to: a b c Berchtold NC, Cotman CW (1998). "Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s". Neurobiology of Aging. 19 (3): 173–189. doi:10.1016/S0197-4580(98)00052-9. PMID 9661992. S2CID 24808582.
- ^ "The top 10 causes of death". www.who.int. Retrieved 19 March 2024.
- ^ Jump up to: a b c "Alzheimer's disease – Symptoms". National Health Service (NHS). 10 May 2018. Archived from the original on 30 January 2021. Retrieved 25 January 2021.
- ^ Jump up to: a b Waldemar G, Dubois B, Emre M, Georges J, McKeith IG, Rossor M, et al. (January 2007). "Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline". European Journal of Neurology. 14 (1): e1-26. doi:10.1111/j.1468-1331.2006.01605.x. PMID 17222085. S2CID 2725064.
- ^ Jump up to: a b c Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ (September 2004). "Multiple cognitive deficits during the transition to Alzheimer's disease". Journal of Internal Medicine. 256 (3): 195–204. doi:10.1111/j.1365-2796.2004.01386.x. PMID 15324363. S2CID 37005854.
- ^ Nygård L (2003). "Instrumental activities of daily living: a stepping-stone towards Alzheimer's disease diagnosis in subjects with mild cognitive impairment?". Acta Neurologica Scandinavica. Supplementum. 179 (s179): 42–46. doi:10.1034/j.1600-0404.107.s179.8.x. PMID 12603250. S2CID 25313065.
- ^ Deardorff WJ, Grossberg GT (2019). "Behavioral and psychological symptoms in Alzheimer's dementia and vascular dementia". Psychopharmacology of Neurologic Disease. Handbook of Clinical Neurology. Vol. 165. Elsevier. pp. 5–32. doi:10.1016/B978-0-444-64012-3.00002-2. ISBN 978-0-444-64012-3. PMID 31727229. S2CID 208037448.
- ^ Murray ED, Buttner N, Price BH (2012). "Depression and Psychosis in Neurological Practice". In Bradley WG, Daroff RB, Fenichel GM, Jankovic J (eds.). Bradley's neurology in clinical practice (6th ed.). Philadelphia, PA: Elsevier/Saunders. ISBN 978-1-4377-0434-1.
- ^ Jump up to: a b Petersen RC, Lopez O, Armstrong MJ, Getchius TS, Ganguli M, Gloss D, et al. (January 2018). "Practice guideline update summary: Mild cognitive impairment: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology". Neurology. 90 (3): 126–135. doi:10.1212/WNL.0000000000004826. PMC 5772157. PMID 29282327.
- ^ Jump up to: a b c Atri A (March 2019). "The Alzheimer's Disease Clinical Spectrum: Diagnosis and Management". The Medical Clinics of North America (Review). 103 (2): 263–293. doi:10.1016/j.mcna.2018.10.009. PMID 30704681. S2CID 73432842.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s Förstl H, Kurz A (1999). "Clinical features of Alzheimer's disease". European Archives of Psychiatry and Clinical Neuroscience. 249 (6): 288–290. doi:10.1007/s004060050101. PMID 10653284. S2CID 26142779.
- ^ Carlesimo GA, Oscar-Berman M (June 1992). "Memory deficits in Alzheimer's patients: a comprehensive review". Neuropsychology Review. 3 (2): 119–169. doi:10.1007/BF01108841. PMID 1300219. S2CID 19548915.
- ^ Jelicic M, Bonebakker AE, Bonke B (1995). "Implicit memory performance of patients with Alzheimer's disease: a brief review". International Psychogeriatrics. 7 (3): 385–392. doi:10.1017/S1041610295002134. PMID 8821346. S2CID 9419442.
- ^ Jump up to: a b Taler V, Phillips NA (July 2008). "Language performance in Alzheimer's disease and mild cognitive impairment: a comparative review". Journal of Clinical and Experimental Neuropsychology. 30 (5): 501–556. doi:10.1080/13803390701550128. PMID 18569251. S2CID 37153159.
- ^ Jump up to: a b c Frank EM (September 1994). "Effect of Alzheimer's disease on communication function". Journal of the South Carolina Medical Association. 90 (9): 417–423. PMID 7967534.
- ^ Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A (May 2001). "Sundowning and circadian rhythms in Alzheimer's disease". The American Journal of Psychiatry. 158 (5): 704–711. doi:10.1176/appi.ajp.158.5.704. PMID 11329390. S2CID 10492607.
- ^ Gold DP, Reis MF, Markiewicz D, Andres D (January 1995). "When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia". Journal of the American Geriatrics Society. 43 (1): 10–16. doi:10.1111/j.1532-5415.1995.tb06235.x. PMID 7806732. S2CID 29847950.
- ^ Mashour GA, Frank L, Batthyany A, Kolanowski AM, Nahm M, Schulman-Green D, et al. (August 2019). "Paradoxical lucidity: A potential paradigm shift for the neurobiology and treatment of severe dementias". Alzheimer's & Dementia. 15 (8): 1107–1114. doi:10.1016/j.jalz.2019.04.002. hdl:2027.42/153062. PMID 31229433. S2CID 195063786.
- ^ "Alzheimer's disease – Causes". National Health Service (NHS). 24 April 2023. Archived from the original on 29 September 2020. Retrieved 10 July 2023.
- ^ Tackenberg C, Kulic L, Nitsch RM (2020). "Familial Alzheimer's disease mutations at position 22 of the amyloid β-peptide sequence differentially affect synaptic loss, tau phosphorylation and neuronal cell death in an ex vivo system". PLOS ONE. 15 (9): e0239584. Bibcode:2020PLoSO..1539584T. doi:10.1371/journal.pone.0239584. PMC 7510992. PMID 32966331.
- ^ Wang H, Kulas JA, Wang C, Holtzman DM, Ferris HA, Hansen SB (August 2021). "Regulation of beta-amyloid production in neurons by astrocyte-derived cholesterol". Proceedings of the National Academy of Sciences of the United States of America. 118 (33): e2102191118. Bibcode:2021PNAS..11802191W. doi:10.1073/pnas.2102191118. ISSN 0027-8424. PMC 8379952. PMID 34385305. S2CID 236998499.
- ^ Vilchez D, Saez I, Dillin A (December 2014). "The role of protein clearance mechanisms in organismal ageing and age-related diseases". Nature Communications. 5: 5659. Bibcode:2014NatCo...5.5659V. doi:10.1038/ncomms6659. PMID 25482515.
- ^ Jacobson M, McCarthy N (2002). Apoptosis. Oxford, OX: Oxford University Press. p. 290. ISBN 0-19-963849-7.
- ^ Hardy J, Allsop D (October 1991). "Amyloid deposition as the central event in the aetiology of Alzheimer's disease". Trends in Pharmacological Sciences. 12 (10): 383–388. doi:10.1016/0165-6147(91)90609-V. PMID 1763432.
- ^ Jump up to: a b Mudher A, Lovestone S (January 2002). "Alzheimer's disease-do tauists and baptists finally shake hands?". Trends in Neurosciences. 25 (1): 22–26. doi:10.1016/S0166-2236(00)02031-2. PMID 11801334. S2CID 37380445.
- ^ Polvikoski T, Sulkava R, Haltia M, Kainulainen K, Vuorio A, Verkkoniemi A, et al. (November 1995). "Apolipoprotein E, dementia, and cortical deposition of beta-amyloid protein". The New England Journal of Medicine. 333 (19): 1242–1247. doi:10.1056/NEJM199511093331902. PMID 7566000.
- ^ Jump up to: а б Эндрюс С.Дж., Рентон А.Э., Фултон-Ховард Б., Подлесный-Драбинок А., Маркора Э., Гоут А.М. (апрель 2023 г.). «Сложная генетическая архитектура болезни Альцгеймера: новые идеи и будущие направления» . Электронная биомедицина . 90 : 104511. doi : 10.1016/j.ebiom.2023.104511 . ПМЦ 10024184 . ПМИД 36907103 .
- ^ Jump up to: а б Шелтенс П., Де Струпер Б., Кивипелто М., Хольстеге Х., Четела Г., Теуниссен CE и др. (апрель 2021 г.). «Болезнь Альцгеймера» . Ланцет . 397 (10284): 1577–1590. дои : 10.1016/S0140-6736(20)32205-4 . ПМЦ 8354300 . ПМИД 33667416 .
- ^ Симс Р., Хилл М., Уильямс Дж. (март 2020 г.). «Мультиплексная модель генетики болезни Альцгеймера» (PDF) . Нат Нейроски . 23 (3): 311–322. дои : 10.1038/s41593-020-0599-5 . ПМИД 32112059 . S2CID 256839971 .
- ^ Пиачери И., Накмиас Б., Сорби С. (январь 2013 г.). «Генетика семейной и спорадической болезни Альцгеймера» . Границы бионауки (Элитное издание) . 5 (1): 167–177. дои : 10.2741/e605 . ПМИД 23276979 .
- ^ Переа-младший, Болос М., Авила Дж. (октябрь 2020 г.). «Микроглия при болезни Альцгеймера в контексте тау-патологии» . Биомолекулы . 10 (10): 1439. doi : 10.3390/biom10101439 . ПМЦ 7602223 . ПМИД 33066368 .
- ^ Махли Р.В., Вайсграбер К.Х., Хуан Ю (апрель 2006 г.). «Аполипопротеин Е4: причинный фактор и терапевтическая мишень при невропатологиях, включая болезнь Альцгеймера» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (15): 5644–5651. Бибкод : 2006PNAS..103.5644M . дои : 10.1073/pnas.0600549103 . ПМЦ 1414631 . ПМИД 16567625 .
- ^ Бленноу К., де Леон М.Дж., Зеттерберг Х. (июль 2006 г.). «Болезнь Альцгеймера». Ланцет . 368 (9533): 387–403. дои : 10.1016/S0140-6736(06)69113-7 . ПМИД 16876668 . S2CID 47544338 .
- ^ Холл К., Мюррел Дж., Огунний А., Диг М., Байеву О., Гао С. и др. (январь 2006 г.). «Холестерин, генотип APOE и болезнь Альцгеймера: эпидемиологическое исследование нигерийской йоруба» . Неврология . 66 (2): 223–227. дои : 10.1212/01.wnl.0000194507.39504.17 . ПМЦ 2860622 . ПМИД 16434658 .
- ^ Гуреже О, Огуннийи А, Байеву О, Прайс Б, Унверзагт Ф.В., Эванс Р.М. и др. (январь 2006 г.). «APOE epsilon4 не связан с болезнью Альцгеймера у пожилых нигерийцев» . Анналы неврологии . 59 (1): 182–185. дои : 10.1002/ana.20694 . ПМК 2855121 . ПМИД 16278853 .
- ^ Пиачери I (2013). «Генетика семейной и спорадической болезни Альцгеймера» . Границы бионауки . Е5 (1): 167–177. дои : 10.2741/E605 . ISSN 1945-0494 . ПМИД 23276979 .
- ^ Селькое DJ (июнь 1999 г.). «Перевод клеточной биологии в терапевтические достижения при болезни Альцгеймера» . Природа . 399 (Приложение 6738): A23–A31. дои : 10.1038/19866 . ПМИД 10392577 . S2CID 42287088 .
- ^ Борчелт Д.Р., Тинакаран Г., Экман С.Б., Ли М.К., Давенпорт Ф., Ратовицкий Т. и др. (ноябрь 1996 г.). «Варианты пресенилина 1, связанные с семейной болезнью Альцгеймера, повышают соотношение Abeta1-42/1-40 in vitro и in vivo» . Нейрон . 17 (5): 1005–1013. дои : 10.1016/S0896-6273(00)80230-5 . ПМИД 8938131 . S2CID 18315650 .
- ^ Ким Дж. Х. (декабрь 2018 г.). «Генетика болезни Альцгеймера» . Деменция и нейрокогнитивные расстройства . 17 (4): 131–136. дои : 10.12779/день.2018.17.4.131 . ПМЦ 6425887 . ПМИД 30906402 .
- ^ Кармона С., Зас К., Ву Э, Дакин К., Брас Дж., Геррейро Р. (август 2018 г.). «Роль TREM2 при болезни Альцгеймера и других нейродегенеративных расстройствах» . Ланцет Нейрол . 17 (8): 721–730. дои : 10.1016/S1474-4422(18)30232-1 . ПМИД 30033062 . S2CID 51706988 . Архивировано из оригинала 27 марта 2022 года . Проверено 21 февраля 2022 г.
- ^ Томияма Т. (июль 2010 г.). «[Участие бета-амилоида в этиологии болезни Альцгеймера]». Мозг и нервы = Синкей Кенкю Но Синпо . 62 (7): 691–699. ПМИД 20675873 .
- ^ Томияма Т., Нагата Т., Симада Х., Тераока Р., Фукусима А., Канемицу Х. и др. (март 2008 г.). «Новый вариант бета-амилоида, способствующий олигомеризации при деменции типа Альцгеймера». Анналы неврологии . 63 (3): 377–387. дои : 10.1002/ana.21321 . ПМИД 18300294 . S2CID 42311988 .
- ^ Томияма Т., Симада Х. (февраль 2020 г.). «Мутация APP Osaka при семейной болезни Альцгеймера - ее открытие, фенотипы и механизм рецессивного наследования» . Международный журнал молекулярных наук . 21 (4): 1413. doi : 10.3390/ijms21041413 . ПМК 7073033 . ПМИД 32093100 .
- ^ Гедерт М., Спиллантини М.Г., Кроутер Р.А. (июль 1991 г.). «Тау-белки и нейрофибриллярная дегенерация» . Патология головного мозга . 1 (4): 279–286. дои : 10.1111/j.1750-3639.1991.tb00671.x . ПМИД 1669718 . S2CID 33331924 .
- ^ Икбал К., Алонсо А., Чен С., Чохан М.О., Эль-Аккад Э., Гонг С.Х. и др. (январь 2005 г.). «Тау-патология при болезни Альцгеймера и других таупатиях» . Biochimica et Biophysica Acta (BBA) - Молекулярные основы болезней . 1739 (2–3): 198–210. дои : 10.1016/j.bbadis.2004.09.008 . ПМИД 15615638 .
- ^ Синьор Б., Минео Дж., Охнер С. (июнь 2020 г.). «Болезнь Альцгеймера, воспаление и роль антиоксидантов» . Журнал отчетов о болезни Альцгеймера . 4 (1): 175–183. doi : 10.3233/ADR-200171 . ПМЦ 7369138 . ПМИД 32715278 .
- ^ Кинни Дж.В., Бемиллер С.М., Муртишоу А.С., Лейсганг А.М., Салазар А.М., Лэмб Б.Т. (2018). «Воспаление как центральный механизм болезни Альцгеймера» . Болезнь Альцгеймера и деменция . 4 : 575–590. дои : 10.1016/j.trci.2018.06.014 . ПМК 6214864 . ПМИД 30406177 .
- ^ Лин X, Капур А., Гу Ю, Чоу М.Дж., Пэн Дж., Чжао К. и др. (февраль 2020 г.). «Вклад повреждения ДНК в болезнь Альцгеймера» . Int J Mol Sci . 21 (5): 1666. doi : 10.3390/ijms21051666 . ПМК 7084447 . ПМИД 32121304 .
- ^ Ирвин М.Р., Витиелло М.В. (март 2019 г.). «Последствия нарушения сна и воспаления для деменции при болезни Альцгеймера». «Ланцет». Неврология . 18 (3): 296–306. дои : 10.1016/S1474-4422(18)30450-2 . ПМИД 30661858 . S2CID 58546748 .
- ^ Льорет М.А., Сервера-Ферри А., Непомучено М., Монлор П., Эстеве Д., Льорет А. (февраль 2020 г.). «Является ли нарушение сна причиной или следствием болезни Альцгеймера? Обзор его возможной роли в качестве биомаркера» . Международный журнал молекулярных наук . 21 (3): 1168. doi : 10.3390/ijms21031168 . ПМК 7037733 . ПМИД 32050587 .
- ^ Хуат Т.Дж., Каматс-Перна Дж., Ньюкомб Э.А., Валмас Н., Китазава М., Медейрос Р. (апрель 2019 г.). «Токсичность металлов связана с болезнью Альцгеймера и нейровоспалением» . Дж Мол Биол . 431 (9): 1843–1868. дои : 10.1016/j.jmb.2019.01.018 . ПМК 6475603 . PMID 30664867 .
- ^ Эйкеленбум П., ван Эксель Э., Хуземанс Дж.Дж., Веерхейс Р., Роземюллер А.Дж., ван Гул В.А. (2010). «Нейровоспаление - раннее событие как в истории, так и в патогенезе болезни Альцгеймера». Нейродегенеративные заболевания . 7 (1–3): 38–41. дои : 10.1159/000283480 . ПМИД 20160456 . S2CID 40048333 .
- ^ Алвес Г.С., Эртель Кнехель В., Кнехель С., Карвальо А.Ф., Пантель Дж., Энгельхардт Е. и др. (2015). «Интеграция теории ретрогенеза в патологию болезни Альцгеймера: выводы из исследования DTI-TBSS микроструктурной целостности белого вещества» . БиоМед Исследования Интернэшнл . 2015 : 291658. дои : 10.1155/2015/291658 . ПМК 4320890 . ПМИД 25685779 .
- ^ Рейсберг Б., Франссен Э.Х., Хасан С.М., Монтейро И., Боксай И., Сурен Л.Е. и др. (1999). «Ретрогенез: клинические, физиологические и патологические механизмы старения мозга, болезни Альцгеймера и других процессов деменции». Европейский архив психиатрии и клинической неврологии . 249 (3): 28–36. дои : 10.1007/pl00014170 . ПМИД 10654097 . S2CID 23410069 .
- ^ Зис П., Хадживасилиу М. (февраль 2019 г.). «Лечение неврологических проявлений чувствительности к глютену и целиакии» . Современные варианты лечения в неврологии . 21 (3): 10. дои : 10.1007/s11940-019-0552-7 . ПМИД 30806821 . S2CID 73466457 .
- ^ Махлуф С., Мессельмани М., Зауали Дж., Мрисса Р. (март 2018 г.). «Когнитивные нарушения при целиакии и нецелиакийной чувствительности к глютену: обзор литературы об основных когнитивных нарушениях, визуализации и влиянии безглютеновой диеты». Acta Neurologica Belgica (обзор). 118 (1): 21–27. дои : 10.1007/s13760-017-0870-z . ПМИД 29247390 . S2CID 3943047 .
- ^ Барцокис Г. (август 2011 г.). «Болезнь Альцгеймера как гомеостатическая реакция на возрастное разрушение миелина» . Нейробиология старения . 32 (8): 1341–1371. doi : 10.1016/j.neurobiolaging.2009.08.007 . ПМК 3128664 . ПМИД 19775776 .
- ^ Цай З, Сяо М (2016). «Олигодендроциты и болезнь Альцгеймера». Международный журнал неврологии . 126 (2): 97–104. дои : 10.3109/00207454.2015.1025778 . ПМИД 26000818 . S2CID 21448714 .
- ^ Чжоу Л., Миранда-Саксена М., Саксена Н.К. (май 2013 г.). «Вирусы и нейродегенерация» . Вирусологический журнал . 10 (1): 172. дои : 10.1186/1743-422X-10-172 . ПМК 3679988 . ПМИД 23724961 .
- ^ Гонсалес-Фернандес Э., Хуан Дж. (сентябрь 2023 г.). «Когнитивные аспекты COVID-19». Текущие отчеты по неврологии и нейробиологии . 23 (9): 531–538. дои : 10.1007/s11910-023-01286-y . ПМИД 37490194 . S2CID 260132167 .
- ^ Венк Г.Л. (2003). «Нейропатологические изменения при болезни Альцгеймера». Журнал клинической психиатрии . 64 (Приложение 9): 7–10. ПМИД 12934968 .
- ^ Браак Х., Дель Тредичи К. (декабрь 2012 г.). «Где, когда и в какой форме начинается спорадическая болезнь Альцгеймера?». Современное мнение в неврологии . 25 (6): 708–714. дои : 10.1097/WCO.0b013e32835a3432 . ПМИД 23160422 .
- ^ Десикан Р.С., Кабрал Х.Дж., Хесс К.П., Диллон В.П., Гластонбери К.М., Вайнер М.В. и др. (август 2009 г.). «Автоматические методы МРТ выявляют людей с легкими когнитивными нарушениями и болезнью Альцгеймера» . Мозг . 132 (Часть 8): 2048–2057 гг. дои : 10.1093/brain/awp123 . ПМК 2714061 . ПМИД 19460794 .
- ^ Стон Р. (июль 2009 г.). «Программное обеспечение МРТ точно идентифицирует доклиническую болезнь Альцгеймера» . Диагностическая визуализация . Архивировано из оригинала 21 февраля 2022 года . Проверено 21 февраля 2022 г.
- ^ Jump up to: а б Тирабоски П., Хансен Л.А., Тал Л.Дж., Кори-Блум Дж. (июнь 2004 г.). «Важность нейритных бляшек и клубков для развития и эволюции БА». Неврология . 62 (11): 1984–1989. дои : 10.1212/01.WNL.0000129697.01779.0A . ПМИД 15184601 . S2CID 25017332 .
- ^ ДеТюр М.А., Диксон Д.В. (август 2019 г.). «Невропатологический диагноз болезни Альцгеймера» . Молекулярная нейродегенерация . 14 (1): 32. дои : 10.1186/s13024-019-0333-5 . ПМК 6679484 . ПМИД 31375134 .
- ^ Тирабоски П., Саббах М.Н., Хансен Л.А., Салмон Д.П., Мердес А., Гамст А. и др. (апрель 2004 г.). «Болезнь Альцгеймера без неокортикальных нейрофибриллярных клубков: «второй взгляд» ». Неврология . 62 (7): 1141–1147. дои : 10.1212/01.wnl.0000118212.41542.e7 . ПМИД 15079014 . S2CID 22832110 .
- ^ Бурас С., Хоф П.Р., Яннакопулос П., Мишель Дж.П., Моррисон Дж.Х. (1994). «Региональное распределение нейрофибриллярных клубков и сенильных бляшек в коре головного мозга пожилых пациентов: количественная оценка годового аутопсии из гериатрической больницы». Кора головного мозга . 4 (2): 138–150. дои : 10.1093/cercor/4.2.138 . ПМИД 8038565 .
- ^ Коцбауэр П.Т., Трояновск JQ, Ли В.М. (октябрь 2001 г.). «Патология телец Леви при болезни Альцгеймера». Журнал молекулярной нейронауки . 17 (2): 225–232. дои : 10.1385/JMN:17:2:225 . ПМИД 11816795 . S2CID 44407971 .
- ^ Хасимото М., Рокенштейн Э., Крюс Л., Маслия Э. (2003). «Роль агрегации белков в митохондриальной дисфункции и нейродегенерации при болезнях Альцгеймера и Паркинсона». Нейромолекулярная медицина . 4 (1–2): 21–36. дои : 10.1385/НММ:4:1-2:21 . ПМИД 14528050 . S2CID 20760249 .
- ^ Приллер С., Бауэр Т., Миттериггер Г., Кребс Б., Кречмар Х.А., Хермс Дж. (июль 2006 г.). «Формирование и функция синапсов модулируются белком-предшественником амилоида» . Журнал неврологии . 26 (27): 7212–7221. doi : 10.1523/JNEUROSCI.1450-06.2006 . ПМК 6673945 . ПМИД 16822978 .
- ^ Тернер П.Р., О'Коннор К., Тейт В.П., Авраам В.К. (май 2003 г.). «Роль белка-предшественника амилоида и его фрагментов в регуляции нервной активности, пластичности и памяти». Прогресс нейробиологии . 70 (1): 1–32. дои : 10.1016/S0301-0082(03)00089-3 . ПМИД 12927332 . S2CID 25376584 .
- ^ Хупер, Н.М. (апрель 2005 г.). «Роль протеолиза и липидных рафтов в обработке белка-предшественника амилоида и прионного белка». Труды Биохимического общества . 33 (Часть 2): 335–338. дои : 10.1042/BST0330335 . ПМИД 15787600 . S2CID 14269634 .
- ^ Ониши С., Такано К. (март 2004 г.). «Амилоидные фибриллы с точки зрения сворачивания белка» . Клеточные и молекулярные науки о жизни . 61 (5): 511–524. дои : 10.1007/s00018-003-3264-8 . ПМЦ 11138910 . ПМИД 15004691 . S2CID 25739126 .
- ^ Эрнандес Ф., Авила Дж. (сентябрь 2007 г.). «Тауопатии» . Клеточные и молекулярные науки о жизни . 64 (17): 2219–2233. дои : 10.1007/s00018-007-7220-x . ПМЦ 11136052 . ПМИД 17604998 . S2CID 261121643 .
- ^ Сан В., Самими Х., Гамез М., Заре Х., Фрост Б. (август 2018 г.). «Патогенное тау-индуцированное истощение piRNA способствует гибели нейронов из-за нарушения регуляции мобильных элементов при нейродегенеративных тауопатиях» . Природная неврология . 21 (8): 1038–1048. дои : 10.1038/s41593-018-0194-1 . ПМК 6095477 . ПМИД 30038280 .
- ^ Балусу С, Хорре К, Трапп Н, Краессертс К, Снеллинкс А, Сернелс Л, Т'Сиен Д, Хрисиду И, Арранс А.М., Сьерксма А, Симрен Дж, Карикари Т.К., Зеттерберг Х., Чен В.Т., Тал Д.Р., Сальта Е. , Фирс М., Де Струпер Б. MEG3 активирует некроптоз в ксенотрансплантатах нейронов человека, моделирующих болезнь Альцгеймера. Наука . 15 сентября 2023 г.; 381 (6663): 1176–1182. doi : 10.1126/science.abp9556 ПМИД 37708272
- ^ «Ученые выяснили, как клетки мозга умирают при болезни Альцгеймера» . Новости Би-би-си . 15 сентября 2023 г. Проверено 27 сентября 2023 г.
- ^ Ван Брук Б., Ван Брокховен С., Кумар-Сингх С. (2007). «Современное понимание молекулярных механизмов болезни Альцгеймера и их значение для терапевтических подходов». Нейродегенеративные заболевания . 4 (5): 349–365. дои : 10.1159/000105156 . ПМИД 17622778 . S2CID 7949658 .
- ^ Хуан Ю, Маке Л. (март 2012 г.). «Механизмы болезни Альцгеймера и терапевтические стратегии» . Клетка . 148 (6): 1204–1222. дои : 10.1016/j.cell.2012.02.040 . ПМК 3319071 . ПМИД 22424230 .
- ^ Янкнер Б.А., Даффи Л.К., Киршнер Д.А. (октябрь 1990 г.). «Нейротрофические и нейротоксические эффекты бета-амилоидного белка: обращение вспять нейропептидами тахикинина». Наука . 250 (4978): 279–282. Бибкод : 1990Sci...250..279Y . дои : 10.1126/science.2218531 . ПМИД 2218531 .
- ^ Чен X, Ян С.Д. (декабрь 2006 г.). «Митохондриальный Абета: потенциальная причина метаболической дисфункции при болезни Альцгеймера». ИУБМБ Жизнь . 58 (12): 686–694. дои : 10.1080/15216540601047767 . ПМИД 17424907 . S2CID 85423830 .
- ^ Райан С.К., Угальде К.Л., Роллан А.С., Скидмор Дж., Девос Д., Хаммонд Т.Р. (октябрь 2023 г.). «Терапевтическое ингибирование ферроптоза при нейродегенеративных заболеваниях» . Тенденции в фармакологических науках . 44 (10): 674–688. дои : 10.1016/j.tips.2023.07.007 . ПМИД 37657967 .
- ^ Грейг Н.Х., Мэттсон М.П., Перри Т., Чан С.Л., Джордано Т., Самбамурти К. и др. (декабрь 2004 г.). «Новые терапевтические стратегии и кандидаты в лекарства от нейродегенеративных заболеваний: ингибиторы p53 и TNF-альфа, а также агонисты рецептора GLP-1» . Анналы Нью-Йоркской академии наук . 1035 (1): 290–315. Бибкод : 2004NYASA1035..290G . дои : 10.1196/анналы.1332.018 . ПМИД 15681814 . S2CID 84659695 . Архивировано из оригинала 3 июня 2020 года . Проверено 19 июля 2019 г.
- ^ Хенека М.Т., Карсон М.Дж., Эль Хури Дж., Ландрет Г.Е., Броссерон Ф., Файнштейн Д.Л. и др. (апрель 2015 г.). «Нейровоспаление при болезни Альцгеймера» . «Ланцет». Неврология . 14 (4): 388–405. дои : 10.1016/S1474-4422(15)70016-5 . ПМК 5909703 . ПМИД 25792098 .
- ^ Тапиа-Арансибия Л., Алиага Е., Силхол М., Аранчибия С. (ноябрь 2008 г.). «Новое понимание функции BDNF мозга при нормальном старении и болезни Альцгеймера». Обзоры исследований мозга . 59 (1): 201–220. дои : 10.1016/j.brainresrev.2008.07.007 . hdl : 10533/142174 . ПМИД 18708092 . S2CID 6589846 .
- ^ Шиндовски К., Беларби К., Буэ Л. (февраль 2008 г.). «Нейротрофические факторы при болезни Альцгеймера: роль аксонального транспорта» . Гены, мозг и поведение . 7 (Приложение 1): 43–56. дои : 10.1111/j.1601-183X.2007.00378.x . ПМК 2228393 . ПМИД 18184369 .
- ^ Jump up to: а б Сачдев П.С., Блэкер Д., Блейзер Д.Г., Гангули М., Йесте Д.В., Полсен Дж.С. и др. (ноябрь 2014 г.). «Классификация нейрокогнитивных расстройств: подход DSM-5» . Обзоры природы. Неврология . 10 (11): 634–642. дои : 10.1038/nrneurol.2014.181 . ПМИД 25266297 . S2CID 20635070 . Архивировано из оригинала 20 марта 2022 года . Проверено 27 ноября 2021 г.
- ^ Мендес М.Ф. (2006). «Точный диагноз раннего деменции» . Международный журнал психиатрии в медицине . 36 (4): 401–412. doi : 10.2190/Q6J4-R143-P630-KW41 . ПМИД 17407994 . S2CID 43715976 . Архивировано из оригинала 3 июня 2020 года . Проверено 25 мая 2020 г.
- ^ Клафки Х.В., Штауфенбиль М., Корнхубер Дж., Вилтфанг Дж. (ноябрь 2006 г.). «Терапевтические подходы к болезни Альцгеймера» . Мозг . 129 (Часть 11): 2840–2855. дои : 10.1093/brain/awl280 . ПМИД 17018549 .
- ^ Деменция: Краткое справочное руководство (PDF) . Лондон: (Великобритания) Национальный институт здравоохранения и клинического совершенства . 2006. ISBN 978-1-84629-312-2 . Архивировано из оригинала (PDF) 27 февраля 2008 года . Проверено 22 февраля 2008 г.
- ^ Шретер М.Л., Штейн Т., Масловски Н., Нейман Дж. (октябрь 2009 г.). «Нейральные корреляты болезни Альцгеймера и легких когнитивных нарушений: систематический и количественный метаанализ с участием 1351 пациента» . НейроИмидж . 47 (4): 1196–1206. doi : 10.1016/j.neuroimage.2009.05.037 . ПМК 2730171 . ПМИД 19463961 .
- ^ Цзе К.В., Трейер В., Шибли Р., Му Л. (январь 2021 г.). «Таувид: первый одобренный FDA ПЭТ-индикатор для визуализации тау-патологии при болезни Альцгеймера» . Фармацевтика . 14 (2): 110. дои : 10.3390/ph14020110 . ПМК 7911942 . ПМИД 33573211 .
- ^ Jump up to: а б с д и Веллер Дж., Бадсон А. (2018). «Современное понимание диагностики и лечения болезни Альцгеймера» . F1000Research (Обзор). 7 : 1161. дои : 10.12688/f1000research.14506.1 . ПМК 6073093 . ПМИД 30135715 .
- ^ Сильва М.В., Лурес К.М., Алвес Л.К., де Соуза Л.К., Борхес К.Б., Карвалью М.Д. (май 2019 г.). «Болезнь Альцгеймера: факторы риска и потенциально защитные меры» . Журнал биомедицинской науки . 26 (1): 33. дои : 10.1186/s12929-019-0524-y . ПМК 6507104 . ПМИД 31072403 .
- ^ Хейн Ф.Т., Робинсон М., Ли Б.И., Бай О., Леоненко З., Альберт М.С. (2017). «Последние достижения в исследованиях болезни Альцгеймера, Часть 3: Диагностика и лечение» . Журнал болезни Альцгеймера (обзор). 57 (3): 645–665. дои : 10.3233/JAD-160907 . ПМК 5389048 . ПМИД 28269772 .
- ^ Диагностическое и статистическое руководство по психическим расстройствам: DSM-IV-TR (4-я текстовая редакция). Вашингтон, округ Колумбия: Американская психиатрическая ассоциация. 2000. ISBN 978-0-89042-025-6 .
- ^ Jump up to: а б с Диагностическое и статистическое руководство по психическим расстройствам: ДСМ-5 . Вашингтон, округ Колумбия: Американская психиатрическая ассоциация. 2013. с. 611. ИСБН 978-0-89042-555-8 .
- ^ Сакс-Эрикссон Н., Блейзер Д.Г. (январь 2015 г.). «Новый диагноз легкого нейрокогнитивного расстройства в DSM-5 и его связь с исследованиями легких когнитивных нарушений». Старение и психическое здоровье . 19 (1): 2–12. дои : 10.1080/13607863.2014.920303 . ПМИД 24914889 . S2CID 46244321 .
- ^ Стокин Г.Б., Крелл-Рош Дж., Петерсен Р.К., Геда Ю.Е. (2015). «Легкое нейрокогнитивное расстройство: старое вино в новой бутылке» . Гарвардский обзор психиатрии (обзор). 23 (5): 368–376. doi : 10.1097/HRP.0000000000000084 . ПМЦ 4894762 . ПМИД 26332219 .
- ^ Сперри Л., Карлсон Дж., Зауэрхебер Дж., Сперри Дж., ред. (2014). Психопатология и психотерапия: диагностика DSM-5, концептуализация случая и лечение (3-е изд.). Нью-Йорк: Рутледж. стр. 342–343. дои : 10.4324/9780203772287 . ISBN 978-0-203-77228-7 . Архивировано из оригинала 16 ноября 2021 года . Проверено 16 ноября 2021 г.
- ^ Финк Х.А., Хемми Л.С., Линскенс Э.Дж., Сильверман П.С., Макдональд Р., МакКартен Дж.Р. и др. (2020). Диагностика и лечение клинической деменции альцгеймеровского типа: систематический обзор . Сравнительные обзоры эффективности AHRQ. Роквилл (Мэриленд): Агентство исследований и качества здравоохранения (США). ПМИД 32369312 . Архивировано из оригинала 7 июля 2023 года . Проверено 16 ноября 2021 г.
- ^ Стокин Г.Б., Крелл-Рош Дж., Петерсен Р.К., Геда Ю.Е. (сентябрь 2015 г.). «Легкое нейрокогнитивное расстройство: старое вино в новой бутылке» . Гарвардский обзор психиатрии . 23 (5). Здоровье Уолтерса Клювера: 368–376. doi : 10.1097/HRP.0000000000000084 . ПМЦ 4894762 . ПМИД 26332219 .
- ^ Брэдфилд Н.И., Эймс Д. (апрель 2020 г.). «Легкие когнитивные нарушения: описательный обзор таксономий и систематический обзор их прогнозирования возникновения деменции при болезни Альцгеймера» . Бюллетень BJPsych (обзор). 44 (2): 67–74. дои : 10.1192/bjb.2019.77 . ПМЦ 7283119 . ПМИД 31724527 .
- ^ Jump up to: а б Вега Дж. Н., Ньюхаус, Пенсильвания (октябрь 2014 г.). «Легкие когнитивные нарушения: диагноз, течение и новые методы лечения» . Текущие отчеты психиатрии . 16 (10). SpringerLink: 490. doi : 10.1007/s11920-014-0490-8 . ПМК 4169219 . ПМИД 25160795 .
- ^ Парнетти Л., Чипи Э., Сальвадори Н., Д'Андреа К., Эусеби П. (январь 2019 г.). «Распространенность и риск прогрессирования доклинических стадий болезни Альцгеймера: систематический обзор и метаанализ» . Исследования и терапия болезни Альцгеймера . 11 (1). Springer Nature: 7. doi : 10.1186/s13195-018-0459-7 . ПМК 6334406 . ПМИД 30646955 .
- ^ Jump up to: а б с д и Джек CR, Беннетт Д.А., Бленноу К., Каррильо MC, Данн Б., Хэберлейн С.Б. и др. (апрель 2018 г.). «Рамка исследования NIA-AA: к биологическому определению болезни Альцгеймера» . Болезнь Альцгеймера и деменция . 14 (4): 535–562. дои : 10.1016/j.jalz.2018.02.018 . ПМЦ 5958625 . ПМИД 29653606 .
- ^ Сперлинг Р.А., Айсен П.С., Беккет Л.А., Беннетт Д.А., Крафт С., Фаган А.М. и др. (май 2011 г.). «На пути к определению доклинических стадий болезни Альцгеймера: рекомендации рабочих групп Национального института старения-Ассоциации Альцгеймера по диагностическим рекомендациям для болезни Альцгеймера» . Болезнь Альцгеймера и деменция . 7 (3): 280–292. дои : 10.1016/j.jalz.2011.03.003 . ПМК 3220946 . ПМИД 21514248 .
- ^ Ченг Ю.В., Чен Т.Ф., Чиу М.Дж. (16 февраля 2017 г.). «От легких когнитивных нарушений к субъективному снижению когнитивных функций: концептуальная и методологическая эволюция» . Нервно-психические заболевания и лечение . 13 . Dove Medical Press Limited: 491–498. дои : 10.2147/NDT.S123428 . ПМЦ 5317337 . ПМИД 28243102 .
- ^ Альберт М.С., ДеКоски С.Т., Диксон Д., Дюбуа Б., Фельдман Х.Х., Фокс, Северная Каролина и др. (май 2011 г.). «Диагностика легких когнитивных нарушений вследствие болезни Альцгеймера: рекомендации рабочих групп Национального института старения-Ассоциации Альцгеймера по диагностическим рекомендациям для болезни Альцгеймера» . Болезнь Альцгеймера и деменция . 7 (3): 270–279. дои : 10.1016/j.jalz.2011.03.008 . ПМК 3312027 . ПМИД 21514249 .
- ^ Jump up to: а б с д Чертков Х., Фельдман Х.Х., Якова С., Массуд Ф. (июль 2013 г.). «Определения состояний деменции и преддеменции при болезни Альцгеймера и сосудистых когнитивных нарушениях: консенсус Канадской конференции по диагностике деменции» . Исследования и терапия болезни Альцгеймера . 5 (Приложение 1). БМК: S2. дои : 10.1186/alzrt198 . ПМЦ 3981054 . ПМИД 24565215 .
- ^ Jump up to: а б с Пападакис М.А., Макфи С.Дж., Рабоу М.В. (2021). Текущая медицинская диагностика и лечение (шестидесятое изд.). Нью-Йорк: МакГроу Хилл. п. 1760. ISBN 978-1-260-46986-8 . OCLC 1195972209 .
- ^ Томбо, Теннесси, Макинтайр, Нью-Джерси (сентябрь 1992 г.). «Мини-психическое обследование: комплексный обзор». Журнал Американского гериатрического общества . 40 (9): 922–935. дои : 10.1111/j.1532-5415.1992.tb01992.x . ПМИД 1512391 . S2CID 25169596 .
- ^ Паскье Ф (январь 1999 г.). «Ранняя диагностика деменции: нейропсихология». Журнал неврологии . 246 (1): 6–15. дои : 10.1007/s004150050299 . ПМИД 9987708 . S2CID 2108587 .
- ^ Харви П.Д., Мориарти П.Дж., Кляйнман Л., Койн К., Садовски С.Х., Чен М. и др. (2005). «Подтверждение оценки деменции лицом, осуществляющим уход: шкала тяжести деменции». Болезнь Альцгеймера и связанные с ней расстройства . 19 (4): 186–194. дои : 10.1097/01.wad.0000189034.43203.60 . ПМИД 16327345 . S2CID 20238911 .
- ^ Антуан С., Антуан П., Гермонпре П., Фригард Б. (2004). «[Осознание дефицита и анозогнозии при болезни Альцгеймера]». L'Encéphale (на французском языке). 30 (6): 570–577. дои : 10.1016/S0013-7006(04)95472-3 . ПМИД 15738860 .
- ^ Круз В.Т., Паис Дж., Тейшейра А., Нуньес Б. (2004 г.). «[Начальные симптомы болезни Альцгеймера: восприятие лица, осуществляющего уход]». Acta Médica Portuguesa (на португальском языке). 17 (6): 435–444. ПМИД 16197855 .
- ^ Jump up to: а б с Штерн С.Д., Cifu AS, Альткорн Д. (2020). Симптом к диагнозу: научно обоснованное руководство (4-е изд.). Нью-Йорк: McGraw-Hill Medical. стр. 209–210. ISBN 978-1-260-12111-7 . OCLC 1121597721 .
- ^ Джа А, Мухопадхая К (2021). Болезнь Альцгеймера: руководство по диагностике и лечению . Чам, Швейцария: Springer. п. 32. ISBN 978-3-030-56739-2 . OCLC 1202472277 .
- ^ Сан X, Стеффенс Д.К., Ау Р., Фольштейн М., Саммерград П., Йи Дж. и др. (май 2008 г.). «Амилоид-ассоциированная депрессия: продромальная депрессия болезни Альцгеймера?» . Архив общей психиатрии . 65 (5): 542–550. дои : 10.1001/archpsyc.65.5.542 . ПМК 3042807 . ПМИД 18458206 .
- ^ Гельдмахер Д.С., Уайтхаус П.Дж. (май 1997 г.). «Дифференциальная диагностика болезни Альцгеймера». Неврология . 48 (5 Приложение 6): S2–S9. дои : 10.1212/WNL.48.5_Suppl_6.2S . ПМИД 9153154 . S2CID 30018544 .
- ^ Поттер Г.Г., Стеффенс, округ Колумбия (май 2007 г.). «Вклад депрессии в когнитивные нарушения и деменцию у пожилых людей». Невролог . 13 (3): 105–117. дои : 10.1097/01.nrl.0000252947.15389.a9 . ПМИД 17495754 . S2CID 24569198 .
- ^ Чжан С., Смайлагич Н., Хайд С., Ноэль-Сторр А.Х., Таквоинги Ю., МакШейн Р. и др. (июль 2014 г.). «(11)C-PIB-PET для ранней диагностики деменции при болезни Альцгеймера и других деменций у людей с легкими когнитивными нарушениями (MCI)» . Кокрановская база данных систематических обзоров . 2014 (7): CD010386. дои : 10.1002/14651858.CD010386.pub2 . ПМК 6464750 . ПМИД 25052054 .
- ^ Смайлагич Н., Ваканте М., Хайд С., Мартин С., Укумунне О., Сачпекидис С. (январь 2015 г.). " 18 ПЭТ с F-ФДГ для ранней диагностики деменции при болезни Альцгеймера и других деменций у людей с легкими когнитивными нарушениями (MCI)» . Кокрановская база данных систематических обзоров . 1 (1): CD010632. doi : 10.1002/14651858.CD010632.pub2 . ПМЦ 7081123 . ПМИД 25629415 .
- ^ Винья Дж., Санс-Рос Дж. (октябрь 2018 г.). «Болезнь Альцгеймера: имеет смысл только профилактика» . Европейский журнал клинических исследований . 48 (10): e13005. дои : 10.1111/eci.13005 . ПМИД 30028503 . S2CID 51703879 .
- ^ Jump up to: а б с Сюй Д., Маршалл Г.А. (2017). «Испытания первичной и вторичной профилактики болезни Альцгеймера: оглядываясь назад, двигаясь вперед» . Курр Альцгеймер Рез . 14 (4): 426–440. дои : 10.2174/1567205013666160930112125 . ПМЦ 5329133 . ПМИД 27697063 .
- ^ Паттерсон С., Фейтнер Дж.В., Гарсия А., Сюн Г.И., Макнайт С., Садовник А.Д. (февраль 2008 г.). «Диагностика и лечение деменции: 1. Оценка риска и первичная профилактика болезни Альцгеймера» . CMAJ . 178 (5): 548–556. дои : 10.1503/cmaj.070796 . ПМК 2244657 . ПМИД 18299540 .
- ^ Розендорфф С., Бери М.С., Сильверман Дж.М. (2007). «Сердечно-сосудистые факторы риска болезни Альцгеймера». Американский журнал гериатрической кардиологии . 16 (3): 143–149. дои : 10.1111/j.1076-7460.2007.06696.x . ПМИД 17483665 .
- ^ Чу К.С., Ценг П.Т., Стаббс Б., Чен Т.И., Тан Ч.Х., Ли Д.Д. и др. (апрель 2018 г.). «Использование статинов и риск деменции и легких когнитивных нарушений: систематический обзор и метаанализ» . Научные отчеты . 8 (1): 5804. Бибкод : 2018NatSR...8.5804C . дои : 10.1038/s41598-018-24248-8 . ПМЦ 5895617 . ПМИД 29643479 .
- ^ Унгвари З., Тот П., Тарантини С., Продан С.И., Соронд Ф., Меркели Б. и др. (октябрь 2021 г.). «Когнитивные нарушения, вызванные гипертонией: от патофизиологии к общественному здравоохранению» . Обзоры природы Нефрология . 17 (10): 639–654. дои : 10.1038/s41581-021-00430-6 . ПМК 8202227 . ПМИД 34127835 .
- ^ Летаби А., Хогерворст Э., Ричардс М., Йесуфу А., Яффе К. (январь 2008 г.). «Заместительная гормональная терапия когнитивных функций у женщин в постменопаузе» . Cochrane Database Syst Rev. 2008 (1): CD003122. дои : 10.1002/14651858.CD003122.pub2 . ПМК 6599876 . ПМИД 18254016 .
- ^ Фарина Н., Растед Дж., Табет Н. (январь 2014 г.). «Влияние физических упражнений на когнитивные результаты при болезни Альцгеймера: систематический обзор». Международная психогериатрия (обзор). 26 (1): 9–18. дои : 10.1017/S1041610213001385 . ПМИД 23962667 . S2CID 24936334 .
- ^ Барнард Н.Д., Буш А.И., Чеккарелли А., Купер Дж., де Ягер К.А., Эриксон К.И. и др. (сентябрь 2014 г.). «Руководства по питанию и образу жизни для профилактики болезни Альцгеймера» . Нейробиология старения . 35 (Приложение 2): S74–S78. doi : 10.1016/j.neurobiolaging.2014.03.033 . hdl : 11343/52774 . ПМИД 24913896 . S2CID 8265377 .
- ^ Jump up to: а б Бхатти Г.К., Редди А.П., Редди П.Х., Бхатти Дж.С. (2019). «Модификации образа жизни и диетические вмешательства при снижении когнитивных функций, связанном со старением, и болезни Альцгеймера» . Границы стареющей неврологии (обзор). 11 :369. дои : 10.3389/fnagi.2019.00369 . ПМК 6966236 . ПМИД 31998117 .
- ^ Лопес-Ортис С., Листа С., Валенсуэла П.Л., Пинто-Фрага Х., Кармона Р., Карачи Ф. и др. (ноябрь 2022 г.). «Влияние физической активности и физических упражнений на болезнь Альцгеймера: общий обзор существующих метаанализов». Журнал неврологии . 270 (2): 711–725. дои : 10.1007/s00415-022-11454-8 . ПМИД 36342524 . S2CID 253382289 .
- ^ Имтиаз Б., Толппанен А.М., Кивипелто М., Сойнинен Х. (апрель 2014 г.). «Будущие направления борьбы с болезнью Альцгеймера от факторов риска к профилактике». Биохимическая фармакология (обзор). 88 (4): 661–670. дои : 10.1016/j.bcp.2014.01.003 . ПМИД 24418410 .
- ^ Имтиаз Б., Толппанен А.М., Кивипелто М., Сойнинен Х. (апрель 2014 г.). «Будущие направления борьбы с болезнью Альцгеймера от факторов риска к профилактике». Биохим Фармакол . 88 (4): 661–70. дои : 10.1016/j.bcp.2014.01.003 . ПМИД 24418410 .
- ^ Кивипелто М., Мангиалаше Ф., Нганду Т. (ноябрь 2018 г.). «Вмешательства в образ жизни для предотвращения когнитивных нарушений, деменции и болезни Альцгеймера». Нат преподобный Нейрол . 14 (11): 653–666. дои : 10.1038/s41582-018-0070-3 . ПМИД 30291317 . S2CID 52925352 .
- ^ Jump up to: а б с д Борхес Ч.Р., Поярес Д., Пиовезан Р., Нитрини Р., Бруки С. (ноябрь 2019 г.). «Болезнь Альцгеймера и нарушения сна: обзор» . Arq Нейропсихиатр . 77 (11): 815–824. дои : 10.1590/0004-282X20190149 . ПМИД 31826138 . S2CID 209327994 .
- ^ Jump up to: а б Уддин М.С., Тевари Д., Мамун А.А., Кабир М.Т., Нияз К., Вахед М.И. и др. (июль 2020 г.). «Циркадный ритм и дисфункция сна при болезни Альцгеймера». Обзоры исследований старения . 60 : 101046. doi : 10.1016/j.arr.2020.101046 . ПМИД 32171783 . S2CID 212729131 .
- ^ Расмуссен М.К., Местре Х., Недергаард М. (ноябрь 2018 г.). «Глимфатический путь при неврологических расстройствах» . Ланцет Нейрол . 17 (11): 1016–1024. дои : 10.1016/S1474-4422(18)30318-1 . ПМК 6261373 . ПМИД 30353860 .
- ^ Ирвин М.Р., Витиелло М.В. (март 2019 г.). «Последствия нарушения сна и воспаления для деменции при болезни Альцгеймера». Ланцет Нейрол . 18 (3): 296–306. дои : 10.1016/S1474-4422(18)30450-2 . ПМИД 30661858 . S2CID 58546748 .
- ^ Хампель Х., Вергалло А., Агилар Л.Ф., Бенда Н., Бройх К., Куэлло А.С. и др. (апрель 2018 г.). «Точная фармакология болезни Альцгеймера» . Фармакологические исследования . 130 : 331–365. дои : 10.1016/J.phrs.2018.02.014 . ПМК 8505114 . ПМИД 29458203 .
- ^ Чен Ю, Чжан Дж, Чжан Т, Цао Л, Ю Ю, Чжан С и др. (март 2020 г.). «Лечение болезни Альцгеймера и легких когнитивных нарушений с помощью медитации: протокол систематического обзора» . Лекарство . 99 (10): e19313. дои : 10.1097/MD.0000000000019313 . ПМЦ 7478420 . ПМИД 32150066 .
- ^ Винкельман М.Ю., Сабо А., Фречка Э. (ноябрь 2023 г.). «Потенциал психоделиков для лечения болезни Альцгеймера и связанных с ней деменций» . Европейская нейропсихофармакология . 76 : 3–16. дои : 10.1016/j.euroneuro.2023.07.003 . hdl : 10852/108211 . ПМИД 37451163 .
- ^ Дрислейн Ф., Овауимян А., Тарулли А., Богл А.К., МакИдафф С., Каплан Л.Р. (2019). Чертежи неврологии (Пятое изд.). Филадельфия: Уолтерс Клювер. п. 146. ИСБН 978-1-4963-8739-4 . OCLC 1048659425 .
- ^ Jump up to: а б с Биркс Дж.С., Харви Р.Дж. (июнь 2018 г.). «Донепезил при деменции, вызванной болезнью Альцгеймера» . Кокрановская база данных систематических обзоров . 2018 (6): CD001190. дои : 10.1002/14651858.CD001190.pub3 . ПМК 6513124 . ПМИД 29923184 .
- ^ Финк Х.А., Линскенс Э.Дж., Макдональд Р., Сильверман П.С., МакКартен Дж.Р., Тэлли К.М. и др. (май 2020 г.). «Польза и вред рецептурных лекарств и добавок для лечения клинической деменции альцгеймеровского типа». Анналы внутренней медицины . 172 (10): 656–668. дои : 10.7326/M19-3887 . ПМИД 32340037 . S2CID 216595473 .
- ^ Берковиц А (2017). Клиническая неврология и нейроанатомия: локализационный подход . Нью-Йорк: МакГроу Хилл. п. 236. ИСБН 978-1-259-83440-0 . OCLC 948547621 .
- ^ Геула С., Месулам М.М. (1995). «Холинэстераза и патология болезни Альцгеймера». Болезнь Альцгеймера и связанные с ней расстройства . 9 (Приложение 2): 23–28. дои : 10.1097/00002093-199501002-00005 . ПМИД 8534419 .
- ^ Шталь С.М. (ноябрь 2000 г.). «Новые ингибиторы холинэстеразы при болезни Альцгеймера, Часть 2: иллюстрация механизмов их действия» . Журнал клинической психиатрии . 61 (11): 813–814. дои : 10.4088/JCP.v61n1101 . ПМИД 11105732 .
- ^ Jump up to: а б Биркс Дж. (январь 2006 г.). Биркс Дж. (ред.). «Ингибиторы холинэстеразы при болезни Альцгеймера» . Кокрановская база данных систематических обзоров . 2016 (1): CD005593. дои : 10.1002/14651858.CD005593 . ПМЦ 9006343 . ПМИД 16437532 .
- ^ Рашетти Р., Альбанезе Э., Ванакор Н., Маггини М. (ноябрь 2007 г.). «Ингибиторы холинэстеразы при легких когнитивных нарушениях: систематический обзор рандомизированных исследований» . ПЛОС Медицина . 4 (11): е338. doi : 10.1371/journal.pmed.0040338 . ПМК 2082649 . ПМИД 18044984 .
- ^ Олдридж Б.К., Корелли Р.Л., Эрнст М.Е., Гульельмо Б.Дж., Джейкобсон П.А., Краджан В.А. и др. (2013). Прикладная терапия: клиническое применение лекарств (10-е изд.). Балтимор: Wolters Kluwer Health/Lippincott Williams & Wilkins. п. 2385. ИСБН 978-1-60913-713-7 .
- ^ Jump up to: а б Lipton SA (февраль 2006 г.). «Смена парадигмы нейропротекции путем блокады рецепторов NMDA: мемантин и не только». Обзоры природы. Открытие наркотиков . 5 (2): 160–170. дои : 10.1038/nrd1958 . ПМИД 16424917 . S2CID 21379258 .
- ^ «Мемантин» . Национальная медицинская библиотека США (Medline). 4 января 2004 г. Архивировано из оригинала 22 февраля 2010 г. Проверено 3 февраля 2010 г.
- ^ МакШейн Р., Вестби М.Дж., Робертс Э., Минакаран Н., Шнайдер Л., Фарримонд Л.Е. и др. (март 2019 г.). «Мемантин при слабоумии» . Кокрановская база данных систематических обзоров . 3 (3): CD003154. дои : 10.1002/14651858.CD003154.pub6 . ПМК 6425228 . ПМИД 30891742 .
- ^ «Наменда-мемантин гидрохлорид таблетка Наменда-набор мемантин гидрохлорид» . ДейлиМед . 15 ноября 2018 года. Архивировано из оригинала 27 января 2022 года . Проверено 20 февраля 2022 г.
- ^ «Namenda XR-капсулы гидрохлорида мемантина, набор пролонгированного действия Namenda XR-гидрохлорида мемантина» . ДейлиМед . 15 ноября 2019 года. Архивировано из оригинала 21 февраля 2022 года . Проверено 20 февраля 2022 г.
- ^ «Намзарик-мемантин гидрохлорид и донепезил гидрохлорид в капсулах. Намзарик-мемантин гидрохлорид и донепезил гидрохлорид. Набор» . ДейлиМед . 22 января 2019 г. Архивировано из оригинала 20 января 2022 г. Проверено 20 февраля 2022 г.
- ^ Райна П., Сантагуида П., Исмаила А., Паттерсон С., Коуэн Д., Левин М. и др. (март 2008 г.). «Эффективность ингибиторов холинэстеразы и мемантина для лечения деменции: обзор доказательств для руководства по клинической практике». Анналы внутренней медицины . 148 (5): 379–397. дои : 10.7326/0003-4819-148-5-200803040-00009 . ПМИД 18316756 . S2CID 22235353 .
- ^ Jump up to: а б Кандия Н., Онг П.А., Юда Т., Нг ЛЛ, Мамун К., Мерчант Р.А. и др. (февраль 2019 г.). «Лечение деменции и легких когнитивных нарушений с цереброваскулярными заболеваниями или без них: консенсус экспертов по использованию экстракта гинкго двулопастного, EGb 761» . Нейронауки и терапия ЦНС . 25 (2): 288–298. дои : 10.1111/cns.13095 . ПМК 6488894 . PMID 30648358 .
- ^ Маккидж К., Лисенг-Уильямсон К.А. (2018). « Экстракт гинкго двулопастного EGb 761 в симптоматическом лечении легкой и умеренной деменции: профиль его использования» . Лекарства и перспективы терапии . 34 (8): 358–366. дои : 10.1007/s40267-018-0537-8 . ПМК 6267544 . ПМИД 30546253 .
- ^ Ян Г, Ван Ю, Сунь Дж, Чжан К, Лю Дж (22 октября 2015 г.). «Гинкго билоба при легких когнитивных нарушениях и болезни Альцгеймера: систематический обзор и метаанализ рандомизированных контролируемых исследований». Актуальные темы медицинской химии . 16 (5): 520–528. дои : 10.2174/1568026615666150813143520 . ПМИД 26268332 .
- ^ Баллард С., Уэйт Дж (январь 2006 г.). Баллард К.Г. (ред.). «Эффективность атипичных нейролептиков для лечения агрессии и психоза при болезни Альцгеймера». Кокрейновская база данных систематических обзоров (1): CD003476. дои : 10.1002/14651858.CD003476.pub2 . ПМИД 16437455 .
- ^ Баллард С., Ханни М.Л., Теодулу М., Дуглас С., МакШейн Р., Коссаковски К. и др. (февраль 2009 г.). «Исследование отмены антипсихотиков при деменции (DART-AD): долгосрочное наблюдение за рандомизированным плацебо-контролируемым исследованием». «Ланцет». Неврология . 8 (2): 151–157. дои : 10.1016/S1474-4422(08)70295-3 . ПМИД 19138567 . S2CID 23000439 . См . резюме , январь 2009 г.
- ^ Деклерк Т., Петрович М., Азермай М., Вандер Стихеле Р., Де Саттер А.И., ван Дрил М.Л. и др. (март 2013 г.). «Отмена или продолжение хронического приема антипсихотических препаратов при поведенческих и психологических симптомах у пожилых людей с деменцией». Кокрановская база данных систематических обзоров . 3 (3): CD007726. дои : 10.1002/14651858.CD007726.pub2 . hdl : 1854/LU-3109108 . ПМИД 23543555 .
- ^ Jump up to: а б с д и [ нужно обновить ] Рабинс П.В., Блэкер Д., Ровнер Б.В., Румманс Т., Шнайдер Л.С., Тариот П.Н. и др. (Руководящий комитет по практическим рекомендациям) (декабрь 2007 г.). «Практическое руководство Американской психиатрической ассоциации по лечению пациентов с болезнью Альцгеймера и другими деменциями. Второе издание». Американский журнал психиатрии . 164 (12 Приложение): 5–56. ПМИД 18340692 .
- ^ Боттино CM, Карвальо И.А., Альварес AM, Авила Р., Зукаускас П.Р., Бустаманте С.Е. и др. (декабрь 2005 г.). «Когнитивная реабилитация в сочетании с медикаментозным лечением у пациентов с болезнью Альцгеймера: пилотное исследование». Клиническая реабилитация . 19 (8): 861–869. дои : 10.1191/0269215505cr911oa . ПМИД 16323385 . S2CID 21290731 .
- ^ Дуди Р.С. , Стивенс Дж.К., Бек С., Дубинский Р.М., Кэй Дж.А., Гвитер Л. и др. (май 2001 г.). «Практический параметр: ведение деменции (обзор фактических данных). Отчет подкомитета по стандартам качества Американской академии неврологии» . Неврология . 56 (9): 1154–1166. дои : 10.1212/WNL.56.9.1154 . ПМИД 11342679 . S2CID 10711725 .
- ^ Херманс Д.Г., Хтай У.Х., МакШейн Р. (январь 2007 г.). «Нефармакологические вмешательства при блуждании людей с деменцией в домашних условиях» . Кокрановская база данных систематических обзоров . 2010 (1): CD005994. дои : 10.1002/14651858.CD005994.pub2 . ПМК 6669244 . ПМИД 17253573 .
- ^ Робинсон Л., Хатчингс Д., Дикинсон Х.О., Корнер Л., Бейер Ф., Финч Т. и др. (январь 2007 г.). «Эффективность и приемлемость нефармакологических вмешательств для уменьшения блуждания при деменции: систематический обзор». Международный журнал гериатрической психиатрии . 22 (1): 9–22. дои : 10.1002/gps.1643 . ПМИД 17096455 . S2CID 45660235 .
- ^ Абраха И., Римланд Дж.М., Тротта Ф.М., Делл'Акуила Г., Круз-Джентофт А., Петрович М. и др. (март 2017 г.). «Систематический обзор систематических обзоров нефармакологических вмешательств для лечения поведенческих нарушений у пожилых пациентов с деменцией. Серия SENATOR-OnTop» . БМЖ Опен . 7 (3): e012759. doi : 10.1136/bmjopen-2016-012759 . ПМК 5372076 . ПМИД 28302633 .
- ^ Чунг Дж.К., Лай С.К., Чунг П.М., французский HP (2002). «Снузелен при слабоумии» . Кокрановская база данных систематических обзоров . 2010 (4): CD003152. дои : 10.1002/14651858.CD003152 . ПМЦ 9002239 . ПМИД 12519587 .
- ^ Вудс Б., О'Филбин Л., Фаррелл Э.М., Спектор А.Е., Оррелл М. (март 2018 г.). «Терапия воспоминаний при деменции» . Кокрановская база данных систематических обзоров . 2018 (3): CD001120. дои : 10.1002/14651858.CD001120.pub3 . ПМК 6494367 . ПМИД 29493789 .
- ^ Зеттелер Дж. (ноябрь 2008 г.). «Эффективность симулированной терапии присутствия для людей с деменцией: систематический обзор и метаанализ». Старение и психическое здоровье . 12 (6): 779–785. дои : 10.1080/13607860802380631 . ПМИД 19023729 . S2CID 39529938 .
- ^ Спектор А., Торгримсен Л., Вудс Б., Ройан Л., Дэвис С., Баттерворт М. и др. (сентябрь 2003 г.). «Эффективность научно обоснованной программы терапии когнитивной стимуляции для людей с деменцией: рандомизированное контролируемое исследование» . Британский журнал психиатрии . 183 (3): 248–254. дои : 10.1192/bjp.183.3.248 . ПМИД 12948999 .
- ^ Гитлин Л.Н., Коркоран М., Винтер Л., Бойс А., Хаук В.В. (февраль 2001 г.). «Рандомизированное контролируемое исследование вмешательства в домашнюю среду: влияние на эффективность и расстройство лиц, осуществляющих уход, а также на повседневную деятельность людей с деменцией» . Геронтолог . 41 (1): 4–14. дои : 10.1093/геронт/41.1.4 . ПМИД 11220813 .
- ^ Гитлин Л.Н., Хаук В.В., Деннис М.П., Винтер Л. (март 2005 г.). «Поддержание эффективности программы развития навыков домашней среды для лиц, осуществляющих уход за членами семьи, и людей с болезнью Альцгеймера и связанными с ней расстройствами» . Журналы геронтологии. Серия А, Биологические и медицинские науки . 60 (3): 368–374. дои : 10.1093/герона/60.3.368 . ПМИД 15860476 .
- ^ «Лечение поведенческих и психиатрических симптомов» . Ассоциация Альцгеймера. 2006. Архивировано из оригинала 25 сентября 2006 года . Проверено 25 сентября 2006 г.
- ^ Данн Т.Э., Ниаргардер С.А., Чиполлони П.Б., Кронин-Голомб А. (август 2004 г.). «Визуальный контраст увеличивает потребление пищи и жидкости при запущенной стадии болезни Альцгеймера». Клиническое питание . 23 (4): 533–538. дои : 10.1016/j.clnu.2003.09.015 . ПМИД 15297089 .
- ^ Дудек С.Б. (2007). Основы питания для сестринского дела . Хагерстаун, Мэриленд: Липпинкотт Уильямс и Уилкинс. п. 360. ИСБН 978-0-7817-6651-7 . Проверено 19 августа 2008 г.
- ^ Деннехи С. (2006). «Анализ прав пациентов: деменция и введение ПЭГ». Британский журнал медсестер . 15 (1): 18–20. дои : 10.12968/bjon.2006.15.1.20303 . ПМИД 16415742 .
- ^ Чернофф Р. (апрель 2006 г.). «Зондовое кормление пациентов с деменцией». Питание в клинической практике . 21 (2): 142–146. дои : 10.1177/0115426506021002142 . ПМИД 16556924 . S2CID 20841502 .
- ^ Шега Дж.В., Левин А. , Хоэм Г.В., Кокс-Хейли Д., Лучинс Д., Ханрахан П. и др. (апрель 2003 г.). «Совершенство паллиативной помощи в лечении болезни Альцгеймера (PEACE): описание программы». Журнал паллиативной медицины . 6 (2): 315–320. дои : 10.1089/109662103764978641 . ПМИД 12854952 . S2CID 6072807 .
- ^ Jump up to: а б Домингес LJ, Барбагалло М (июнь 2018 г.). «Питательная профилактика снижения когнитивных функций и деменции» . Акта Био-Медика . 89 (2): 276–290. дои : 10.23750/abm.v89i2.7401 . ПМК 6179018 . ПМИД 29957766 .
- ^ Jump up to: а б Занетти О, Солерте СБ, Кантони Ф (2009). «Ожидаемая продолжительность жизни при болезни Альцгеймера (БА)». Архив геронтологии и гериатрии . 49 (Приложение 1): 237–243. дои : 10.1016/j.archger.2009.09.035 . ПМИД 19836639 .
- ^ «Таблица продолжительности жизни в США, 2017 г.» (PDF) . Национальные отчеты по статистике естественного движения населения, CDC . Архивировано (PDF) из оригинала 24 мая 2021 года . Проверено 10 июня 2021 г.
- ^ Jump up to: а б Мёлся П.К., Марттила Р.Дж., Ринне, Великобритания (март 1995 г.). «Долгосрочная выживаемость и предикторы смертности при болезни Альцгеймера и мультиинфарктной деменции». Acta Neurologica Scandinavica . 91 (3): 159–164. дои : 10.1111/j.1600-0404.1995.tb00426.x . ПМИД 7793228 . S2CID 19724937 .
- ^ Боуэн Дж.Д., Мальтер А.Д., Шеппард Л., Кукулл В.А., Маккормик В.К., Тери Л. и др. (август 1996 г.). «Прогностические факторы смертности у пациентов с вероятной болезнью Альцгеймера». Неврология . 47 (2): 433–439. дои : 10.1212/wnl.47.2.433 . ПМИД 8757016 . S2CID 24961809 .
- ^ Ларсон Э.Б., Шадлен М.Ф., Ван Л., Маккормик В.К., Боуэн Дж.Д., Тери Л. и др. (апрель 2004 г.). «Выживаемость после первоначального диагноза болезни Альцгеймера». Анналы внутренней медицины . 140 (7): 501–509. дои : 10.7326/0003-4819-140-7-200404060-00008 . ПМИД 15068977 . S2CID 27410149 .
- ^ Джаггер С., Кларк М., Стоун А. (январь 1995 г.). «Предсказатели выживаемости при болезни Альцгеймера: исследование на уровне сообщества». Психологическая медицина . 25 (1): 171–177. дои : 10.1017/S0033291700028191 . ПМИД 7792352 . S2CID 34066330 .
- ^ Додж Х.Х., Шен С., Пандав Р., ДеКоски С.Т., Гангули М. (февраль 2003 г.). «Функциональные переходы и продолжительность активной жизни, связанные с болезнью Альцгеймера» . Архив неврологии . 60 (2): 253–259. дои : 10.1001/archneur.60.2.253 . ПМИД 12580712 .
- ^ Гангули М., Додж Х.Х., Шен С., Пандав Р.С., ДеКоски С.Т. (май 2005 г.). «Болезнь Альцгеймера и смертность: 15-летнее эпидемиологическое исследование» . Архив неврологии . 62 (5): 779–784. дои : 10.1001/archneur.62.5.779 . ПМИД 15883266 .
- ^ Ланни С., Маси М., Ракки М., Говони С. (январь 2021 г.). «Рак и болезнь Альцгеймера обратная связь: возрастное расхождение общих путей». Молекулярная психиатрия . 26 (1): 280–295. дои : 10.1038/s41380-020-0760-2 . ПМИД 32382138 .
- ^ Jump up to: а б Бермехо-Пареха Ф, Бенито-Леон Х, Вега С, Медрано МЮ, Роман ГЦ (январь 2008 г.). «Заболеваемость и подтипы деменции у трех пожилых людей в центральной Испании». Журнал неврологических наук . 264 (1–2): 63–72. дои : 10.1016/j.jns.2007.07.021 . ПМИД 17727890 . S2CID 34341344 .
- ^ Jump up to: а б Ди Карло А., Балдерески М., Амадуччи Л., Лепор В., Бракко Л., Магги С. и др. (январь 2002 г.). «Заболеваемость деменцией, болезнью Альцгеймера и сосудистой деменцией в Италии. Исследование ILSA». Журнал Американского гериатрического общества . 50 (1): 41–48. дои : 10.1046/j.1532-5415.2002.50006.x . ПМИД 12028245 . S2CID 22576935 .
- ^ Техада-Вера Б. (2013). Смертность от болезни Альцгеймера в Соединенных Штатах: данные за 2000 и 2010 годы. Хаяттсвилл, Мэриленд: Министерство здравоохранения и социальных служб США , Центры по контролю и профилактике заболеваний , Национальный центр статистики здравоохранения .
- ^ Рейтц С., Рогаева Е., Бичем Г.В. (октябрь 2020 г.). «Болезнь Альцгеймера с поздним началом и неменделевская болезнь Альцгеймера с ранним началом: различие без разницы?» . Неврология. Генетика . 6 (5): е512. дои : 10.1212/NXG.0000000000000512 . ПМЦ 7673282 . ПМИД 33225065 .
- ^ Jump up to: а б Лю CC, Лю CC, Канекиё Т, Сюй Х, Бу Г (февраль 2013 г.). «Аполипопротеин Е и болезнь Альцгеймера: риск, механизмы и терапия» . Обзоры природы. Неврология . 9 (2): 106–118. дои : 10.1038/nrneurol.2012.263 . ПМЦ 3726719 . ПМИД 23296339 .
- ^ Массетт Х.А., Митчелл А.К., Элли Л., Симоно Э., Берк П., Хан Ш.Х. и др. (29 июня 2021 г.). «Содействующие факторы, проблемы и стратегии обмена сообщениями для латиноамериканского / латиноамериканского населения, участвующего в клинических исследованиях болезни Альцгеймера и связанной с ней деменции: обзор литературы». Журнал болезни Альцгеймера . 82 (1): 107–127. дои : 10.3233/JAD-201463 . ПМИД 33998537 . S2CID 234745473 .
- ^ Хюинь Р.А., Мохан С. (2017). «Болезнь Альцгеймера: биомаркеры в геноме, крови и спинномозговой жидкости» . Границы в неврологии . 8 : 102. doi : 10.3389/fneur.2017.00102 . ПМК 5357660 . ПМИД 28373857 .
- ^ Раджан К.Б., Вёв Дж., Барнс Л.Л., Макэнинч Э.А., Уилсон Р.С., Эванс Д.А. (май 2021 г.). «Популяционная оценка людей с клинической болезнью Альцгеймера и легкими когнитивными нарушениями в США (2020–2060 гг.)» . Болезнь Альцгеймера и деменция . 17 (12): 1966–1975. дои : 10.1002/alz.12362 . ПМК 9013315 . ПМИД 34043283 . S2CID 235215290 .
- ^ Рицци Л., Россет И., Рорис-Круз М. (2014). «Глобальная эпидемиология деменции: болезнь Альцгеймера и сосудистые типы» . Биомед Рес Инт . 2014 : 908915. doi : 10.1155/2014/908915 . ПМК 4095986 . ПМИД 25089278 .
- ^ Ферри С.П., Принс М., Брейн С., Бродати Х., Фратильони Л., Гангули М. и др. (декабрь 2005 г.). «Глобальная распространенность деменции: консенсусное исследование Delphi» . Ланцет . 366 (9503): 2112–2117. дои : 10.1016/S0140-6736(05)67889-0 . ПМК 2850264 . ПМИД 16360788 .
- ^ Ли Ф, Цинь В, Чжу М, Цзя Дж (1 января 2021 г.). «Модельный прогноз распространенности деменции в Китае и во всем мире: 2020-2050 гг.». Журнал болезни Альцгеймера . 82 (4). IOS Press: 1823–1831. дои : 10.3233/JAD-210493 . ПМИД 34219732 . S2CID 235735045 .
- ^ Огюст Д.:
- Альцгеймер А (1907). «О своеобразном заболевании коры головного мозга». Общий журнал психиатрии и психиатро-судебной медицины (на немецком языке). 64 (1–2): 146–148.
- «О своеобразном заболевании коры головного мозга. Алоис Альцгеймер, 1907 г. (Перевод Л. Ярвика и Х. Гринсона)». Болезнь Альцгеймера и связанные с ней расстройства . 1 (1). Перевод Х. Гринсона: 3–8. 1987. ПМИД 3331112 .
- Маурер У, Маурер К (2003). Альцгеймер: жизнь врача и карьера болезни . Нью-Йорк: Издательство Колумбийского университета. п. 270 . ISBN 978-0-231-11896-5 .
- ^ Берриос Г.Е. (1990). «Болезнь Альцгеймера: концептуальная история». Межд. Дж. Гериатр. Психиатрия . 5 (6): 355–365. дои : 10.1002/gps.930050603 . S2CID 145155424 .
- ^ Крепелин Э (2007). Клиническая психиатрия: Учебник для студентов и врачей (переиздание) . Перевод Дифендорфа А.Р. Издательство Кессинджер. п. 568. ИСБН 978-1-4325-0833-3 .
- ^ Кацман Р., Терри Р.Д., Бик К.Л., ред. (1978). Болезнь Альцгеймера: старческое слабоумие и связанные с ним расстройства . Нью-Йорк: Рэйвен Пресс. п. 595. ИСБН 978-0-89004-225-0 .
- ^ Боллер Ф., Forbes MM (июнь 1998 г.). «История деменции и деменции в истории: обзор». Журнал неврологических наук . 158 (2): 125–133. дои : 10.1016/S0022-510X(98)00128-2 . ПМИД 9702682 . S2CID 42399340 .
- ^ Амадуччи Л.А., Рокка В.А., Шенберг Б.С. (ноябрь 1986 г.). «Происхождение различия между болезнью Альцгеймера и старческим слабоумием: как история может уточнить нозологию». Неврология . 36 (11): 1497–1499. дои : 10.1212/wnl.36.11.1497 . ПМИД 3531918 . S2CID 7689479 .
- ^ МакХанн Г., Драхман Д., Фольштейн М., Кацман Р., Прайс Д., Стадлан Э.М. (июль 1984 г.). «Клинический диагноз болезни Альцгеймера: отчет рабочей группы NINCDS-ADRDA под эгидой Целевой группы Министерства здравоохранения и социальных служб по болезни Альцгеймера» . Неврология . 34 (7): 939–944. дои : 10.1212/wnl.34.7.939 . ПМИД 6610841 . S2CID 11646075 .
- ^ Дюбуа Б., Фельдман Х.Х., Якова С., Декоски С.Т., Барбергер-Гато П., Каммингс Дж. и др. (август 2007 г.). «Критерии исследования для диагностики болезни Альцгеймера: пересмотр критериев NINCDS-ADRDA». «Ланцет». Неврология . 6 (8): 734–746. дои : 10.1016/S1474-4422(07)70178-3 . ПМИД 17616482 . S2CID 7356809 .
- ^ Блэкер Д., Альберт М.С., Бассетт С.С., Го Р.К., Харрелл Л.Е., Фольштейн М.Ф. (декабрь 1994 г.). «Надежность и достоверность критериев NINCDS-ADRDA для болезни Альцгеймера. Инициатива Национального института генетики психического здоровья». Архив неврологии . 51 (12): 1198–1204. дои : 10.1001/archneur.1994.00540240042014 . ПМИД 7986174 .
- ^ Jump up to: а б с д Эль-Хайек Ю.Х., Уайли Р.Э., Хури С.П., Дайя Р.П., Баллард С., Эванс А.Р. и др. (2019). «Вершина айсберга: оценка глобальных социально-экономических издержек болезни Альцгеймера и связанных с ней деменций и стратегических последствий для заинтересованных сторон» . Журнал болезни Альцгеймера . 70 (2): 323–341. дои : 10.3233/JAD-190426 . ПМК 6700654 . ПМИД 31256142 .
- ^ Jump up to: а б с Вонг В. (август 2020 г.). «Экономическое бремя болезни Альцгеймера и вопросы управляемого ухода» . Am J Manag Care . 26 (8 дополнений): S177–S183. дои : 10.37765/ajmc.2020.88482 . ПМИД 32840331 . S2CID 221308149 . Архивировано из оригинала 25 февраля 2022 года . Проверено 17 марта 2022 г.
- ^ Jump up to: а б Тахами Монфаред А.А., Бирнс М.Дж., Уайт Л.А., Чжан Ц (февраль 2022 г.). «Гуманистическое и экономическое бремя болезни Альцгеймера» . Нейрол Тер . 11 (2): 525–551. дои : 10.1007/s40120-022-00335-x . ПМК 9095804 . ПМИД 35192176 . S2CID 247014076 .
- ^ Jump up to: а б Косанер Клисс М., Мартинс Р., Коннолли член парламента (2021 г.). «Основные факторы затрат при оценке экономического бремени болезни Альцгеймера: структурированный, быстрый обзор» . J Предыдущая болезнь Альцгеймера Dis . 8 (3): 362–370. дои : 10.14283/jpad.2021.17 . ПМИД 34101795 . S2CID 233403683 .
- ^ Демирбас М., Хан-Педерсен Дж.Х., Йоргенсен Х.Л. (август 2023 г.). «Сравнение нагрузки на партнеров по уходу за людьми с болезнью Альцгеймера и людьми с другими хроническими заболеваниями» . Неврология и терапия . 12 (4): 1051–1068. дои : 10.1007/s40120-023-00493-6 . ПМЦ 10310688 . ПМИД 37222859 .
- ^ Jump up to: а б «Исследование болезни Альцгеймера, проведенное MetLife: опыт ухода» (PDF) . Институт зрелого рынка MetLife. Август 2006 г. Архивировано из оригинала (PDF) 8 января 2011 г. . Проверено 5 февраля 2011 г.
- ^ Шнайдер Дж., Мюррей Дж., Банерджи С., Манн А. (август 1999 г.). «EUROCARE: межнациональное исследование совместно проживающих супругов, осуществляющих уход за людьми с болезнью Альцгеймера: I — Факторы, связанные с бременем ухода» . Международный журнал гериатрической психиатрии . 14 (8): 651–661. doi : 10.1002/(SICI)1099-1166(199908)14:8<651::AID-GPS992>3.0.CO;2-B . ПМИД 10489656 . S2CID 27346798 .
- ^ Мюррей Дж., Шнайдер Дж., Банерджи С., Манн А. (август 1999 г.). «EUROCARE: межнациональное исследование совместно проживающих супругов, осуществляющих уход за людьми с болезнью Альцгеймера: II — качественный анализ опыта ухода». Международный журнал гериатрической психиатрии . 14 (8): 662–667. doi : 10.1002/(SICI)1099-1166(199908)14:8<662::AID-GPS993>3.0.CO;2-4 . ПМИД 10489657 . S2CID 41741923 .
- ^ Jump up to: а б Чжу CW, Сано М (2006). «Экономические соображения при лечении болезни Альцгеймера» . Клинические вмешательства в старение . 1 (2): 143–154. дои : 10.2147/ciia.2006.1.2.143 . ПМК 2695165 . ПМИД 18044111 .
- ^ Гоглер Дж. Э., Кейн Р.Л., Кейн Р.А., Ньюкомер Р. (апрель 2005 г.). «Раннее использование услуг по месту жительства и его влияние на институционализацию ухода за деменцией» . Геронтолог . 45 (2): 177–185. дои : 10.1093/геронт/45.2.177 . ПМИД 15799982 .
- ^ Ричи К., Лавстон С. (ноябрь 2002 г.). «Слабоумие». Ланцет . 360 (9347): 1759–1766. дои : 10.1016/S0140-6736(02)11667-9 . ПМИД 12480441 . S2CID 21404062 .
- ^ Бродати Х., Хаджи-Павлович Д. (сентябрь 1990 г.). «Психосоциальное воздействие на лиц, осуществляющих уход за людьми, страдающими деменцией». Австралийский и новозеландский журнал психиатрии . 24 (3): 351–361. дои : 10.3109/00048679009077702 . ПМИД 2241719 . S2CID 11788466 .
- ^ Дональдсон С., Тарриер Н., Бернс А. (апрель 1998 г.). «Детерминанты стресса лица, осуществляющего уход, при болезни Альцгеймера». Международный журнал гериатрической психиатрии . 13 (4): 248–256. doi : 10.1002/(SICI)1099-1166(199804)13:4<248::AID-GPS770>3.0.CO;2-0 . ПМИД 9646153 . S2CID 22187694 .
- ^ Мур MJ, Чжу CW, Clipp EC (июль 2001 г.). «Неофициальные затраты на лечение деменции: оценки Национального продольного исследования лиц, осуществляющих уход» . Журналы геронтологии. Серия B, Психологические науки и социальные науки . 56 (4): С219–С228. дои : 10.1093/geronb/56.4.S219 . ПМИД 11445614 .
- ^ Пьюзи Х., Ричардс Д. (май 2001 г.). «Систематический обзор эффективности психосоциальных вмешательств для лиц, осуществляющих уход за людьми с деменцией». Старение и психическое здоровье . 5 (2): 107–119. дои : 10.1080/13607860120038302 . ПМИД 11511058 . S2CID 32517015 .
- ^ Бэйли Дж (2000). Айрис: Мемуары Айрис Мердок . Лондон: Абакус. ISBN 978-0-349-11215-2 . OCLC 41960006 .
- ^ Спаркс Н (1996). Блокнот . Торндайк, Мэн: Thorndike Press. п. 268 . ISBN 978-0-7862-0821-0 .
- ^ «Танматра» . Вебиндия123.com. Архивировано из оригинала 6 ноября 2007 года . Проверено 24 января 2008 г.
- ^ Огивара Х (2004) Ашита-но Киоку (на японском языке: Кобунша) . 978-4-334-92446-1 . OCLC 57352130 .
- ^ Манро А. (2001). Ненависть, Дружба, Ухаживание, Любовь, Брак: Рассказы . Нью-Йорк: А.А. Кнопф. ISBN 978-0-375-41300-1 . OCLC 46929223 .
- ^ «Малкольм и Барбара: История любви» . Dfgdocs. Архивировано из оригинала 24 мая 2008 года . Проверено 24 января 2008 г.
- ^ «Малкольм и Барбара: История любви» . BBC Кембриджшир. Архивировано из оригинала 10 ноября 2012 года . Проверено 2 марта 2008 г.
- ^ Планкетт Дж. (7 августа 2007 г.). «Кинорежиссер, страдающий болезнью Альцгеймера, встретится с юристами ITV» . Лондон: Гардиан Медиа. Архивировано из оригинала 15 января 2008 года . Проверено 24 января 2008 г.
- ^ «Смотритель: Постоянное повторение фраз » . Факт . 26 августа 2009 г. Архивировано из оригинала 15 апреля 2021 г. Проверено 9 апреля 2021 г.
- ^ Пауэлл М. (14 июня 2011 г.). «Смотритель: Обзор альбома Empty Bliss Beyond This World » . Вилы . Архивировано из оригинала 18 июня 2011 года . Проверено 19 февраля 2021 г.
- ^ Эзра М. (23 октября 2020 г.). «Почему подростки TikTok слушают альбом о слабоумии?» . Нью-Йорк Таймс . Архивировано из оригинала 23 октября 2020 года . Проверено 21 апреля 2021 г.
- ^ Джеррард Н. (19 июля 2015 г.). «Нам не хватает слов: слабоумие и искусство» . Хранитель . Архивировано из оригинала 19 июля 2015 года . Проверено 14 июня 2021 г.
- ^ Грейди Д. (24 октября 2006 г.). «Хроника автопортретов о спуске к болезни Альцгеймера» . Нью-Йорк Таймс . Архивировано из оригинала 24 октября 2006 года . Проверено 14 июня 2021 г.
- ^ Ши М, Чу Ф, Чжу Ф, Чжу Дж (2022). «Влияние моноклональных антител против амилоида-β на патологию и клинический профиль болезни Альцгеймера: внимание к адуканумабу и леканемабу» . Границы стареющей неврологии . 14 : 870517. дои : 10.3389/fnagi.2022.870517 . ПМЦ 9039457 . ПМИД 35493943 .
- ^ Каммингс Дж., Чжоу Ю., Ли Дж., Чжун К., Фонсека Дж., Ченг Ф. (2023). «План разработки лекарств от болезни Альцгеймера: 2023 год» . Болезнь Альцгеймера и деменция . 9 (2): e12385. дои : 10.1002/trc2.12385 . ПМЦ 10210334 . ПМИД 37251912 .
- ^ «Как лечат болезнь Альцгеймера?» . США Национальный институт старения . 1 апреля 2023 г. Проверено 10 июля 2023 г.
- ^ Ваз М, Сильва В, Монтейро С, Сильвестр С (2022). «Роль адуканумаба в лечении болезни Альцгеймера: проблемы и возможности» . Клинические вмешательства в старение . 17 : 797–810. дои : 10.2147/CIA.S325026 . ПМЦ 9124475 . ПМИД 35611326 .
- ^ Дэй Г.С., Скармиас Н., Дубинский Р., Курвер К., Мостасеро А., Уэст Б. и др. (апрель 2022 г.). «Использование адуканумаба при симптоматических доказательствах болезни Альцгеймера в центре внимания: отчет подкомитета по рекомендациям AAN» . Неврология . 98 (15): 619–631. дои : 10.1212/wnl.0000000000200176 . ПМЦ 9012273 . ПМИД 35197360 .
- ^ Махасе Э (июнь 2021 г.). «Три члена консультативной комиссии FDA подали в отставку из-за одобрения препарата от болезни Альцгеймера» . БМЖ . 373 : n1503. дои : 10.1136/bmj.n1503 . ПМИД 34117086 . S2CID 235405355 . Архивировано из оригинала 8 июля 2023 года . Проверено 7 июля 2023 г.
- ^ Беллак П., Роббинс Р. (10 июня 2021 г.). «Три советника FDA ушли в отставку из-за одобрения агентством препарата от болезни Альцгеймера» . Нью-Йорк Таймс . Архивировано из оригинала 14 ноября 2021 года . Проверено 7 июля 2023 г.
- ^ Абьяде М., Гупта В., Гупта В., Читранши Н., Ву Й., Амирхани А. и др. (декабрь 2021 г.). «Сравнительный анализ адуканумаба, заготенемаба и пиоглитазона как стратегий таргетного лечения болезни Альцгеймера» . Старение и болезни . 12 (8): 1964–1976. дои : 10.14336/AD.2021.0719 . ПМЦ 8612603 . ПМИД 34881080 .
- ^ Марсул, доктор медицинских наук, Праджвал П., Редди Ю.Б., Марсул А.Д., Лам Дж.Р., Нандвана В. (май 2023 г.). «Новые методы лечения деменции Альцгеймера, а также роль адуканумаба и леканемаба в лечении ее рефрактерных случаев». Болезнь в месяц . 69 (5): 101547. doi : 10.1016/j.disamonth.2023.101547 . ПМИД 36931947 . S2CID 257568052 .
- ^ «FDA предоставляет ускоренное одобрение лечения болезни Альцгеймера» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 6 января 2023 года. Архивировано из оригинала 7 января 2023 года . Проверено 7 января 2023 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Краткий обзор леканемаба» (PDF) . США Управление по контролю за продуктами и лекарствами (FDA). Архивировано (PDF) из оригинала 7 января 2023 года . Проверено 7 января 2023 г.
- ^ «FDA превращает новое лечение болезни Альцгеймера в традиционное одобрение» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 6 июля 2023 г. Проверено 6 июля 2023 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «FDA делает лекарство от болезни Альцгеймера Лекемби широко доступным» . Нью-Йорк Таймс . 6 июля 2023 года. Архивировано из оригинала 7 июля 2023 года . Проверено 8 июля 2023 г.
- ^ «FDA одобрило лечение взрослых с болезнью Альцгеймера» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 2 июля 2024 года. Архивировано из оригинала 2 июля 2024 года . Проверено 2 июля 2024 г.
- ^ Алвес Ф., Калиновски П., Эйтон С. (май 2023 г.). «Ускоренная потеря объема мозга, вызванная анти-β-амилоидными препаратами: систематический обзор и метаанализ» . Неврология . 100 (20): е2114–е2124. дои : 10.1212/WNL.0000000000207156 . ПМЦ 10186239 . ПМИД 36973044 .
- ^ Jump up to: а б Макдейд Э., Ллибре-Герра Дж. Дж., Хольцман Д. М., Моррис Дж. К., Бэйтман Р. Дж. (июль 2021 г.). «Информированная дорожная карта по профилактике болезни Альцгеймера: призыв к оружию» . Мол Нейродегенер . 16 (1): 49. дои : 10.1186/s13024-021-00467-y . ПМЦ 8293489 . ПМИД 34289882 .
- ^ Лемче Э (ноябрь 2018 г.). «Стресс в раннем возрасте и эпигенетика при позднем слабоумии при болезни Альцгеймера: систематический обзор» . Карр Геномика . 19 (7): 522–602. дои : 10.2174/1389202919666171229145156 . ПМК 6194433 . ПМИД 30386171 .
- ^ Галле С.А., Гераедц И.К., Дейен Дж.Б., Милдерс М.В., Дрент М.Л. (2020). «Взаимосвязь между инсулиноподобным фактором роста 1, аполипопротеином E ε4, факторами образа жизни и старением тела и мозга» . J Предыдущая болезнь Альцгеймера Dis . 7 (4): 265–273. дои : 10.14283/jpad.2020.11 . ПМИД 32920629 . S2CID 214784366 .
- ^ Ли Q, Ян X, Сюй J, Го Y, Хэ X, Ху Х и др. (февраль 2023 г.). «Раннее прогнозирование болезни Альцгеймера и связанных с ней деменций с использованием реальных электронных медицинских записей» . Болезнь Альцгеймера и деменция . 19 (8): 3506–3518. дои : 10.1002/alz.12967 . ПМЦ 10976442 . ПМИД 36815661 . S2CID 257101613 .
Дальнейшее чтение
- Ван Акер З.П., Пердок А., Брету М., Аннаерт В. (ноябрь 2021 г.). «Микроглиальная лизосомальная система при болезни Альцгеймера: защита от протеинопатии» . Обзоры исследований старения . 71 : 101444. doi : 10.1016/j.arr.2021.101444 . ПМИД 34391945 . S2CID 236994329 .
- Си Ю, Чен Ю, Цзинь Ю, Хан Г, Сун М, Сонг Т и др. (май 2022 г.). «Универсальные наноматериалы для лечения болезни Альцгеймера: терапия, модифицирующая заболевание, вдохновленная патогенезом». Журнал контролируемого выпуска . 345 : 38–61. дои : 10.1016/j.jconrel.2022.02.034 . ПМИД 35257810 . S2CID 247285338 .
Внешние ссылки
- «Хронология исследований болезни Альцгеймера - Alzforum» . www.alzforum.org .
- «Атлас клеток головного мозга при болезни Альцгеймера-brain-map.org» . портал.brain-map.org .



