Круговая хромосома
— Круговая хромосома хромосома у бактерий , архей , митохондрий и хлоропластов , имеющая форму молекулы кольцевой ДНК, в отличие от линейной хромосомы большинства эукариот .
Большинство хромосом прокариот содержат кольцевую молекулу ДНК. Это имеет главное преимущество, заключающееся в отсутствии свободных концов ( теломеров ) ДНК . Напротив, большинство эукариот имеют линейную ДНК, требующую сложных механизмов для поддержания стабильности теломер и репликации ДНК . Однако кольцевая хромосома имеет тот недостаток, что после репликации две кольцевые хромосомы потомства могут оставаться связанными или запутанными, и их необходимо высвободить, чтобы каждая клетка унаследовала одну полную копию хромосомы во время клеточного деления .
Репликация
[ редактировать ]
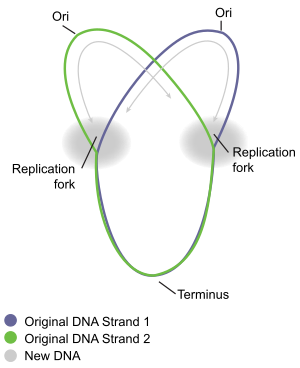
Циклическая репликация хромосом бактерий лучше всего понятна у хорошо изученных бактерий Escherichia coli и Bacillus subtilis . Репликация хромосом протекает в три основные стадии: инициация, элонгация и терминация. Стадия инициации начинается с упорядоченной сборки белков-«инициаторов» в исходной области хромосомы, называемой oriC . Эти этапы сборки регулируются таким образом, чтобы репликация хромосом происходила только один раз в каждом клеточном цикле. Во время фазы элонгации репликации ферменты , которые были собраны в oriC во время инициации, действуют вдоль каждого плеча ( реплихора ) хромосомы в противоположных направлениях от oriC, реплицируя ДНК для создания двух идентичных копий. Этот процесс известен как двунаправленная репликация. Вся совокупность молекул, участвующих в репликации ДНК на каждом плече, называется реплисомой . В передней части реплисомы находится ДНК-хеликаза , которая раскручивает две цепи ДНК, создавая движущуюся репликационную вилку . Две раскрученные одиночные цепи ДНК служат матрицами для ДНК-полимераза , которая движется вместе с хеликазой (вместе с другими белками) для синтеза комплементарной копии каждой цепи. Таким образом создаются две идентичные копии исходной ДНК. В конце концов, две репликационные вилки, движущиеся вокруг кольцевой хромосомы, встречаются в определенной зоне хромосомы, примерно противоположной oriC, называемой терминальной областью. Затем ферменты элонгации разбираются, и две «дочерние» хромосомы разделяются до завершения деления клетки.
Инициация
[ редактировать ]
Источник E. coli репликации , называемый oriC, состоит из последовательностей ДНК , которые распознаются белком DnaA , который высоко консервативен среди различных видов бактерий . Связывание ДНК с источником инициирует регулируемый рекрутинг других ферментов и белков , что в конечном итоге приведет к созданию двух полных реплисом для двунаправленной репликации. [1]
Элементы последовательности ДНК внутри oriC , которые важны для его функции, включают DnaA-боксы, 9-мерный повтор с высококонсервативной консенсусной последовательностью 5' – TTATCCACA – 3', [2] которые распознаются белком ДНКА. Белок DnaA играет решающую роль в инициации репликации хромосомной ДНК. [3] Связавшись с АТФ, и с помощью бактериальных гистон -подобных белков [HU] ДНКА затем раскручивает богатую АТ область вблизи левой границы oriC , которая несет три 13-мерных мотива: [4] и открывает двухцепочечную ДНК для входа других белков репликации. [5]
Эта область также содержит четыре последовательности элементов раскручивания ДНК «GATC» , которые распознаются ДНК-аденин-метилазой (Dam), ферментом, который модифицирует адениновое основание, когда эта последовательность неметилирована или гемиметилирована. Метилирование важно , аденинов . поскольку оно изменяет конформацию ДНК, способствуя разделению цепей [6] и кажется, что эта область ori C имеет естественную тенденцию к раскручиванию. [7]
Затем DnaA рекрутирует репликативную хеликазу DnaB . из комплекса DnaB-DnaC в развернутую область, чтобы сформировать комплекс предварительного прайминга [8] После того, как DnaB перемещается к вершине каждой репликационной вилки, геликаза одновременно раскручивает родительскую ДНК и на мгновение взаимодействует с примазой . [9]
Для продолжения репликации ДНК необходимы одноцепочечные связывающие белки, которые предотвращают образование вторичных структур одиночными цепями ДНК и предотвращают их повторное отжиг . Кроме того, ДНК-гираза необходима для снятия топологического напряжения, создаваемого действием DnaB-хеликазы.
Удлинение
[ редактировать ]Когда репликационная вилка движется по кругу, структура, имеющая форму греческой буквы тета образуется Ө. Джон Кэрнс продемонстрировал тета-структуру хромосомной репликации E. coli в 1963 году, используя инновационный метод визуализации репликации ДНК. В своем эксперименте он радиоактивно пометил хромосому, выращивая свои культуры в среде, содержащей 3H- тимидин . Нуклеозидное основание было равномерно включено в бактериальную хромосому. Затем он выделил хромосомы путем осторожного лизирования клеток и поместил их на сетку электронной микрофотографии (ЭМ), которую подвергал воздействию рентгеновской пленки в течение двух месяцев. Этот эксперимент ясно демонстрирует модель тета-репликации кольцевых бактериальных хромосом. [10]
- См. Ауторентгенограмму интактной реплицирующейся хромосомы E.coli [1].
Как описано выше, репликация хромосом бактерий происходит двунаправленным образом. Впервые это было продемонстрировано путем специфического мечения реплицирующихся бактериальных хромосом радиоактивными изотопами . Затем участки ДНК, подвергавшиеся репликации во время эксперимента, были визуализированы с помощью авторадиографии и микроскопического исследования проявленной пленки. Это позволило исследователям увидеть, где происходит репликация. Первые убедительные наблюдения двунаправленной репликации были сделаны в ходе исследований B. subtilis. [11] Вскоре после этого было также показано, что хромосома E. coli реплицируется в двух направлениях. [12]
- См. рисунок 4 DM Prescott и PL Kuempel (1972): След зерна, полученный хромосомой E. coli из клеток, меченных в течение 19 минут [3H] тимином, с последующим мечением в течение 2,5 минут [3H]тимином и [' Н]тимидин. [2] .
E. coli Голофермент ДНК-полимеразы III представляет собой комплекс массой 900 кДа, имеющий по существу димерную структуру. Каждая мономерная единица имеет каталитическое ядро, субъединицу димеризации и процессивный компонент. [13] ДНК Pol III использует один набор своих основных субъединиц для непрерывного синтеза ведущей цепи , в то время как другой набор основных субъединиц циклически перемещается от одного фрагмента Оказаки к следующему на петлевой отстающей цепи . Синтез ведущей цепи начинается с синтеза короткого праймера РНК в месте начала репликации ферментом примазой ( белок DnaG ).
дезоксинуклеотиды Затем к этому праймеру добавляются с помощью одного димера ДНК-полимеразы III в интегрированном комплексе с DnaB-хеликазой. Затем синтез ведущей цепи происходит непрерывно, в то время как ДНК одновременно раскручивается на репликационной вилке. Напротив, синтез отстающей цепи осуществляется в виде коротких фрагментов Оказаки. Сначала праймер РНК синтезируется примазой, и, как и при синтезе ведущей цепи, ДНК Pol III связывается с праймером РНК и добавляет дезоксирибонуклеотиды .
Когда синтез фрагмента Оказаки завершен, репликация останавливается, и основные субъединицы ДНК Pol III отделяются от скользящего зажима β [скользящий зажим B является субъединицей процессивности ДНК Pol III]. [14] Праймер РНК удаляется и заменяется ДНК с помощью ДНК-полимеразы I (которая также обладает корректирующей экзонуклеазной активностью), а оставшийся разрыв запечатывается ДНК-лигазой , которая затем связывает эти фрагменты с образованием отстающей цепи.
Значительная часть (10-15%) репликационных вилок, происходящих из oriC, сталкивается с повреждением ДНК или разрывом цепи при выращивании клеток в нормальных лабораторных условиях (без обработки, повреждающей экзогенную ДНК). [15] Встречающиеся повреждения ДНК обычно обрабатываются ферментами рекомбинационной репарации, чтобы обеспечить дальнейшее развитие репликационной вилки. [15]
Прекращение действия
[ редактировать ]
Терминация — это процесс слияния репликационных вилок и разборки реплисом с образованием двух отдельных и полных молекул ДНК . Это происходит в терминальной области, примерно напротив oriC хромосомы (рис. 5). Концевая область содержит несколько сайтов терминатора репликации ДНК, или сайтов «Ter». Специальный белок «терминатор репликации» должен быть связан с сайтом Ter, чтобы он мог приостановить репликацию. Каждый сайт Ter имеет полярность действия, то есть он останавливает репликационную вилку, приближающуюся к сайту Ter с одного направления, но разрешает беспрепятственное движение вилки через сайт Ter с другого направления. Расположение участков Тер образует две противоположные группы, которые вынуждают два развилка встречаться друг с другом в пределах региона, который они охватывают. Такое устройство называется «ловушкой репликационной вилки». [16]
- См. расположение и последовательность концов репликации E. coli. (A) Карта, показывающая места Ори и 10 Тер. (B) Консенсусная последовательность Ter. [3]
Сайты Ter специфически взаимодействуют с белком-терминатором репликации, называемым Tus, в E. coli . [17] Комплекс Tus-Ter препятствует активности DnaB по раскручиванию ДНК зависимым от ориентации образом. [18]
- Кристаллическая структура белкового комплекса Ter DNA-Tus (A), демонстрирующая неблокирующуюся и блокирующую вилку грани Tus. (B) Поперечное сечение задерживающей геликазу поверхности. [4]
Репликация ДНК, разделяющая противоположные репликационные вилки, приводит к тому, что завершенные хромосомы соединяются в виде « катенанов » или топологически связанных кругов. Круги связаны не ковалентно, а механически, потому что они переплетены и каждый ковалентно замкнут. Цепные круги требуют действия топоизомераз для разделения кругов (декатенация). В E. coli ДНК-топоизомераза IV играет основную роль в разделении цепочек хромосом, временно разрывая обе цепи ДНК одной хромосомы и позволяя другой хромосоме пройти через разрыв.
Существует некоторая путаница относительно роли ДНК-гиразы в декатенации. Чтобы определить номенклатуру, существует два типа топоизомераз: тип I вызывает временные одноцепочечные разрывы в ДНК, а тип II производит временные двухцепочечные разрывы. В результате фермент типа I удаляет суперспирали из ДНК по одной, тогда как фермент типа II удаляет суперспирали по две. Топо I как прокариот , так и эукариот представляет собой топоизомеразу I типа. Эукариотический топо II, бактериальная гираза и бактериальный топо IV относятся к типу II.
ДНК-гираза также обладает активностью топоизомеразы II типа; таким образом, поскольку он является гомологом топоизомеразы IV (также обладающим активностью топоизомеразы II), мы ожидаем сходства функций двух белков. Первоначальная роль ДНК-гиразы заключается во введении в ДНК отрицательных суперспиралей, тем самым расслабляя положительные суперспирали, образующиеся во время репликации ДНК. Топоизомераза IV также расслабляет положительные суперспирали, поэтому ДНК-гираза и топоизомераза IV играют почти идентичную роль в удалении положительных суперспиралей перед транслоцирующей ДНК-полимеразой, позволяя репликации ДНК продолжаться без препятствий со стороны топологического напряжения. [19]
ДНК-гираза — не единственный фермент, ответственный за декатенацию. В эксперименте Зехидриха , Ходурского и Коццарелли в 1997 году было обнаружено, что топоизомераза IV является единственной важной декатеназой промежуточных продуктов репликации ДНК у бактерий. [20] Когда ингибировалась только ДНК-гираза, большая часть катенанов не связывалась. Однако когда ингибировалась только топоизомераза IV, декатенация почти полностью блокировалась. Это предполагает, что топоизомераза IV является основным белком для декатенации связанных хромосом in vivo , при этом ДНК-гираза играет второстепенную роль.
Множественные кольцевые хромосомы
[ редактировать ]Несколько групп бактерий, включая бруцеллы , Paracoccus denitrificans и вибрионы , имеют множественные кольцевые хромосомы.
- Многие альфапротеобактерии имеют две кольцевые молекулы. В некоторых случаях, например, у Brucella melitensis , оба кажутся хромосомоподобными с oriC -типа. началом репликации [21] В других случаях, таких как близкородственный Ochrobactrum , меньшая хромосома реплицируется как плазмида и явно является хромидой . [22]
- Paracoccus denitrificans имеет две кольцевые хромосомы и одну большую плазмиду. [23] несущий гены, не необходимые для выживания, но ключевые для его биохимического поведения. [24] Вторую хромосому также называют хромидой , поскольку они имеют такое же использование кодонов , что и хромосома, необходимы для жизни, как и основная хромосома, но имеют элементы плазмидного типа, такие как начало репликации. Многие другие секвенированные Paracoccus также имеют хромиды. [25]
- Вибрионы имеют две кольцевые хромосомы. Более крупный из них использует традиционное происхождение типа oriC , но последний использует происхождение типа плазмиды P1, что делает его хромидой. [22]
См. также
[ редактировать ]Ссылки
[ редактировать ]Это основано на статье Имальды Девапаранам и Дэвида Трайба, опубликованной на условиях лицензирования CC by SA в ходе университетского курса на факультете микробиологии и иммунологии Мельбурнского университета, 2007 г. [ нужна ссылка ] Эта статья включает в себя материал из статьи Citizendium « Репликация кольцевой бактериальной хромосомы », которая лицензируется по лицензии Creative Commons Attribution-ShareAlike 3.0 Unported License , но не по GFDL .
- ^ Джон М. Кагуни DnaA: контроль инициации репликации бактериальной ДНК и многое другое. Анну. Преподобный Микробиол. 2006. 60:351–71.
- ^ C Вайгель, А. Шмидт, Б. Рюкерт, Р. Лурц и В. Мессер. Белок DnaA, связывающийся с отдельными блоками DnaA в точке начала репликации Escherichia coli, oriC. ЭМБО Дж. 1997 г., 3 ноября; 16 (21): 6574–6583.
- ^ Хирота Ю., Мордо Дж. и Джейкоб Ф. (1970) О процессе клеточного деления Escherichia coli III. Термочувствительные мутанты Escherichia coli, измененные в процессе инициации ДНК. Дж Мол Биол, 53, 369–387.
- ^ Брэмхилл Д., Корнберг А. 1988. Открытие дуплекса белком dnaA в новых последовательностях при инициации репликации в начале хромосомы E. coli. Ячейка 52: 743–55
- ^ Секимидзу К., Брэмхилл Д. и Корнберг А. (1987) АТФ активирует белок dnaA, инициируя репликацию плазмид, несущих происхождение хромосомы E.coli. Ячейка, 50, 259–265
- ^ Гото О, Тагашира Ю. 1981. Расположение часто открывающихся областей на природных ДНК и их связь с функциональными локусами. Биополимеры 20:1043–58.
- ^ Ковальски Д., Эдди М.Дж. 1989. Элемент раскручивания ДНК: новый цис-действующий компонент, который облегчает открытие точки начала репликации Escherichia coli. ЭМБО Дж. 8: 4335–44.
- ^ Карр К.М., Кагуни Дж.М. 2001. Стехиометрия белков DnaA и DnaB при инициации хромосомного происхождения Escherichia coli. Ж. Биол. хим. 276:44919–25
- ^ Тогу К., Марианс К.Дж. 1996. Взаимодействие между хеликазой и примазой устанавливает часы репликационной вилки. Ж. Биол. хим. 271: 21398–405
- ^ Кэрнс, JP: Симпозиумы Колд-Спринг-Харбор по количественной биологии 28:44, 1963.
- ^ Уэйк, Р.Г. 1972. Визуализация повторно инициированных хромосом у Bacillus subtilis. Дж Мол Биол. 28 июля;68(3):501-9.
- ^ Прескотт Д.М., Куемпель П.Л. 1972. Двунаправленная репликация хромосомы в Escherichia coli. Proc Natl Acad Sci, США, октябрь; 69 (10): 2842-5.
- ^ О'Доннелл М., Джерузалми Д., Куриян Дж. Структура зажимного загрузчика предсказывает архитектуру голофермента ДНК-полимеразы III и RFC. Курс. Биол. 11 Р935-Р946 2001 г.
- ^ Индиани С., О'Доннелл М. Механизм треугольного ключа при открытии бета-скользящего зажима. J Биол Хим. 10 октября 2003 г.; 278(41): 40272-81. Epub, 8 июля 2003 г.
- ^ Перейти обратно: а б Кокс ММ (1998). «Расширяющийся взгляд на рекомбинационную репарацию ДНК у бактерий». Генные клетки . 3 (2): 65–78. дои : 10.1046/j.1365-2443.1998.00175.x . ПМИД 9605402 . S2CID 2723712 .
- ^ Даггин И.Г., Wake RG, Bell SD, Hill TM. 2008. Ловушка репликационной вилки и прекращение репликации хромосом. Мол Микробиол. Декабрь 70 (6): 1323–33.
- ^ Камада К., Хориучи Т., Осуми К., Симамото Н., Морикава К. 1996. Структура белка-терминатора репликации в комплексе с ДНК. Природа, 17;383(6601):598–603.
- ^ Каплан Д.Л., Бастия Д. 2009. Механизмы полярного ареста репликационной вилки. Мол Микробиол. 72(2):279-85. ПМИД 19298368
- ^ Крис Уллспергер и Николас Р. Коззарелли. Сравнение ферментативной активности топоизомеразы IV и ДНК-гиразы Escherichia coli. Том 271, номер 49, выпуск от 6 декабря 1996 г., стр. 31549-31555.
- ^ Э. Л. Зехидрих, А. Б. Ходурский, Н. Р. Коццарелли. Топоизомераза IV, а не гираза, декатенирует продукты сайт-специфической рекомбинации в Escherichia coli. Генс Дев. 1 октября 1997 г.; 11 (19): 2580-92 9334322
- ^ ДельВеккио, В.Г.; Капатрал, В; Редкар, Р.Дж.; Патра, Г; Мухер, К; Потерянный; Иванова Н; Андерсон, я; Бхаттачарья, А; Ликидис, А; Резник, Г; Яблонски, Л; Ларсен, Н.; Д'Суза, М; Бернал, А; Мазур, М; Гольцман, Э; Сельков Е; Эльзер, PH; Хагиус, С; О'Каллаган, Д; Летессон, Джей Джей; Хазелькорн, Р; Кирпид, Н; Овербек, Р. (8 января 2002 г.). «Последовательность генома факультативного внутриклеточного возбудителя Brucella melitensis» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (1): 443–8. Бибкод : 2002PNAS...99..443D . дои : 10.1073/pnas.221575398 . ПМЦ 117579 . ПМИД 11756688 .
- ^ Перейти обратно: а б Харрисон, PW; Нижний, РП; Ким, Северная Каролина; Янг, JP (апрель 2010 г.). «Представляем бактериальную «хромиду»: не хромосому, не плазмиду». Тенденции в микробиологии . 18 (4): 141–8. дои : 10.1016/j.tim.2009.12.010 . ПМИД 20080407 .
- ^ Си, ГГ; Сюй, К.Х.; Ю, XY; Ван, МФ; Чен, XH (июль 2019 г.). «Полная последовательность генома Paracoccus denitrificans ATCC 19367 и ее характеристики денитрификации». Канадский журнал микробиологии . 65 (7): 486–495. дои : 10.1139/cjm-2019-0037 . ПМИД 30897350 . S2CID 85445608 .
- ^ Ларсен, Рэйчел; Польяно, Кит. «Paracoccus denitrificans — микробевики» . microbewiki.kenyon.edu .
- ^ Ласек, Роберт; Шуплевская, Магдалена; Митура, Моника; Децевич, Пшемыслав; Хмелевская, Кора; Павлот, Александра; Сентковска, Дорота; Чарнецкий, Якуб; Бартосик, Дариуш (25 октября 2018 г.). «Структура генома условно-патогенного патогена Paracoccus yeei (альфапротеобактерии) и идентификация предполагаемых факторов вирулентности» . Границы микробиологии . 9 : 2553. дои : 10.3389/fmicb.2018.02553 . ПМК 6209633 . ПМИД 30410477 .