Протамин
| Протамин 1 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ПРМ1 | ||
| ген NCBI | 5619 | ||
| HGNC | 9447 | ||
| МОЙ БОГ | 182880 | ||
| RefSeq | НМ_002761 | ||
| ЮниПрот | P04553 | ||
| Другие данные | |||
| Локус | Хр. 16 п13.13 | ||
| |||
| Протамин 2 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ПРМ2 | ||
| ген NCBI | 5620 | ||
| HGNC | 9448 | ||
| МОЙ БОГ | 182890 | ||
| RefSeq | НМ_002762 | ||
| ЮниПрот | P04554 | ||
| Другие данные | |||
| Локус | Хр. 16 п13.13 | ||
| |||
Протамины — это небольшие аргинином , богатые ядерные белки , которые заменяют гистоны на поздних стадиях гаплоидной фазы сперматогенеза и считаются необходимыми для конденсации головок сперматозоидов и стабилизации ДНК . Они могут обеспечить более плотную упаковку ДНК в сперматозоиде , чем гистоны, но их необходимо распаковать, прежде чем генетические данные можно будет использовать для синтеза белка. Однако часть генома сперматозоидов упакована гистонами (10-15% у людей и других приматов), которые, как полагают, связывают гены, необходимые для раннего эмбрионального развития. [1]
Протамин и протаминоподобные (PL) белки вместе известны как специфичные для спермы основные ядерные белки (SNBP). Белки PL занимают промежуточное положение по структуре между протамином и гистоном H1 . С-концевой домен PL может быть предшественником протамина позвоночных. [2]
Сперматогенез
[ редактировать ]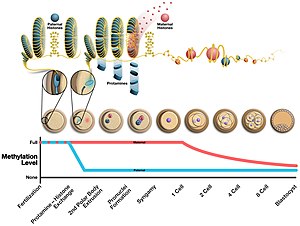
Во время образования сперматозоидов протамин связывается с фосфатным остовом ДНК, используя богатый аргинином домен в качестве якоря. Затем ДНК сворачивается в тороид , О-образную структуру, хотя механизм этого не известен. Сперматозоид может содержать в своем ядре до 50 000 тороидальных структур, каждый тороид содержит около 50 тысяч оснований. [4] Прежде чем образуется тороид, гистоны удаляются из ДНК переходными ядерными белками , так что протамин может конденсировать их. Эффектами этого изменения являются 1) увеличение гидродинамики сперматозоидов для лучшего прохождения жидкости за счет уменьшения размера головки 2) уменьшение возникновения повреждений ДНК 3) удаление эпигенетических маркеров, возникающих при модификациях гистонов. [5]
Структура головки спермия также связана с уровнем протамина. Было обнаружено, что соотношение протамина 2 к протамину 1 и переходным ядерным белкам меняет форму головки сперматозоида у различных видов мышей за счет изменения экспрессии протамина 2 посредством мутаций в его промоторной области. Было обнаружено, что уменьшение этого соотношения повышает конкурентоспособность сперматозоидов у Mus видов . Однако необходимы дальнейшие исследования, чтобы определить, как это соотношение влияет на форму головы и влияет ли моногамия на этот выбор. Исследования показывают, что у людей мужчины с несбалансированным уровнем Prm1/Prm2 являются субфертильными или бесплодными. [6] Протамин 2 кодируется как более длинный белок, которому необходимо расщепить N-конец, прежде чем он станет функциональным. Протамин человека и шимпанзе претерпел быструю эволюцию. [7]
Медицинское использование
[ редактировать ]При смешивании с инсулином протамины замедляют начало и увеличивают продолжительность действия инсулина (см. Инсулин НПХ ). [8]
Протамин используется в кардиохирургии, сосудистой хирургии и интервенционной радиологии для нейтрализации антисвертывающего действия гепарина . Побочные эффекты включают повышение давления в легочной артерии и снижение периферического артериального давления, потребления кислорода миокардом, сердечного выброса и частоты сердечных сокращений. [9]
Протамина сульфат является антидотом при передозировке гепарина , но может возникнуть тяжелая аллергия. [10] Версия протамина с укороченной цепью также действует как мощный антагонист гепарина, но с заметно сниженной антигенностью . Первоначально он был получен в виде смеси, полученной путем термолизинового расщепления протамина. [11] но фактическая эффективная часть пептида VSRRRRRRGGRRRR с тех пор был изолирован. [12] Также был произведен аналог этого пептида. [13]
В генной терапии способность протамина сульфата конденсировать плазмидную ДНК, а также его одобрение Управлением по контролю за продуктами и лекарствами США (FDA) сделали его привлекательным кандидатом для увеличения скорости трансдукции как вирусными [14] и невирусные (например, с использованием катионных липосом) [15] опосредованные механизмы доставки.
Протамин может использоваться как лекарство для предотвращения ожирения. Было показано, что протамин сдерживает увеличение массы тела и липопротеинов низкой плотности у крыс с высоким содержанием жиров. Этот эффект возникает за счет ингибирования активности липазы , фермента, ответственного за переваривание и всасывание триацилглицерина , что приводит к снижению всасывания пищевых жиров. При лечении крыс протамином не было обнаружено повреждений печени. Однако эмульгирование длинноцепочечных жирных кислот для переваривания и всасывания в тонком кишечнике менее постоянно у людей, чем у крыс, что будет варьировать эффективность протамина как лекарственного средства. Кроме того, человеческие пептидазы могут разлагать протамин с разной скоростью, поэтому необходимы дальнейшие исследования для определения способности протамина предотвращать ожирение у людей. [16]
Распространение видов и изоформы
[ редактировать ]Мыши, люди [1] и у некоторых рыб есть два или более разных протамина, тогда как сперма быка и хряка [17] имеют одну форму протамина из-за мутации в гене PRM2. У крысы, хотя ген PRM2 присутствует, экспрессия этого белка чрезвычайно мала из-за ограниченной транскрипции из-за неэффективного промотора в дополнение к измененному процессингу транскрипта мРНК. [18]
Млекопитающие
[ редактировать ]Два человеческих протамина обозначаются PRM1 и PRM2 .У мышей и людей PRM1, PRM2 и TNP2 расположены в консервативном кластере генов . [19]
У млекопитающих Eutherian обычно есть как PRM1, так и PRM2. С другой стороны, метатерийцы имеют только гомолог P1. [20]
Рыба
[ редактировать ]Примеры протаминов из рыбы:
- сальмин и протамина сульфат из лосося
- клепеин из сельди спермы ( Clupea )
- иридин из радужной форели
- тонкая часть тунца ( Thunnus )
- севрюга из севрюги ( Acipenser stellatus )
- сциллиоринин из акулы ( Scylliorhinus )
Протамин рыб обычно короче, чем у млекопитающих, и содержит большее количество аргинина. [20]
Последовательность
[ редактировать ]| Протамин Р1 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Протамин_P1 | ||
| Пфам | PF00260 | ||
| ИнтерПро | IPR000221 | ||
| PROSITE | PDOC00047 | ||
| |||
| Протамин Р2 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Протамин_P2 | ||
| Пфам | PF00841 | ||
| ИнтерПро | IPR000492 | ||
| |||

Первичная структура протамина P1, протамина, используемого для упаковки ДНК в клетках спермы, у плацентарных млекопитающих обычно состоит из 49 или 50 аминокислот. Эта последовательность разделена на три отдельных домена: богатый аргинином домен для связывания ДНК, фланкированный более короткими пептидными последовательностями, содержащими в основном остатки цистеина. Богатый аргинином домен состоит из 3-11 остатков аргинина и консервативен между последовательностями протамина рыб и протамина 1 млекопитающих при примерно 60-80% идентичности последовательностей. [1]
Структура
[ редактировать ]После трансляции структура протамина Р1 немедленно фосфорилируется по всем трем вышеупомянутым доменам. Следующий раунд фосфорилирования происходит, когда сперматозоид попадает в яйцеклетку, но функция этого фосфорилирования неясна. [1]
Точная вторичная и третичная структура протамина точно неизвестна, но с 1970-х годов было опубликовано несколько предложений. [22] [23] [1] [24] [25] [20] [26] Широкий консенсус заключается в том, что протамин образует структуры бета-цепи, которые затем сшиваются через дисульфидные связи (и, возможно, дитирозиновые и цистеин-тирозиновые связи). [25] [20] Когда протамин P1 связывается с ДНК, цистеин на аминоконце одного протамина P1 образует дисульфидные связи с цистеином на карбокси-конце другого протамина P1. Нейтрализуя заряд основной цепи, протамин позволяет ДНК более плотно скручиваться. [3] [26] Дисульфидные связи предотвращают диссоциацию протамина P1 от ДНК до тех пор, пока связи не восстановятся, когда сперматозоид попадет в яйцеклетку. [1] Эти длинные полимеры протамина могут затем обернуться вокруг ДНК внутри большой бороздки. [1] [23]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г Бэлхорн Р. (2007). «Семейство протаминов ядерных белков сперматозоидов» . Геномная биология . 8 (9): 227. doi : 10.1186/gb-2007-8-9-227 . ПМК 2375014 . ПМИД 17903313 .
- ^ Эйрин-Лопес Х.М., Аусио Дж. (октябрь 2009 г.). «Происхождение и эволюция хромосомных белков спермы». Биоэссе . 31 (10): 1062–70. doi : 10.1002/bies.200900050 . ПМИД 19708021 . S2CID 17131119 .
- ^ Jump up to: а б Дженкинс Т.Г., Каррелл Д.Т. (2012). «Динамические изменения в отцовском эпигенетическом ландшафте после оплодотворения» . Границы генетики . 3 : 143. дои : 10.3389/fgene.2012.00143 . ПМЦ 3442791 . ПМИД 23024648 .
- ^ Брюэр Л.Р., Корзетт М., Балхорн Р. (октябрь 1999 г.). «Вызванная протамином конденсация и деконденсация одной и той же молекулы ДНК» . Наука . 286 (5437): 120–3. дои : 10.1126/science.286.5437.120 . ПМИД 10506559 .
- ^ Вуп М (январь 2015 г.). «Оптимизация движения связанных частиц для измерения уплотнения ДНК протамином» . Биофизический журнал . 108 (2): 393а. Бибкод : 2015BpJ...108..393W . дои : 10.1016/j.bpj.2014.11.2156 .
- ^ Люк Л., Кэмпбелл П., Вареа Санчес М., Нахман М.В., Ролдан Э.Р. (май 2014 г.). «Половой отбор по экспрессии протамина и переходного ядерного белка у мышей» . Слушания. Биологические науки . 281 (1783): 20133359. doi : 10.1098/rspb.2013.3359 . ПМЦ 3996607 . ПМИД 24671975 .
- ^ Вайкофф Г.Дж., Ван В., Ву Си (январь 2000 г.). «Быстрая эволюция мужских репродуктивных генов в происхождении человека». Природа . 403 (6767): 304–9. Бибкод : 2000Natur.403..304W . дои : 10.1038/35002070 . ПМИД 10659848 . S2CID 3136139 .
- ^ Оуэнс Д.Р. (июнь 2011 г.). «Препараты инсулина пролонгированного действия». Технология и терапия диабета . 13 (Приложение 1): С5-14. дои : 10.1089/диаметр.2011.0068 . PMID 21668337 .
- ^ Карр Дж. А., Сильверман Н. (октябрь 1999 г.). «Взаимодействие гепарина и протамина. Обзор». Журнал сердечно-сосудистой хирургии . 40 (5): 659–66. ПМИД 10596998 .
- ^ Вейлер Дж.М., Фрейман П., Шарат М.Д., Мецгер В.Дж., Смит Дж.М., Ричерсон Х.Б. и др. (февраль 1985 г.). «Серьезные побочные реакции на сульфат протамина: нужны ли альтернативы?». Журнал аллергии и клинической иммунологии . 75 (2): 297–303. дои : 10.1016/0091-6749(85)90061-2 . ПМИД 2857186 .
- ^ Бён Ю, Чанг Л.К., Ли Л.М., Хан И.С., Сингх В.К., Ян В.К. (2000). «Низкомолекулярный протамин: мощный, но нетоксичный антагонист гепарина/низкомолекулярного протамина» . Журнал АСАИО . 46 (4): 435–9. дои : 10.1097/00002480-200007000-00013 . ПМИД 10926141 . S2CID 13106365 .
- ^ Хэ Х, Е Дж, Лю Э, Лян Ц, Лю Ц, Ян ВК (ноябрь 2014 г.). «Низкомолекулярный протамин (LMWP): нетоксичный заменитель протамина и эффективный проникающий в клетки пептид». Журнал контролируемого выпуска . 193 : 63–73. дои : 10.1016/j.jconrel.2014.05.056 . ПМИД 24943246 .
- ^ Чанг LC, Ли HF, Ян З, Ян ВК (1 сентября 2001 г.). «Низкомолекулярный протамин (LMWP) как нетоксичный гепарин / антидот низкомолекулярного гепарина (I): получение и характеристика» . AAPS PharmSci . 3 (3): 7–14. дои : 10.1208/ps030317 . ПМК 2751012 . ПМИД 11741268 .
- ^ Корнетта К., Андерсон В.Ф. (февраль 1989 г.). «Протамина сульфат как эффективная альтернатива полибрену при ретровирусном переносе генов: значение для генной терапии человека» . Журнал вирусологических методов . 23 (2): 187–94. дои : 10.1016/0166-0934(89)90132-8 . ПМИД 2786000 .
- ^ Сорги Ф.Л., Бхаттачарья С., Хуан Л. (сентябрь 1997 г.). «Протамина сульфат усиливает липидопосредованный перенос генов» . Генная терапия . 4 (9): 961–8. дои : 10.1038/sj.gt.3300484 . ПМИД 9349433 . S2CID 22101764 .
- ^ Дуарте-Васкес М.А., Гарсия-Падилья С., Ольвера-Очоа Л., Гонсалес-Ромеро К.Е., Акоста-Инигес Х., Де ла Крус-Ламб Р., Росадо Х.Л. (июнь 2009 г.). «Влияние протамина на ожирение, вызванное диетой с высоким содержанием жиров у крыс». Международный журнал ожирения . 33 (6): 687–92. дои : 10.1038/ijo.2009.78 . ПМИД 19434066 . S2CID 22589323 .
- ^ Майер В.М., Нуссбаум Г., Доменжу Л., Клемм У., Энгель В. (март 1990 г.). «Недостаток протамина 2 (P2) в сперматозоидах хряков и быков обусловлен мутациями в гене P2» . Исследования нуклеиновых кислот . 18 (5): 1249–54. дои : 10.1093/нар/18.5.1249 . ПМК 330441 . ПМИД 2320417 .
- ^ Буник Д., Балхорн Р., Станкер Л.Х., Хехт Н.Б. (май 1990 г.). «Экспрессия гена крысиного протамина 2 подавляется на уровне транскрипции и трансляции». Экспериментальные исследования клеток . 188 (1): 147–52. дои : 10.1016/0014-4827(90)90290-q . ПМИД 2328773 .
- ^ Уайкс С.М., Кравец С.А. (октябрь 2003 г.). «Сохранение домена PRM1 → PRM2 → TNP2». Последовательность ДНК . 14 (5): 359–67. дои : 10.1080/10425170310001599453 . ПМИД 14756422 . S2CID 37737173 .
- ^ Jump up to: а б с д Пауэлл С.Д., Кирчофф, округ Колумбия, Деруши Дж.Э., Мозли Х.Н. (апрель 2020 г.). «Энтропийный анализ последовательностей протаминов сперматозоидов позвоночных: свидетельства потенциального перекрестного связывания дитирозина и цистеин-тирозина в протаминах сперматозоидов» . БМК Геномика . 21 (1): 277. doi : 10.1186/s12864-020-6681-2 . ПМК 7126135 . ПМИД 32245406 .
- ^ Бэлхорн Р. (26 сентября 2007 г.). «Семейство протаминов ядерных белков сперматозоидов» . Геномная биология . 8 (9): 227. doi : 10.1186/gb-2007-8-9-227 . ПМК 2375014 . ПМИД 17903313 .
- ^ Ордер Р.В., Ким Ш. (январь 1978 г.). «Взаимодействие альфа-спирали и двойной спирали, показанное в структуре комплекса протамин-переносящей РНК и модели нуклеопротамина». Природа . 271 (5641): 130–5. Бибкод : 1978Natur.271..130W . дои : 10.1038/271130a0 . ПМИД 622153 . S2CID 4172929 .
- ^ Jump up to: а б Худ Н.В., Миланович Ф.П., Балхорн Р. (июнь 1994 г.). «Доказательства новой вторичной структуры ДНК-связанного протамина обнаружены с помощью рамановской спектроскопии». Биохимия . 33 (24): 7528–35. дои : 10.1021/bi00190a005 . ПМИД 8011618 .
- ^ Мартинс Р.П., Остермайер Г.К., Кравец С.А. (декабрь 2004 г.). «Взаимодействия ядерной матрицы в домене протамина человека: рабочая модель потенциирования» . Журнал биологической химии . 279 (50): 51862–8. дои : 10.1074/jbc.M409415200 . ПМИД 15452126 .
- ^ Jump up to: а б Вилфан И.Д., Конвелл CC, Hud NV (май 2004 г.). «Формирование нативного хроматина сперматозоидов млекопитающих со свернутым бычьим протамином» . Журнал биологической химии . 279 (19): 20088–95. дои : 10.1074/jbc.M312777200 . ПМИД 14990583 .
- ^ Jump up to: а б Укогу О.А., Смит А.Д., Девеница Л.М., Бедиако Х., Макмиллан Р.Б., Ма Ю. и др. (июнь 2020 г.). «Протамин закольцовывает ДНК в несколько этапов» . Исследования нуклеиновых кислот . 48 (11): 6108–6119. дои : 10.1093/NAR/GKAA365 . ПМК 7293030 . ПМИД 32392345 .
Внешние ссылки
[ редактировать ]- Протамины Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- V03AB14 ( ВОЗ )