протеинопатия
| протеинопатия | |
|---|---|
 | |
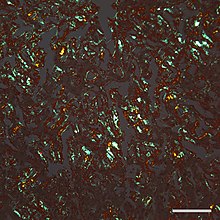
| Микрофотография среза коры головного мозга человека с болезнью Альцгеймера , иммуноокрашенного антителом к бета -амилоиду (коричневый), фрагменту белка, который накапливается в амилоидных бляшках и церебральной амилоидной ангиопатии . Объектив микроскопа с 10-кратным увеличением. |
В медицине , протеинопатия ([ преф . белок]; -патия [ суфф . болезнь]; протеинопатии мн .; протеинопатический прил ), или протеопатия , конформационное нарушение белка или болезнь неправильного сворачивания белков , — это класс заболеваний , при которых определенные белки становятся структурно аномальными, и тем самым нарушают функции клеток , тканей и органов организма. [1] [2] Часто белкам не удается свернуть свою нормальную конфигурацию; в этом неправильно свернутом состоянии белки могут стать каким-то образом токсичными (токсическое усиление функции ) или потерять свою нормальную функцию. [3] К протеинопатиям относятся такие заболевания, как болезнь Крейтцфельдта-Якоба (и вариант, связанный с коровьим бешенством ) и другие прионные заболевания , болезнь Альцгеймера , болезнь Паркинсона , амилоидоз , множественная системная атрофия и широкий спектр других заболеваний. [2] [4] [5] [6] [7] [8] Термин «протеопатия» был впервые предложен в 2000 году Лари Уокером и Гарри Левином. [1]
Концепция протеопатии зародилась в середине 19 века, когда в 1854 году Рудольф Вирхов ввел термин амилоид («крахмальноподобный») для описания вещества в амилацеа мозговых тел , которое проявляло химическую реакцию, напоминающую реакцию целлюлозы. . В 1859 году Фридрейх и Кекуле продемонстрировали, что «амилоид» на самом деле богат белком, а не состоит из целлюлозы. [9] Последующие исследования показали, что многие различные белки могут образовывать амилоид, и что все амилоиды демонстрируют двойное лучепреломление в кросс- поляризованном свете после окрашивания красителем Конго красный , а также фибриллярную ультраструктуру при просмотре под электронным микроскопом . [9] Однако некоторые белковые поражения лишены двойного лучепреломления и содержат мало или вообще не содержат классических амилоидных фибрилл, например, диффузные отложения белка бета-амилоида (Aβ) в мозге людей с болезнью Альцгеймера. [10] Более того, появились доказательства того, что небольшие нефибриллярные белковые агрегаты, известные как олигомеры, токсичны для клеток пораженного органа и что амилоидогенные белки в их фибриллярной форме могут быть относительно доброкачественными. [11] [12]
Патофизиология
[ редактировать ]При большинстве, если не во всех протеинопатиях, изменение трехмерной складчатой конформации увеличивает склонность специфического белка связываться с самим собой. [5] В этой агрегированной форме белок устойчив к клиренсу и может нарушать нормальную работу пораженных органов. В некоторых случаях неправильное сворачивание белка приводит к потере его обычной функции. Например, муковисцидоз вызван дефектным белком регулятором трансмембранной проводимости муковисцидоза (CFTR), [3] а при боковом амиотрофическом склерозе/лобно-височной долевой дегенерации (FTLD) некоторые белки, регулирующие гены, неправильно агрегируют в цитоплазме и, таким образом, не могут выполнять свои нормальные задачи в ядре. [13] [14] Поскольку белки имеют общую структурную особенность, известную как полипептидный остов, все белки при некоторых обстоятельствах могут неправильно сворачиваться. [15] Однако лишь относительно небольшое количество белков связано с протеопатическими нарушениями, возможно, из-за структурных особенностей уязвимых белков. Например, белки, которые обычно развернуты или относительно нестабильны как мономеры (то есть как отдельные несвязанные белковые молекулы), с большей вероятностью неправильно свернутся в аномальную конформацию. [5] [15] [16] Почти во всех случаях вызывающая заболевание молекулярная конфигурация включает увеличение вторичной структуры бета-листа белка. [5] [15] [17] [18] [19] Было показано, что аномальные белки при некоторых протеопатиях складываются во множество трехмерных форм; Эти варианты белковых структур определяются их различными патогенными, биохимическими и конформационными свойствами. [20] Они наиболее тщательно изучены в отношении прионных болезней и называются белковыми штаммами . [21] [22]

Вероятность развития протеинопатии увеличивается при наличии определенных факторов риска , способствующих самосборке белка. К ним относятся дестабилизирующие изменения первичной аминокислотной последовательности белка, посттрансляционные модификации (такие как гиперфосфорилирование ), изменения температуры или pH , увеличение продукции белка или снижение его клиренса. [1] [5] [15] Преклонный возраст является сильным фактором риска, [1] как и черепно-мозговая травма. [23] [24] В стареющем мозге несколько протеопатий могут перекрываться. [25] Например, в дополнение к таупатии и Aβ-амилоидозу (которые сосуществуют как ключевые патологические признаки болезни Альцгеймера), у многих пациентов с болезнью Альцгеймера имеется сопутствующая синуклеинопатия ( тельца Леви ) в головном мозге. [26]
Предполагается, что шапероны и ко-шапероны (белки, которые способствуют сворачиванию белков ) могут противодействовать протеотоксичности во время старения и при заболеваниях неправильной сворачивания белков, поддерживая протеостаз . [27] [28] [29]
Посевная индукция
[ редактировать ]Некоторые белки можно заставить образовывать аномальные сборки под воздействием того же (или подобного) белка, который свернулся в конформацию, вызывающую заболевание. Этот процесс называется «засевом» или «разрешительным шаблоном». [30] [31] Таким образом, болезненное состояние может быть вызвано у восприимчивого хозяина путем введения экстракта больной ткани от пораженного донора. Наиболее известными формами индуцируемой протеопатии являются прионные заболевания . [32] который может передаваться при воздействии на организм хозяина очищенного прионного белка в болезнетворной конформации. [33] [34] В настоящее время имеются доказательства того, что другие протеинопатии могут быть вызваны аналогичным механизмом, включая амилоидоз Аβ , амилоидоз А (АА) и амилоидоз аполипопротеина AII. [31] [35] таупатия, [36] синуклеинопатия, [37] [38] [39] [40] и агрегация супероксиддисмутазы -1 (СОД1), [41] [42] полиглутамин, [43] [44] и ДНК-связывающий белок TAR-43 ( TDP-43 ). [45]
Во всех этих случаях патогенным агентом является аберрантная форма самого белка. В некоторых случаях отложение одного типа белков может быть экспериментально индуцировано агрегированными ансамблями других белков, богатых структурой β-листа, возможно, из-за структурной комплементарности белковых молекул. Например, АА-амилоидоз у мышей можно стимулировать такими разнообразными макромолекулами , как шелк, дрожжевой амилоид Sup35 и курчавые фибриллы бактерии Escherichia coli . [46] Амилоид AII может индуцироваться у мышей с помощью различных амилоидных фибрилл, богатых β-листами. [47] и церебральная таупатия может быть вызвана экстрактами головного мозга, богатыми агрегированными Aβ. [48] Существуют также экспериментальные доказательства перекрестного посева между прионным белком и Aβ. [49] В общем, такой гетерологичный посев менее эффективен, чем посев поврежденной формой того же белка.
Список протеинопатий
[ редактировать ]Управление
[ редактировать ]Разработка эффективных методов лечения многих протеопатий оказалась сложной задачей. [75] [76] Поскольку протеопатии часто включают в себя разные белки, происходящие из разных источников, стратегии лечения должны быть адаптированы к каждому заболеванию; однако общие терапевтические подходы включают поддержание функции пораженных органов, уменьшение образования вызывающих заболевание белков, предотвращение неправильного сворачивания и/или агрегации белков или содействие их удалению. [77] [75] [78] Например, при болезни Альцгеймера исследователи ищут способы уменьшить выработку связанного с заболеванием белка Aβ путем ингибирования ферментов , которые освобождают его от родительского белка. [76] Другая стратегия заключается в использовании антител для нейтрализации определенных белков путем активной или пассивной иммунизации . [79] При некоторых протеопатиях может быть полезным подавление токсических эффектов белковых олигомеров. [80]
Например, амилоидоз амилоида А (АА) можно уменьшить путем лечения воспалительного состояния, которое увеличивает количество белка в крови (называемого сывороточным амилоидом А или SAA). [75] При амилоидозе легкой цепи иммуноглобулина (AL-амилоидозе) химиотерапию можно использовать для снижения количества клеток крови, вырабатывающих белок легкой цепи, образующий амилоид в различных органах тела. [81] Транстиретиновый (TTR) амилоидоз (ATTR) возникает в результате отложения неправильно свернутого TTR во многих органах. [82] Поскольку TTR в основном вырабатывается в печени TTR-амилоидоз можно замедлить , в некоторых наследственных случаях с помощью трансплантации печени . [83] TTR-амилоидоз также можно лечить путем стабилизации нормальных сборок белка (называемых тетрамерами, поскольку они состоят из четырех молекул TTR, связанных вместе). Стабилизация предотвращает утечку, неправильное сворачивание и агрегацию отдельных молекул TTR в амилоид. [84] [85]
Исследуются несколько других стратегий лечения протеопатий, включая малые молекулы и биологические лекарства, такие как малые интерферирующие РНК , антисмысловые олигонуклеотиды , пептиды и сконструированные иммунные клетки . [84] [81] [86] [87] В некоторых случаях для повышения эффективности можно комбинировать несколько терапевтических агентов. [81] [88]
Дополнительные изображения
[ редактировать ]- Микрофотография таупатии (коричневая) в теле нейрональной клетки (стрелка) и отростке (кончик стрелки) в коре головного мозга пациента с болезнью Альцгеймера. Бар = 25 микрон (0,025 мм).
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Уокер LC, ЛеВин Х (2000). «Церебральные протеопатии». Нейробиология старения . 21 (4): 559–61. дои : 10.1016/S0197-4580(00)00160-3 . ПМИД 10924770 . S2CID 54314137 .
- ^ Перейти обратно: а б Уокер LC, ЛеВин Х (2000). «Церебральные протеопатии: нейродегенеративные нарушения конформации и сборки белков». Молекулярная нейробиология . 21 (1–2): 83–95. дои : 10.1385/МН:21:1-2:083 . ПМИД 11327151 . S2CID 32618330 .
- ^ Перейти обратно: а б Лухеши Л.М., Кроутер, округ Колумбия, Добсон К.М. (февраль 2008 г.). «Неправильное сворачивание белка и болезни: от пробирки к организму». Современное мнение в области химической биологии . 12 (1): 25–31. дои : 10.1016/j.cbpa.2008.02.011 . ПМИД 18295611 .
- ^ Чити Ф, Добсон СМ (2006). «Неправильное сворачивание белка, функциональный амилоид и болезни человека». Ежегодный обзор биохимии . 75 (1): 333–66. doi : 10.1146/annurev.biochem.75.101304.123901 . ПМИД 16756495 . S2CID 23797549 .
- ^ Перейти обратно: а б с д и Каррелл Р.В., Ломас Д.А. (июль 1997 г.). «Конформационная болезнь». Ланцет . 350 (9071): 134–8. дои : 10.1016/S0140-6736(97)02073-4 . ПМИД 9228977 . S2CID 39124185 .
- ^ Вестермарк П., Бенсон М.Д., Буксбаум Дж.Н., Коэн А.С., Франджионе Б., Икеда С., Мастерс К.Л., Мерлини Г., Сараива М.Дж., Сайп Дж.Д. (сентябрь 2007 г.). «Основная номенклатура амилоида». Амилоид . 14 (3): 179–83. дои : 10.1080/13506120701460923 . ПМИД 17701465 . S2CID 12480248 .
- ^ Вестермарк ГТ, Фендрих М, Лундмарк К, Вестермарк П (январь 2018 г.). «Нецеребральные амилоидозы: аспекты посева, перекрестного посева и передачи» . Перспективы Колд-Спринг-Харбора в медицине . 8 (1): а024323. doi : 10.1101/cshperspect.a024323 . ПМК 5749146 . ПМИД 28108533 .
- ^ Прусинер С.Б. (2013). «Биология и генетика прионов, вызывающих нейродегенерацию» . Ежегодный обзор генетики . 47 : 601–23. doi : 10.1146/annurev-genet-110711-155524 . ПМК 4010318 . ПМИД 24274755 .
- ^ Перейти обратно: а б Сайп Дж.Д., Коэн А.С. (июнь 2000 г.). «Обзор: история амилоидных фибрилл». Журнал структурной биологии . 130 (2–3): 88–98. дои : 10.1006/jsbi.2000.4221 . ПМИД 10940217 .
- ^ Вишневский Х.М., Садовский М., Якубовска-Садовска К., Тарнавский М., Вегель Дж. (июль 1998 г.). «Диффузные, озеркообразные отложения бета-амилоида в парвопирамидном слое пресубикулума при болезни Альцгеймера» . Журнал невропатологии и экспериментальной неврологии . 57 (7): 674–83. дои : 10.1097/00005072-199807000-00004 . ПМИД 9690671 .
- ^ Glabe CG (апрель 2006 г.). «Общие механизмы патогенеза амилоидных олигомеров при дегенеративных заболеваниях». Нейробиология старения . 27 (4): 570–5. doi : 10.1016/j.neurobiolaging.2005.04.017 . ПМИД 16481071 . S2CID 32899741 .
- ^ Гадад Б.С., Бриттон ГБ, Рао КС (2011). «Нацеливание на олигомеры при нейродегенеративных заболеваниях: уроки α-синуклеина, тау и пептида амилоида-β». Журнал болезни Альцгеймера . 24 (Приложение 2): 223–32. дои : 10.3233/JAD-2011-110182 . ПМИД 21460436 .
- ^ Ито Д., Сузуки Н. (октябрь 2011 г.). «Совместные патологические каскады, опосредованные ALS/FTLD-U, связанными РНК-связывающими белками TDP-43 и FUS» . Неврология . 77 (17): 1636–43. дои : 10.1212/WNL.0b013e3182343365 . ПМК 3198978 . ПМИД 21956718 .
- ^ Волозин Б. , Апикко Д. (2015). «РНК-связывающие белки и генез нейродегенеративных заболеваний». ГеНеДис 2014 . Достижения экспериментальной медицины и биологии. Том. 822. стр. 11–5. дои : 10.1007/978-3-319-08927-0_3 . ISBN 978-3-319-08926-3 . ПМЦ 4694570 . ПМИД 25416971 .
- ^ Перейти обратно: а б с д Добсон CM (сентябрь 1999 г.). «Неправильное сворачивание белка, эволюция и болезни». Тенденции биохимических наук . 24 (9): 329–32. дои : 10.1016/S0968-0004(99)01445-0 . ПМИД 10470028 .
- ^ Перейти обратно: а б Джакер М. , Уокер Л.С. (сентябрь 2013 г.). «Самовоспроизведение патогенных белковых агрегатов при нейродегенеративных заболеваниях» . Природа . 501 (7465): 45–51. Бибкод : 2013Natur.501...45J . дои : 10.1038/nature12481 . ПМЦ 3963807 . ПМИД 24005412 .
- ^ Селькое DJ (декабрь 2003 г.). «Сворачивание белков фатальным образом». Природа . 426 (6968): 900–4. Бибкод : 2003Natur.426..900S . дои : 10.1038/nature02264 . ПМИД 14685251 . S2CID 6451881 .
- ^ Айзенберг Д., Джакер М. (март 2012 г.). «Амилоидное состояние белков при заболеваниях человека» . Клетка . 148 (6): 1188–203. дои : 10.1016/j.cell.2012.02.022 . ПМЦ 3353745 . ПМИД 22424229 .
- ^ Рёр Д., Бун Б.Д. (декабрь 2020 г.). «Вибрационная визуализация без меток различных типов бляшек Aβ при болезни Альцгеймера выявляет последовательные события в развитии бляшек» . Acta Neuropathologica Communications . 8 (1): 222. дои : 10.1186/s40478-020-01091-5 . ПМЦ 7733282 . ПМИД 33308303 .
- ^ Уокер LC (ноябрь 2016 г.). «Протеопатические штаммы и гетерогенность нейродегенеративных заболеваний» . Ежегодный обзор генетики . 50 : 329–346. doi : 10.1146/annurev-genet-120215-034943 . ПМК 6690197 . ПМИД 27893962 .
- ^ Коллиндж Дж., Кларк А.Р. (ноябрь 2007 г.). «Общая модель прионных штаммов и их патогенности». Наука . 318 (5852): 930–6. Бибкод : 2007Sci...318..930C . дои : 10.1126/science.1138718 . ПМИД 17991853 . S2CID 8993435 .
- ^ Колби Д.В., Прусинер С.Б. (сентябрь 2011 г.). «Поколение прионных штаммов de novo» . Обзоры природы. Микробиология . 9 (11): 771–7. дои : 10.1038/nrmicro2650 . ПМЦ 3924856 . ПМИД 21947062 .
- ^ ДеКоски С.Т., Икономович, доктор медицинских наук, Ганди С. (сентябрь 2010 г.). «Черепно-мозговая травма - футбол, война и долгосрочные последствия». Медицинский журнал Новой Англии . 363 (14): 1293–6. дои : 10.1056/NEJMp1007051 . ПМИД 20879875 .
- ^ Макки AC, Стейн Т.Д., Кирнан П.Т., Альварес В.Е. (май 2015 г.). «Невропатология хронической травматической энцефалопатии» . Патология головного мозга . 25 (3): 350–64. дои : 10.1111/bpa.12248 . ПМК 4526170 . ПМИД 25904048 .
- ^ Нельсон П.Т., Алафузофф И., Бигио Э.Х., Бурас К., Браак Х., Кэрнс Н.Дж., Кастеллани Р.Дж., Крейн Б.Дж., Дэвис П., Дель Тредичи К., Дайкартс К., Фрош М.П., Арутюнян В., Хоф PR, Хулетт К.М., Хайман Б.Т., Ивацубо Т., Йеллингер К.А., Джиха Г.А., Кёвари Э., Кукулл В.А., Леверенц Дж.Б., Лав С., Маккензи И.Р., Манн Д.М., Маслия Е., Макки А.С., Монтин Т.Дж., Моррис Дж.С., Шнайдер Дж.А., Соннен Дж.А., Таль Д.Р., Трояновский JQ, Тронкозо Дж.К., Вишневски Т., Вольтьер Р.Л., Бич Т.Г. (май 2012 г.). «Корреляция невропатологических изменений болезни Альцгеймера с когнитивным статусом: обзор литературы» . Журнал невропатологии и экспериментальной неврологии . 71 (5): 362–81. дои : 10.1097/NEN.0b013e31825018f7 . ПМК 3560290 . ПМИД 22487856 .
- ^ Мрак Р.Э., Гриффин В.С. (2007). «Слабоумие с тельцами Леви: определение, диагностика и патогенетическая связь с болезнью Альцгеймера» . Нервно-психические заболевания и лечение . 3 (5): 619–25. ПМЦ 2656298 . ПМИД 19300591 .
- ^ Дуглас П.М., Саммерс Д.В., Сир Д.М. (2009). «Молекулярные шапероны противодействуют протеотоксичности путем дифференциальной модуляции путей агрегации белков» . Прион . 3 (2): 51–8. дои : 10.4161/при.3.2.8587 . ПМЦ 2712599 . ПМИД 19421006 .
- ^ Бреме М., Вуазин С., Роллан Т., Вачи С., Сопер Дж.Х., Чжу Ю., Ортон К., Виллелла А., Гарса Д., Видаль М., Ге Х., Моримото Р.И. (ноябрь 2014 г.). «Подсеть шаперомов защищает протеостаз при старении и нейродегенеративных заболеваниях» . Отчеты по ячейкам . 9 (3): 1135–50. дои : 10.1016/j.celrep.2014.09.042 . ПМЦ 4255334 . ПМИД 25437566 .
- ^ Бреме М., Вуазин К. (август 2016 г.). «Модельные системы заболеваний, связанных с неправильным сворачиванием белков, выявляют шапероны-модификаторы протеотоксичности» . Модели и механизмы заболеваний . 9 (8): 823–38. дои : 10.1242/dmm.024703 . ПМК 5007983 . ПМИД 27491084 .
- ^ Харди Дж. (август 2005 г.). «Экспрессия патогенных белков с нормальной последовательностью при нейродегенеративных заболеваниях способствует риску заболевания:« разрешительный шаблон »как общий механизм, лежащий в основе нейродегенерации». Труды Биохимического общества . 33 (Часть 4): 578–81. дои : 10.1042/BST0330578 . ПМИД 16042548 .
- ^ Перейти обратно: а б Уокер Л.К., Левин Х., Мэттсон член парламента, Джакер М. (август 2006 г.). «Индуцибельные протеопатии» . Тенденции в нейронауках . 29 (8): 438–43. дои : 10.1016/j.tins.2006.06.010 . ПМЦ 10725716 . ПМИД 16806508 . S2CID 46630402 .
- ^ Прусинер С.Б. (май 2001 г.). «Лекция Шаттука - нейродегенеративные заболевания и прионы» . Медицинский журнал Новой Англии . 344 (20): 1516–26. дои : 10.1056/NEJM200105173442006 . ПМИД 11357156 .
- ^ Цзоу WQ, Гамбетти П. (апрель 2005 г.). «От микробов к прионам — окончательное доказательство прионной гипотезы» . Клетка . 121 (2): 155–7. дои : 10.1016/j.cell.2005.04.002 . ПМИД 15851020 .
- ^ Ма Дж (2012). «Роль кофакторов в распространении прионов и инфекционности» . ПЛОС Патогены . 8 (4): e1002589. дои : 10.1371/journal.ppat.1002589 . ПМК 3325206 . ПМИД 22511864 .
- ^ Мейер-Люманн М, Кумарасвами Дж, Болмонт Т, Кэзер С, Шефер С, Килгер Е, Нойеншвандер А, Абрамовски Д, Фрей П, Джейтон А.Л., Вигуре Дж.М., Паганетти П., Уолш Д.М., Мэтьюз П.М., Гисо Дж., Штауфенбиль М., Уокер LC, Джакер М (сентябрь 2006 г.). «Экзогенная индукция церебрального бета-амилоидогенеза регулируется агентом и хозяином». Наука . 313 (5794): 1781–4. Бибкод : 2006Sci...313.1781M . дои : 10.1126/science.1131864 . ПМИД 16990547 . S2CID 27127208 .
- ^ Клавагера Ф., Болмонт Т., Кроутер Р.А., Абрамовски Д., Фрэнк С., Пробст А., Фрейзер Г., Сталдер А.К., Бейбель М., Штауфенбиль М., Джакер М. , Годерт М. , Толнай М. (июль 2009 г.). «Передача и распространение таупатии в мозге трансгенных мышей» . Природная клеточная биология . 11 (7): 909–13. дои : 10.1038/ncb1901 . ПМК 2726961 . ПМИД 19503072 .
- ^ Десплац П., Ли Х.Дж., Бэ Э.Дж., Патрик С., Рокенштейн Э., Крюс Л., Спенсер Б., Маслия Э., Ли С.Дж. (август 2009 г.). «Формирование включений и гибель нейрональных клеток посредством передачи альфа-синуклеина от нейрона к нейрону» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (31): 13010–5. дои : 10.1073/pnas.0903691106 . ПМЦ 2722313 . ПМИД 19651612 .
- ^ Хансен С., Ангот Э., Бергстрем А.Л., Штайнер Дж.А., Пьери Л., Пол Г., Оутейро Т.Ф., Мелки Р., Каллунки П., Фог К., Ли Дж.Ю., Брундин П. (февраль 2011 г.). «α-синуклеин распространяется из мозга мыши к привитым дофаминергическим нейронам и агрегации семян в культивируемых клетках человека» . Журнал клинических исследований . 121 (2): 715–25. дои : 10.1172/JCI43366 . ПМК 3026723 . ПМИД 21245577 .
- ^ Кордауэр Дж.Х., Додия Х.Б., Кордауэр А.М., Терпстра Б., Паумье К., Мадхаван Л., Сортвелл С., Стис-Коллиер К., Коллиер Т.Дж. (сентябрь 2011 г.). «Перенос α-синуклеина, полученного из хозяина, в привитые дофаминергические нейроны крысы» . Нейробиология болезней . 43 (3): 552–7. дои : 10.1016/j.nbd.2011.05.001 . ПМК 3430516 . ПМИД 21600984 .
- ^ Кордауэр Дж.Х., Чу Ю., Хаузер Р.А., Фриман Т.Б., Оланов К.В. (май 2008 г.). «Патология, подобная тельцу Леви, при длительной трансплантации эмбриональных нигрелов при болезни Паркинсона». Природная медицина . 14 (5): 504–6. дои : 10.1038/nm1747 . ПМИД 18391962 . S2CID 11991816 .
- ^ Чиа Р., Таттум М.Х., Джонс С., Коллиндж Дж., Фишер Э.М., Джексон Г.С. (май 2010 г.). Фиани М.Б. (ред.). «Супероксиддисмутаза 1 и tgSOD1 семенные фибриллы спинного мозга мыши, что указывает на механизм размножающейся гибели клеток при боковом амиотрофическом склерозе» . ПЛОС ОДИН . 5 (5): е10627. дои : 10.1371/journal.pone.0010627 . ПМЦ 2869360 . ПМИД 20498711 .
- ^ Мюнх С., О'Брайен Дж., Бертолотти А. (март 2011 г.). «Прионоподобное распространение мутантной супероксиддисмутазы-1, неправильно сворачивающейся в нейрональных клетках» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (9): 3548–53. Бибкод : 2011PNAS..108.3548M . дои : 10.1073/pnas.1017275108 . ПМК 3048161 . ПМИД 21321227 .
- ^ Рен П.Х., Лаукнер Дж.Э., Качирская И., Хойзер Дж.Э., Мелки Р., Копито Р.Р. (февраль 2009 г.). «Цитоплазматическое проникновение и стойкое инфицирование клеток млекопитающих агрегатами полиглутамина» . Природная клеточная биология . 11 (2): 219–25. дои : 10.1038/ncb1830 . ПМК 2757079 . ПМИД 19151706 .
- ^ Пирс М.М., Копито Р.Р. (февраль 2018 г.). «Прионоподобные характеристики полиглутаминсодержащих белков» . Перспективы Колд-Спринг-Харбора в медицине . 8 (2): а024257. doi : 10.1101/cshperspect.a024257 . ПМЦ 5793740 . ПМИД 28096245 .
- ^ Фурукава Ю., Канеко К., Ватанабэ С., Яманака К., Нукина Н. (май 2011 г.). «Реакция посева повторяет внутриклеточное образование включений ДНК-связывающего белка-43 нерастворимого в саркозиле элемента ответа на трансактивацию (TAR)» . Журнал биологической химии . 286 (21): 18664–72. дои : 10.1074/jbc.M111.231209 . ПМК 3099683 . ПМИД 21454603 .
- ^ Лундмарк К., Вестермарк Г.Т., Ольсен А., Вестермарк П. (апрель 2005 г.). «Белковые фибриллы в природе могут усиливать амилоидоз белка А у мышей: перекрестный посев как механизм заболевания» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (17): 6098–102. Бибкод : 2005PNAS..102.6098L . дои : 10.1073/pnas.0501814102 . ПМК 1087940 . ПМИД 15829582 .
- ^ Фу X, Коренага Т, Фу Л, Син Ю, Го З, Мацусита Т, Хосокава М, Наики Х, Баба С, Кавата Ю, Икеда С, Исихара Т, Мори М, Хигучи К (апрель 2004 г.). «Индукция амилоидоза AApoAII различными гетерогенными амилоидными фибриллами» . Письма ФЭБС . 563 (1–3): 179–84. Бибкод : 2004FEBSL.563..179F . дои : 10.1016/S0014-5793(04)00295-9 . ПМИД 15063745 .
- ^ Болмонт Т., Клавагера Ф., Мейер-Люман М., Херциг М.К., Радде Р., Штауфенбиль М., Льюис Дж., Хаттон М., Толней М., Джакер М. (декабрь 2007 г.). «Индукция тау-патологии путем внутримозговой инфузии экстракта головного мозга, содержащего бета-амилоид, и отложения бета-амилоида у трансгенных мышей APP x Tau» . Американский журнал патологии . 171 (6): 2012–20. дои : 10.2353/ajpath.2007.070403 . ПМК 2111123 . ПМИД 18055549 .
- ^ Моралес Р., Эстрада Л.Д., Диас-Эспиноза Р., Моралес-Шейхинг Д., Хара М.К., Кастилья Х., Сото К. (март 2010 г.). «Молекулярный перекрестный контакт между неправильно свернутыми белками на животных моделях болезни Альцгеймера и прионных заболеваний» . Журнал неврологии . 30 (13): 4528–35. doi : 10.1523/JNEUROSCI.5924-09.2010 . ПМК 2859074 . ПМИД 20357103 .
- ^ Перейти обратно: а б с д Ревес Т., Гисо Дж., Лэшли Т., Плант Дж., Ростаньо А., Франджионе Б., Холтон Дж.Л. (сентябрь 2003 г.). «Церебральные амилоидные ангиопатии: патологический, биохимический и генетический взгляд». Журнал невропатологии и экспериментальной неврологии . 62 (9): 885–98. дои : 10.1093/jnen/62.9.885 . ПМИД 14533778 .
- ^ Го Л, Солт Т.Э., Луонг В., Вуд Н., Ченг В., Маасс А., Феррари Дж., Руссо-Мари Ф., Силлито А.М., Читэм М.Э., Мосс С.Э., Фитцке Ф.В., Кордейро М.Ф. (август 2007 г.). «Нацеливание на бета-амилоид в лечении глаукомы» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (33): 13444–9. Бибкод : 2007PNAS..10413444G . дои : 10.1073/pnas.0703707104 . ПМК 1940230 . ПМИД 17684098 .
- ^ Прусинер, С.Б. (2004). Прионная биология и болезни (2-е изд.). Колд-Спринг-Харбор, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор. ISBN 0-87969-693-1 .
- ^ Гёдерт М. , Спиллантини М.Г., Дель Тредичи К., Браак Х. (январь 2013 г.). «100 лет патологии Леви». Обзоры природы. Неврология . 9 (1): 13–24. дои : 10.1038/nrneurol.2012.242 . ПМИД 23183883 . S2CID 12590215 .
- ^ Клавагера Ф., Хенч Дж., Гедерт М. , Толнай М. (февраль 2015 г.). «Приглашенный обзор: прионоподобная передача и распространение тау-патологии». Невропатология и прикладная нейробиология . 41 (1): 47–58. дои : 10.1111/nan.12197 . ПМИД 25399729 . S2CID 45101893 .
- ^ Перейти обратно: а б Манн Д.М., Сноуден Дж.С. (ноябрь 2017 г.). «Лобно-височная долевая дегенерация: Патогенез, патология и пути к фенотипу» . Патология головного мозга . 27 (6): 723–736. дои : 10.1111/bpa.12486 . ПМК 8029341 . ПМИД 28100023 .
- ^ Град Л.И., Фернандо С.М., Кэшман Н.Р. (май 2015 г.). «От молекулы к молекуле и от клетки к клетке: прионоподобные механизмы при боковом амиотрофическом склерозе». Нейробиология болезней . 77 : 257–65. дои : 10.1016/j.nbd.2015.02.009 . ПМИД 25701498 . S2CID 18510138 .
- ^ Людольф А.С., Бреттшнайдер Дж., Вейсхаупт Дж.Х. (октябрь 2012 г.). «Боковой амиотрофический склероз». Современное мнение в неврологии . 25 (5): 530–5. дои : 10.1097/WCO.0b013e328356d328 . ПМИД 22918486 .
- ^ Орр Х.Т., Зогби Х.Ю. (июль 2007 г.). «Нарушения тринуклеотидных повторов». Ежегодный обзор неврологии . 30 (1): 575–621. дои : 10.1146/annurev.neuro.29.051605.113042 . ПМИД 17417937 .
- ^ Алмейда Б., Фернандес С., Абреу И.А., Маседо-Рибейро С. (2013). «Тринуклеотидные повторы: структурная перспектива» . Границы в неврологии . 4 : 76. doi : 10.3389/fneur.2013.00076 . ПМК 3687200 . ПМИД 23801983 .
- ^ Spinner NB (март 2000 г.). «КАДАСИЛ: дефект передачи сигналов Notch или проблема накопления белка?» . Журнал клинических исследований . 105 (5): 561–2. дои : 10.1172/JCI9511 . ПМЦ 292459 . ПМИД 10712425 .
- ^ Куинлан Р.А., Бреннер М., Голдман Дж.Э., Мессинг А. (июнь 2007 г.). «GFAP и его роль в болезни Александера» . Экспериментальные исследования клеток . 313 (10): 2077–87. doi : 10.1016/j.yexcr.2007.04.004 . ПМК 2702672 . ПМИД 17498694 .
- ^ Ито Д., Сузуки Н. (январь 2009 г.). «Сейпинопатия: новое заболевание, связанное со стрессом эндоплазматической сети» . Мозг . 132 (Часть 1): 8–15. дои : 10.1093/brain/awn216 . ПМИД 18790819 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа Сайп Дж.Д., Бенсон М.Д., Буксбаум Дж.Н., Икеда С.И., Мерлини Дж., Сараива М.Дж., Вестермарк П. (декабрь 2016 г.). «Амилоидные фибрилловые белки и амилоидоз: химическая идентификация и клиническая классификация, Руководство по номенклатуре Международного общества амилоидоза, 2016 г.» . Амилоид . 23 (4): 209–213. дои : 10.1080/13506129.2016.1257986 . ПМИД 27884064 .
- ^ Ломас Д.А., Каррелл Р.В. (октябрь 2002 г.). «Серпинопатии и конформационные деменции». Обзоры природы Генетика . 3 (10): 759–68. дои : 10.1038/nrg907 . ПМИД 12360234 . S2CID 21633779 .
- ^ Мукерджи А., Сото С. (май 2017 г.). «Прионоподобные белковые агрегаты и диабет 2 типа» . Перспективы Колд-Спринг-Харбора в медицине . 7 (5): а024315. doi : 10.1101/cshperspect.a024315 . ПМЦ 5411686 . ПМИД 28159831 .
- ^ Асканас В., Энгель В.К. (январь 2006 г.). «Миозит с тельцами включения: миодегенеративное конформационное нарушение, связанное с абетой, неправильным сворачиванием белка и ингибированием протеасом». Неврология . 66 (2 Приложение 1): С39–48. дои : 10.1212/01.wnl.0000192128.13875.1e . ПМИД 16432144 . S2CID 24365234 .
- ^ Экройд Х., Карвер Дж. А. (январь 2009 г.). «Белки-кристаллины и амилоидные фибриллы» . Клеточные и молекулярные науки о жизни . 66 (1): 62–81. дои : 10.1007/s00018-008-8327-4 . ПМЦ 11131532 . ПМИД 18810322 . S2CID 6580402 . Архивировано из оригинала 23 июля 2018 г. Проверено 15 сентября 2021 г.
- ^ Сургучев А, Сургучев А (январь 2010 г.). «Конформационные заболевания: глядя в глаза». Бюллетень исследований мозга . 81 (1): 12–24. дои : 10.1016/j.brainresbull.2009.09.015 . ПМИД 19808079 . S2CID 38832894 .
- ^ Уильгол С.К., Рамнарайн Н., Кэррингтон П., Ли И.М., Блэк М.М. (май 1998 г.). «Цитокератины при первичном кожном амилоидозе». Австралазийский журнал дерматологии . 39 (2): 81–5. дои : 10.1111/j.1440-0960.1998.tb01253.x . ПМИД 9611375 . S2CID 25820489 .
- ^ Яниг Э., Штумптнер С., Фуксбихлер А., Денк Х., Затлукал К. (март 2005 г.). «Взаимодействие стрессовых белков с неправильно свернутыми кератинами». Европейский журнал клеточной биологии . 84 (2–3): 329–39. дои : 10.1016/j.ejcb.2004.12.018 . ПМИД 15819411 .
- ^ Д'Суза А., Тайс Дж.Д., Врана Дж.А., Доган А. (июнь 2014 г.). «Фармацевтический амилоидоз, связанный с подкожным введением инсулина и энфувиртида» . Амилоид . 21 (2): 71–5. дои : 10.3109/13506129.2013.876984 . ПМК 4021035 . ПМИД 24446896 .
- ^ Мэн Икс, Клюс Дж., Каргас В., Ван Икс, Форд Р.С. (январь 2017 г.). «Регулятор трансмембранной проводимости муковисцидоза (CFTR) и его стабильность» . Клеточные и молекулярные науки о жизни . 74 (1): 23–38. дои : 10.1007/s00018-016-2386-8 . ПМК 5209436 . ПМИД 27734094 .
- ^ Стюарт М.Дж., Нагель Р.Л. (2004). "Серповидно-клеточная анемия". Ланцет . 364 (9442): 1343–60. дои : 10.1016/S0140-6736(04)17192-4 . ПМИД 15474138 . S2CID 8139305 .
- ^ Бернштейн А.М., Ритч Р., Волосин Дж.М. (июль 2018 г.). «Синдром эксфолиации: болезнь аутофагии и протеопатии LOXL1» . Журнал глаукомы . 27 (Дополнение 1): С44–С53. doi : 10.1097/IJG.0000000000000919 . ПМК 6028293 . ПМИД 29547474 .
- ^ Перейти обратно: а б с Пепис МБ (2006). "Амилоидоз". Анну Рев Мед . 57 : 223–241. дои : 10.1146/annurev.med.57.121304.131243 . ПМИД 16409147 .
- ^ Перейти обратно: а б Хольцман Д.М., Моррис Дж.К., Гоут А.М. (2011). «Болезнь Альцгеймера: вызов второго века» . Научный перевод Мед . 3 (77): 77ср1. doi : 10.1126/scitranslmed.3002369 . ПМК 3130546 . ПМИД 21471435 .
- ^ Пепис МБ (2001). «Патогенез, диагностика и лечение системного амилоидоза» . Фил Транс Р. Сок Лонд Б. 356 (1406): 203–211. дои : 10.1098/rstb.2000.0766 . ПМК 1088426 . ПМИД 11260801 .
- ^ Уокер LC, ЛеВин Х. третий (2002). «Протеопатия: следующий терапевтический рубеж?». Curr Opin по расследованию наркотиков . 3 (5): 782–7. ПМИД 12090553 .
- ^ Брачинский А.К., Шульц Ю.Б., Бах Дж.П. (2017). «Стратегии вакцинации при тауопатиях и синуклеинопатиях» . Дж. Нейрохем . 143 (5): 467–488. дои : 10.1111/jnc.14207 . ПМИД 28869766 .
- ^ Кляйн В.Л. (2013). «Синаптотоксические олигомеры амилоида-β: молекулярная основа причины, диагностики и лечения болезни Альцгеймера?». Дж. Альцгеймерс Дис . 33 (Приложение 1): С49-65. дои : 10.3233/JAD-2012-129039 . ПМИД 22785404 .
- ^ Перейти обратно: а б с Бадар Т., Д'Суза А., Хари П. (2018). «Последние достижения в понимании и лечении амилоидоза легкой цепи иммуноглобулина» . F1000Рес . 7 : 1348. doi : 10.12688/f1000research.15353.1 . ПМК 6117860 . ПМИД 30228867 .
- ^ Карвальо А., Роша А., Лобату Л. (2015). «Трансплантация печени при транстиретиновом амилоидозе: проблемы и проблемы» . Транспл печени . 21 (3): 282–292. дои : 10.1002/lt.24058 . ПМИД 25482846 .
- ^ Зур О.Б., Херлениус Г., Фриман С., Эрикзон Б.Г. (2000). «Трансплантация печени при наследственном транстиретиновом амилоидозе» . Транспл печени . 6 (3): 263–276. дои : 10.1053/lv.2000.6145 . ПМИД 10827225 .
- ^ Перейти обратно: а б Зур О.Б., Ларссон М., Эрикзон Б.Г., Вильчек Х.Е. и др. (2016). «Выживаемость после трансплантации у пациентов с мутациями, отличными от Val30Met: выдержки из Всемирного реестра трансплантатов FAP» . Трансплантация . 100 (2): 373–381. дои : 10.1097/TP.0000000000001021 . ПМК 4732012 . ПМИД 26656838 .
- ^ Коэльо Т. и др. (2016). «Механизм действия и клиническое применение тафамидиса при наследственном транстиретиновом амилоидозе» . Нейрол Тер . 5 (1): 1–25. дои : 10.1007/s40120-016-0040-x . ПМЦ 4919130 . ПМИД 26894299 .
- ^ Ю Д и др. (2012). «Одноцепочечные РНК используют РНКи для мощного и аллель-селективного ингибирования экспрессии мутантного хантингтина» . Клетка . 150 (5): 895–908. дои : 10.1016/j.cell.2012.08.002 . ПМЦ 3444165 . ПМИД 22939619 .
- ^ Нуволоне М., Мерлини Дж. (2017). «Новые терапевтические цели, которые в настоящее время исследуются для лечения системного амилоидоза». Экспертное мнение. Цели . 21 (12): 1095–1110. дои : 10.1080/14728222.2017.1398235 . ПМИД 29076382 . S2CID 46766370 .
- ^ Джозеф Н.С., Кауфман Дж.Л. (2018). «Новые подходы к лечению AL-амилоидоза». Карр Гематол Малиг Респ . 13 (3): 212–219. дои : 10.1007/s11899-018-0450-1 . ПМИД 29951831 . S2CID 49475930 .
