Изобарный процесс
Эта статья нуждается в дополнительных цитатах для проверки . ( октябрь 2016 г. ) |
| Термодинамика |
|---|
 |
В термодинамике изобарный процесс — это тип термодинамического процесса , при котором давление системы работу остается постоянным: Δ P = 0. Тепло , передаваемое системе, совершает , но также изменяет внутреннюю энергию ( U ) системы. В этой статье для обозначения работы используется соглашение о физических знаках, согласно которому положительная работа — это работа, совершаемая системой . Используя это соглашение, согласно первому закону термодинамики ,

где W — работа, U — внутренняя энергия, а Q — тепло. [1] Работа давление- объем в замкнутой системе определяется как:
где Δ означает изменение в течение всего процесса, тогда как d обозначает дифференциал. Поскольку давление постоянно, это означает, что
- .
Применяя закон идеального газа , это становится
где R представляет собой газовую константу , а n представляет количество вещества нет фазового перехода , которое, как предполагается, остается постоянным (например, во время химической реакции ). По о равнораспределении теореме [2] изменение внутренней энергии связано с температурой системы соотношением
- ,
где c V, m — молярная теплоемкость при постоянном объеме .
Подстановка последних двух уравнений в первое уравнение дает:
где c P — молярная теплоемкость при постоянном давлении .
Удельная теплоемкость [ править ]
Чтобы найти молярную удельную теплоемкость рассматриваемого газа, следующие уравнения применимы для любого обычного газа, который является калорически совершенным. Свойство γ называется либо показателем адиабаты , либо коэффициентом теплоемкости . может использоваться k В некоторых опубликованных источниках вместо γ .
Молярная изохорная удельная теплоемкость:
- .
Молярная изобарная удельная теплоемкость:
- .
Значения γ : γ = 7/5 воздух , для двухатомных газов, таких как и его основные компоненты и γ = 5/3 таких . для одноатомных газов, как газы благородные В этих особых случаях формулы для удельной теплоемкости уменьшаются:
Одноатомный:
- и
Двухатомный:
- и
Изобарный процесс изображается на P – V- диаграмме в виде прямой горизонтальной линии, соединяющей начальное и конечное термостатические состояния. Если процесс движется вправо, то это расширение. Если процесс движется влево, то это сжатие.
Соглашение о подписании трудовых договоров [ править ]
Мотивация принятия особых соглашений о знаках в термодинамике исходит из раннего развития тепловых двигателей. При проектировании теплового двигателя цель состоит в том, чтобы система производила и обеспечивала рабочую мощность. Источником энергии в тепловой машине является тепловложение.
- Если объем сжимается (Δ V = конечный объем − начальный объем <0), то W <0. То есть при изобарном сжатии газ совершает отрицательную работу, либо окружающая среда совершает положительную работу. Другими словами, окружающая среда оказывает положительное воздействие на газ.
- Если объем расширяется (Δ V = конечный объем - начальный объем > 0), то W > 0. То есть во время изобарного расширения газ совершает положительную работу или, что то же самое, окружающая среда совершает отрицательную работу. Другими словами, газ оказывает положительное воздействие на окружающую среду.
- Если в систему добавляется тепло, то Q > 0. То есть во время изобарного расширения/нагрева к газу добавляется положительное тепло или, что то же самое, окружающая среда получает отрицательное тепло. Другими словами, газ получает положительное тепло из окружающей среды.
- Если система отдает тепло, то Q < 0. То есть при изобарном сжатии/охлаждении к газу добавляется отрицательное тепло или, что то же самое, окружающая среда получает положительное тепло. Другими словами, окружающая среда получает положительное тепло от газа.
Определение энтальпии [ править ]
Изохорный процесс описывается уравнением Q = Δ U . Было бы удобно иметь аналогичное уравнение для изобарических процессов. Подставив второе уравнение в первое, получим
Величина U + pV является функцией состояния, поэтому ей можно дать имя. Она называется энтальпией и обозначается H. как Поэтому изобарный процесс можно более кратко описать как
- .
Энтальпия и изохорная удельная теплоемкость являются очень полезными математическими конструкциями, поскольку при анализе процесса в открытой системе возникает ситуация нулевой работы, когда жидкость течет при постоянном давлении. В открытой системе энтальпия — это величина, которую полезно использовать для отслеживания энергосодержания жидкости.
Примеры изобарических процессов [ править ]
Обратимое расширение идеального газа можно использовать как пример изобарного процесса. [3] Особый интерес представляет способ преобразования тепла в работу, когда расширение осуществляется при различных давлениях рабочего/окружающего газа.
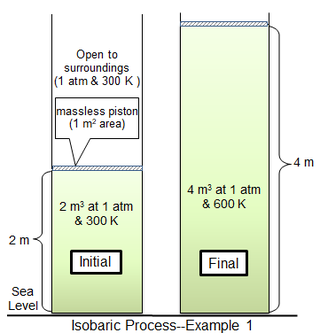
В первом примере процесса цилиндрическая камера площадью 1 м 2 по площади вмещает 81,2438 моль идеального двухатомного газа с молекулярной массой 29 г моль. −1 при 300 К. Окружающий газ находится при давлении 1 атм и температуре 300 К и отделен от баллонного газа тонким поршнем. Для предельного случая безмассового поршня газ в цилиндре также находится под давлением 1 атм и начальным объемом 2 м. 3 . Тепло медленно добавляется до тех пор, пока температура газа не станет однородной 600 К, после чего объем газа составит 4 м. 3 а поршень находится на 2 м выше своего исходного положения. Если движение поршня достаточно медленное, то давление газа в каждый момент времени будет иметь практически одно и то же значение ( p сис = 1 атм) на всем протяжении.
Для термически совершенного двухатомного газа молярная удельная теплоемкость при постоянном давлении ( c p ) равна 7 / 2 Р или 29,1006 Дж моль −1 ты −1 . Молярная теплоемкость при постоянном объеме ( c v ) равна 5 / 2 Р или 20,7862 Дж моль −1 ты −1 . Соотношение из двух теплоемкостей составляет 1,4. [4]
Теплота Q, необходимая для нагрева газа от 300 до 600 К, равна
- .
Увеличение внутренней энергии происходит
Поэтому,
Также
, что, конечно, идентично разнице между Δ H и Δ U .
Здесь работа полностью поглощается расширением окружающей среды . Из общего количества приложенного тепла (709,3 кДж) выполненная работа (202,7 кДж) составляет около 28,6% от подведенного тепла.

Второй технологический пример аналогичен первому, за исключением того, что безмассовый поршень заменен на поршень массой 10332,2 кг, что увеличивает давление баллонного газа в два раза до 2 атм. Объем газа в баллоне тогда составит 1 м3. 3 при начальной температуре 300 К. Тепло медленно добавляется до тех пор, пока температура газа не станет однородной 600 К, после чего объем газа составит 2 м. 3 а поршень находится на 1 м выше своего исходного положения. Если движение поршня достаточно медленное, то давление газа в каждый момент времени будет иметь практически одно и то же значение ( p сис = 2 атм) на протяжении всего времени.
Поскольку энтальпия и внутренняя энергия не зависят от давления,
- и .
Как и в первом примере, в работу преобразуется около 28,6% подведенного тепла. Но здесь работа применяется двумя разными способами: частично за счет расширения окружающей атмосферы и частично за счет поднятия 10 332,2 кг на расстояние h , равное 1 м. [5]
Таким образом, половина работы поднимает массу поршня (работа силы тяжести, или «полезная» работа), а другая половина расширяет окружающую среду.
Результаты этих двух примеров процесса иллюстрируют разницу между долей тепла, преобразованной в полезную работу ( мг Δ ч), и долей, преобразованной в работу давление-объем, выполненную против окружающей атмосферы. Полезная работа приближается к нулю, когда давление рабочего газа приближается к давлению окружающего газа, тогда как максимальная полезная работа достигается при отсутствии давления окружающего газа. Отношение всей выполненной работы к подводу тепла для идеального изобарного расширения газа равно
плотности переменной зрения Точка
Данное количество (масса m ) газа в изменяющемся объеме вызывает изменение плотности ρ . В этом контексте закон идеального газа записывается
где T — термодинамическая температура , а M — молярная масса . Когда R и M принимаются постоянными, тогда давление P плотности-температуры может оставаться постоянным, поскольку квадрант ( ρ , T ) подвергается отображению сжатия . [6]
Этимология [ править ]
Прилагательное «изобарический» происходит от греческих слов ἴσος ( isos ), означающих «равный», и βάρος ( baros ), означающих «вес».
См. также [ править ]
- Адиабатический процесс
- Циклический процесс
- Изохорный процесс
- Изотермический процесс
- Политропный процесс
- Изентальпический процесс
Ссылки [ править ]
- ^ «Первый закон термодинамики» . www.grc.nasa.gov . Проверено 19 октября 2017 г.
- ^ Эйланд, Питер. «Лекция 9 (Теория равнораспределения)» . www.insula.com.au .
- ^ Гаскелл, Дэвид Р., 1940- (2008). Введение в термодинамику материалов (5-е изд.). Нью-Йорк: Тейлор и Фрэнсис. п. 32. ISBN 978-1-59169-043-6 . OCLC 191024055 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ^ «Теплоемкость идеальных газов» . ccrma.stanford.edu . Проверено 5 октября 2018 г.
- ^ ДеВо, Ховард. (2001). Термодинамика и химия . Река Аппер-Сэдл, Нью-Джерси: Прентис-Холл. п. 58. ИСБН 0-02-328741-1 . OCLC 45172758 .
- ^ Олвер, Питер Дж. (1999). Классическая теория инвариантов . Кембридж, Великобритания: Издательство Кембриджского университета. п. 217. ИСБН 978-1-107-36236-9 . OCLC 831669750 .







































