Термодинамический процесс
| Термодинамика |
|---|
 |
Классическая термодинамика рассматривает три основных вида термодинамических процессов : (1) изменения в системе, (2) циклы в системе и (3) проточные процессы.
(1) Термодинамический процесс – это процесс, при котором изменяется термодинамическое состояние системы. Изменение системы определяется переходом от начального к конечному состоянию термодинамического равновесия . В классической термодинамике реальный ход процесса не является первостепенным и часто игнорируется. Состояние термодинамического равновесия сохраняется неизменным, если оно не прерывается термодинамической операцией, инициирующей термодинамический процесс. Каждое из состояний равновесия соответственно полностью определяется подходящим набором термодинамических переменных состояния, которые зависят только от текущего состояния системы, а не от пути, пройденного процессами, которые создают это состояние. В общем, в ходе реального термодинамического процесса система может проходить через физические состояния, которые невозможно описать как термодинамические состояния, поскольку они далеки от внутреннего термодинамического равновесия. Однако неравновесная термодинамика рассматривает процессы, в которых состояния системы близки к термодинамическому равновесию, и стремится описать непрерывное движение по пути с определенными скоростями прогресса.
В качестве полезного теоретического, но фактически физически не реализуемого предельного случая можно представить, что процесс протекает практически бесконечно медленно или достаточно плавно, чтобы его можно было описать непрерывным путем равновесных термодинамических состояний, когда его называют «квазистатическим» . " процесс. Это теоретическое упражнение по дифференциальной геометрии, а не описание реально возможного физического процесса; в этом идеализированном случае расчет может быть точным.
Действительно возможный или реальный термодинамический процесс, при внимательном рассмотрении, включает в себя трение . Это контрастирует с теоретически идеализированными, воображаемыми или ограничивающими, но фактически невозможными квазистатическими процессами, которые могут происходить с теоретической медлительностью, позволяющей избежать трения. Это также контрастирует с идеализированными процессами без трения в окружающей среде, которые можно рассматривать как включающие «чисто механические системы»; это различие близко к определению термодинамического процесса. [1]
(2) Циклический процесс проводит систему через цикл стадий, начинающихся и завершающихся в некотором конкретном состоянии. Описания поэтапных состояний системы не являются основной задачей. Основной проблемой являются суммы входов и выходов материи и энергии в цикл. Циклические процессы были важным концептуальным устройством на заре термодинамических исследований, когда разрабатывалась концепция термодинамической переменной состояния.
, определяемый потоками через систему, (3) Процесс течения представляет собой устойчивое состояние потоков в сосуд и из него с определенными свойствами стенок. Внутреннее состояние содержимого сосуда не является первоочередной проблемой. Количества, имеющие первостепенное значение, описывают состояния притока и оттока материалов, а также, с другой стороны, передачу тепла, работы, кинетической и потенциальной энергии сосуду. Проточные процессы представляют интерес в технике.
Виды процесса [ править ]
Циклический процесс [ править ]
Циклический процесс, определяемый циклом перемещений в систему и из системы, описывается количествами, передаваемыми на нескольких стадиях цикла. Описания стадийных состояний системы могут представлять мало или даже не представлять интереса. Цикл — это последовательность небольшого количества термодинамических процессов, которые бесконечно часто, неоднократно возвращают систему в исходное состояние. При этом не обязательно описывать сами постановочные состояния, поскольку интерес представляют именно трансферы. Аргументируется, что если цикл может повторяться бесконечно часто, то можно предположить, что состояния рекуррентно не изменяются. Состояние системы во время нескольких стадийных процессов может представлять еще меньший интерес, чем точная природа повторяющихся состояний. Однако если несколько стадийных процессов идеализированы и квазистатичны, тогда цикл описывается путем непрерывного развития состояний равновесия.
Поток процесса [ править ]
Процесс течения, определяемый потоками через систему, представляет собой устойчивое состояние потока в сосуд и из него с определенными свойствами стенок. Внутреннее состояние содержимого сосуда не является первоочередной проблемой. Количества, имеющие первостепенное значение, описывают состояния притока и оттока материалов, а также, с другой стороны, передачу тепла, работы, кинетической и потенциальной энергии сосуду. Состояния материалов притока и оттока состоят из их внутренних состояний, а также их кинетической и потенциальной энергии как целых тел. Очень часто величины, описывающие внутренние состояния входных и выходных материалов, оцениваются в предположении, что они представляют собой тела, находящиеся в собственных состояниях внутреннего термодинамического равновесия. Поскольку допускаются быстрые реакции, термодинамическая трактовка может быть приближенной, а не точной.
Цикл квазистатических процессов [ править ]
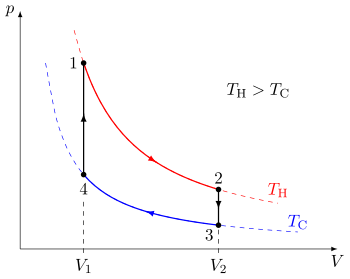
Квазистатический термодинамический процесс можно визуализировать, графически показав системы путь идеализированных изменений переменных состояния . В примере показан цикл, состоящий из четырех квазистатических процессов. Каждый процесс имеет четко определенные начальную и конечную точки в пространстве состояний давление-объем . В этом конкретном примере процессы 1 и 3 являются изотермическими , тогда как процессы 2 и 4 являются изохорными . является PV-диаграмма особенно полезной визуализацией квазистатического процесса, поскольку площадь под кривой процесса представляет собой объем работы , выполненной системой во время этого процесса. Таким образом, работа считается переменной процесса , поскольку ее точное значение зависит от конкретного пути, пройденного между начальной и конечной точками процесса. Аналогично, тепло может передаваться во время процесса, и оно тоже является переменной процесса.
Процессы сопряженных переменных [ править ]
Часто бывает полезно сгруппировать процессы в пары, в которых каждая переменная, сохраняемая постоянной, является одним из членов сопряженной пары.
Давление – объем [ править ]
Сопряженная пара давление-объем связана с передачей механической энергии в результате работы.
- Изобарный процесс происходит при постоянном давлении. Примером может служить наличие подвижного поршня в цилиндре, так что давление внутри цилиндра всегда соответствует атмосферному давлению, хотя оно отделено от атмосферы. Другими словами, система динамически связана подвижной границей с резервуаром постоянного давления.
- Изохорный процесс — это процесс, в котором объем поддерживается постоянным, в результате чего механическая фотоэлектрическая работа, совершаемая системой, будет равна нулю. С другой стороны, работа в системе может выполняться изохорно, например, с помощью вала, который приводит в движение вращающуюся лопасть, расположенную внутри системы. Отсюда следует, что для простой системы с одной переменной деформации любая тепловая энергия, передаваемая системе извне, будет поглощаться как внутренняя энергия. Изохорный процесс также известен как изометрический процесс или изоволюметрический процесс. Примером может служить помещение закрытой консервной банки с материалом в огонь. В первом приближении банка не будет расширяться, и единственным изменением будет то, что содержимое приобретет внутреннюю энергию, о чем свидетельствует увеличение температуры и давления. Математически, . Система динамически изолирована жесткой границей от окружающей среды.
Температура – энтропия [ править ]
Сопряженная пара температура-энтропия связана с передачей энергии, особенно для закрытой системы.
- Изотермический процесс протекает при постоянной температуре. Примером может служить закрытая система, погруженная в и термически связанная большую ванну с постоянной температурой с ней. Энергия, полученная системой в результате проделанной над ней работы, теряется в ванне, так что ее температура остается постоянной.
- Адиабатический процесс — это процесс, в котором отсутствует передача вещества или тепла, поскольку теплоизолирующая стенка отделяет систему от окружающей среды. Чтобы процесс был естественным, либо (а) работа должна быть совершена над системой с конечной скоростью, чтобы внутренняя энергия системы увеличилась; энтропия системы возрастает, даже если она теплоизолирована; или (б) система должна совершить работу с окружающей средой, энтропия которой затем увеличивается, а также получать энергию от системы.
- Изэнтропический процесс обычно определяют как идеализированный квазистатический обратимый адиабатический процесс передачи энергии как работы. В противном случае для процесса с постоянной энтропией, если работа совершается необратимо, необходима передача тепла, чтобы процесс не был адиабатическим, и необходим точный искусственный механизм управления; следовательно, это не обычный природный термодинамический процесс.
Химический потенциал число - частиц
В описанных выше процессах предполагалось, что границы также непроницаемы для частиц. В противном случае мы можем предположить, что границы являются жесткими, но проницаемыми для одного или нескольких типов частиц. Аналогичные соображения справедливы и для сопряженной пары химический потенциал – число частиц , которая связана с передачей энергии посредством этой передачи частиц.
- В процессе постоянного химического потенциала система переноса частиц соединена границей, проницаемой для частиц, с резервуаром с постоянным мкм.
- Сопряжение здесь представляет собой процесс с постоянным числом частиц. Это процессы, описанные чуть выше. В результате переноса частиц энергия не добавляется и не вычитается из системы. Система изолирована от окружающей среды при переносе частиц с помощью границы, которая непроницаема для частиц, но допускает передачу энергии в виде работы или тепла. Именно эти процессы определяют термодинамическую работу и теплоту, и для них система называется замкнутой .
потенциалы Термодинамические
Любой из термодинамических потенциалов может поддерживаться постоянным во время процесса. Например:
Политропные процессы [ править ]
Политропный процесс – это термодинамический процесс, подчиняющийся соотношению:
где P — давление, V — объем, n — любое действительное число («индекс политропы»), а C — константа. Это уравнение можно использовать для точной характеристики процессов в определенных системах , в частности, , но в некоторых сжатия или расширения газа случаях жидкостей и твердых тел .
классифицируемые вторым термодинамики законом , Процессы
Согласно Планку, можно выделить три основных класса термодинамических процессов: естественные, фиктивно обратимые и невозможные или неестественные. [2] [3]
Естественный процесс [ править ]
В природе происходят только естественные процессы. Для термодинамики естественным процессом является необратимый перенос между системами, который увеличивает сумму их энтропий. [2] Естественные процессы могут происходить самопроизвольно при снятии ограничения или при какой-либо другой термодинамической операции или могут запускаться в метастабильной или нестабильной системе, как, например, при конденсации пересыщенного пара. [4] Планк подчеркивал возникновение трения как важную характеристику естественных термодинамических процессов, которые включают передачу вещества или энергии между системой и окружающей средой.
Эффективно обратимый процесс
Для описания геометрии графических поверхностей, иллюстрирующих равновесные отношения между термодинамическими функциями состояния, никто не может мысленно думать о так называемых «обратимых процессах». Это удобные теоретические объекты, прослеживающие пути по графическим поверхностям. Они называются «процессами», но не описывают естественные процессы, которые всегда необратимы. Поскольку точки на путях являются точками термодинамического равновесия, принято думать о «процессах», описываемых путями, как о фиктивно «обратимых». [2] Обратимые процессы всегда являются квазистатическими процессами, но обратное не всегда верно.
Неестественный процесс [ править ]
Противоестественные процессы логически мыслимы, но не происходят в природе. Если бы они произошли, они уменьшили бы сумму энтропий. [2]
Квазистатический процесс [ править ]
Квазистатический процесс — это идеализированная или вымышленная модель термодинамического «процесса», рассматриваемого в теоретических исследованиях. В физической реальности этого не происходит. Можно представить, что это происходит бесконечно медленно, так что система проходит через континуум состояний, бесконечно близких к равновесию .
См. также [ править ]
Ссылки [ править ]
- ^ Рейсс, Х. (1965). «Методы термодинамики» , Блейсделл, Нью-Йорк, стр. 52: «Системы без трения можно назвать чисто механическими системами, тогда как системы с трением являются термодинамическими системами».
- ↑ Перейти обратно: Перейти обратно: а б с д Гуггенхайм, Э.А. (1949/1967). Термодинамика. Расширенное лечение для химиков и физиков , пятое исправленное издание, Северная Голландия, Амстердам, с. 12.
- ^ Тиса, Л. (1966). Обобщенная термодинамика , MIT Press, Кембридж, Массачусетс, с. 32.
- ^ Планк, М. (1897/1903). Трактат по термодинамике , перевод А. Огга, Longmans, Green & Co., Лондон , с. 82.
Дальнейшее чтение [ править ]
- Физика для ученых и инженеров - с современной физикой (6-е издание), П. А. Типлер, Г. Моска, Фриман, 2008 г., ISBN 0-7167-8964-7
- Энциклопедия физики (2-е издание), Р.Г. Лернер , Г.Л. Тригг, издательство VHC, 1991, ISBN 3-527-26954-1 (издательская компания), ISBN 0-89573-752-3 (VHC Inc.)
- Энциклопедия физики МакГроу Хилла (2-е издание), CB Parker, 1994, ISBN 0-07-051400-3
- Физика с современными приложениями , Л. Х. Гринберг, Holt-Saunders International WB Saunders and Co, 1978, ISBN 0-7216-4247-0
- «Основные принципы физики» , П.М. Уилан, М.Дж. Ходжесон, 2-е издание, 1978 г., Джон Мюррей, ISBN 0-7195-3382-1
- Термодинамика, От концепций к приложениям (2-е издание), А. Шавит, К. Гутфингер, CRC Press (Taylor and Francisco Group, США), 2009 г., ISBN 9781420073683
- Химическая термодинамика , DJG Ives, Университет химии, Macdonald Technical and Scientific, 1971, ISBN 0-356-03736-3
- Элементы статистической термодинамики (2-е издание), Л. К. Нэш, Принципы химии, Аддисон-Уэсли, 1974, ISBN 0-201-05229-6
- Статистическая физика (2-е издание), Ф. Мандл, Манчестерская физика, John Wiley & Sons, 2008 г., ISBN 9780471915331
















