Флавонол 3-O-глюкозилтрансфераза
| Флавонол 3-O-глюкозилтрансфераза | |||
|---|---|---|---|
 Флавонол 3-O-глюкозилтрансфераза | |||
| Идентификаторы | |||
| ЕС №. | 2.4.1.91 | ||
| CAS №. | 50812-18-5 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| Джин Онтология | Друг / Quickgo | ||
| |||
В фермере флавонол 3-O-глюкозилтрансфераза ( EC 2.4.1.91 )-это фермент , который катализирует химическую реакцию
- UDP-глюкоза + флавонол Udp + a flavonol 3-o-beta-d-глюкозид
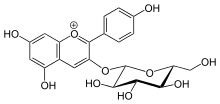
Таким образом, двумя субстратами этого фермента являются UDP-глюкоза и флавонол , тогда как его двумя продуктами являются UDP и флавонол 3-O-бета-D-глюкозид . Флавоноиды, которые могут действовать в качестве субстратов в рамках этой реакции, включают кверцетин, кампферол, дигидрокэмпферол, кампферид, физетин и изорхамнетин. Флавонол 3-O-глюкозилтрансфераза представляет собой фермент переноса гексозильной группы. [ 1 ]
Этот фермент известен под систематическим названием Upd-Glucose: Flavonol 3-Od глюкозилтрансфераза, и он участвует в биосинтезе флавоноидов и вызывает образование антоцианинов . Антоцианины производят фиолетовый цвет в растительных тканях, в которых они присутствуют. [ 2 ]
Это фермент, который можно найти, особенно в винограде ( Vitis vinifera ). [ 3 ] Этот фермент находится и во многих других растениях, таких как Snapdragons ( Antirrhinum majus ), капуста ( Brassica oleracea ) и грейпфрут ( Citrus x paradisi ). [ 4 ]
Пути
[ редактировать ]Этот фермент участвует в биосинтезе вторичных метаболитов. Первичной функцией этого фермента в его пути является связывание глюкозида с молекулой флавонола, образуя флавонол 3-O-глюкозид. [ 5 ] Именно благодаря этому механизму фермент превращает антоцианидины в антоцианины как часть фенилпропаноидного пути. Одним из конкретных примеров может быть действие этого ферментов на пеларгонидин. Флавонол 3-O-глюкозилтрансфераза связывает глюкозид с этим белком, делая пеларгонидин 3-O-глюкозид. Этот фермент также участвует в пути флавонового гликозида и модификации дафнетина в некоторых организмах. Роль фермента в этих путях опять же заключается в том, чтобы связывать глюкозид с субстратом для построения флавонола 3-O-глюкозида. [ 6 ]

Номенклатура
[ редактировать ]Этот фермент относится к семейству гликозилтрансфераз , в частности, гексозилтрансферазы. Систематическим названием этого класса ферментов является UDP-глюкоза: флавонол 3-od-глюкозилтрансфераза . Другие общие имена включают в себя:
- GTI ,
- уридинофосфоглюкозо-флавонол 3-O-глюкозилтрансфераза,
- UDP-глюкоза: флавонол 3-O-глюкозилтрансфераза и
- UDP-глюкоза: флавоноид 3-O-глюкозилтрансфераза (UFGT).
Среди них UFGT делится на UDP-глюкозу: флавоноид 3-O-глюкозилтрансфераза (UF3GT) и UDP-глюкоза: флавоноидная 5-O-глюкозилтрансфераза (UF5GT), которые ответственны за глюкозилирование антоцианинов для получения стабильных молекул. [ 7 ]
Ингибиторы и структура фермента
[ редактировать ]Некоторые из ингибиторов этого фермента включают CACL 2 , COCL 2 , CU +2 , Cucl 2 , KCL, MG +2 и мн +2 . [ 8 ] Основным остатком активного сайта этого фермента является ASP181, что определено в исследованиях того, как мутации влияют на способность фермента. [ 9 ] Существует несколько документов кристаллической структуры флавонол 3-O-глюкозилтрансферазы (2C1X, 2C1Z и 2C9Z), [ 10 ] И, основываясь на этих визуализациях фермента, в четвертичной структуре молекулы есть только одна субъединица.
Ссылки
[ редактировать ]- ^ http://brenda-enzymes.info/enzyme.php ?
- ^ DOONER, HK & NELSON, OE BIOCHEM GENET (1977) 15: 509. Два : 10.1007/bf00520194
- ^ Kobayashi S, Ishimaru M, Ding CK, Yakushiji H, Goto N (февраль 2001 г.). «Сравнение UDP-глюкозы: флавоноидные гены 3-O-глюкозилтрансфераза (UFGT) между белым виноградом (Vitis Vinifera) и их спортом с красной кожей». Plant Sci . 160 (3): 543–550. doi : 10.1016/s0168-9452 (00) 00425-8 . PMID 11166442 .
- ^ «Бренда - Информация о ЕС 2.4.1.91 - Флавонол 3 -O -глюкозилтрансфераза» .
- ^ http://brenda-enzymes.info/enzyme.php ?
- ^ «Кегг фермент: 2.4.1.115» . www.genome.jp . Получено 2016-12-06 .
- ^ Zhao DQ, Han CX, GE JT, Tao J (ноябрь 2012 г.). «Выделение UDP-глюкозы: флавоноид 5-O-глюкозилтрансфераза и анализ экспрессии генов биосинтеза антоцианов в травянистых пионах (Paeonia Lactiflora pall.)» . Электронный журнал биотехнологии . 15 (6). doi : 10.2225/vol15-issue6-fulltext-7 .
- ^ Шомбург, профессор Дитмар; Schomburg, д -р Ida, Eds. (1 января 2006 г.). «Флавонол 3-O-глюкозилтрансфераза». Справочник Springer по ферментам . Тол. 32. Springer Berlin Heidelberg. С. 21–29. doi : 10.1007/978-3-540-49534-5_2 . ISBN 978-3-540-32591-8 .
- ^ Хиромото, Такеши; Хонджо, Эйджиро; Нода, Наонобу; Тамада, Таро; Казума, Кохей; Сузуки, Масахико; Блабер, Майкл; Kuroki, Ryota (2016-12-06). «Структурные основы для распознавания акцептора-субстрата UDP-глюкозы: антоцианидин 3-O-глюкозилтрансфераза из Clitoria ternatea» . Белковая наука . 24 (3): 395–407. doi : 10.1002/pro.2630 . ISSN 0961-8368 . PMC 4353365 . PMID 25556637 .
- ^ Оффен, W; Martinez-Fleites, c; Ян, м; Киат-Лим, E; Дэвис, BG; Тарлинг, Калифорния; Ford, CM; Боулз, DJ; Дэвис, GJ (2006-01-01). «Структура флавоноидной глюкозилтрансферазы выявляет основу для модификации натурального продукта растений» . Embo j . 25 (6): 1396–405. doi : 10.1038/sj.emboj.7600970 . PMC 1422153 . PMID 16482224 .
Дальнейшее чтение
[ редактировать ]- Wiermann R (1982). «Образование флавонол 3-O-дигликозидов и флавонол 3-тригликозидов с помощью ферментных экстрактов из пыльников Tulipa CV apeldoorn-характеристика и активность 3 различных о-гликозилтрансфераз во время развития пылью» . Z. Naturforsch. В 37 : 587–599. doi : 10.1515/Znc-1982-7-808 . S2CID 37241803 .
- Sutter A, Grisebach H (1973). «UDP-глюкоза: флавонол 3-0-глюкозилтрансфераза из клеточной суспензии культур петрушки». Биохим. Биофиз. Акт . 309 (2): 289–95. doi : 10.1016/0005-2744 (73) 90027-2 . PMID 4731963 .
