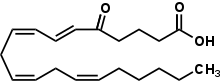
5-оксо-эйкозатетраеновая кислота
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
(6 E ,8 Z ,11 Z ,14 Z )-5-Оксойкоза-6,8,11,14-тетраеновая кислота | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| КЕГГ | |
ПабХим CID
|
|
| Характеристики | |
| С 20 Н 30 О 3 | |
| Молярная масса | 318.457 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
5-оксо-эйкозатетраеновая кислота (т.е. 5-оксо-6 E ,8 Z ,11 Z ,14 Z -эйкозатетраеновая кислота; также называемая 5-оксо-ЭТЕ и 5-оксоЭТЕ ) представляет собой неклассический эйкозаноидный метаболит арахидоновой кислоты и наиболее мощный природный член семейства агентов 5-HETE клеточных сигнальных . Как и другие клеточные сигнальные агенты, 5-оксо-ETE вырабатывается клеткой, а затем возвращается обратно, чтобы стимулировать родительскую клетку (см. Аутокринная передача сигналов ) и/или выходит из этой клетки, чтобы стимулировать близлежащие клетки (см. Паракринная передача сигналов ). 5-Оксо-ЭТЕ может стимулировать различные типы клеток, особенно лейкоциты человека , но обладает высочайшей эффективностью и способностью стимулировать лейкоциты эозинофильного типа человека. Поэтому предполагается, что он образуется во время и вносит важный вклад в формирование и прогрессирование аллергических реакций на основе эозинофилов; [ 1 ] [ 2 ] также предполагается, что 5-оксо-ЭТЕ способствует развитию воспаления , росту раковых клеток и другим патологическим и физиологическим явлениям. [ 1 ] [ 3 ]
Биохимия и производство
[ редактировать ]Наиболее распространенным способом его производства клетки вырабатывают 5-оксо-ЭТЕ в четырехэтапном пути, который включает стимул-индуцированную активацию следующего пути: а) высвобождение арахидоновой кислоты (т.е. 5Z,8Z,11Z,14Z- эйкозатетраеновая кислота) из мест ее хранения в фосфолипидах мембран за счет активации ферментов фосфолипазы А2 ; б) оксигенация этой арахидоновой кислоты активированной арахидонат-5-липоксигеназой (ALOX5) с образованием 5( S )-гидроперокси-6 E ,8 Z ,11 Z ,14 Z -эйкозатетраеновой кислоты (5( S )-HpETE); в) восстановление этого 5( S )-HpETE повсеместно распространенными клеточными пероксидазами с образованием 5( S )-гидрокси-6E , 8Z , 11Z , 14Z - эйкозатетраеновой кислоты (5( S )-HETE); и ( d ) окисление 5( S )-HETE связанным с никотинамидадениндинуклеотидфосфатом микросомами ( NADP + )-зависимый фермент дегидрогеназы, а именно 5-гидроксиэйкозаноиддегидрогеназа (5-HEDH), с образованием 5-оксо-ЭТЕ: [ 1 ]
5-HEDH обладает незначительной способностью или вообще не метаболизирует R -стереоизомер 5( S )-HETE, а именно 5( R )-HETE, в 5-оксо-ETE. Более того, он действует полностью обратимо, легко превращая 5-оксо-ЭТЕ обратно в 5( S )-НЕТЕ. Поскольку клетки обычно поддерживают очень высокий уровень НАДФН по сравнению с их НАДФ. + уровнях, они обычно практически не имеют способности превращать 5( S )-HEE в 5-оксо-ETE, а при столкновении с 5-oxo-ETE быстро метаболизируют его до 5( S )-HETE. [ 1 ] Однако клетки, подвергающиеся старению, старению, апоптозу , окислительному стрессу или другим состояниям, которые повышают уровень активных форм кислорода (например, супероксидного аниона, кислородных радикалов и пероксидов ) либо физиологически (например, человеческие фагоциты, поглощающие бактерии), либо патологически (например, подвергшиеся окислительному воздействию) В-лимфоциты ) используют НАДФ. + , имеют низкий уровень НАДФН/НАДФ + соотношения и, следовательно, легко превращают 5( S )-HETE в 5-оксо-ETE. [ 1 ] Таким образом, многие патологические состояния, связанные с окислительным стрессом, например, возникающие при быстро растущем раке, могут быть важными стимуляторами накопления 5-оксо-ЭТЕ in vivo .
5-Оксо-ETE также может быть получен из 5( S )-HpETE (и, возможно, 5( R )-HpEPE) под действием ферментов цитохрома P450 (CYP), таких как CYP1A1 , CYP1A2 , CYP1B1 и CYP2S1 . [ 4 ] из 5( S )-HETE (и, вероятно, 5( R )-HETE) путем неферментативной атаки гема или различных других дегидратирующих агентов; [ 1 ] Он также может образовываться путем превращения 5-( S )-HpETE или 5( R )-HpETE в 5-оксо-ETE под действием цитозольного белка мышиных макрофагов массой 50–60 килодальтон . [ 5 ] Вклад последних трех путей в физиологическую продукцию 5-оксо-ЭТЕ полностью не оценен.
Изомер 5-оксо-ЭТЕ, 5-оксо-(7E , 9E , 11Z , 14Z ) -эйкозатетраеновая кислота, образуется неферментативно как побочный продукт гидролиза метаболита 5-липоксгеназы, лейкотриена А4 . Этот побочный продукт отличается от 5-оксо-ETE не только положением и геометрией своих двойных связей, но и своей активностью: он стимулирует нейтрофилы человека, по-видимому, воздействуя на один или несколько рецепторов LTB4, а не на OXER1. [ 1 ] [ 6 ]
Источники тканей
[ редактировать ]Сотовое производство
[ редактировать ]человека нейтрофилы , моноциты , эозинофилы , B-лимфоциты , дендритные клетки , тромбоциты , эпителиальные клетки дыхательных путей и гладкомышечные клетки , эндотелиальные клетки сосудов и кератиноциты Было обнаружено и/или предполагается, что кожи производят 5-оксо-ЭТЕ из эндогенных или экзогенных 5. -HETE, особенно в условиях окислительного стресса; Было также показано, что клеточные линии, полученные из раковых клеток человека, таких как рак молочной железы, предстательной железы, легких, толстой кишки и различных типов лейкемии, являются продуцентами 5-оксо-ЭТЕ. [ 3 ]
Трансцеллюлярное производство
[ редактировать ]Клетки одного типа могут выделять вырабатываемый ими 5( S )-HETE в близлежащие клетки второго типа, которые затем окисляют 5( S )-HETE до 5-оксо-ETE. Это трансклеточное производство обычно включает ограниченное разнообразие типов клеток, которые экспрессируют активную 5-липоксигеназу и лишены активности HEDH из-за более высоких уровней НАДФН по сравнению с НАДФ. + уровни и, следовательно, при стимуляции накапливают 5( S )-HETE, а не 5-оксо-ETE. Этот 5( S )-ETE может покидать эти клетки и проникать в различные типы клеток, обладающие активностью 5-HEDH, а также с пониженным уровнем НАДФН до НАДФ. + уровнях и, таким образом, превращаться в 5-оксо-ЭТЕ. Трансклеточная продукция 5-оксо-эйкозатетраеноатов была продемонстрирована in vitro с использованием нейтрофилов человека в качестве клеток, продуцирующих 5( S )-HETE, и PC-3 клеток рака предстательной железы человека, тромбоцитов и моноцитов, происходящих из дендритных клеток, в качестве окисляющих клеток. [ 3 ] [ 7 ] Предполагается, что этот трансклеточный метаболизм происходит in vivo и обеспечивает механизм контроля продукции 5-оксо-ЭТЕ, позволяя ему происходить или увеличиваться в местах, где клетки, содержащие 5-липоксигеназу, собираются с типами клеток, обладающими 5-ГЭДГ и благоприятным НАДФН. /НАДП + соотношения; Предполагается, что такие места могут включать в себя те, которые связаны с аллергией, воспалением, окислительным стрессом и быстрорастущим раком. [ 1 ] [ 3 ]
Метаболизм
[ редактировать ]Как указано в предыдущем разделе, 5-оксо-ЭТЕ легко превращается в 5( S )-HETE с помощью 5-HEDH в клетках, содержащих очень низкий уровень НАДФН/НАДФ. + соотношения. человека Нейтрофилы , важная модельная клетка для изучения производства 5-оксо-ЭТЕ, поглощают 5-оксо-ЭТЕ и восстанавливают его до 5( S )-НЕТЕ; они также образуют значительные количества 5( S )-20-дигидрокси-ЭТЕ и небольшие количества 5-оксо,20-гидрокси-ЭТЕ, вероятно, под действием фермента ω-гидроксилазы цитохрома P450 , CYP453A, на 5( S )-HETE. и 5-оксо-ЭТЕ соответственно. [ 3 ] [ 8 ] Клетки также включают 5( S )-HETE-продукт 5-оксо-ETE, но мало или вообще не включают сам 5-oxo-ETE в виде сложного эфира в различные фосфолипидов и глицеролипидов пулы ; однако изолированные плазматические мембраны нейтрофилов , у которых отсутствует заметная активность 5-HEDH, действительно этерифицируют 5-оксо-ETE в эти липидные пулы. [ 1 ] [ 8 ]
Некоторые другие пути могут метаболизировать 5-оксо-ЭТЕ. человека Во-первых, эозинофилы используют арахидонат-15-липоксигеназу -1 (или, возможно, арахидонат-15-липоксигеназу-2) для метаболизма 5-оксо-ЭТЕ до 5-оксо-15-( S )-гидроперокси-ЭТЕ, который быстро восстанавливается до 5-оксо-ЭТЭ. 15( S )-гидрокси-ЭТЕ; 5-оксо-15( S )-гидрокси-ЭТЕ; примерно на одну треть слабее 5-оксо-ЭТЕ в стимулировании клеток. [ 1 ] [ 3 ] Во-вторых, тромбоциты человека используют 12-липоксигеназу для метаболизма 5-оксо-ЭТЕ до 5-оксо-12( S )-гидроперокси-эйкозатетраеноата, который быстро превращается в 5-оксо-12( S )-гидрокси-эйкозатетраеноат (5-оксо -12( S )-гидрокси-ЭТЕ); 5-оксо-12( S )-гидроксил-ЭТЕ является слабым антагонистом 5-оксо-ЭТЕ. [ 3 ] В-третьих, мышиные макрофаги используют а) фермент цитохрома P450 для метаболизма 5-оксо-ЭТЕ до 5-оксо-18-гидрокси-ЭТЕ (5-оксо-18-НЕТЕ), который либо подвергается атаке 5-кеторедуктазы (возможно, 5-HEDH) с образованием 5,18-дигидроксиэйкозатетраеновой кислоты (5,18-diHETE) или с помощью Δ6-редуктаза с образованием 5-оксо-18-гидроксиэйкозатриеновой кислоты (5-оксо-18-HETrE), которая затем восстанавливается 5-кеторедуктазой (возможно, 5-HEDH) до 5,18-дигидрокси-эйкозатриеновой кислоты. (5,18-ДИГЕТРЕ); б) фермент цитохрома P450 превращает 5-оксо-ЭТЕ в 5-оксо-19-гидроксиэйкозатетраеновую кислоту (5-оксо-19-НЕТЕ), которая затем либо восстанавливается кеторедуктазой (возможно, 5-ГЭДГ) до 5, 19-дигидроксиэйкозатетраеновая кислота (5,19-диНЕТЕ) или Δ6-редуктазой до 5-оксо-19-гидроксиэйкозатриеновая кислота (5-оксо-19-HETrE); [ 9 ] или в) лейкотриен-С4-синтаза для метаболизма 5-оксо-ЭТЕ до 5-оксо-7-глутатионил-8,11,14-эйкозатриеновой кислоты (FOG7). FOG7 моделирует клетки по иному механизму, чем 5-оксо-ETE; о биологической активности других метаболитов мышиного происхождения не сообщалось. [ 10 ] [ 11 ]
Механизм действия
[ редактировать ]Рецептор OXER1
[ редактировать ]Исследования нейтрофилов человека впервые обнаружили локализованный на плазматической мембране сайт, который обратимо связывал 5-оксо-ЭТЕ и имел свойства субъединицей Gi-альфа, с рецептора, связанного с G-белком, связанного на основе способности 5-оксо-ЭТЕ активировать этот класс. мембранных G-белков по механизму, чувствительному к коклюшному токсину . [ 3 ] [ 8 ] Впоследствии этот рецептор был клонирован несколькими группами, которые назвали его оксоэйкозаноидным рецептором 1 (OXER1), OXE, OXE-R, hGPCR48, HGPCR48 или R527 (его ген называется OXE1 или OXER1 ), и обнаружили, что он связан и активирует Комплекс G-белка, состоящий из субъединицы Gi-альфа (Gαi) и комплекса G-бета-гамма (Gβγ). [ 1 ] [ 3 ] [ 12 ] При связывании 5-оксо-ETE OXER1 запускает диссоциацию этого комплекса G-белка на его компоненты Gαi и Gβγ; диссоциированный Gβγ отвечает за активацию многих сигнальных путей, которые приводят к клеточным функциональным ответам, вызываемым 5-оксо-ЭТЕ. [ 13 ] Эти сигнальные пути включают те, которые вызывают повышение уровня ионов кальция , а также другие, которые активируют MAPK/ERK , митоген-активируемые протеинкиназы p38 , цитозольную фосфолипазу A2 , PI3K / Akt , протеинкиназу C бета (PKCβ) и/или (PKCε). . [ 1 ] [ 3 ] [ 12 ] [ 14 ] Большинство действий 5-оксо-ETE, по-видимому, опосредовано OXER1; однако некоторые из его клеточно-стимулирующих действий, по-видимому, не зависят от OXER1, как указано в следующем разделе. Другие соединения также могут стимулировать клетки посредством OXER1. Многие из этих соединений незначительно отличаются от 5-оксо-ЭТЕ по структуре заменой одного атома на атом другого элемента, потерей одного или нескольких атомов и/или наличием функциональной группы, не обнаруженной в 5-оксо-ЭТЕ. Эти соединения называются аналогами 5-оксо-ЭТЕ или членами семейства агонистов 5-оксо-ЭТЕ. 5-НЕТЕ и 5-гидрокси-15( S Примерами таких аналогов являются )-гидроксиэйкозатетраеновая кислота. 5-Оксо-ЭТЕ и многие его аналоги продуцируются клетками человека, клетками других млекопитающих, например, кошек и опоссумов, а также клетками нескольких видов рыб. [ 2 ] [ 3 ] На основании наличия мРНК предполагается, что рецептор OXER1 высоко экспрессируется в эозинофилах крови человека , нейтрофилах, селезенке, легких, печени и почках и на более низких уровнях в базофилах человека, моноцитах, макрофагах легких и различных линиях раковых клеток человека. и клеточную линию , полученную из коры надпочечников человека ; однако в клетках мышей и крыс, по-видимому, отсутствует четкий OXER1. [ 1 ]
Другие рецепторы GPCR
[ редактировать ]Мышиные клетки MA-10 реагируют на 5-оксо-ETE, но лишены OXER1. Было высказано предположение, что ответы этих клеток на 5-оксо-ETE опосредуются ортологом OXER1, мышиным рецептором ниацина 1 , Niacr1, который представляет собой рецептор ниацина , связанный с G-белком , или, альтернативно, одним или несколькими из семейство мышиных гидроксикарбоновых кислот (HCA) рецепторов, связанных с G-белком, HCA1 ( GPR81 ), HCA2 ( GPR109A ) и HCA3 ( GPR109B ), которые представляют собой связанные с G-белком рецепторы жирных кислот. [ 3 ] [ 15 ]
PPARγ
[ редактировать ]5-оксо-ETE и 5-оксо-15( S )-гидрокси-ETE, но не 5-гидрокси члены семейства 5-HETE, такие как 5-( S )-HETE, активируют гамма-рецептор, активирующий пролифератор пероксисомы (PPARγ). Эта активация не происходит через OXER1; скорее, он включает прямое связывание оксо-аналога с PPARγ, при этом 5-оксо-15-( S )-гидрокси-ЭТЕ является более эффективным, чем 5-оксо-ЭТЕ, в связывании и активации PPARγ. [ 16 ] Активация рецептора OXER1 и PPARγ оксоаналогами может иметь противоположные эффекты на функцию клеток. Например, 5-оксо-ЭТЕ-связанный OXER1 стимулирует, тогда как 5-оксо-ЭТЕ-связанный PPARγ ингибирует пролиферацию различных типов линий раковых клеток человека; это приводит к тому, что 5-оксо-ETE и 5-оксо-15-( S )-HETE обладают значительно меньшей эффективностью, чем ожидалось, в стимулировании пролиферации этих раковых клеток по сравнению с эффективностью 5-( S )-HETE, взаимосвязь не является тесной. следуя за эффективностью этих трех соединений в активации OXER1. [ 3 ] [ 16 ]
Другие механизмы
[ редактировать ]5-Oxo-ETE расслабляет предварительно сокращенные бронхи человека с помощью механизма, который, по-видимому, не задействует OXER1, но в остальном не определен. [ 3 ] [ 17 ]
Клетки-мишени
[ редактировать ]Воспалительные клетки
[ редактировать ]5-Оксо-ЭТЕ является мощным in vitro стимулятором и/или усилителем хемотаксиса (т.е. направленной миграции) и, в зависимости от типа клеток, различных других реакций, таких как дегрануляция (т.е. высвобождение связанных с гранулами ферментов), окислительный метаболизм (т.е. генерация активных форм кислорода ) и продукция медиаторов, таких как различные метаболиты арахидоновой кислоты и фактор активации тромбоцитов в эозинофилах человека, базофилах , нейтрофилы и моноциты . [ 3 ] [ 18 ] Кроме того, инъекция 5-оксо-ЭТЕ в кожу человека вызывает локальное накопление циркулирующих клеток крови, особенно эозинофилов, но также, в меньшей степени, нейтрофилов и моноцитов происходящих из макрофагов, . [ 19 ] Активность 5-оксо-ЭТЕ в отношении двух типов клеток, которые, как известно, участвуют в воспалении, вызванном аллергией, эозинофилов и базофилов, позволяет предположить, что он может участвовать в стимулировании аллергических реакций, возможно, путем привлечения этих клеток посредством хемотаксиса к возникающим участкам аллергии и /или путем стимуляции этих клеток к высвобождению связанных с гранулами ферментов, активных форм кислорода или других стимуляторов аллергических реакций. [ 3 ] [ 12 ] Активность 5-оксо-ЭТЕ в отношении клеток человека, участвующих в неаллергических воспалительных заболеваниях, а именно нейтрофилов и моноцитов, а также его способность привлекать эти типы клеток к коже человека позволяют предположить, что 5-оксо-ЭТЕ также может участвовать в широкая категория неаллергических воспалительных заболеваний, включая те, которые связаны с защитой организма хозяина от патогенов. [ 12 ]
Гладкомышечные клетки дыхательных путей легких
[ редактировать ]5-оксо-ETE сокращает гладкие мышцы и бронхи, выделенные из морских свинок, но расслабляет бронхи, выделенные из легких человека; расслабление бронхов человека, вызванное 5-оксо-ETE, может не затрагивать его OXER1. [ 3 ] [ 20 ] Эти результаты позволяют предположить, что 5-оксо-ЭТЕ не участвует непосредственно в бронхоконстрикции на основе эозинофилов , которая возникает при аллергических реакциях астмы у людей.
Раковые клетки
[ редактировать ]5-Оксо-ЭТЕ (или другой член семейства 5-НЕТЕ) стимулирует рост и/или выживание линий клеток человека, полученных в результате рака простаты, молочной железы, легких, яичников, толстой кишки и поджелудочной железы. [ 1 ] [ 3 ] [ 16 ] [ 21 ] Эти доклинические исследования показывают, что 5-оксо-ETE (или другой член семейства 5-HETE) может способствовать прогрессированию указанного рака у людей.
Стероидогенные клетки
[ редактировать ]5-оксо-ETE стимулирует клетки надпочечников человека H295R к увеличению транскрипции стероидогенной острой регуляторной белковой информационной РНК и выработке альдостерона и прогестерона по явно OXER1-зависимому пути. [ 15 ]
Другие типы клеток
[ редактировать ]5-Оксо-ЭТЕ индуцирует изотоническое уменьшение объема эпителиальных клеток крипт кишечника морской свинки. [ 22 ]
Взаимодействие с другими стимулами
[ редактировать ]5-Оксо-ЭТЕ и еще один потенциальный медиатор аллергических реакций человека, фактор активации тромбоцитов , действуют синергически, стимулируя эозинофилы и нейтрофилы человека: комбинированные агенты вызывают реакции, которые превосходят простую сумму их индивидуальных действий, и делают это при относительно низкий. [ 23 ] [ 24 ] 5-Oxo-ETE также значительно увеличивает активность компонента комплемента 5a , LTB4 и FMLP в стимуляции дегрануляции эозинофилов человека, а его дегранулирующая активность значительно увеличивается при предварительной обработке эозинофилов человека фактором, стимулирующим колонии гранулоцитов-макрофагов , или нейтрофилов человека либо последним, либо цитокин или с гранулоцитарным колониестимулирующим фактором , фактором некроза опухоли α или различные нуклеотиды, включая АТФ . [ 23 ] [ 24 ] [ 25 ] [ 26 ] Предварительная обработка эозинофилов интерлейкином 5 (ключевым медиатором активации эозинофилов) также увеличивает их in vitro на 5-оксо-ЭТЕ. хемотаксический ответ [ 27 ] 5-Оксо-ETE также действует синергично с двумя хемокинами , CCL2 и CCL8 , стимулируя хемотаксис моноцитов. [ 18 ] Взаимодействие 5-оксо-ЭТЕ с этими медиаторами аллергии (например, фактором активации тромбоцитов, интерлейкином 5) в эозинофилах также позволяет предположить, что он играет роль в аллергических заболеваниях, в то время как его взаимодействие с медиаторами воспалительных реакций (например, фактором некроза опухоли α, колониестимулирующие факторы и два хемокина CCL) в нейтрофилах и моноцитах также позволяют предположить, что он играет роль в воспалительных реакциях и защитных механизмах хозяина.
Клиническое значение
[ редактировать ]По сути, все исследования активности 5-оксо-ЭТЕ и клеток-мишеней, аналогичные исследованиям других членов семейства агонистов 5( S )-HETE, лучше всего классифицировать как доклинические исследования разработки: они еще не определены. иметь важное значение в патофизиологии человека. Исследования перевода необходимы, чтобы выяснить, являются ли доклинические исследования вовлечения 5-Oxo-ETE и других членов семейства 5( S )-HETE в аллергические заболевания, воспалительные заболевания, рак, выработку стероидов, ремоделирование костей, роды и другие патофизиологические явления, как указано выше. здесь и на странице 5-HETE актуальны для человека и, следовательно, имеют клиническое значение.
Потенциальное участие в аллергии
[ редактировать ]Клиническое значение 5-оксо-ЭТЕ чаще всего изучалось как возможный медиатор аллергических реакций, вызванных эозинофилами. При внутрикожном введении у обезьян он вызывает инфильтрацию эозинофилов в месте инъекции. У людей он вызывает инфильтрацию эозинофилов, что сопровождается значительным уровнем инфильтрации нейтрофилов и макрофагов. Эти инъекции 5-оксо-ЭТЕ вызывали значительно больший инфильтрат эозинофилов у астматиков по сравнению со здоровыми людьми. Исследования на макаках-резусах, сенсибилизированных к аллергену, показали, что внутрикожная инъекция исходного аллергена вызывала локализованное накопление эозинофилов; эта инфильтрация блокировалась примерно на 50% у животных, предварительно обработанных перорально принимаемым антагонистом рецептора OXER1. Этот же антагонист рецептора также блокировал инфильтрацию эозинофилов в легкие у макак-резус, которые были сенсибилизированы к исходному аллергену, а затем подверглись заражению им. Повышенные уровни 5-оксо-ЭТЕ были обнаружены в конденсате выдыхаемого воздуха у людей, у которых развилась астматическая астма. бронхоконстрикционная реакция на вдыхание аллергена клеща домашней пыли : уровни этого повышения были выше у лиц, у которых развилась более тяжелая поздняя астматическая реакция . Аналогичным образом, повышенные уровни 5-оксо-ЭТЕ были обнаружены в жидкости бронхоальвеолярного лаважа после вдыхания аллергена клеща домашней пыли мышам, сенсибилизированным к клещам домашней пыли. Наконец, эпителиальные клетки, полученные из полипов носа человека, продуцируют 5-оксо-ЭТЕ, а при применении к культурам ткани полипа носа 5-оксо-ЭТЕ стимулирует выработку катионного белка эозинофилов , белка, связанного с воспалением на основе эозинофилов. и астма. Эти результаты показывают, что: 1) 5-оксо-ЭТЕ вызывает аллергические реакции, подобные кожным эозинофилам; 2) его действие, по крайней мере у обезьян, включает стимуляцию OXER1; 3) 5-оксо-ЭТЕ (или аналог 5-оксо-ЭТЕ) может способствовать развитию кожных (например, атопический дерматит ), легочных (например, астма) и назальных (например, аллергический ринит ) аллергических реакций у человека; и 4) антагонисты OXER1 могут быть полезны при лечении кожных, легочных и, возможно, назальных реакций у людей. [ 28 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л м н Пауэлл В.С., Рокач Дж. (апрель 2015 г.). «Биосинтез, биологические эффекты и рецепторы гидроксиэйкозатетраеновых кислот (HETE) и оксоэйкозатетраеновых кислот (оксо-ETE), полученных из арахидоновой кислоты» . Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1851 (4): 340–55. дои : 10.1016/j.bbalip.2014.10.008 . ПМК 5710736 . ПМИД 25449650 .
- ^ Jump up to: а б Коссетт С., Гравель С., Редди С.Н., Гор В., Чоури С., Йе К., Снайдер Н.В., Месарос К.А., Блэр И.А., Лавуа Дж.П., Рейнеро С.Р., Рокач Дж., Пауэлл В.С. (август 2015 г.). «Биосинтез и действие 5-оксоэйкозатетраеновой кислоты (5-оксо-ЭТЕ) на гранулоциты кошек» . Биохимическая фармакология . 96 (3): 247–55. дои : 10.1016/j.bcp.2015.05.009 . ПМЦ 4830392 . ПМИД 26032638 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р Пауэлл В.С., Рокач Дж. (октябрь 2013 г.). «Хемоаттрактант эозинофилов 5-оксо-ETE и рецептор OXE» . Прогресс в исследованиях липидов . 52 (4): 651–65. дои : 10.1016/j.plipres.2013.09.001 . ПМК 5710732 . ПМИД 24056189 .
- ^ Буи П., Имаидзуми С., Биданагари С.Р., Редди С.Т., Хэнкинсон О. (февраль 2011 г.). «Человеческий CYP2S1 метаболизирует эйкозаноиды, полученные из циклооксигеназы и липоксигеназы» . Метаболизм и распределение лекарств . 39 (2): 180–90. дои : 10.1124/dmd.110.035121 . ПМК 3033693 . ПМИД 21068195 .
- ^ Зарини С., Мерфи Р.К. (март 2003 г.). «Биосинтез 5-оксо-6,8,11,14-эйкозатетраеновой кислоты из 5-гидропероксиэйкозатетраеновой кислоты в мышиных макрофагах» . Журнал биологической химии . 278 (13): 11190–6. дои : 10.1074/jbc.M208496200 . ПМИД 12547823 .
- ^ Фальгейре Дж., Риендо Д. (февраль 2000 г.). «5-оксо-эйкозатетраеновая кислота, производная LTA (4): pH-зависимое образование и взаимодействие с рецептором LTB (4) полиморфноядерных лейкоцитов человека». Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1484 (1): 51–8. дои : 10.1016/s1388-1981(99)00198-5 . ПМИД 10685030 .
- ^ Цимпфер У., Дихманн С., Термеер К.С., Саймон Дж.К., Шредер Дж.М., Норгауэр Дж. (ноябрь 2000 г.). «Дендритные клетки человека являются физиологическим источником хемотаксического метаболита арахидоновой кислоты 5-оксо-эйкозатетраеновой кислоты». Исследование воспаления . 49 (11): 633–8. дои : 10.1007/s000110050641 . ПМИД 11131304 . S2CID 21430700 .
- ^ Jump up to: а б с О'Флаэрти Дж.Т., Тейлор Дж.С., Томас М.Дж. (декабрь 1998 г.). «Рецепторы класса 5-оксо эйкозаноидов в нейтрофилах» . Журнал биологической химии . 273 (49): 32535–41. дои : 10.1074/jbc.273.49.32535 . ПМИД 9829988 .
- ^ Хевко Дж. М., Бауэрс RC, Мерфи RC (февраль 2001 г.). «Синтез 5-оксо-6,8,11,14-эйкозатетраеновой кислоты и идентификация новых омега-окисленных метаболитов в макрофагах мыши». Журнал фармакологии и экспериментальной терапии . 296 (2): 293–305. ПМИД 11160610 .
- ^ Мерфи Р.К., Зарини С. (2002). «Глутатионовые аддукты оксиэйкозаноидов». Простагландины Другие липидные медиаторы . 68–69: 471–82. дои : 10.1016/s0090-6980(02)00049-7 . ПМИД 12432937 .
- ^ Хевко Дж. М., Бауэрс RC, Мерфи RC (февраль 2001 г.). «Синтез 5-оксо-6,8,11,14-эйкозатетраеновой кислоты и идентификация новых омега-окисленных метаболитов в макрофагах мыши». J Pharmacol Exp Ther . 296 (2): 293–305. ПМИД 11160610 .
- ^ Jump up to: а б с д Бринк С., Дален С.Э., Дразен Дж., Эванс Дж.Ф., Хэй Д.В., Ровати Г.Е., Серхан К.Н., Симидзу Т., Ёкомизо Т. (март 2004 г.). «Международный союз фармакологии XLIV. Номенклатура оксоэйкозаноидных рецепторов». Фармакологические обзоры . 56 (1): 149–57. дои : 10.1124/пр.56.1.4 . ПМИД 15001665 . S2CID 7229884 . Вт
- ^ Конья В., Блаттерманн С., Яндл К., Платцер В., Оттерсбах П.А., Марше Г., Гютшов М., Костенис Е., Хайнеманн А. (май 2014 г.). «Смещенный антагонист OXE-R, не относящийся к Gαi, демонстрирует, что субъединица белка Gαi не участвует напрямую в активации нейтрофилов, эозинофилов и моноцитов с помощью 5-оксо-ETE» . Журнал иммунологии . 192 (10): 4774–82. doi : 10.4049/jimmunol.1302013 . ПМИД 24733850 .
- ^ Росси А.Г., О'Флаэрти Дж.Т. (1991). «Биодействие 5-гидроксикозатетраеноата и его взаимодействие с фактором активации тромбоцитов». Липиды . 26 (12): 1184–8. дои : 10.1007/bf02536528 . ПМИД 1668115 . S2CID 3964822 .
- ^ Jump up to: а б Кук М., Ди Консоли Х., Малоберти П., Корнехо Масиэль Ф. (май 2013 г.). «Экспрессия и функция рецептора OXE, эйкозаноидного рецептора, в стероидогенных клетках». Молекулярная и клеточная эндокринология . 371 (1–2): 71–8. дои : 10.1016/j.mce.2012.11.003 . hdl : 11336/8381 . ПМИД 23159987 . S2CID 8520991 .
- ^ Jump up to: а б с О'Флаэрти Дж.Т., Роджерс Л.К., Пауми К.М., Хантган Р.Р., Томас Л.Р., Клэй CE, Хай К., Чен Ю.К., Уиллингем М.С., Смитерман П.К., Куте Т.Э., Рао А., Крамер С.Д., Морроу К.С. (октябрь 2005 г.). «Аналоги 5-оксо-ETE и пролиферация раковых клеток». Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1736 (3): 228–236. дои : 10.1016/j.bbalip.2005.08.009 . ПМИД 16154383 .
- ^ Морен С., Сируа М., Эчав В., Гомес М.М., Руссо Э. (июнь 2007 г.). «Расслабляющее воздействие 5-оксо-ЭТЕ на бронхи человека включает активацию канала BK Ca». Простагландины и другие липидные медиаторы . 83 (4): 311–9. doi : 10.1016/j.prostaglandins.2007.03.001 . ПМИД 17499751 .
- ^ Jump up to: а б Соццани С., Чжоу Д., Локати М., Бернаскони С., Луини В., Мантовани А., О'Флаэрти Дж.Т. (ноябрь 1996 г.). «Стимулирующие свойства 5-оксо-эйкозаноидов для моноцитов человека: синергизм с моноцитарными хемотаксическими белками-1 и -3» . Журнал иммунологии . 157 (10): 4664–71. дои : 10.4049/jimmunol.157.10.4664 . ПМИД 8906847 . S2CID 23499393 .
- ^ Муро С., Хамид К., Оливенштейн Р., Таха Р., Рокач Дж., Пауэлл В.С. (октябрь 2003 г.). «5-оксо-6,8,11,14-эйкозатетраеновая кислота индуцирует инфильтрацию гранулоцитов в кожу человека» . Журнал аллергии и клинической иммунологии . 112 (4): 768–74. дои : 10.1016/S0091-6749(03)01888-8 . ПМИД 14564360 .
- ^ Морен С., Сируа М., Эчав В., Гомес М.М., Руссо Э. (2007). «Расслабляющее воздействие 5-оксо-ЭТЕ на бронхи человека включает активацию канала BK Ca». Простагландины и другие липидные медиаторы . 83 (4): 311–9. doi : 10.1016/j.prostaglandins.2007.03.001 . ПМИД 17499751 .
- ^ Грант Дж.Э., Рубино С., Гравий С., Ван Х, Патель П., Рокач Дж., Пауэлл В.С. (июнь 2011 г.). «Усиленное образование 5-оксо-6,8,11,14-эйкозатетраеновой кислоты раковыми клетками в ответ на окислительный стресс, докозагексаеновой кислоты и 5-гидрокси-6,8,11,14-эйкозатетраеновой кислоты, полученной из нейтрофилов» . Канцерогенез . 32 (6): 822–8. дои : 10.1093/carcin/bgr044 . ПМК 3146358 . ПМИД 21393477 .
- ^ Маклауд Р.Дж., Лембессис П., Гамильтон Дж.Р., Пауэлл В.С. (ноябрь 1999 г.). «5-Оксо-6,8,11,14-эйкозатетраеновая кислота стимулирует изотоническое уменьшение объема эпителиальных клеток крипт тощей кишки морской свинки». Журнал фармакологии и экспериментальной терапии . 291 (2): 511–6. ПМИД 10525065 .
- ^ Jump up to: а б О'Флаэрти Дж.Т., Куроки М., Никсон А.Б., Вейкандер Дж., Йи Э., Ли С.Л., Смитерман П.К., Вайкл Р.Л., Дэниел Л.В. (июль 1996 г.). «5-оксо-эйкозатетраеноат является широко активным, селективным в отношении эозинофилов стимулом для гранулоцитов человека» . Журнал иммунологии . 157 (1): 336–42. дои : 10.4049/jimmunol.157.1.336 . ПМИД 8683135 . S2CID 35264541 .
- ^ Jump up to: а б О'Флаэрти Дж.Т., Кордес Дж.Ф., Ли С.Л., Сэмюэл М., Томас М.Дж. (декабрь 1994 г.). «Химическая и биологическая характеристика оксо-эйкозатетраеновых кислот». Biochimica et Biophysical Acta (BBA) – Общие предметы . 1201 (3): 505–15. дои : 10.1016/0304-4165(94)90083-3 . ПМИД 7803484 .
- ^ О'Флаэрти Дж.Т., Куроки М., Никсон А.Б., Вейкандер Дж., Йи Э., Ли С.Л., Смитерман П.К., Вайкл Р.Л., Дэниел Л.В. (июль 1996 г.). «5-оксо-эйкозаноиды и гемопоэтические цитокины взаимодействуют в стимулировании функции нейтрофилов и митоген-активируемого пути протеинкиназы» . Журнал биологической химии . 271 (30): 17821–8. дои : 10.1074/jbc.271.30.17821 . ПМИД 8663432 .
- ^ О'Флаэрти Дж. Т., Кордес Дж. Ф. (июнь 1994 г.). «Реакция дегрануляции нейтрофилов человека на нуклеотиды». Лабораторные исследования; Журнал технических методов и патологии . 70 (6): 816–21. ПМИД 8015286 .
- ^ Гильбер М., Ферланд С., Боссе М., Фламан Н., Лавин С., Лавиолетт М. (июль 1999 г.). «5-Оксо-6,8,11,14-эйкозатетраеновая кислота индуцирует важную трансмиграцию эозинофилов через компоненты базальной мембраны: сравнение нормальных и астматических эозинофилов». Американский журнал респираторной клеточной и молекулярной биологии . 21 (1): 97–104. CiteSeerX 10.1.1.326.2636 . дои : 10.1165/ajrcmb.21.1.3517 . ПМИД 10385597 .
- ^ Пауэлл В.С., Рокач Дж. (март 2020 г.). «Нацеливание на рецептор OXE как на потенциальную новую терапию астмы» . Биохимическая фармакология . 179 : 113930. дои : 10.1016/j.bcp.2020.113930 . ПМЦ 10656995 . ПМИД 32240653 . S2CID 214768793 .
