Липоксин
 | |
| Имена | |
|---|---|
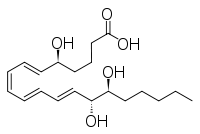
| Предпочтительное название ИЮПАК ( 5S , 6E , 8Z ,10E , 12E , 14R , 15S ) -5,14,15-тригидроксиикоза-6,8,10,12-тетраеновая кислота | |
| Другие имена LXB4 | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 20 Н 32 О 5 | |
| Молярная масса | 352.46508 g/mol |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |

Липоксин , ( LX или Lx ), аббревиатура от продукта взаимодействия липоксигеназы , представляет собой биоактивный аутакоидный метаболит арахидоновой кислоты вырабатываемый различными типами клеток. Они классифицируются как неклассические эйкозаноиды и члены семейства специализированных про-рассасывающихся медиаторов (СПМ) метаболитов полиненасыщенных жирных кислот (ПНЖК). , а затем действуют для их устранения Как и другие СПМ, LX формируются во время воспалительных реакций . Первоначально были идентифицированы два липоксина, липоксин A 4 (LXA 4 ) и LXB 4 , но более поздние исследования идентифицировали эпимеры этих двух LX: эпилипоксины , 15-epi-LXA 4 и 15-epi-LXB 4 соответственно.
История
[ редактировать ]LXA 4 и LXB 4 были впервые описаны Серханом, Хамбергом и нобелевским лауреатом Самуэльссоном в 1984 году. [1] крови человека Они сообщили, что нейтрофилы при стимуляции вырабатывают эти два липоксина и что нейтрофилы при стимуляции любым из LXs присоединяют супероксид -анион (O 2 − ) реакции генерации и дегрануляции . Оба ответа считаются провоспалительными, поскольку, хотя они направлены на нейтрализацию вторжения патогенов и переваривание инородного материала, они могут способствовать повреждению тканей хозяина и тем самым продлевать и способствовать дальнейшему воспалению. Последующие исследования, однако, показали, что эти липоксины, а также их эпимеры, epi-LXA 4 и LXB 4 , действуют в первую очередь на подавление и разрешение воспаления, т.е. они являются противовоспалительными клеточными сигнальными агентами.
Биохимия
[ редактировать ]Липоксины получают ферментативно из арахидоновой кислоты , ω-6 жирной кислоты . Структурно они определяются как метаболиты арахидоновой кислоты, которые содержат три гидроксильных остатка (также называемых гидроксильными остатками) и четыре двойные связи . Это структурное определение отличает их от других СПМ, таких как резольвины , нейропротектины и марезины , которые являются метаболитами жирных кислот омега-3 , эйкозапентаеновой кислоты или докозагексаеновой кислоты , а также ряда метаболитов, полученных из других ПНЖК (см . разрешающие медиаторы ). Все эти другие СПМ обладают активностью и функциями, сходными, хотя и не обязательно идентичными, с липоксинами. [2] [3]
Синтез
[ редактировать ]Формирование LX сохраняется у широкого круга видов животных, от рыб до человека. [4] Биосинтез LX требует двух отдельных ферментативных атак на арахидоновую кислоту (АК). Одна атака включает присоединение остатка гидроперокси (-O-OH) к углероду 15, превращение этого вида в 14,15- эпоксид и расщепление этого эпоксида с образованием либо 14,15-дигидрокси-эйкозатетраеноата, либо 15-гидрокси. -эйкозатетраеноатные продукты. Этот этап катализируется ферментами с 15-липоксигеназной активностью, которая у человека включает ALOX15 , ALOX12 , обработанную аспирином циклооксигеназу 2 и цитохром P450 микросомального, митохондриального или бактериального подклассов. ALOX15B также может осуществлять этот метаболизм. Другая точка атаки фермента образует 5,6- эпоксид , который распадается либо на 5,6-дигидрокси-эйкозатетраеноат, либо на 5-гидрокси-эйкозатетраеноатные продукты; этот этап катализируется 5-липоксигеназой (ALOX5). Соответственно, эти двойные оксигенации дают либо 5,6,15-тригидрокси-, либо 5,14,15-тригидрокси-эйкозатетраеноаты. [5] [6] Двойная оксигенация может проводиться внутри одного типа клеток, который обладает ALOX5 и ферментом с 15-липоксигеназной активностью, или, альтернативно, с помощью двух разных типов клеток, каждый из которых обладает одной из этих ферментативных активностей. В последнем трансклеточном биосинтетическом пути один тип клеток образует 5,6-дигидрокси-, 5-гидрокси-, 14,15-дигидрокси- или 15-гидрокси-эйкозатетраеноат, а затем передает этот промежуточный продукт второму типу клеток. который метаболизирует его до конечного продукта LX. [7] Например, LX образуются тромбоцитами, которые из-за отсутствия ALOX5 не могут их синтезировать. Скорее, нейтрофилы образуют 5,6-эпоксид, лейкотриен А4 (LTA 4 ), через ALOX5 и передают его тромбоцитам, которые затем восстанавливают его до 5,6-дигидрокси-эйкозатетераноата и далее метаболизируют его через ALOX12 с образованием 15 -гидроксипродукт, LXA 4 . [5] Два LX отличаются от своих эпимеров 15-epi-LTX своими структурными формулами:
- LxA 4 : 5 S ,6 R ,15 S -тригидрокси-7 E ,9 E ,11 Z ,13 E -эйкозатетраеновая кислота
- LxB 4 : 5 S ,14 R ,15 S -тригидрокси-6 E ,8 Z ,10 E ,12 E -эйкозатетраеновая кислота
- 15-эпи-LxA 4 :5S , 6R , 15R - тригидрокси-7 E ,9 E ,11 Z ,13 E -эйкозатетраеновая кислота
- 15-эпи-LxB 4 : 5S ,14 R ,15 R -тригидрокси-6 E ,8 Z ,10 E ,12 E -эйкозатриеновая кислота
Обратите внимание, что два LX имеют свои 15-гидроксильные остатки в конфигурации S- хиральности , поскольку все ферменты ALOX образуют 15 S -гидрокси-продукты АК. Напротив, 15-гидрокси-остатки двух epi-LX представляют собой продукты хиральности 15 R , поскольку они синтезируются обработанной аспирином циклооксигеназой 2 или микросомальным, митохондриальным или бактериальным цитохромом P450s ; эти ферменты почти полностью или частично образуют 15 R -гидроксипродукты. [5] (15-Epi-LTA4 4 и 15-epi-LTB4 4 иногда называют AT-LxA 4 и AT-LxB 4 соответственно, учитывая их образование обработанной аспирином циклооксигеназой 2, т.е. A -спирином -T циклооксигеназой 2, запускаемой . )
В дополнение к путям, указанным выше, было показано, что другие трансклеточные метаболические пути образуют LX. Например, 5-липоксигеназа (т.е. (ALOX5) в нейтрофилах и 15-липоксигеназа -1 (т.е. ALOX15) в незрелых эритроцитах и ретикулоцитах последовательно действуют с образованием LxA4 4 и LxB4 4 ; этот путь также происходит при последовательных взаимодействиях между нейтрофилами и эозинофилами. между эпителием или макрофагами М2 /моноцитами и нейтрофилами и эндотелием или скелетными мышцами и нейтрофилами; [5] [6] [7]
Стимуляция синтеза
[ редактировать ]Липоксины обычно образуются в результате стимуляции выработки провоспалительных метаболитов арахидоновой кислоты. Однако некоторые цитокины, такие как IFN-γ и IL-1β, дополнительно увеличивают выработку липоксинов (а также других противовоспалительных метаболитов и белков ПНЖК, например IL4 ). [8]
Дальнейший метаболизм
[ редактировать ]LX быстро метаболизируются, в основном макрофагами, до неактивных продуктов путем окисления по углероду 15 с образованием 15- кето (также называемых 15-оксо) продуктов LX под действием 15-гидроксипростагландиндегидрогеназы ; 15-оксо-LXA 4 может далее метаболизироваться до 13,14-дигидро-LXA 4 под действием оксидоредуктазы . 15-Epi-LXA 4 и 15-epi-LXB 4 более устойчивы к ферменту дегидрирования, чем их LX-эпимеры. [4] В результате действия этого анаболического пути LX имеют очень короткий период полураспада in vivo , epi-LX имеют более длительный in vivo период полураспада и, следовательно, большую эффективность, чем их эпимеры LX, а синтетические липоксины метаболически устойчивы к этому пути. были приготовлены, использованы на животных моделях для изучения активности LX и протестированы в качестве потенциальных терапевтических агентов на животных и людях. [5] [7]
Подобно различным другим метаболитам АК, таким как LTA4 и 5-оксо-эйкозатетраеновая кислота , клетки и ткани могут превращать LX в 20-гидрокси-продукты путем омега-окисления ; также было показано, что они связывают LXA 4 с глутатионом с образованием цистеинил-липоксинов , первоначально LXC 4 , который затем последовательно метаболизируется до LXD 4 и LXE 4 . [9] Роль этих путей в ограничении или усилении активности LX полностью не оценена.
Эндоканнабиноидная система
[ редактировать ]Противовоспалительный липидный липоксин А 4 является эндогенным аллостерическим усилителем CB1 каннабиноидного рецептора . Липоксин А 4 усиливает сродство анандамида к этому рецептору , оказывая каннабимиметические эффекты в головном мозге , аллостерически усиливая передачу сигналов AEA и тем самым усиливая эффекты этого эндоканнабиноида как in vitro , так и in vivo . В дополнение к этому, липоксин А 4 проявляет защитное действие, зависимое от рецептора CB1, против β-амилоидом вызванного нарушения пространственной памяти у мышей. [10]
Аналоги липоксина
[ редактировать ]Относительно стабильные, т.е. метаболически устойчивые, синтетические аналоги LX и запускаемые аспирином 15-эпи-LXA 4 могут имитировать многие из желательных противовоспалительных и «способствующих разрешению» действий нативных LX и проходят испытания для клинического использования. [11] [12] Структурно эти аналоги LX часто имитируют LX, поскольку они представляют собой 20-углеродную тригидроксижирную кислоту или очень похожи на нее, но устойчивы к метаболической инактивации 15-гидроксипростагландиндегидрогеназы за счет объемной или другой структурной модификации вблизи их 15-гидрокси-остатков. [5] Например, некоторые аналоги просто изменяют структуру LX путем: замены атома водорода на метильный остаток при углероде 15 в LXA 4 с образованием 15-метил-LXA 4 ; замену последних 4 атомов углерода LXA 4 или 15-эпи-LXA 4 на остаток 1-фенокси или остаток 1-фенокси-4-фтора с образованием 16-фенокси-LX 4 , 15-эпи-15-фенокси-LXA 4 , 16-(пара-фтор-фенокси-LXA 4 или 15-эпи-16-(пара-фтор-фенокси-LXA 4 ) ; и образование связи между углеродом 9 и углеродом 14 LXA 4 с образованием внутреннего аналога фенильного кольца, называемого ароматический LXA 4 ; другие, более сложные структурные аналоги, находящиеся в разработке, включают аналоги 15-эпи-LXA 4 , называемые ZK-142 и ZK994. [5]
Биологическая активность
[ редактировать ]Клеточные исследования
[ редактировать ]На начальных стадиях многих острых воспалительных реакций поврежденные ткани, проникновение патогенов и другие местные явления заставляют близлежащие клетки вырабатывать и высвобождать провоспалительные метаболиты, производные арахидоновой кислоты, такие как: лейкотриены (LT), например LTB 4 , LTB 4 , LTC 4 , LTD 4 и LTE 4 ; гидроксиэйкозатетраеновые кислоты (HETE), например 5-HETE и 12-HETE ; и оксоэйкозаноиды (оксо-ЭТЕ), например 5-оксо-эйкозатетраеновая кислота (5-оксо-ЭТЕ) и 12-оксо-ЭТЕ. Эти метаболиты действуют прямо или косвенно, привлекая циркулирующие лейкоциты, тканевые макрофаги и тканевые дендритные клетки к поврежденному участку ткани. Последующая конгрегация различных типов клеток способствует трансклеточным путям формирования специализированных провоспалительных медиаторов (СПМ), включая LX, которые затем начинают стимулировать клеточные и тканевые реакции, которые имеют тенденцию обратить вспять действия провоспалительных медиаторов, ослабить и обратить вспять воспалительную реакцию и инициировать восстановление тканей. [13]
LXA 4 и 15-эпи-LXA 4 с высоким сродством представляют собой лиганды рецептора и активаторы рецептора FPR2 . FPR2, который теперь называется рецептором ALX, ALX/FPR или ALX/FPR2, представляет собой рецептор, связанный с G-белком, первоначально идентифицированный как рецептор фактора хемотаксиса лейкоцитов , N-формилметионин-лейцил-фенилаланина (FMLP), на основе его сходство аминокислотной последовательности с известным рецептором FMLP, FPR1 . У мышей обнаружено не менее шести гомологов этого рецептора. ALX/FPR представляет собой беспорядочный (т.е. взаимодействующий с различными лигандами) рецептор, который связывает и активирует другие лиганды, включая: а) различные N-формилолигопептиды, которые, как и FMLP, либо высвобождаются микробами и митохондриями , либо являются аналогами тех, которые высвобождаются микроорганизмами и митохондриями. микробы и митохондрии; б) нонформильные олигопептиды микробного происхождения; в) определенные полипептиды, которые связаны с развитием хронического амилоидоза и/или воспаления, включая белки сывороточного амилоида А (SAA), пептидную форму из 42 аминокислот бета- амилоида, называемую Aβ42, гуманин и отщепленный растворимый фрагмент (аминокислоты 274–388) рецептора урокиназы ; и г) другие СЗМ, включая резольвины RvD1, RvD2, RvD5, AT-RvD1 и RvD3 (см. Специализированные медиаторы про-разрешения ). [5] [7] [14]
LXA 4 и 15-эпи-LXA 4 ингибируют хемотаксис , трансмиграцию , генерацию супероксида, активацию NF-κB и/или генерацию провоспалительных цитокинов (например, IL8 , IL13 , IL12 и IL5 ) нейтрофилами, эозинофилами, моноцитами , врожденными лимфоидные клетки и/или макрофаги , а также подавляют пролиферацию и выработку IgM и IgG антител В-лимфоцитами . Эти действия, по-видимому, включают стимуляцию противовоспалительных сигнальных путей, а также блокирование действия других лигандов ALX/FPR, которые имитируют провоспалительные пути. [5] [6] [13] [15] Трансгенные мыши, созданные для сверхэкспрессии ALX/FPR, демонстрируют заметно сниженные воспалительные реакции на различные повреждения. [4] LXA 4 и 15-эпи-LXA 4 при интратекальном введении грызунам подавляют восприятие воспалительной боли; это действие может включать рецептор ALX/FPR, который, как показано, присутствует на спинальных астроцитах подопытного животного, и, на основании исследований с использованием 15-epi-LXA, ингибирование сигнального комплекса NALP1 воспалительного . [6] [16]
По механизмам, которые еще предстоит четко определить, два LX также: а) стимулируют способность лейкоцитов и эпителиальных клеток дыхательных путей уничтожать бактерии; б) блокируют выработку провоспалительного цитокина TNFα , одновременно увеличивая выработку противовоспалительного цитокина CCR5 лимфоцитами Т- ; в)' повышают способность моноцитов и макрофагов фагоцитировать (т.е. поглощать) и тем самым удалять потенциально вредные апоптотические нейтрофилы и эозинофилы из участков воспаления (см. Эффероцитоз ) либо путем прямого воздействия на эти клетки, либо путем стимуляции NK-клеток к этому; г) заставляют различные типы клеток снижать выработку провоспалительных активных форм кислорода и экспрессию молекул клеточной адгезии , а также увеличивать выработку ингибитора тромбоцитов PGI2 и сосудорасширяющего средства оксида азота ; д) ингибируют выработку провоспалительных цитокинов мезангиальными клетками , фибробластами и другими типами провоспалительных клеток; и f) уменьшить восприятие боли из-за воспаления. [5] [6] [13] [15]
LXA 4 и 15-epi-LTA 4 также действуют путем мобилизации факторов транскрипции, которые регулируют экспрессию различных генов, регулирующих воспаление. LXA 4 стимулирует различные типы клеток, способствуя проникновению Nrf2 в ядро и тем самым увеличивая экспрессию генов, таких как гемоксигеназа-1 (HMOX1), которая увеличивает выработку противовоспалительного газообразного сигнального агента, оксида углерода и генов. участвует в синтезе глутатиона , продукта, который нейтрализует окислительный стресс и вызванное окислителями повреждение тканей. [17] [18] Метаболически устойчивые структурные аналоги LXB 4 и 15-эпи-LXA 4 ингибируют образование пероксинитрита (т.е. ONOO − ) ослабить мобилизацию транскрипционных факторов NFκB и AP-1 за счет уменьшения их накопления в ядрах нейтрофилов, моноцитов и лимфоцитов; NFκB и AP-1 повышают экспрессию провоспалительных генов. Два LXB также вызывают активацию супрессора сигнальных белков цитокинов (см. Белки SOCS ), которые, в свою очередь, ингибируют активацию факторов транскрипции белка STAT , которые активируют многие гены, производящие провоспалительные продукты. [7]
LXA 4 и 15-epi-LXA 4 с высоким сродством также являются антагонистами к цистеинил-лейкотриеновому рецептору 1 , для которого лейкотриены (LT) LTC4 , LTD4 и LTE4 являются агонистами , т.е. три лейкотриена связываются и тем самым стимулируют сокращение гладких мышц, хемотаксис эозинофилов. , секрецию слизистых желез и различные другие проаллергические реакции в клетках легких, кожи и других тканей. [4] [19] (CysLT1 и ATX/FPR2 имеют идентичность аминокислотных последовательностей 47%. [19] ) Способность этих LX блокировать действие трех LT может способствовать их способности разрешать аллергические реакции; например, LXA4 расслабляет сокращение гладких мышц, вызванное цистеиниловыми лейкотриенами в анализе защечного мешка хомяка , а метаболически устойчивый аналог 15-epi-LXAA 4 эффективно ингибирует аллерген -обусловленную гиперчувствительность и воспаление дыхательных путей на мышиной модели. [4] [19] [20]
При более высоких концентрациях (>30 нмоль/литр) LXA 4 связывается с AHR , арилуглеводородным рецептором; после этого связывания AHR попадает в ядро, где соединяется с ядерным транслокатором AhR (ARNT). Комплекс AHR/ARNT связывается с элементами ответа на ксенобиотики, активируя транскрипцию генов, большинство из которых участвуют в основном в метаболизме ксенобиотиков . Эти гены включают SOCS2 (т.е. супрессор передачи сигналов цитокинов 2), CYP1A1 , CYP1A2 , CYP1B1 , субъединицу Ya глутатион S-трансферазы , хиноноксидоредуктазу, UDP-глюкуронозилтрансферазу и семейство альдегиддегидрогеназы 3, член A1 . Эта активность LXA 4 была продемонстрирована только в мышиных клетках. [21] [22]
LXA 4 связывается и активирует альфа-рецептор эстрогена с IC50 46 нМ. Было показано, что LXA 4 и ATLa активируют транскрипционные и функциональные (щелочная фосфатаза и пролиферация) ответы через ERa в эндометрия эпителиальных клетках человека in vitro и в ткани матки мыши in vivo . Интересно, что LXA 4 также продемонстрировал антиэстрогенный потенциал, значительно ослабляя активность, индуцированную E2. В мышиной модели эндометриоза физиологически значимые концентрации ATLa вызывали уменьшение размера очага поражения и влияли на выработку медиаторов воспаления. Молекулы, регулируемые с помощью ERa, также подверглись воздействию, а это означает, что липоксин А 4 и его аналоги, ингибирующие как пролиферативные, так и воспалительные пути, можно рассматривать как потенциальные терапевтические средства. [23] [24]
Действия LXB 4 и 15-epi-LXB 4 гораздо менее четко определены, чем действия их аналогов LXA 4 . Их механизм стимуляции клеток-мишеней (например, рецепторов) неизвестен. Было показано, что один или оба этих аналога ингибируют привлечение нейтрофилов к участкам воспаления, ингибируют цитотоксичность NK-клеток , стимулируют привлечение моноцитов к участкам воспаления, усиливают фагоцитоз макрофагов и подавляют восприятие воспалительной боли у грызунов. [5] [6] [25]
Исследования на животных моделях
[ редактировать ]Неинфекционное воспаление
[ редактировать ]Было продемонстрировано, что один или несколько липоксинов или их метаболически резистентных аналогов подавляют, ограничивают тяжесть и/или увеличивают выживаемость при широком спектре воспалительных и аллергических заболеваний, как было оценено в модельных исследованиях на мышах и крысах. Эти исследования включают модели экспериментально вызванного: эндометриоза [26] , колит , перитонит , панкреатит , воспаление почек и гломерулонефрит , легочная астма , кислотное поражение легких , муковисцидоз , плеврит , воспаление головного мозга и воспалительный компонент болезни Альцгеймера , ишемически-реперфузионное поражение сосудов различных органов, включая сердце и задние конечности , отторжение трансплантата сердца, почек и костного мозга , артрит , дерматит , пародонтит , воспаление роговицы , вызванные воспалением , а также боль и гипералгезия . [5] [7] [4]
Воспаление, связанное с инфекцией
[ редактировать ]Липоксины оказывают защитное действие на животных моделях инфекционного воспаления: а) LXA 4 и аналог LXA 4 уменьшают системное воспаление и улучшают выживаемость на крысиных моделях грамотрицательного бактериального сепсиса ; [13] [27] б) 15-эпи-LXA 4 подавлял повреждение легких (т.е. шок легких или острый респираторный дистресс-синдром ), вызванное внутрибрюшинной инъекцией Escherichia coli мышам; в) трансгенные мыши, у которых был нарушен синтез липоксина в результате делеции их гена Alox5, были более восприимчивы к воспалительным и летальным эффектам Toxoplasma gondii и были спасены от этих дефектов с помощью LXA4 4 ; [28] г) LXA 4 восстанавливал функцию макрофагов, вызванную респираторно-синцитиальным вирусом, у трансгенных мышей с дефицитом синтеза липоксина в результате Alox5 ; делеции гена [13] д) LXA 4 облегчал инфекционный пародонтит на моделях кроликов и свиней; [13] f) 15-epi-LXA 4 снижал уровень паразитов в крови, уменьшал воспаление сердца и повышал выживаемость на мышиной модели Trypanosoma cruzi , индуцированной болезни Шагаса ; [28] f') 15-epi-LXA 4 продлевает выживаемость на мышиной модели Plasmodium berghei ; церебральной малярии, индуцированной [28] и g) LXA 4 сокращает продолжительность аллергического ответа на паразитарное заражение Angiostrongylus costaricensis . [13]
Однако в этих моделях липоксины также оказывают вредное воздействие: аэрозольное заражение Mycobacterium Tuberculosis у трансгенных мышей, дефектных по ALOX5, который способствует синтезу LX, демонстрировало гораздо менее тяжелое воспаление и лучшую выживаемость, чем контрольные мыши; [28] и лечение трансгенных мышей пероральным LXA 4 обратило вспять защитный эффект делеции ALOX5. [28]
Человеческие исследования
[ редактировать ]Доклинические исследования
[ редактировать ]LX и epi-LX были обнаружены в различных тканях человека, подвергающихся широкому спектру воспалительных реакций, аллергических реакций и других состояний, например, в крови пациентов, перенесших коронарную ангиопластику или напряженные физические нагрузки. [5] [6] [25] LXA 4 ингибирует сократительное действие LTC4 на бронхи и расслабляет предварительно сокращенные бронхи у астматиков. [4]
Герпесвирус, ассоциированный с саркомой Капоши (KSHV), вызывает злокачественную трансформацию клеток человека и ответственен за саркому Капоши и первичную выпотную лимфому , два вида рака, которые поражают, в частности, людей, инфицированных ВИЧ . Исследования на клетках саркомы Капоши и первичной выпотной лимфомы человека показывают, что: а) KSHV способствует выработке провоспалительных цитокинов, липоксигеназ, циклооксигеназы и метаболитов последних двух классов ферментов, одновременно подавляя выработку противовоспалительных сигнальных агентов, таких как LXA. 4 , по-видимому, как стратегия, способствующая его латентности и способности к злокачественной трансформации; б) клетки саркомы Капоши и первичной выпотной лимфомы экспрессируют рецептор ALX/FPR; и c)' обработка последних клеток LXA 4 или 15-epi-LXA 4 обращает вспять этот предзлокачественный профиль провоспалительной передачи сигналов с помощью ALX/FPR-зависимого механизма. Эти исследования предполагают, что два LX или их аналоги следует протестировать на животных моделях, чтобы определить, могут ли они быть полезны для лечения двух злокачественных опухолей человека. [7] [29]
Клинические исследования
[ редактировать ]В рандомизированном контролируемом исследовании местное применение 15-epi-LXA4 или сравнительно стабильного аналога LXB4, 15 R/S -метил-LXB4, уменьшало тяжесть экземы в исследовании с участием 60 младенцев. [30] [31]
В настоящее время BLXA4, аналог липоксина, проходит фазу 1 клинических испытаний и в настоящее время набирает добровольцев для лечения гингивита полости рта (см.: Безопасность и предварительная эффективность полоскания для полости рта аналога липоксина BLXA4-ME для лечения гингивита (BLXA4) по адресу https:// Clinicaltrials.gov/ct2/show/NCT02342691?term=Lipoxin&rank=3 ). [7]
См. также
[ редактировать ]- Эпилипоксины
- Специализированные посредники по разрешению споров
- 15-гидроксиэйкозатетраеновая кислота
Ссылки
[ редактировать ]- ^ Серхан CN, Хамберг М, Самуэльссон Б (1984). «Тригидрокситетраены: новая серия соединений, образующихся из арахидоновой кислоты в лейкоцитах человека». Связь с биохимическими и биофизическими исследованиями . 118 (3): 943–9. дои : 10.1016/0006-291x(84)91486-4 . ПМИД 6422933 .
- ^ Цюй Цюй, Сюань В, Фань Г.Х. (2015). «Роль резольвинов в разрешении острого воспаления». Международная клеточная биология . 39 (1): 3–22. дои : 10.1002/cbin.10345 . ПМИД 25052386 . S2CID 10160642 .
- ^ Вейландт К.Х. (2016). «Метаболиты и медиаторы, производные докозапентаеновой кислоты - в двух словах новый мир медицины липидных медиаторов». Европейский журнал фармакологии . 785 : 108–15. дои : 10.1016/j.ejphar.2015.11.002 . ПМИД 26546723 .
- ^ Перейти обратно: а б с д и ж г Леви Б.Д. (2005). «Липоксины и аналоги липоксинов при астме». Простагландины, лейкотриены и незаменимые жирные кислоты . 73 (3–4): 231–7. дои : 10.1016/j.plefa.2005.05.010 . ПМИД 16046112 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м Романо М, Чианчи Э, Симеле Ф, Реккиути А (2015). «Липоксины и липоксины, вызываемые аспирином, в разрешении воспаления». Европейский журнал фармакологии . 760 : 49–63. дои : 10.1016/j.ejphar.2015.03.083 . ПМИД 25895638 .
- ^ Перейти обратно: а б с д и ж г Маркворт Дж. Ф., Маддипати К. Р., Кэмерон-Смит Д. (2016). «Новая роль про-разрешающих липидных медиаторов в иммунологических и адаптивных реакциях на мышечные травмы, вызванные физической нагрузкой». Обзор иммунологии упражнений . 22 : 110–34. ПМИД 26853678 .
- ^ Перейти обратно: а б с д и ж г час Чандрасекхаран Дж.А., Шарма-Валиа Н. (2015). «Липоксины: природный способ устранения воспаления» . Журнал исследований воспаления . 8 : 181–92. дои : 10.2147/JIR.S90380 . ПМК 4598198 . ПМИД 26457057 .
- ^ МакМахон, Блейтин и Годсон, Кэтрин (2004). «Липоксины: эндогенные регуляторы воспаления» . Американский журнал физиологии. Почечная физиология . 286 (2): F189-201. дои : 10.1152/ajprenal.00224.2003 . ПМИД 14707005 . Архивировано из оригинала 25 января 2010 г. Проверено 7 февраля 2006 г. Приглашенная обзорная статья.
- ^ Пауэлл В.С., Чанг Д., Гравий С. (1995). «5-Оксо-6,8,11,14-эйкозатетраеновая кислота является мощным стимулятором миграции эозинофилов человека» . Дж. Иммунол . 154 (8): 4123–32. дои : 10.4049/jimmunol.154.8.4123 . ПМИД 7706749 . S2CID 35712418 .
- ^ Памплона, Фабрисио А.; Феррейра, Хулиано; Менезеш де Лима, Октавио; Дуарте, Филипе Сильвейра; Бенто, Эллиссон Фрейре; Форнер, Стефания; Вильяриньо, Жардел Дж.; Беллоккьо, Луиджи; Вотьяк, Карстен Т. (18 декабря 2012 г.). «Противовоспалительный липоксин А4 является эндогенным аллостерическим усилителем каннабиноидного рецептора CB1» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (51): 21134–21139. Бибкод : 2012PNAS..10921134P . дои : 10.1073/pnas.1202906109 . ISSN 0027-8424 . ПМК 3529012 . ПМИД 23150578 .
- ^ МакМахон Б., Митчелл С., Брэди Х.Р. (2001). «Липоксины: открытия по разрешению». Тренды Фармакол. Наука . 22 (8): 391–5. дои : 10.1016/S0165-6147(00)01771-5 . ПМИД 11478982 .
- ^ Липосакция Тампы
- ^ Перейти обратно: а б с д и ж г Бэзил MC, Леви BD (2016). «Специализированные проразрешающие медиаторы: эндогенные регуляторы инфекции и воспаления» . Обзоры природы. Иммунология . 16 (1): 51–67. дои : 10.1038/nri.2015.4 . ПМЦ 5242505 . ПМИД 26688348 .
- ^ Йе Р.Д., Буле Ф., Ван Дж.М., Дальгрен С., Жерар С., Парментье М., Серхан К.Н., Мерфи П.М. (2009). «Международный союз фундаментальной и клинической фармакологии. LXXIII. Номенклатура семейства формилпептидных рецепторов (FPR)» . Фармакологические обзоры . 61 (2): 119–61. дои : 10.1124/пр.109.001578 . ПМЦ 2745437 . ПМИД 19498085 .
- ^ Перейти обратно: а б Чан Н.; Арита М. и Серхан К.Н. (2005). «Противовоспалительная схема: липоксин, липоксины, запускаемые аспирином, и их рецептор ALX». Простагландины, лейкотриены и незаменимые жирные кислоты . 73 (3–4): 163–177. дои : 10.1016/j.plefa.2005.05.003 . ПМИД 16125378 .
- ^ Ли Ц, Тянь Ю, Ван ЗФ, Лю СБ, Ми ВЛ, Ма ХДж, Ву GC, Ван Дж, Ю Дж, Ван YQ (2013). «Участие спинального воспаления NALP1 в нейропатической боли и аналгезии, вызванной аспирином-15-эпилипоксином А4». Нейронаука . 254 : 230–40. doi : 10.1016/j.neuroscience.2013.09.028 . ПМИД 24076348 . S2CID 207253564 .
- ^ Чен XQ, Ву Ш, Чжоу Ю, Тан ЮР (2013). «Гемоксигеназа-1, индуцированная липоксином А4, защищает кардиомиоциты от повреждений, вызванных гипоксией/реоксигенацией, посредством активации p38 MAPK и комплекса Nrf2/ARE» . ПЛОС ОДИН . 8 (6): е67120. Бибкод : 2013PLoSO...867120C . дои : 10.1371/journal.pone.0067120 . ПМЦ 3691153 . ПМИД 23826208 .
- ^ Ву Л, Ли ХХ, Ву Ц, Мяо С, Лю ЗДжей, Ву П, Йе ДЮ (2015). «Липоксин А4 активирует путь Nrf2 и уменьшает повреждение клеток в культивируемых кортикальных астроцитах, подвергшихся кислородно-глюкозной депривации/реперфузии». Журнал молекулярной нейронауки . 56 (4): 848–57. дои : 10.1007/s12031-015-0525-6 . ПМИД 25702137 . S2CID 14077073 .
- ^ Перейти обратно: а б с Гронерт К., Мартинссон-Нисканен Т., Раваси С., Чанг Н., Серхан К.Н. (2001). «Селективность рекомбинантных человеческих рецепторов лейкотриена D (4), лейкотриена B (4) и липоксина A (4) с запускаемым аспирином 15-эпи-LXA (4) и регуляцией сосудистых и воспалительных реакций» . Американский журнал патологии . 158 (1): 3–9. дои : 10.1016/S0002-9440(10)63937-5 . ПМК 1850279 . ПМИД 11141472 .
- ^ Ван КС, Ву ВФ (2007). «Эйкозаноиды при астме». Acta Paediatrica Taiwanica = Тайвань Эр Кэ И Сюэ Хуэй За Чжи . 48 (6): 299–304. ПМИД 18437962 .
- ^ Шальдах К.М., Риби Дж., Бьелданес Л.Ф. (июнь 1999 г.). «Липоксин А4: новый класс лиганда рецептора Ah». Биохимия . 38 (23): 7594–600. дои : 10.1021/bi982861e . ПМИД 10360957 .
- ^ Беннетт М., Гилрой Д.В. (2016). «Липидные медиаторы воспаления» (PDF) . Микробиологический спектр . 4 (6): 343–366. doi : 10.1128/microbiolspec.MCHD-0035-2016 . ISBN 9781555819187 . ПМИД 27837747 .
- ^ Рассел Р., Гори И., Пеллегрини С., Кумар Р., Ахтари С., Кэнни ГО (декабрь 2011 г.). «Липоксин А4 — новый модулятор рецепторов эстрогена» . ФАСЕБ Дж . 25 (12): 4326–37. дои : 10.1096/fj.11-187658 . ПМИД 21885654 . S2CID 2715055 .
- ^ Шальдах К.М., Риби Дж., Бьелданес Л.Ф. (1999). «Липоксин А4: новый класс лиганда рецептора Ah». Биохимия . 38 (23): 7594–600. дои : 10.1021/bi982861e . ПМИД 10360957 .
- ^ Перейти обратно: а б Элажами Т.К., Колас Р.А., Далли Дж., Чанг Н., Серхан К.Н., Велти ФК (2016). «Специализированные проразрешающие липидные медиаторы у пациентов с ишемической болезнью сердца и их потенциал для ремоделирования тромбов» . Журнал ФАСЭБ . 30 (8): 2792–801. дои : 10.1096/fj.201500155R . ПМК 4970606 . ПМИД 27121596 .
- ^ Кумар Р., Клерк А.С., Гори И., Рассел Р., Пеллегрини С., Говендер Л., Висс Дж.К., Гольшаян Д., Кэнни ГО (февраль 2014 г.). «Липоксин А4 предотвращает прогрессирование De Novo и установившегося эндометриоза на мышиной модели путем ослабления выработки простагландина E2 и передачи сигналов эстрогена» . ПЛОС ОДИН . 9 (2): e89742, 1–14. Бибкод : 2014PLoSO...989742K . дои : 10.1371/journal.pone.0089742 . ПМЦ 3933674 . ПМИД 24587003 .
- ^ Ву Б, Уокер Дж, Спер Б, Родригес А, Инь К (2015). «Влияние липоксина А4 на антимикробное действие нейтрофилов при сепсисе». Простагландины, лейкотриены и незаменимые жирные кислоты . 94 : 55–64. дои : 10.1016/j.plefa.2014.11.005 . ПМИД 25476955 .
- ^ Перейти обратно: а б с д и Рассел CD, Шварце Дж. (2014). «Роль липидных медиаторов, способствующих разрешению инфекционных заболеваний» . Иммунология . 141 (2): 166–73. дои : 10.1111/imm.12206 . ПМЦ 3904237 . ПМИД 24400794 .
- ^ Чандрасекхаран Дж.А., Хуанг Х.М., Хван А., Шарма-Валия Н. (2016). «Изменение противовоспалительного микроокружения липоксина: новый взгляд на патогенез KSHV» . Журнал вирусологии . 90 (24): 11020–11031. дои : 10.1128/JVI.01491-16 . ПМК 5126361 . ПМИД 27681120 .
- ^ У Ш, Чен XQ, Лю Б, Ву HJ, Донг Л (2013). «Эффективность и безопасность 15 (R/S)-метиллипоксина А (4) при местном лечении детской экземы». Британский журнал дерматологии . 168 (1): 172–8. дои : 10.1111/j.1365-2133.2012.11177.x . ПМИД 22834636 . S2CID 31721094 .
- ^ Аслам I, Сандовал Л.Ф., Фельдман С.Р. (2014). «Что нового в местном лечении аллергических заболеваний кожи». Современное мнение в области аллергии и клинической иммунологии . 14 (5): 436–50. doi : 10.1097/ACI.0000000000000093 . ПМИД 25061854 . S2CID 20136504 .
Внешние ссылки
[ редактировать ]- Липоксины Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)