Малатдегидрогеназа (оксалоацетатдекарбоксилирующая) (НАДФ) + )
| НАДФ-яблочный фермент | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 1.1.1.40 | ||
| Номер CAS. | 9028-47-1 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Малатдегидрогеназа (оксалоацетатдекарбоксилирующая) (НАДФ) + ) ( КФ 1.1.1.40 ) или НАДФ-яблочный фермент (НАДФ-МЭ) — фермент химическую , катализирующий реакцию в присутствии иона двухвалентного металла: [ 1 ]
- (S)-малат + НАДФ + пируват + СО 2 + НАДФН
Таким образом, двумя субстратами этого фермента являются (S)-малат и НАДФ. + , тогда как его тремя продуктами являются пируват , CO 2 и НАДФН . Малат окисляется до пирувата и СО 2 , и НАДФ. + восстанавливается до НАДФН.
Этот фермент принадлежит к семейству оксидоредуктаз , а именно тех, которые действуют на группу CH-OH донора с НАД. + или НАДФ + как акцептор. Систематическое название этого класса ферментов — (S)-малат:НАДФ. + оксидоредуктаза (оксалоацетатдекарбоксилирующая) . Этот фермент участвует в метаболизме пирувата и фиксации углерода . НАДФ-яблочный фермент является одним из трех ферментов декарбоксилирования, используемых в механизмах концентрации неорганического углерода C4 и CAM- растений. Остальные представляют собой НАД-малеиновый фермент и PEP-карбоксикиназу . [ 2 ] [ 3 ] Хотя часто преобладает одна из трех фотосинтетических декарбоксилаз, показано также одновременное действие всех трех. [ 4 ]
Структура фермента
[ редактировать ]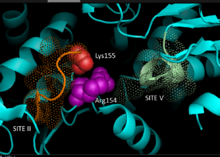
На основе кристаллографии данных гомологичных НАДФ-зависимых яблочных ферментов млекопитающих . разработана 3D-модель С4-пути НАДФ-МЭ в растениях, идентифицирующая ключевые остатки, участвующие в связывании субстрата или катализе Связывание динуклеотидов включает два богатых глицином мотива GXGXXG, гидрофобную бороздку, включающую по меньшей мере шесть аминокислотных остатков, и отрицательно заряженный остаток на конце βB-цепи. [ 5 ] [ 6 ] Первичная последовательность первого мотива, 240 ГЛГДЛГ 245 , является консенсусным маркером связывания фосфата, что свидетельствует об участии в связывании NADP, в то время как другой богатый глицином мотив принимает классическую складку Россмана - также типичный маркер NADP связывания кофактора . [ 7 ] Эксперименты по мутагенезу NADP-ME кукурузы подтвердили текущую модель. [ 1 ] Замена глицина на валин в любой области мотива сделала фермент полностью неактивным, в то время как спектральный анализ не выявил серьезных изменений по сравнению с формой дикого типа. Данные свидетельствуют о прямом нарушении ключевого остатка, участвующего в связывании или катализе, а не междоменного остатка, влияющего на конформационную стабильность. ключевой остаток аргинина Кроме того, было показано, что в сайте 237 взаимодействует как с малатом , так и с НАДФ. + субстраты, образующие ключевые благоприятные электростатические взаимодействия с отрицательно заряженной карбоновой кислотой и фосфатной группой соответственно. Еще предстоит выяснить, играет ли этот остаток роль в связывании субстрата или позиционировании субстрата для катализа. [ 8 ] Остаток лизина 255 играет роль каталитической основы реактивности ферментов; однако для окончательного установления его биохимической роли все еще необходимы дальнейшие исследования. [ 1 ]
Структурные исследования
[ редактировать ]По состоянию на 2007 год [update] 3 структуры Для этого класса ферментов были решены PDB с кодами доступа 1GQ2 , 1GZ4 и 2AW5 . [ нужна ссылка ]
Биологическая функция
[ редактировать ]В более широком контексте яблочные ферменты обнаруживаются в широком спектре эукариотических организмов, от грибов до млекопитающих, и, кроме того, показано, что они локализуются в ряде субклеточных мест, включая цитозоль , митохондрии и хлоропласты . С 4 НАДФ-МЭ, в частности, у растений локализуется в хлоропластах оболочки пучка . [ 1 ]
C 4 Во время фотосинтеза , развитого пути увеличения локализованных концентраций CO 2 под угрозой усиленного фотодыхания , CO 2 захватывается клетками мезофилла , фиксируется в виде оксалоацетата , превращается в малат и высвобождается внутри клеток оболочки пучка, чтобы непосредственно подпитывать RuBisCO . активность [ 9 ] Это высвобождение фиксированного CO 2 , вызванное благоприятным декарбоксилированием малата в пируват , опосредовано НАДФ-зависимым яблочным ферментом. Фактически, значимость активности НАДФ-МЭ в сохранении CO 2 подтверждается исследованием, проведенным на трансгенных растениях, демонстрирующих мутацию потери функции НАДФ-МЭ. Растения с мутацией испытывали на 40% активность НАДФ-МЭ дикого типа и достигли значительного снижения поглощения CO 2 даже при высоких межклеточных уровнях CO 2 , что доказывает биологическую важность НАДФ-МЭ в регулировании потока углерода в направлении цикла Кальвина . [ 10 ] [ 11 ]
Регуляция ферментов
[ редактировать ]НАДФ-МЭ экспрессия Было показано, что регулируется факторами абиотического стресса. Для растений CAM условия засухи приводят к тому , что устьица в основном остаются закрытыми, чтобы избежать потери воды за счет эвапотранспирации , что, к сожалению, приводит к нехватке CO 2 . В качестве компенсации закрытая стома активирует трансляцию НАДФ-МЭ, чтобы усилить высокую эффективность ассимиляции CO 2 во время коротких интервалов потребления CO 2 , позволяя фиксацию углерода продолжать .
Помимо регуляции в более длительном масштабе времени посредством контроля экспрессии, регуляция в кратковременном масштабе может происходить посредством аллостерических механизмов. C 4 Было показано, что NADP-ME частично ингибируется его субстратом малатом, что указывает на наличие двух независимых сайтов связывания: одного в активном сайте и одного в аллостерическом сайте. Однако ингибирующий эффект зависит от pH – он существует при pH 7, но не при pH 8. Контроль активности фермента за счет изменений pH согласуется с гипотезой о том, что НАДФ-МЭ наиболее активен во время фотосинтеза : Активный Световые реакции приводят к повышению основности в хлоропласта строме , расположению НАДФ-МЭ, что приводит к уменьшению ингибирующего действия малата на НАДФ-МЭ и тем самым способствует переходу в более активное состояние. И наоборот, замедление световых реакций приводит к повышению кислотности стромы, способствуя ингибированию НАДФ-МЭ малатом. Поскольку высокоэнергетические продукты световых реакций , НАДФН и АТФ , необходимы для Чтобы продолжить цикл Кальвина , накопление CO 2 без них бесполезно, что объясняет необходимость в регулирующем механизме. [ 12 ]
Этот белок может использовать морфеиновую модель аллостерической регуляции . [ 13 ]
Эволюция
[ редактировать ]НАДФ-яблочный фермент, как и все другие C 4 декарбоксилазы, не эволюционировал de novo для объединения CO 2 в пользу RuBisCO . [ 14 ] Скорее, НАДФ-МЭ был непосредственно трансформирован из вида C 3 в ходе фотосинтеза и даже раньше произошел от древнего цистольного предка . В цитозоле фермент существовал в виде ряда изоформ «домашнего хозяйства» , предназначенных для выполнения различных функций, включая поддержание уровня малата во время гипоксии , разделение микроспор и защиту от патогенов . Что касается механизма эволюции, функциональность C 4 , как полагают, возникла из-за ошибки дупликации гена как внутри промоторных областей, вызывая сверхэкспрессию в клетках оболочки пучка, так и внутри кодирующей области, вызывая неофункционализацию . [ 15 ] Выбор функции сохранения CO 2 , а также улучшенного использования воды и азота в стрессовых условиях был обусловлен естественным давлением. [ 16 ]
См. также
[ редактировать ]- ME1 (ген человека)
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Детарсио Э., Уилер М.К., Кампос Бермудес В.А., Андрео К.С., Дринкович М.Ф. (апрель 2003 г.). «НАДФ-яблочный фермент C4 кукурузы. Экспрессия в Escherichia coli и характеристика сайт-направленных мутантов по предполагаемым сайтам связывания нуклеозидов» . Журнал биологической химии . 278 (16): 13757–64. дои : 10.1074/jbc.M212530200 . ПМИД 12562758 .
- ^ Канаи, Рюзи; Эдвардс, Джеральд Э. (1999). «Биохимия фотосинтеза C 4 » . В Сейдже, Роуэн Ф.; Монсон, Рассел К. (ред.). C 4 Биология растений . Академическая пресса. стр. 49–87. ISBN 978-0-08-052839-7 .
- ^ Кристофер Дж. Т., Холтум Дж. (сентябрь 1996 г.). «Закономерности распределения углерода в листьях видов толстянковых кислотного метаболизма во время нейтрализации кислотности» . Физиология растений . 112 (1): 393–399. дои : 10.1104/стр.112.1.393 . ПМК 157961 . ПМИД 12226397 .
- ^ Фурумото Т., Хата С., Изуи К. (октябрь 1999 г.). «Клонирование кДНК и характеристика фосфоенолпируваткарбоксикиназы кукурузы, фермента, специфичного для клеток оболочки пучка». Молекулярная биология растений . 41 (3): 301–11. дои : 10.1023/A:1006317120460 . ПМИД 10598098 . S2CID 8302572 .
- ^ Россман, Майкл Г.; Лильяс, Андерс; Бранден, Карл-Ивар; Банасзак, Леонард Дж. (1975). «Эволюционные и структурные связи между дегидрогеназами». В Бойере, Пол Д. (ред.). Ферменты . Том. 11. С. 61–102. дои : 10.1016/S1874-6047(08)60210-3 . ISBN 978-0-12-122711-1 .
- ^ Белламачина CR (сентябрь 1996 г.). «Мотив связывания никотинамиддинуклеотида: сравнение белков, связывающих нуклеотиды» . Журнал ФАСЭБ . 10 (11): 1257–69. дои : 10.1096/fasebj.10.11.8836039 . ПМИД 8836039 .
- ^ Ротермель Б.А., Нельсон Т. (ноябрь 1989 г.). «Первичная структура НАДФ-зависимого яблочного фермента кукурузы» . Журнал биологической химии . 264 (33): 19587–92. дои : 10.1016/S0021-9258(19)47154-8 . ПМИД 2584183 .
- ^ Коулман, Дэвид Э.; Рао, Г.С. Джаганнатха; Голдсмит, Э.Дж.; Кук, Пол Ф.; Харрис, Бен Г. (июнь 2002 г.). «Кристаллическая структура яблочного фермента из Ascaris suum в комплексе с никотинамид-аденин-динуклеотидом при разрешении 2,3 Å». Биохимия . 41 (22): 6928–38. дои : 10.1021/bi0255120 . ПМИД 12033925 .
- ^ Эдвардс Г.Е., Франчески В.Р., Вознесенская Е.В. (2004). «Одноклеточный фотосинтез C (4) в сравнении с парадигмой двух клеток (Кранц)» . Ежегодный обзор биологии растений . 55 : 173–96. doi : 10.1146/annurev.arplant.55.031903.141725 . ПМИД 15377218 .
- ^ Пенгелли Дж. Дж., Тан Дж., Фурбанк RT, фон Кеммерер С. (октябрь 2012 г.). «Антисмысловое снижение НАДФ-яблочного фермента у Flaveria bidentis уменьшает поток CO2 через цикл C4» . Физиология растений . 160 (2): 1070–80. дои : 10.1104/стр.112.203240 . ПМЦ 3461530 . ПМИД 22846191 .
- ^ Ратнам К.К. (январь 1979 г.). «Метаболическая регуляция потока углерода во время фотосинтеза C4: II. Доказательства in situ рефиксации фотодыхательного CO2 с помощью C 4 фосфоенолпируваткарбоксилазы». Планта . 145 (1): 13–23. дои : 10.1007/BF00379923 . ПМИД 24317560 . S2CID 22462853 .
- ^ Сайго М., Тронкони М.А., Джеррард Уиллер MC, Альварес CE, Дринкович М.Ф., Андрео CS (ноябрь 2013 г.). «Биохимические подходы к изучению эволюции фотосинтеза C4: на примере яблочных ферментов декарбоксилаз». Исследования фотосинтеза . 117 (1–3): 177–87. Бибкод : 2013PhoRe.117..177S . дои : 10.1007/s11120-013-9879-1 . hdl : 11336/7831 . ПМИД 23832612 . S2CID 17803651 .
- ^ Селвуд Т., Яффе ЭК (март 2012 г.). «Динамическая диссоциация гомоолигомеров и контроль функции белка» . Архив биохимии и биофизики . 519 (2): 131–43. дои : 10.1016/j.abb.2011.11.020 . ПМЦ 3298769 . ПМИД 22182754 .
- ^ Майер А., Зелл М.Б., Маурино В.Г. (май 2011 г.). «Малатдекарбоксилазы: эволюция и роль изоформ НАД (P)-ME у видов, осуществляющих фотосинтез C (4) и C (3)» . Журнал экспериментальной ботаники . 62 (9): 3061–9. дои : 10.1093/jxb/err024 . ПМИД 21459769 .
- ^ Монсон, Рассел К. (май 2003 г.). «Дупликация генов, неофункционализация и эволюция фотосинтеза C4». Международный журнал наук о растениях . 164 (С3): С43–С54. дои : 10.1086/368400 . S2CID 84685191 . ИНИСТ 14976375 .
- ^ Дринкович М.Ф., Казати П., Андрео К.С. (февраль 2001 г.). «НАДФ-яблочный фермент растений: повсеместно распространенный фермент, участвующий в различных метаболических путях» . Письма ФЭБС . 490 (1–2): 1–6. дои : 10.1016/S0014-5793(00)02331-0 . ПМИД 11172800 . S2CID 31317255 .
Дальнейшее чтение
[ редактировать ]- Харари, Исаак; Кори, Сол Р.; Очоа, Северо (август 1953 г.). «Биосинтез дикарбоновых кислот путем фиксации углекислого газа. VII. Равновесие реакции яблочного фермента» . Журнал биологической химии . 203 (2): 595–604. дои : 10.1016/S0021-9258(19)52329-8 . ПМИД 13084629 .
- Очоа С., Мелер А.Х., Корнберг А. (июль 1948 г.). «Биосинтез дикарбоновых кислот путем фиксации углекислого газа; выделение и свойства фермента из печени голубя, катализирующего обратимое окислительное декарбоксилирование 1-яблочной кислоты» . Журнал биологической химии . 174 (3): 979–1000. дои : 10.1016/S0021-9258(18)57307-5 . ПМИД 18871257 .
- Раттер В.Дж., Ларди Х.А. (август 1958 г.). «Очистка и свойства яблочного фермента печени голубей» . Журнал биологической химии . 233 (2): 374–82. дои : 10.1016/S0021-9258(18)64768-4 . ПМИД 13563505 .
- Stickland RG (декабрь 1959 г.). «Некоторые свойства яблочного фермента печени голубя. 1. Превращение малата в пируват» . Биохимический журнал . 73 (4): 646–54. дои : 10.1042/bj0730646 . ПМК 1197115 . ПМИД 13834656 .
- Stickland RG (декабрь 1959 г.). «Некоторые свойства яблочного фермента печени голубя. 2. Синтез малата из пирувата» . Биохимический журнал . 73 (4): 654–9. дои : 10.1042/bj0730654 . ПМК 1197116 . ПМИД 13834657 .
- Уокер Д.А. (февраль 1960 г.). «Физиологические исследования кислотного обмена. 7. Яблочный фермент каланхоэ крепчатого: влияние концентрации углекислого газа» . Биохимический журнал . 74 (2): 216–23. дои : 10.1042/bj0740216 . ПМК 1204145 . ПМИД 13842495 .

