Эпигенетика физических упражнений
Эпигенетика физических упражнений — это изучение эпигенетических модификаций клеточного генома, возникающих в результате физических упражнений. Было показано, что факторы окружающей среды, включая физические упражнения, оказывают благотворное влияние на эпигенетические модификации. В целом было показано, что кратковременные и длительные физические нагрузки оказывают значительное влияние на метилирование ДНК, важный аспект эпигенетических модификаций.
Более широкая область эпигенетики изучает наследственные изменения генов, которые не связаны с изменением самой последовательности ДНК. В следующем разделе кратко обсуждаются два важных механизма, участвующих в эпигенетических модификациях.
Эпигенетические модификации
[ редактировать ]Эпигенетические модификации, такие как метилирование ДНК и модификации гистонов, изменяют доступность ДНК и структуру хроматина, тем самым регулируя характер экспрессии генов. [1] Эти модификации могут передаваться по наследству, передаваясь, таким образом, от родителей к потомкам.
Как упоминалось ранее, факторы окружающей среды могут модулировать эпигенетические изменения. Было показано, что такие факторы, как диета, воздействие токсинов окружающей среды и стресс, играют роль во влиянии на эпигенетические модификации, особенно путем влияния на закономерности метилирования в ДНК. [2] Физические упражнения являются одним из таких факторов, который также, как было показано, влияет на метилирование и модификации хроматина.
Метилирование ДНК
[ редактировать ]Метилирование ДНК происходит, когда метильная группа ковалентно присоединяется к положению C5 нуклеотида цитозина с помощью фермента ДНК-метилтрансферазы (DNMT). Эти динуклеотидные повторы, в которых за цитозином следует дополнительный гуаниновый нуклеотид, называются сайтами CpG, где буква «p» указывает на фосфодиэфирную связь. Части генома, которые содержат большое количество сайтов CpG, называются CpG-островками, и эти островки часто перекрываются со многими основными промоторными областями, обнаруженными в геноме человека. [3] Существуют также сайты CpG, которые не являются частью CpG-островков, и они конститутивно метилированы, чтобы указать транскрипционному аппарату, что он не позволяет инициировать там транскрипцию. Напротив, CpG-островки представляют собой области генома, где сайты CpG обычно не метилируются до тех пор, пока DNMT не метилируют их, что приводит к влиянию на экспрессию генов.
Метилирование CpG-островков обычно приводит к подавлению транскрипции промотора, что можно осуществить двумя способами. Метилирование может задействовать деацетилазы гистонов (HDAC), которые формируют плотно конденсированный гетерохроматин, который транскрипционно неактивен. Метилирование CpG-островка также приведет к вклиниванию метильной группы в большую бороздку ДНК, эффективно блокируя сайты связывания белков, которые могут активировать транскрипцию.
Посттрансляционные модификации гистонов
[ редактировать ]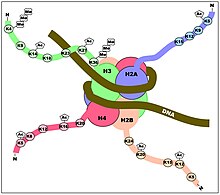

Гистоны — это белки, которые помогают организовывать ДНК. Восемь белков-гистонов собираются в октомер, который обертывает ДНК, образуя единицу, называемую нуклеосомой. Способность гистона модифицироваться путем маркировки на его N-концевом хвосте необходима для модуляции экспрессии генов. [5] В самом простом смысле гистоны могут быть модифицированы, чтобы стать более или менее конденсированными с помощью деацетилаз гистонов (HDAC) или ацетилтранфераз гистонов (HAT) соответственно. Когда гистоны ацетилируются и в результате становятся менее конденсированными, лежащая в основе ДНК становится более доступной для транскрипции, увеличивая экспрессию генов. Таким образом, ацетилированные гистоны могут служить сайтами связывания для важных факторов инициации транскрипции и ферментов, обладающих способностью ремоделировать хроматин. Между тем, повышенная конденсация гистонов посредством деацетилирования приводит к противоположному эффекту, вызывая снижение экспрессии генов. Регуляция экспрессии генов может влиять на то, какие гены транскрибируются, что в конечном итоге влияет на выработку белка в организме человека.
Хотя хвосты гистонов можно пометить разными способами, в этой статье будут обсуждаться четыре основных модификации: ацетилирование, метилирование (гистонов), убиквинирование и фосфорилирование. [1]
Кроме того, метилированные гистоны могут как служить сайтами связывания определенных факторов транскрипции за счет своих бромодоменов и хромодоменов, так и предотвращать связывание таких факторов, скрывая сайт узнавания фактора транскрипции. [6] Факторы транскрипции, включая промоторы и энхансеры, могут впоследствии модулировать скорость транскрипции ДНК в РНК, что также влияет на экспрессию генов.
Мышечные и эндокринные эффекты вследствие физических упражнений
[ редактировать ]
человека Упражнение на латеральную широкую мышцу бедра (мышцу бедра) в первую очередь влияет на эпигенный статус участков энхансеров мышечных клеток в хроматине , как подробно описано ниже. Напротив, упражнения на эту скелетную мышцу вызывают незначительные или вообще не вызывают эпигенетических изменений в промоторах или внутри генов хроматина мышечных клеток. [7] [8]
Скелетные мышцы в основном состоят из очень крупных многоядерных сократительных клеток мышечных волокон (миоцитов). Однако в скелетных мышцах также присутствует значительное количество мелких резидентных и инфильтрирующих мононуклеаров. [9] По объему миоциты составляют подавляющее большинство скелетных мышц. Однако с точки зрения ядер, присутствующих в скелетных мышцах, ядра миоцитов могут составлять только половину присутствующих ядер, тогда как ядра резидентных и инфильтрирующих мононуклеаров составляют другую половину. [9]

Мононуклеары скелетных мышц
[ редактировать ]Мононуклеарные клетки обнаружены в образцах ткани скелетных мышц мышей и людей [11] [12] [10] можно идентифицировать путем транскрипции информационной РНК маркеров клеточного типа. Кэмерон и др. [10] идентифицировали девять типов клеток в скелетных мышцах. К ним относятся эндотелиальные клетки (45% клеток), фиброадипогенные предшественники (ФАП) (20%), [13] перициты (14%) и эндотелиоподобные перициты (4%). Еще 9% мононуклеаров представляют собой мышечные стволовые клетки , прилегающие к клеткам мышечных волокон. Типы лимфоидных клеток (таких как В-клетки и Т-клетки) (3%) и миелоидные клетки, такие как макрофаги (2%) составляют большую часть оставшихся мононуклеарных клеток скелетных мышц. [10] Кроме того, Кэмерон и др. [10] также идентифицировали два типа клеток миоцитов: тип I и тип II. Было обнаружено, что каждый из различных типов клеток скелетных мышц экспрессирует разные наборы генов. Среднее количество генов, экспрессируемых в каждом из девяти различных типов клеток, составило 1331 ген. Однако когда биопсия берется из мышцы бедра, она содержит все различные типы клеток. В совокупности в биопсии скелетных мышц бедра человека обнаружено от 13 026 до 13 108 генов с обнаруженной экспрессией. [14] [8]
Функции скелетных мышц включают в себя обеспечение движения, поддержание позы тела, контроль температуры тела и стабилизацию суставов. [15] Скелетные мышцы также являются эндокринным органом . [16] [17] [18] обнаруживаются субпопуляции 654 различных белков, а также липидов, аминокислот, метаболитов и малых РНК . В различных физиологических условиях в секретоме скелетных мышц [19] Секретом секретируется клетками скелетных мышц либо локально (в интерстиции скелетных мышц), либо в кровоток, с измеримой концентрацией в плазме. [20] Секретируемые белки часто оказывают эндокринное действие. [21]
Секретом скелетных мышц меняется при физических нагрузках
[ редактировать ]Уильямс и др. [8] получили биопсию скелетных мышц бедра (латеральная широкая мышца) восьми 23-летних мужчин европеоидной расы, изначально ведущих малоподвижный образ жизни. Биопсии брались как до, так и после шестинедельной программы тренировок на выносливость. Упражнение заключалось в езде на велотренажере по одному часу пять дней в неделю в течение шести недель.
Из 13 108 генов, экспрессия которых была обнаружена в биоптатах мышц, 641 ген активировался после тренировки на выносливость, а 176 генов снижался. Из 817 генов, экспрессия которых была изменена, 531 был идентифицирован как находящийся в секретоме скелетных мышц. Поскольку многие из генов, регулируемых физическими упражнениями, идентифицированы как секретируемые, это указывает на то, что большая часть эффекта физических упражнений имеет эндокринную, а не метаболическую функцию. [8] Основные пути, на которые, как выяснилось, влияют секретируемые белками, регулируемыми физическими упражнениями, были связаны с функциями сердца , когнитивных функций , почек и тромбоцитов .
Эффекты тренировок опосредуются эпигенетическими механизмами.
[ редактировать ]В период с 2012 по 2019 год по крайней мере 25 отчетов указывали на важную роль эпигенетических механизмов в реакции скелетных мышц на физические упражнения. [22] Эпигенетические изменения часто происходят путем добавления метильных групп к цитозинам ДНК или удаления метильных групп из цитозинов ДНК , особенно в сайтах CpG внутри энхансеров. Метилирование цитозинов может привести к уплотнению ДНК в гетерохроматин , тем самым препятствуя доступу других молекул к ДНК. [23] Эпигенетические изменения также часто происходят посредством ацетилирования или деацетилирования хвостов гистонов в хроматине . ДНК в ядре обычно состоит из сегментов из 146 пар оснований ДНК, обернутых вокруг восьми тесно связанных гистонов (и каждый гистон также имеет свободный хвост) в структуре, называемой нуклеосомой , и один сегмент ДНК соединен с соседним сегментом ДНК на нуклеосома с помощью линкерной ДНК . Когда гистоновые хвосты ацетилируются, они обычно вызывают ослабление ДНК вокруг нуклеосомы, что приводит к увеличению доступности ДНК.
Регуляция генов в мышцах, вызванная физическими упражнениями
[ редактировать ]Экспрессия генов в мышцах, как и в тканях в целом, в значительной степени регулируется регуляторными последовательностями ДНК , особенно энхансерами . Энхансеры — это некодирующие последовательности в геноме, которые активируют экспрессию отдаленных генов-мишеней. [24] зацикливаясь и взаимодействуя с промоторами своих генов-мишеней [25] (см. рисунок «Регуляция транскрипции у млекопитающих»). Как сообщили Уильямс и др., [8] среднее расстояние в петле между связанными энхансерами и промоторами мышечных генов составляет 239 000 нуклеотидных оснований.
Вызванное физической нагрузкой изменение экспрессии генов за счет метилирования или деметилирования энхансерной ДНК
[ редактировать ]Тренировка мышц на выносливость изменяет экспрессию мышечных генов за счет метилирования эпигенетической ДНК или деметилирования сайтов CpG в энхансерах. [7]
В исследовании Линдхольма и др. [7] Двадцать три человека в возрасте около 27 лет, ведущие малоподвижный образ жизни, вызвались тренироваться на выносливость только на одной ноге в течение 3 месяцев. Другая нога использовалась как нетренированная контрольная нога. Тренировка состояла из тренировки разгибания колена на одной ноге в течение 3 месяцев (45 минут, 4 занятия в неделю). Биопсии скелетных мышц латеральной широкой мышцы бедра (мышцы бедра) были взяты как до начала тренировки, так и через 24 часа после последней тренировки с каждой ноги. Нога, тренируемая на выносливость, по сравнению с нетренированной ногой имела значительные изменения метилирования ДНК в 4919 участках генома. Сайты измененного метилирования ДНК находились преимущественно в энхансерах . Транскрипционный анализ с использованием секвенирования РНК выявил 4076 дифференциально экспрессируемых генов.
Гены с повышенной регуляцией транскрипции были связаны с энхансерами, которые значительно снижали метилирование ДНК , тогда как гены с пониженной регуляцией транскрипции были связаны с энхансерами, которые увеличивали метилирование ДНК. Повышенное метилирование в основном было связано с генами, участвующими в структурном ремоделировании мышц и метаболизме глюкозы. Энхансеры со сниженным метилированием были связаны с генами, участвующими в воспалительных или иммунологических процессах, а также в регуляции транскрипции.
Долгосрочное изменение экспрессии генов, вызванное физическими упражнениями, за счет ацетилирования или деацетилирования энхансерных гистонов.
[ редактировать ]
Как указано выше, после тренировки эпигенетические изменения энхансеров изменяют долговременную экспрессию сотен мышечных генов. [8] Сюда входят гены, продуцирующие белки, секретируемые в системный кровоток, многие из которых могут действовать как эндокринные посланники. [8] Шести мужчинам европеоидной расы, ведущим малоподвижный образ жизни, в возрасте около 23 лет, перед тем, как приступить к программе тренировок (шесть недель 60-минутных сеансов езды на стационарном велосипеде, пять дней в неделю), провели биопсию латеральной широкой мышцы бедра (мышцы бедра). Через четыре дня после завершения этой программы упражнений экспрессия многих генов постоянно эпигенно менялась. Изменения включали ацетилирование и деацетилирование хвостов гистонов, расположенных в энхансерах, контролирующих гены с измененной экспрессией. [8]
Гены с повышенной регуляцией были связаны с эпигенетическим ацетилированием гистона 3 лизина 27 (H3K27ac) нуклеосом, расположенных в их энхансерах . Гены с пониженной регуляцией были связаны с удалением эпигенетического ацетилирования H3K27 в нуклеосомах, расположенных в их энхансерах (см. Рисунок « Нуклеосома с гистоновыми хвостами, настроенными для активации транскрипции»). Биопсия латеральной широкой мышцы бедра показала экспрессию 13 108 генов на исходном уровне перед программой тренировок. Через четыре дня после завершения программы упражнений биопсия тех же мышц показала измененную экспрессию генов: 641 ген активировался, а 176 генов снизился. [8] Уильямс и др. идентифицировали 599 взаимодействий энхансер-ген, охватывающих 491 энхансер и 268 генов (было обнаружено несколько энхансеров, связанных с некоторыми генами), где как энхансер, так и связанный с ним ген-мишень координально активировались или подавлялись после тренировки. [8]
Влияние на рак
[ редактировать ]Физические упражнения приводят к эпигенетическим изменениям, которые могут оказывать благотворное воздействие на больных раком. Влияние физических упражнений на паттерны метилирования ДНК приводит к увеличению экспрессии генов, связанных с подавлением опухоли, и снижению экспрессии онкогенов. Раковые клетки имеют ненормальный характер метилирования ДНК, включая гиперметилирование в промоторных областях генов, подавляющих опухоль , и гипометилирование в промоторных областях онкогенов. [6] Эти эпигенетические мутации в раковых клетках заставляют клетку бесконтрольно расти и делиться, что приводит к онкогенезу. Было показано, что физические упражнения уменьшают и даже обращают вспять эти эпигенетические мутации, повышая уровень экспрессии генов, подавляющих опухоль, и снижая уровень экспрессии онкогенов.
Считается, что гиперметилирование в промоторных областях генов-супрессоров опухолей способствует возникновению некоторых форм рака. Гиперметилирование в промоторных областях генов, подавляющих опухоль, APC и RASSF1A, является распространенным эпигенетическим маркером рака. [26] Ген APC обеспечивает правильное деление клеток и поддержание правильного количества хромосом после завершения деления. Продукт гена RASSF1A взаимодействует с белком репарации ДНК XPA. Было показано, что физические упражнения уменьшают и даже обращают вспять гиперметилирование этих промоторов, снижая риск развития рака. [26] Снижение паттернов гиперметилирования выявляет транскрипционно доступную область промотора, что позволяет повысить экспрессию генов, подавляющих опухоль.
Физические упражнения повышают уровень эустресса, или хорошего стресса, в организме. Этот эустресс стимулирует эпигенетические модификации, затрагивающие ДНК-геном раковых клеток. [27] Условия окружающей среды, такие как эустресс, сильно индуцируют экспрессию гена-супрессора опухоли TP53, влияя на эпигенетические модификации, которые необходимо внести в геном раковых клеток. [27] Ген TP53 кодирует белок p53, белок, важный в апоптотическом пути запрограммированной гибели клеток. Белок p53 важен для регуляции роста клеток и апоптоза, поэтому гиперметилирование промоторной области TP53 является частым маркером, связанным с развитием рака. Помимо паттернов метилирования, влияющих на экспрессию TP53, микроРНК и антисмысловые РНК контролируют уровни белка p53, регулируя экспрессию гена p53, кодирующего TP53. [27]
Рак молочной железы
[ редактировать ]В исследовании эпигенетического воздействия физических упражнений на рак молочной железы у женщин образцы крови больных раком молочной железы были собраны до и после 6 месяцев аэробных упражнений умеренной интенсивности. [28] Тестовая группа тренировалась в среднем 129 минут в неделю по сравнению с 21,8 минутами в контрольной группе. Исследование выявило 43 гена, имеющих значительные изменения в метилировании ДНК. Из 43 генов 3 гена со сниженным уровнем метилирования напрямую коррелировали с увеличением выживаемости при раке молочной железы. Уровень метилирования гена L3MBTL1, известного супрессора опухолей, снизился на 1,48% в группе упражнений, в то время как в контрольной группе с ограниченными упражнениями уровень метилирования увеличился на 2,15%. [28] Снижение метилирования L3MBTL1 на 1,48% привело к большей экспрессии супрессора опухоли, тогда как увеличение метилирования на 2,15%, наблюдаемое в контрольной группе с ограниченными физическими нагрузками, привело к снижению экспрессии. Результаты исследования показали, что у пациентов, которые регулярно занимались спортом, были более низкие уровни метилирования и более высокая экспрессия гена L3MBTL1. [28] У этих пациентов также наблюдалось снижение риска смерти от рака молочной железы более чем на 60% по сравнению с пациентами в группе с ограниченными физическими упражнениями. [28]
Влияние на старение
[ редактировать ]Метилирование ДНК
[ редактировать ]Было также замечено, что эпигенетические механизмы, на которые влияют физические упражнения, участвуют в возрастных процессах. Основным компонентом старения является значительная потеря метилирования ДНК с течением времени. [29] Метилдезоксицитидин, который представляет собой метилированный цитозин на 5'-углероде цитозина, участвует в процессе дифференцировки и поддержания клеток . Дифференциация клеток включает метилирование различных участков ДНК клетки, что может изменить транскрипцию генов. Во время дифференцировки клеток метилирование ДНК важно для установления идентичности и функции клетки из-за его роли в контроле экспрессии генов. Недавнее исследование метилирования геномной ДНК новорожденных и людей в возрасте 100 лет и старше показало, что у пожилых людей общее метилирование ДНК значительно снизилось. [30] С возрастом степень метилирования ДНК постепенно начинает уменьшаться.
В исследованиях также изучались остатки метилдезоксицитидина в тканях, собранных у грызунов разного возраста. Эти исследования показали, что потеря метилирования ДНК значительно увеличивается с возрастом грызунов. [29] Таким образом, старение связано со значительной потерей метилирования ДНК. [29] [30] Однако эта потеря метилирования ДНК, по-видимому, замедляется физическими упражнениями в редких случаях. В целом этот эффект не очень хорошо изучен, и до сих пор кажется, что нет никакой связи между метилированием ДНК и физической активностью. [31] Дальнейшие исследования изучали влияние физических упражнений на метилирование ДНК и старение у людей.
Другой компонент старения — постепенное укорочение теломер, расположенных на концах хромосом. Теломеры — это повторяющиеся последовательности, расположенные на концах хромосом, цель которых — замедлить процесс укорочения и повреждения клеток, который происходит после каждого деления клетки, а также стабилизировать концы ДНК. Старение и возрастные заболевания связаны со значительным укорочением этих последовательностей. Сокращение теломер происходит в соматических клетках, где теломераза, фермент, контролирующий удлинение теломер, не экспрессируется. [32]
Однако было замечено, что теломеры могут транскрибировать некодирующую РНК или функциональные РНК, которые не транслируются в белок. Исследования показали, что некоторые из некодирующих РНК, транскрибируемых на теломерах, участвуют в формировании гетерохроматина и стабильности теломер. [30] [33] На эти некодирующие РНК могут положительно влиять физические упражнения. Примечательно, что исследование показало, что у мышей, подвергавшихся кратковременным фазам бега, наблюдалась повышенная транскрипция некодирующей РНК на теломерах по сравнению с контрольной группой, ведущей малоподвижный образ жизни. [34] Это увеличение транскрипции некодирующей РНК способствовало стабильности теломер, что сделало теломеры участников тренировочной группы менее подверженными старению с течением времени. Помогая повысить стабильность теломер, физические упражнения могут оказать положительное влияние на старение, помогая уменьшить укорочение теломер.
Влияние на метаболические процессы
[ редактировать ]Помимо реструктуризации мышечной и скелетной системы, позволяющей лучше справляться с механическими нагрузками, физические упражнения также влияют на экспрессию генов, связанных с метаболизмом. Эффекты широко распространены и могут повлиять на что угодно: от роста мышц до аэробной выносливости, диабета и других метаболических нарушений. [35]
В целом, даже небольшое количество упражнений может вызвать гипометилирование всего генома мышечных клеток. Это означает, что многие регуляторные гены могут быть задействованы для таких путей, как восстановление и рост мышц. Интенсивность упражнений напрямую коррелирует с степенью деметилирования промотора, поэтому более интенсивные упражнения активируют больше генов. [35]
МикроРНК (миРНК) мешают присутствующей мРНК и делают ее непригодной для использования и, следовательно, уменьшают количество продукта этой мРНК. МикроРНК регулируют многие физиологические процессы, такие как воспаление, ангиогенез (образование кровеносных сосудов), а также предотвращение ишемии (ограничения кровотока внутри сосудов). Аэробные упражнения уменьшают общее количество различных микроРНК в скелетных мышцах, которые оказывают негативное воздействие. Стимулы, которые заставляют организм вступать в анаболическую или конструктивную фазу, такие как тренировки с отягощениями, а также правильная диета, также демонстрируют снижение количества микроРНК. Это сокращение может фактически играть роль в росте мышечной клетки. [35]
Гистондеацетилтрансферазы класса IIa ( HDAC ) высоко экспрессируются в скелетных мышцах человека. Физические упражнения помогают снизить их активность, особенно на промоторах, что влияет на экспрессию генов. Было показано, что у мышей эта регуляция HDAC5 увеличивает количество волокон типа I в мышцах. Волокна I типа – это медленно сокращающиеся волокна, обладающие выносливостью. Эти данные согласуются с данными человека, которые говорят, что количество волокон типа I положительно коррелирует с максимальной аэробной способностью.
Было также предположено, что количество волокон типа 1 коррелирует с гистон-ацетилтрансферазой ( HAT ), которая участвует в дифференцировке остеобластов и формировании кости. [35]
Диабет
[ редактировать ]У людей с диабетом II типа наблюдается гиперметилирование нескольких генов в мышцах, таких как гамма-рецептор, активирующий пролифератор пероксисом ( PPAR-γ ) и коактиватор 1 альфа ( PGC-1α ). Гиперметилирование этих генов снижает экспрессию как митохондриальной ДНК, так и мРНК PGC-1α. Физические упражнения — это способ предотвратить и лечить эти эффекты, помогая гипометилировать PPAR-γ и PGC-1α. Кроме того, физические упражнения также увеличивают экспрессию транспортера глюкозы 4-го типа ( GLUT4 ), что также помогает при симптомах диабета. [35] [36]
Влияние на познание
[ редактировать ]Физические упражнения могут вызывать различные типы эпигенетических изменений, но есть четыре основных типа, влияющих на когнитивные функции , которые будут обсуждаться в этой статье. Нельзя исключить и другие типы эпигенетических изменений, не влияющие на когнитивные функции, но о них пока мало что известно. Обширный обзор 2017 года [37] описывает влияние физических упражнений на мозг из-за (1) метилирования ДНК , (2) ацетилирования гистонов , (3) метилирования гистонов и (4) экспрессии микроРНК , а также последствий этих изменений на обучение и память ( познание ). В целом обзоры показали, что физические упражнения оказывают положительное влияние на когнитивные функции, включая улучшение когнитивных функций и обращение вспять снижения когнитивных функций, которое обычно происходит во время старения. Было обнаружено, что краткосрочные эффекты упражнений также улучшают некоторые когнитивные способности, такие как когнитивная гибкость и рабочая память. Эпигенетические механизмы, которые действуют как мост между упражнениями и познанием, обсуждаются ниже.
Метилирование ДНК
[ редактировать ]Как резюмируется в обзоре 2017 года, у крыс физические упражнения усиливают экспрессию гена Bdnf , который играет важную роль в формировании памяти. Повышенная экспрессия Bdnf экзоне происходит за счет деметилирования его промотора CpG-островка в IV . Деметилирование частично осуществляется за счет действия тимин-ДНК-гликозилазы и системы эксцизионной репарации оснований . [38]
Физические упражнения снижают экспрессию в гиппокампе репрессирующих гены, ферментов метилирования ДНК, DNMT1, DNMT3a и DNMT3b. Гиппокамп выполняет важные функции памяти, пространственной навигации и является частью системы вознаграждения . Физические упражнения также ослабляют глобальные изменения метилирования, вызванные стрессом. [39]
Также было обнаружено, что физические упражнения подавляют протеинфосфатазу 1 (PP1) и кальциневрин, оба гена-супрессора памяти. Имеются данные о том, что PP1 увеличивает конденсацию хроматина за счет дефосфорилирования белков-гистонов, а также за счет подавления метилирования и ацетилирования гистонов с помощью HDAC. Кроме того, было показано, что Tet1, важный ген для формирования памяти, активируется в ответ на две недели физических упражнений. Одновременно физические упражнения также способствовали деметилированию CpG-островков, обнаруженных в промоторной области гена VegfA, фактора роста, который, как известно, модулирует положительные эффекты, которые физические упражнения могут оказывать на мозг. [39]
Ацетилирование гистона H3
[ редактировать ]Физические упражнения вызывают ацетилирование гистона H3 в промоторной области экзона IV гена Bdnf , необходимого для формирования памяти. Это ацетилирование способствует повышению регуляции Bdnf в гиппокампе мозга крыс. [40] Две недели занятий на беговой дорожке улучшают память при выполнении задачи избегания тормозов. [37]
Метилирование гистона H3
[ редактировать ]Метилирование гистонов может вызывать репрессию транскрипции. Лизин может подвергаться моно-, ди- и триметилированию. Ди- и триметилирование гистона H3 по лизину 9 (H3K9) связано с репрессией транскрипции. У мышей с дефицитом определенного гена гистон-метилтрансферазы KMT2A (также известного как MLL1) во взрослых возбуждающих нейронах наблюдаются нарушения в задачах памяти, зависящих от гиппокампа. [41] Старение вызывает снижение глобального метилирования H3K9 в гиппокампе. [37] Однако физические упражнения противодействуют вызванному старением снижению глобального метилирования H3K9. [37]
микроРНК
[ редактировать ]Было обнаружено, что микроРНК (миРНК) являются потенциальными регуляторами многочисленных биологических процессов в головном мозге, включая пролиферацию клеток, дифференцировку, апоптоз, синаптическую пластичность и формирование памяти — все это очень важные процессы, участвующие в познании. Эти микроРНК также были обнаружены в гиппокампе, миндалевидном теле и коре головного мозга, что дополнительно связывает их влияние с формированием памяти и когнитивными способностями. Во время биогенеза преждевременные микроРНК экспортируются из ядра в цитоплазму. Последующий процессинг пре-миРНК генерирует зрелую микроРНК, которая связывается с «затравочной последовательностью» 3'UTR мРНК-мишени, процесс, который катализируется РНК-индуцированным комплексом сайленсинга (RISC). Связывание микроРНК с целевой мРНК может привести к деградации целевой мРНК или ингибированию ее трансляции в белок, при этом степень комплементарности последовательностей между микроРНК и мРНК определяет, какой механизм будет использоваться. Интересно, что каждая микроРНК обладает способностью взаимодействовать с большим количеством мРНК (примерно 200–500 мРНК на каждую микроРНК), указывая тем самым, что большинство генов, кодирующих белки, могут регулироваться микроРНК. Поэтому неудивительно, что микроРНК широко экспрессируются в мозге и могут участвовать в эпигенетических механизмах. [42]
Эукариотические клетки могут взаимодействовать друг с другом напрямую посредством межклеточного контакта или на расстоянии, секретируя растворимые факторы, такие как гормоны, факторы роста, цитокины и хемокины. И РНК, и мРНК могут функционально переноситься от донора к клетке-реципиенту через пузырьки мембранного происхождения, называемые экзосомами. Подобно гормонам, микроРНК высвобождаются в кровоток (так называемые циркулирующие микроРНК или c-миРНК), воздействуя на клетки по всему организму. c-миРНК транспортируются экзосомами, липопротеинами высокой/низкой плотности, апоптотическими тельцами и РНК-связывающими белками. Физические упражнения повышают уровень c-miR-223 в кровообращении у молодых здоровых мужчин, в то время как недостаток миР-223 приводит к гиппокамп-зависимому дефициту памяти и гибели нейронов. Было показано, что, вероятно, возникающие по разным механизмам, как острые физические упражнения, так и хронические тренировки на выносливость сильно изменяют сигнатуру микроРНК в плазме человека. [37]
Одним из путей, в котором участвует микроРНК, является сигнальный путь CREB (белок, связывающий чувствительные элементы цАМФ) и BDNF (нейротрофический фактор мозга), хорошо известный путь, активируемый физической нагрузкой. МикроРНК-132 (миР-132) представляет собой микроРНК, которая регулируется CREB и активируется активностью нейронов и BDNF. Уровни МиР-132 имеют решающее значение для развития памяти: очень низкие или высокие уровни оказывают вредное воздействие, и только умеренные уровни оказывают положительное воздействие. Было описано, что один сеанс прерывистых физических упражнений быстро повышал уровень циркулирующей миР-132 у молодых здоровых мужчин. Совсем недавно было показано, что условный нокаут кластера генов miR-132/212 ухудшает память и способствует грубым изменениям транскрипционного профиля гиппокампа у мышей. В целом миР-132 является одной из наиболее изученных микроРНК в контексте физических упражнений, и доказано, что она играет важную роль во многих функциях мозга, включая развитие нейронов, синаптическую пластичность и формирование памяти. [39]
МиР-132 — лишь одна из многих микроРНК, которые регулируются физическими упражнениями. Анализ микрочипов показывает в общей сложности 32 микроРНК, которые по-разному экспрессируются в гипоталамусе при физической активности. Кроме того, было показано, что миР-21 и миР-34а регулируются физическими упражнениями, что снижает вредное воздействие черепно-мозговых травм и старения на когнитивные функции. Другая микроРНК, miR-124, известная своей ролью в нейрогенезе и формировании памяти, также особенно важна для смягчения последствий стресса и не регулируется физическими упражнениями. Наконец, физические упражнения приводят к изменению кластеров миР, влияющим на усиление сердечного ангиогенеза на животных моделях. Уровни кластеров миР-1, миР-133а и миР-206 были значительно повышены после тренировки и коррелировали с такими параметрами работоспособности, как максимальное поглощение кислорода и анаэробный порог лактата. [43]
В целом было показано, что физические упражнения изменяют уровень нескольких микроРНК в крови, и это указывает на то, что физические упражнения могут использовать эти эпигенетические модуляторы для регулирования связи между мозгом и периферическими органами. При дальнейшем знании эпигенетических путей упражнения будут продолжать показывать свои преимущества на всех этапах жизни, включая, помимо прочего, профилактику и лечение рака, старение, обмен веществ и метаболические расстройства, такие как диабет и когнитивные функции.
Последствия ожирения
[ редактировать ]Хотя легко утверждать, что существует обратная связь между физическими упражнениями и ожирением, реальность и научные данные свидетельствуют об обратном. Начнем с определения: ожирение — это избыточное накопление жира в жировой ткани, характеризующееся индексом массы тела (ИМТ) выше 30. Ожирение коррелирует со многими сопутствующими кардиометаболическими заболеваниями, такими как рак, сердечно-сосудистые заболевания (инсульт, сердечная недостаточность) и различные метаболические заболевания. Одним из методов смягчения этих последствий является уменьшение жировой ткани; это можно сделать двумя методами: снижением энергозатрат (физические упражнения) или изменением диеты. [44]
Исследования эпигенетического влияния физических упражнений на ожирение все еще мало изучены. Большая часть собранных данных просто сравнивает эпигенетические изменения у пациентов, у которых диагностировано ожирение, и у пациентов, у которых его нет. Однако это не может сбрасывать со счетов роль физических упражнений и эпигенетики, поскольку многие эпигенетические различия коррелируют с ИМТ и окружностью талии, которые можно контролировать с помощью физических упражнений. Учитывая вышесказанное, поскольку исследование новое, существует множество информации, большая часть которой не проверена. В целом, доказательства влияния ожирения на эпигенетику заключаются в определенном наборе генов, которые контролируют окружность талии (ОТ) и индекс массы тела (ИМТ).
В исследовании, в котором были объединены данные метилирования из 10 000 образцов крови, было показано, что 187 сайтов CpG связаны с ИМТ. [45] То, что они обнаружили, было очень интересным: отклонения в метилировании ДНК в крови обычно считаются результатом ожирения, а в некоторых случаях и причиной. Используя методы количественного генетического анализа, исследователи попытались найти причинную или косвенную связь между вовлеченными генами и ожирением. Они обнаружили, что большинство взаимодействий между интересующими генами и ожирением были косвенными, демонстрируя, что любое изменение активности генов, скорее всего, является результатом ожирения, а не фактором, вызвавшим его. Это исследование было подтверждено путем тестирования жировой ткани.
CD38 (кластер дифференцировки 38) представляет собой гликопротеин с ферментативной активностью, обнаруженный на поверхности специфических иммунных клеток. Было показано, что эктофермент играет важную роль в синтезе адениндинуклеотидфосфата никотиновой кислоты ( NAADP ). [46] НААДФ — внутриклеточный вторичный мессенджер, участвующий в синтезе кальция. 2+ выпускать. При его нокауте у мышей результатом было повышение скорости метаболизма и устойчивость к ожирению (вызванному диетой с высоким содержанием жиров). [47] Это говорит нам о том, что CD38 является важным фактором эпигенетических изменений в отношении ожирения. Как было обнаружено в дополнительном исследовании, MSI2, ген, кодирующий РНК-связывающий белок 2 Musashi, связан с пищевым поведением. В том же исследовании было обнаружено, что LARS2 (митохондриальный ген) связан с ИМТ и окружностью талии. [48] В обоих случаях исследователи отметили, что при увеличении ИМТ на +1 единицу происходило изменение метилирования на 0,0009 для обоих генов, а на каждую единицу увеличения ОТ происходило изменение метилирования на 0,0004. [48] По другой версии, метилирование MSI2 может быть предиктором ИМТ, составляя 24% дисперсии. [49]
Наконец, в исследовании, проведенном в 2018 году, было обнаружено, что ген SOCS3, супрессор передачи сигналов цитокинов, активируется при ожирении и вызывает резистентность к лептину и инсулину. В документе говорится, что «повышенная экспрессия SOCS3 у людей с ожирением связана с несколькими метаболическими нарушениями, включая снижение расхода энергии, повышенное потребление пищи и ожирение, а также резистентность к инсулину и лептину. Кроме того, недавние исследования показали, что экспрессия SOCS3 регулирует гомеостаз энергии и глюкозы у некоторых людей. метаболические состояния, такие как беременность, ограничение калорий и возобновление питания». [50]
В заключение нельзя сказать, что физические упражнения сами по себе вызывают эпигенетические изменения, способные обратить вспять ожирение. Однако стало ясно, что физические упражнения влияют на определенные факторы (ИМТ, скорость метаболизма, окружность талии), которые являются параметрами для диагностики ожирения. Показано, что сами эти параметры коррелируют с эпигенетическими изменениями, будь то причинными или симптоматическими.
Влияние на нейродегенеративные заболевания
[ редактировать ]Все больше данных показывает, что физические упражнения также участвуют в потенциальном лечении и профилактике нейродегенеративных заболеваний. [51] Ключевая оценка на данный момент заключается в том, что физические упражнения являются ключевым фактором усиления нейрогенеза в гиппокампе у взрослых. [52] Также было показано, что физические упражнения уменьшают чрезмерное нейровоспаление, которое обычно считается основной причиной многих нейродегенеративных заболеваний. [53] [54]
Эпилепсия
[ редактировать ]Исследования показали, что физические упражнения являются жизнеспособным, нефармацевтическим подходом к сопротивлению и даже устранению вредных процессов, которые вызывают внезапные аномальные изменения в активности клеток головного мозга, приводящие к судорогам, которые характеризуют эпилепсию. [55] Одна из областей внимания – влияние на уровни нейротрофического фактора головного мозга ( BDNF ) после приступа. Правильная регуляция уровней BDNF необходима для поддержания сигнального пути BDNF-TrkB, ответственного за здоровую синаптическую пластичность. [56] Было замечено, что за приступами постоянно следует значительное увеличение, а затем резкое падение уровней BDNF, что приводит к снижению когнитивных функций и еще больше увеличивает вероятность приступов в будущем. [55] Тем не менее, модели на животных показали, что у пациентов с эпилепсией, подвергающихся физическим нагрузкам, особенно если они являются обычными, уровень BDNF развивается более стабильно, аналогично тем, которые не затронуты этим расстройством. [55] Это возвращение к нормальным колебаниям BDNF не только способствует более здоровому функционированию мозга, но и снижает общее количество судорог, которые испытывают пациенты, получавшие лечение. [55] Физические упражнения повышают уровень BDNF за счет увеличения ацетилирования H3 и снижения экспрессии некоторых соответствующих гистондеацетилаз. [55] Некоторые данные показали, что физические упражнения также влияют на экспрессию микроРНК, связанных с нейродегенерацией. [55] Влияние микроРНК подробно обсуждается выше в разделе «Влияние на когнитивные функции». Однако механизмы, лежащие в основе упражнений и экспрессии микроРНК, не ясны. Необходимы дальнейшие исследования, чтобы понять, насколько значимо взаимодействие между физическими упражнениями и экспрессией микроРНК. Одной из ключевых функций BDNF является ингибирование активных форм кислорода (АФК), которые, как было замечено, повреждают клетки и, следовательно, препятствуют правильному функционированию мозга. У пациентов, занимающихся физическими упражнениями, подвергающихся высокоинтенсивным тренировкам, наблюдалось заметное увеличение АФК, что могло значительно противодействовать преимуществам умеренных уровней BDNF, обсуждавшимся ранее. [55] Эти данные свидетельствуют о том, что интенсивность от низкой до умеренной является предпочтительным методом лечения для тех, кто уже подвержен риску неврологической дисрегуляции. [55] Однако вредное воздействие высокоинтенсивных тренировок со временем значительно уменьшается, поскольку человек естественным образом адаптируется к окислительному стрессу, который способствует развитию АФК. [55]
Как упоминалось ранее, нарушение нейрогенеза является одновременно индикатором и результатом нейродегенеративных заболеваний, в том числе эпилепсии. Исследования показали, что у субъектов, подвергшихся манипуляциям с целью развития хронической эпилепсии, наблюдалось значительное уменьшение количества гранулярных клеток в зубчатой извилине, подразделении гиппокампа, критическом для нейрогенеза. [52] Затем те же исследования продемонстрировали, как у субъектов, получавших физические упражнения, количество гранулярных клеток возвращалось к нормальному, что, в свою очередь, улучшало нейрогенез и функционирование мозга.
Было продемонстрировано, что физические упражнения оказывают положительное влияние на эпигенетическую модуляцию уровней BDNF и поддержание нейрогенеза, особенно у пациентов с эпилепсией. [55]
Болезнь Альцгеймера
[ редактировать ]Болезнь Альцгеймера (БА) характеризуется значительным снижением когнитивных функций и памяти, причем данные показывают, что физические упражнения могут замедлить ее прогрессирование и даже в некоторых случаях обеспечить восстановление утраченных функций. [57] Одним из основных вариантов AD является потеря или атипичная функциональность микроглии и астроцитов, вызванная чрезмерным накоплением бляшек бета-амилоидного пептида в мозге. [57] Бета-амилоидные бляшки вызывают неправильную активацию регуляторных компонентов микроглии и астроцитов, что приводит к чрезмерному и неточному иммунному ответу, нацеленному на здоровые нейроны. [57] Это взаимодействие действует как петля отрицательной обратной связи, которая создает среду, склонную к массовому накоплению бета-амилоидных бляшек. Чрезмерное количество бета-амилоидных бляшек запускает неправильные регуляторные механизмы, ведущие к дальнейшей гибели нейронов и снижению их функций. Исследования показали, как на животных моделях, так и на людях, что постоянные физические упражнения подавляют упомянутую ранее неправильную активацию микроглии за счет выработки определенных миокинов. [57] Мышечные клетки реагируют на сокращения, высвобождая молекулы, называемые миокинами, одна из которых имеет решающее значение для регуляции реакции микроглии, IL-6. [53] Этот миокин вырабатывается в ответ на постоянные физические нагрузки и оказывает прямое влияние на усиление или понижение воспалительной реакции, связанной с потерей нейронов, в зависимости от сигнальных путей. [53] Кроме того, IL-6 провоцирует выработку цитокина, известного как IL-10, который может предотвращать активацию микроглии, блокируя ее рецепторы, эффективно ингибируя упомянутую ранее вредную активацию микроглии. [53] Ряд пациентов, страдающих нейродегенеративными заболеваниями, такими как AD, имеют заметно более низкие уровни IL-6, что может объяснить более частые случаи дисфункциональной воспалительной реакции. [54] Хотя IL-6 можно искусственно индуцировать, длительные физические упражнения представляют собой нефармацевтический подход, способный обеспечить уровни IL-6, достаточные для нормальных регуляторных процессов. [53]
Подобно эпилепсии, физические упражнения повышают уровень BDNF у пациентов с БА, которого раньше не хватало. [57] Физические упражнения повышают уровень BDNF за счет увеличения ацетилирования H3 и снижения активности некоторых соответствующих деацетилаз гистонов. [55] Нейротрофический фактор головного мозга значительно уменьшает нейровоспаление, тесно связанное с болезнью Альцгеймера и другими расстройствами. [57]
Физические упражнения могут играть решающую роль в регуляции воспалительных путей посредством эпигенетической модуляции миокина IL-6 и BDNF у пациентов с AD. [57]
Влияние на психотические расстройства
[ редактировать ]Шизофрения
[ редактировать ]Шизофрения характеризуется галлюцинациями, бредом, паранойей и симптомами расстройства настроения, причем данные свидетельствуют о том, что физические упражнения могут облегчить нейровоспаление, которое может быть основной причиной этого аффективного расстройства. [58] Хотя до сих пор неясно, что именно вызывает это расстройство, существует несколько объяснений, таких как дофаминергическая и глутаматергическая гипотезы. Дофаминергическая гипотеза утверждает, что шизофрения вызвана пресинаптической дисрегуляцией дофамина. Эта дисрегуляция возникает из-за аномального увеличения количества ключевых рецепторов дофамина, что приводит к его чрезмерному высвобождению. [58] [59] Ранее считалось, что глутаматергическая гипотеза тесно связана с упомянутым чрезмерным высвобождением дофамина. [58] Однако недавняя литература показывает, что дисфункция рецепторов N-метил-D-аспартата (NMDAR) может служить механизмом шизофрении. [60] Дисфункция рецепторов NMDAR вызывает повышение уровня глутамата в сайтах, не относящихся к NMDA. Более высокие уровни генерализованного глутамата в префронтальной коре приводят к атипично высокой передаче сигналов на АМРА-рецепторах. Аномальная сигнальная активность АМРА-рецепторов нарушает возбудимость клеток, что, как полагают, связано с шизофренией. [60] Относительно новое объяснение этой темы фокусируется на дисфункциональных путях нейровоспаления и окислительном стрессе, аналогичном тому, что обсуждалось при таких расстройствах, как болезнь Альцгеймера. [57] [58] У пациентов, страдающих шизофренией, наблюдается резкое увеличение активации микроглии и передачи сигналов арахидоновой кислоты, которые являются основными факторами воспаления, которые, как известно, вызывают потерю нейронов и снижение функции. [53] [58] Эта комбинация факторов особенно уникальна для пациентов с шизофренией, настолько, что профиль, способный определить степень сопутствующих побочных продуктов воспаления (цитокинов и хемокинов), используется для диагностики шизофрении с точностью примерно 90%. [58] Как обсуждалось ранее, постоянные физические упражнения производят большее количество миокина IL-6, который регулирует воспалительные пути и увеличивает выработку IL-10, цитокина, который ингибирует активацию микроглии. [53]
Одной из основных характеристик шизофрении является возникновение острого психоза, вызванного рядом стрессовых событий, зависящих от предрасположенности человека к стрессовой реакции. [61] Реакция человека на стресс в значительной степени регулируется гипоталамо-гипофизарно-надпочечниковой осью или HPA. [61] HPA — это многоэтапный биохимический процесс, который приводит к выбросу кортизола из надпочечников и, как следствие, к чрезмерному выбросу дофамина, связанному с психозом. [61] Считается, что люди, склонные к таким расстройствам, как шизофрения, по своей природе имеют гиперактивный HPA, что делает их особенно чувствительными к стрессорам. [61] Некоторые исследования показали, что умеренные, длительные физические упражнения уменьшают психотические симптомы за счет снижения базального уровня кортизола у пациентов. [61] [62] Тем не менее, кратковременные физические упражнения вызывают немедленное повышение уровня кортизола из-за стрессового характера активности. [62] Ключевым моментом является то, что последовательные упражнения в течение длительного периода времени приводят к значительному снижению исходного уровня кортизола, несмотря на кратковременные всплески, вызванные выполнением этой деятельности. [62] Как правило, более низкие уровни кортизола снижают повышенное высвобождение дофамина, часто встречающееся у пациентов, и приближают уровни кортизола к уровням здоровых субъектов контрольной группы. [61] Хотя это ни в коем случае не является лекарством, оно может заметно улучшить жизнь пострадавших за счет смягчения симптомов и нормализации реакции пациентов на обычные стрессоры.
Недавние исследования показывают, что длительные физические упражнения могут принести пользу пациентам с шизофренией, что приводит к снижению нейровоспаления и базального уровня кортизола, связанного с психотическими явлениями. [58] [62] Эпигенетическая модуляция базального уровня кортизола у пациентов с шизофренией — лишь одно из нескольких изменений, связанных с этим расстройством. Дальнейшие эпигенетические модификации обсуждаются в «Эпигенетике шизофрении» .
Ссылки
[ редактировать ]- ^ Jump up to: а б Суэтт Дж.Д., Мини М.Дж., Нестлер Э.Дж., Акбарян С. (2013), «Обзор молекулярных основ эпигенетики», Эпигенетическая регуляция в нервной системе , Elsevier, стр. 3–33, doi : 10.1016/b978-0-12 -391494-1.00001-х , ISBN 9780123914941
- ^ Фейл Р., Фрага МФ (январь 2012 г.). «Эпигенетика и окружающая среда: новые закономерности и последствия». Обзоры природы. Генетика . 13 (2): 97–109. дои : 10.1038/nrg3142 . ПМИД 22215131 . S2CID 21879458 .
- ^ Яниц К. (01 января 2011 г.). «Глава 12 – Оценка эпигенетической информации». В Толлефсбол Т., Яниц М. (ред.). Справочник по эпигенетике . Сан-Диего: Академическая пресса. стр. 173–181. дои : 10.1016/b978-0-12-375709-8.00012-5 . ISBN 978-0-12-375709-8 .
- ^ Бенданди А., Пателли А.С., Диаспро А., Роккиа В. (2020). «Роль хвостов гистонов в стабильности нуклеосом: электростатический взгляд» . Comput Struct Biotechnol Дж . 18 : 2799–2809. дои : 10.1016/j.csbj.2020.09.034 . ПМЦ 7575852 . ПМИД 33133421 .
- ^ Люгер К., Рехштайнер Т.Дж., Флаус А.Дж., Уэй М.М., Ричмонд Т.Дж. (сентябрь 1997 г.). «Характеристика ядерных частиц нуклеосомы, содержащих белки-гистоны, образующиеся в бактериях». Журнал молекулярной биологии . 272 (3): 301–311. дои : 10.1006/jmbi.1997.1235 . ПМИД 9325091 .
- ^ Jump up to: а б Хэнди Д.Э., Кастро Р., Лоскальцо Дж. (май 2011 г.). «Эпигенетические модификации: основные механизмы и роль в сердечно-сосудистых заболеваниях» . Тираж . 123 (19): 2145–2156. doi : 10.1161/CIRCULATIONAHA.110.956839 . ПМК 3107542 . ПМИД 21576679 .
- ^ Jump up to: а б с Линдхольм М.Э., Марабита Ф., Гомес-Кабреро Д., Рундквист Х., Экстрем Т.Дж., Тегнер Дж., Сундберг К.Дж. (декабрь 2014 г.). «Интегративный анализ показывает скоординированное перепрограммирование эпигенома и транскриптома в скелетных мышцах человека после тренировки» . Эпигенетика . 9 (12): 1557–69. дои : 10.4161/15592294.2014.982445 . ПМК 4622000 . ПМИД 25484259 .
- ^ Jump up to: а б с д и ж г час я дж Уильямс К., Карраскилья Г.Д., Ингерслев Л.Р., Хохройтер М.Ю., Ханссон С., Пиллон Н.Дж., Донкин И., Верстейхе С., Зират Дж.Р., Килпеляйнен Т.О., Баррес Р. (ноябрь 2021 г.). «Эпигенетическая перестройка усилителей скелетных мышц после физических упражнений подтверждает их роль в функционировании всего тела и здоровье человека» . Мол Метаб . 53 : 101290. doi : 10.1016/j.molmet.2021.101290 . ПМЦ 8355925 . ПМИД 34252634 .
- ^ Jump up to: а б Фон Вальден Ф., Ри М., Мобли С.Б., Фондюфе-Миттендорф Ю., Маккарти Дж.Дж., Петерсон К.А., Мурач К.А. (ноябрь 2020 г.). «Метилом миоядерной ДНК в ответ на острый гипертрофический стимул» . Эпигенетика . 15 (11): 1151–1162. дои : 10.1080/15592294.2020.1755581 . ПМЦ 7595631 . ПМИД 32281477 .
- ^ Jump up to: а б с д и Кэмерон А., Уэйклин Дж., Голтон Н., Янг Л.В., Уотерспун С., Ходсон Н., Лиз М.Дж., Мур Д.Р., Джонстон А.П. (декабрь 2022 г.). «Идентификация малоизученных популяций мезенхимальных и сосудистых клеток в скелетных мышцах человека». Am J Physiol Cell Physiol . 323 (6): 1586–1600 гг. doi : 10.1152/ajpcell.00364.2022 . ПМИД 36342160 . S2CID 253383236 .
- ^ Джордани Л., Хе Дж.Дж., Негрони Э., Сакаи Х., Лоу JYC, Сиу М.М., Ван Р., Корно А., Таджбахш С., Ченг Т.Х., Ле Гранд Ф. (май 2019 г.). «Многомерная картография одиночных клеток выявляет новые популяции резидентных клеток скелетных мышц» . Мол Клетка . 74 (3): 609–621.e6. doi : 10.1016/j.molcel.2019.02.026 . ПМИД 30922843 .
- ^ Рубенштейн А.Б., Смит Г.Р., Рауэ У., Бег Г., Минчев К., Руф-Замойски Ф., Наир В.Д., Ван Х, Чжоу Л., Заславский Е., Траппе Т.А., Траппе С., Силфон СК. «Одноклеточные транскрипционные профили в скелетных мышцах человека» . представитель научный 10 (1): Бибкод : 2020НатСР..10..229Р 229. дои : 10.1038/s41598-019-57110-6 . ПМК 6959232 . ПМИД 31937892 .
- ^ Биферали Б, Пройетти Д, Моццетта С, Мадаро Л (2019). «Перекрестные взаимодействия фибро-адипогенных предшественников в скелетных мышцах: социальная сеть» . Фронт Физиол . 10 : 1074. doi : 10.3389/fphys.2019.01074 . ПМЦ 6713247 . ПМИД 31496956 .
- ^ «Протеом, специфичный для скелетных мышц» . Атлас белков человека .
- ^ Маккаллер С., Джессу Р., Каллахан А.Л. (январь 2022 г.) [обновлено 25 марта 2022 г.]. Физиология, Скелетные мышцы . Остров сокровищ, Флорида: StatPearls Publishing. ПМИД 30725824 . NBK537139 – через StatPearls [Интернет].
- ^ Иидзука К., Мачида Т., Хирафудзи М. (2014). «Скелетная мышца является эндокринным органом» . J Pharmacol Sci . 125 (2): 125–31. дои : 10.1254/jphs.14r02cp . ПМИД 24859778 .
- ^ Хоффманн С., Вейгерт С. (ноябрь 2017 г.). «Скелетные мышцы как эндокринный орган: роль миокинов в адаптации к физическим упражнениям» . Колд Спринг Харб Перспектив Мед . 7 (11): а029793. doi : 10.1101/cshperspect.a029793 . ПМК 5666622 . ПМИД 28389517 .
- ^ Северинсен MC, Педерсен Б.К. (август 2020 г.). «Перекрестные помехи между мышцами и органами: новая роль миокинов» . Эндокр преп . 41 (4): 594–609. дои : 10.1210/endrev/bnaa016 . ПМЦ 7288608 . ПМИД 32393961 .
- ^ Флорин А., Ламберт С., Санчес С., Заппиа Дж., Дюрье Н., Тьеппо А.М., Мобашери А., Хенротин Ю. (март 2020 г.). «Секретом клеток скелетных мышц: систематический обзор» . Остеоартр Картиль Открытый . 2 (1): 100019. doi : 10.1016/j.ocarto.2019.100019 . ПМЦ 9718214 . ПМИД 36474563 .
- ^ Агер С., Лоро Э., Ди Раймондо Д. (2020). «Редакционная статья: Роль мышечного секретома в здоровье и болезнях» . Фронт Физиол . 11 : 1101. дои : 10.3389/fphys.2020.01101 . ПМК 7506065 . ПМИД 33013470 .
- ^ Делези Дж., Хандшин С. (2018). «Эндокринные перекрестные помехи между скелетными мышцами и мозгом» . Передний Нейрол . 9 : 698. doi : 10.3389/fneur.2018.00698 . ПМК 6117390 . ПМИД 30197620 .
- ^ Видманн М., Нисс А.М., Мунц Б. (апрель 2019 г.). «Физические упражнения и эпигенетические модификации скелетных мышц». Спорт Мед . 49 (4): 509–523. дои : 10.1007/s40279-019-01070-4 . ПМИД 30778851 . S2CID 73481438 .
- ^ Роуз Н.Р., Клозе Р.Дж. (декабрь 2014 г.). «Понимание связи между метилированием ДНК и метилированием лизина гистонов» . Biochimica et Biophysica Acta (BBA) - Механизмы регуляции генов . 1839 (12): 1362–1372. дои : 10.1016/j.bbagrm.2014.02.007 . ПМК 4316174 . ПМИД 24560929 .
- ^ Паниграхи А., О'Мэлли Б.В. (апрель 2021 г.). «Механизмы действия энхансеров: известные и неизвестные» . Геном Биол . 22 (1): 108. дои : 10.1186/s13059-021-02322-1 . ПМК 8051032 . ПМИД 33858480 .
- ^ Марсман Дж., Хорсфилд Дж.А. (2012). «Отношения на расстоянии: связь энхансер-промотор и динамическая транскрипция генов». Биохим Биофиз Акта . 1819 (11–12): 1217–27. дои : 10.1016/j.bbagrm.2012.10.008 . ПМИД 23124110 .
- ^ Jump up to: а б Койл Ю.М., Се XJ, Льюис К.М., Бу Д., Милчгруб С., Юхус Д.М. (февраль 2007 г.). «Роль физической активности в модуляции риска рака молочной железы, определяемая гиперметилированием промотора APC и RASSF1A в доброкачественной ткани молочной железы» . Эпидемиология рака, биомаркеры и профилактика . 16 (2): 192–196. doi : 10.1158/1055-9965.EPI-06-0700 . ПМИД 17301249 .
- ^ Jump up to: а б с Санчис-Гомар Ф., Гарсия-Хименес Х.Л., Перес-Куилис К., Гомес-Кабрера М.К., Паллардо Ф.В., Липпи Дж. (декабрь 2012 г.). «Физические упражнения как эпигенетический модулятор: эустресс, «позитивный стресс» как эффектор экспрессии генов» . Журнал исследований силы и физической подготовки . 26 (12): 3469–3472. дои : 10.1519/JSC.0b013e31825bb594 . ПМИД 22561977 .
- ^ Jump up to: а б с д Цзэн Х., Ирвин М.Л., Лу Л., Риш Х., Мейн С., Му Л. и др. (май 2012 г.). «Физическая активность и выживаемость при раке молочной железы: эпигенетическая связь через снижение метилирования гена-супрессора опухоли L3MBTL1». Исследование и лечение рака молочной железы . 133 (1): 127–135. дои : 10.1007/s10549-011-1716-7 . ПМИД 21837478 . S2CID 25734433 .
- ^ Jump up to: а б с Уилсон В.Л., Смит Р.А., Ма С., Катлер Р.Г. (июль 1987 г.). «Геномный уровень 5-метилдезоксицитидина уменьшается с возрастом» . Журнал биологической химии . 262 (21): 9948–9951. дои : 10.1016/S0021-9258(18)61057-9 . ПМИД 3611071 .
- ^ Jump up to: а б с Хейн Х., Ли Н., Феррейра Х.Дж., Моран С., Пизано Д.Г., Гомес А. и др. (июнь 2012 г.). «Различные метиломы ДНК новорожденных и долгожителей» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (26): 10522–10527. Бибкод : 2012PNAS..10910522H . дои : 10.1073/pnas.1120658109 . ПМК 3387108 . ПМИД 22689993 .
- ^ Чжан Ф.Ф., Кардарелли Р., Кэрролл Дж., Чжан С., Фульда К.Г., Гонсалес К. и др. (март 2011 г.). «Физическая активность и глобальное метилирование геномной ДНК в популяции, свободной от рака» . Эпигенетика . 6 (3): 293–299. дои : 10.4161/epi.6.3.14378 . ПМК 3092677 . ПМИД 21178401 .
- ^ Энрикес CM, Феррейра MG (декабрь 2012 г.). «Последствия укорочения теломер в течение жизни». Современное мнение в области клеточной биологии . 24 (6): 804–808. дои : 10.1016/j.ceb.2012.09.007 . ПМИД 23127607 .
- ^ Шефтнер С., Бласко М.А. (апрель 2010 г.). «Регуляция хроматина и некодирующие РНК в теломерах млекопитающих». Семинары по клеточной биологии и биологии развития . 21 (2): 186–193. дои : 10.1016/j.semcdb.2009.09.015 . ПМИД 19815087 .
- ^ Вернер С., Ханхун М., Видманн Т., Казаков А., Семенов А., Пёсс Дж. и др. (август 2008 г.). «Влияние физических упражнений на белки, регулирующие теломеры миокарда, пути выживания и апоптоз» . Журнал Американского колледжа кардиологов . 52 (6): 470–482. дои : 10.1016/j.jacc.2008.04.034 . ПМИД 18672169 .
- ^ Jump up to: а б с д и Нтанасис-Статопулос Дж., Цаннинис Дж.Г., Филиппу А., Кутсилиерис М. (июнь 2013 г.). «Эпигенетическая регуляция экспрессии генов, вызванная физическими упражнениями». Журнал скелетно-мышечных и нейрональных взаимодействий . 13 (2): 133–146. ПМИД 23728100 .
- ^ Линг С., Группа L (декабрь 2009 г.). «Эпигенетика: молекулярная связь между факторами окружающей среды и диабетом 2 типа» . Диабет . 58 (12): 2718–2725. дои : 10.2337/db09-1003 . ПМК 2780862 . ПМИД 19940235 .
- ^ Jump up to: а б с д и Фернандес Х., Арида Р.М., Гомес-Пинилья Ф. (сентябрь 2017 г.). «Физические упражнения как эпигенетический модулятор пластичности и познания мозга» . Neurosci Biobehav Rev. 80 : 443–456. doi : 10.1016/j.neubiorev.2017.06.012 . ПМК 5705447 . ПМИД 28666827 .
- ^ Байрактар Г., Кройц М.Р. (23 мая 2018 г.). «Роль деметилирования ДНК, зависящего от активности, в мозге взрослого человека и при неврологических расстройствах» . Границы молекулярной нейронауки . 11 : 169. дои : 10.3389/fnmol.2018.00169 . ПМЦ 5975432 . ПМИД 29875631 .
- ^ Jump up to: а б с Фернандес Х., Арида Р.М., Гомес-Пинилья Ф. (сентябрь 2017 г.). «Физические упражнения как эпигенетический модулятор пластичности и познания мозга» . Неврологические и биоповеденческие обзоры . 80 : 443–456. doi : 10.1016/j.neubiorev.2017.06.012 . ПМК 5705447 . ПМИД 28666827 .
- ^ Гомес-Пинилья Ф, Чжуан Й, Фэн Дж, Инь З, Фань Дж (февраль 2011 г.). «Упражнения влияют на пластичность нейротрофических факторов головного мозга, задействуя механизмы эпигенетической регуляции» . Европейский журнал неврологии . 33 (3): 383–390. дои : 10.1111/j.1460-9568.2010.07508.x . ПМК 3256007 . ПМИД 21198979 .
- ^ Ким С., Каанг Б.К. (январь 2017 г.). «Эпигенетическая регуляция и ремоделирование хроматина в обучении и памяти» . Экспериментальная и молекулярная медицина . 49 (1): e281. дои : 10.1038/emm.2016.140 . ПМК 5291841 . ПМИД 28082740 .
- ^ Окугава Ю., Грейди В.М., Гоэл А. (октябрь 2015 г.). «Эпигенетические изменения при колоректальном раке: новые биомаркеры» . Гастроэнтерология . 149 (5): 1204–1225.e12. дои : 10.1053/j.gastro.2015.07.011 . ПМЦ 4589488 . ПМИД 26216839 .
- ^ Шюттлер Д., Клаусс С., Векбах Л.Т., Бруннер С. (сентябрь 2019 г.). «Молекулярные механизмы ремоделирования и регенерации сердца при физических упражнениях» . Клетки . 8 (10): 1128. doi : 10.3390/cells8101128 . ПМК 6829258 . ПМИД 31547508 .
- ^ Ниемиро Г.М., Ревейн А., Алготар А.М. (2022 г.), «Влияние упражнений и фитнеса на ожирение» , StatPearls , Остров сокровищ (Флорида): StatPearls Publishing, PMID 30969715 , получено 11 апреля 2022 г.
- ^ Валь С., Дронг А., Лене Б., Ло М., Скотт В.Р., Кунце С. и др. (январь 2017 г.). «Общеэпигеномное исследование ассоциации индекса массы тела и неблагоприятных последствий ожирения» . Природа . 541 (7635): 81–86. Бибкод : 2017Natur.541...81W . дои : 10.1038/nature20784 . ПМК 5570525 . ПМИД 28002404 .
- ^ Коскер Ф., Чевирон Н., Ямасаки М., Ментейн А., Лунд Ф.Е., Мутин М.Дж. и др. (декабрь 2010 г.). «Эктофермент CD38 представляет собой синтазу адениндинуклеотидфосфата никотиновой кислоты (NAADP), которая связывает активацию рецептора с мобилизацией Ca2+ из лизосом в ацинарных клетках поджелудочной железы» . Журнал биологической химии . 285 (49): 38251–38259. дои : 10.1074/jbc.M110.125864 . ПМЦ 2992259 . ПМИД 20870729 .
- ^ Барбоза М.Т., Соареш С.М., Новак С.М., Синклер Д., Левин Дж.А., Аксой П., Чини Э.Н. (ноябрь 2007 г.). «Фермент CD38 (НАД-гликогидролаза, EC 3.2.2.5) необходим для развития ожирения, вызванного диетой» . Журнал ФАСЭБ . 21 (13): 3629–3639. дои : 10.1096/fj.07-8290com . ПМИД 17585054 . S2CID 23957625 .
- ^ Jump up to: а б Дхана К., Браун К.В., Нано Дж., Воортман Т., Демерат Э.В., Гуан В. и др. (август 2018 г.). «Эпигеномное ассоциативное исследование особенностей, связанных с ожирением» . Американский журнал эпидемиологии . 187 (8): 1662–1669. дои : 10.1093/aje/kwy025 . ПМК 6070087 . ПМИД 29762635 .
- ^ Хуанг Р.К., Мелтон П.Е., Бертон М.А., Бейлин Л.Дж., Кларк-Харрис Р., Кук Э. и др. (февраль 2021 г.). «Признаки метилирования ДНК, связанные с ожирением, у подростков связаны с лептином и перинатальными факторами» . Эпигенетика . 17 (8): 819–836. дои : 10.1080/15592294.2021.1876297 . ПМЦ 9423832 . ПМИД 33550919 . S2CID 231874789 .
- ^ Педросо Х.А., Рамос-Лобо А.М., Донато Дж. (июнь 2019 г.). «SOCS3 как будущая цель лечения метаболических нарушений». Гормоны . 18 (2): 127–136. дои : 10.1007/s42000-018-0078-5 . ПМИД 30414080 . S2CID 53247404 .
- ^ Грациоли Э., Димауро И., Меркателли Н., Ван Дж., Питсиладис Ю., Ди Луиджи Л., Капоросси Д. (ноябрь 2017 г.). «Физическая активность в профилактике заболеваний человека: роль эпигенетических модификаций» . БМК Геномика . 18 (Приложение 8): 802. doi : 10.1186/s12864-017-4193-5 . ПМЦ 5688489 . ПМИД 29143608 .
- ^ Jump up to: а б Фариоли-Веккьоли С., Тироне Ф. (октябрь 2015 г.). ван Прааг Х., Кристи Б. (ред.). «Контроль клеточного цикла во взрослом нейрогенезе и его связь с физическими упражнениями» . Пластичность мозга . 1 (1): 41–54. дои : 10.3233/BPL-150013 . ПМЦ 5928538 . ПМИД 29765834 .
- ^ Jump up to: а б с д и ж г Ми-Инта О, Чжао З.В., Куо Ю.М. (июль 2019 г.). «Физические упражнения подавляют воспаление и активацию микроглии» . Клетки . 8 (7): 691. doi : 10.3390/cells8070691 . ПМК 6678635 . ПМИД 31324021 .
- ^ Jump up to: а б Шеллер Дж., Чаларис А., Шмидт-Аррас Д., Роуз-Джон С. (май 2011 г.). «Про- и противовоспалительные свойства цитокина интерлейкина-6» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . Включая специальную секцию: 11-й Европейский симпозиум по кальцию. 1813 (5): 878–888. дои : 10.1016/j.bbamcr.2011.01.034 . ПМИД 21296109 .
- ^ Jump up to: а б с д и ж г час я дж к Кавальканте БР, Импрота-Кариа АС, Мело В.Х., Де Соуза РА (август 2021 г.). «Влияние физических упражнений на эпилепсию» . Эпилепсия и поведение . 121 (Часть А): 108079. doi : 10.1016/j.yebeh.2021.108079 . ПМИД 34058490 . S2CID 235226035 .
- ^ Охира К., Хаяши М. (декабрь 2009 г.). «Новый аспект сигнального пути TrkB в нейронной пластичности» . Современная нейрофармакология . 7 (4): 276–285. дои : 10.2174/157015909790031210 . ПМЦ 2811861 . ПМИД 20514207 .
- ^ Jump up to: а б с д и ж г час Лопес-Ортис С., Пинто-Фрага Дж., Валенсуэла П.Л., Мартин-Эрнандес Дж., Шестифингерс М.М., Гарсия-Лопес О. и др. (март 2021 г.). «Физические упражнения и болезнь Альцгеймера: влияние на патофизиологические молекулярные пути заболевания» . Международный журнал молекулярных наук . 22 (6):2897.doi : 10.3390 /ijms22062897 . ПМЦ 7999827 . ПМИД 33809300 .
- ^ Jump up to: а б с д и ж г Спилман Л.Дж., Литтл Дж.П., Клегерис А. (июль 2016 г.). «Физическая активность и упражнения ослабляют нейровоспаление при неврологических заболеваниях». Бюллетень исследований мозга . 125 : 19–29. дои : 10.1016/j.brainresbull.2016.03.012 . ПМИД 27021169 . S2CID 3938257 .
- ^ Хоуз О.Д., Капур С. (май 2009 г.). «Дофаминовая гипотеза шизофрении: версия III — последний общий путь» . Бюллетень шизофрении . 35 (3): 549–562. дои : 10.1093/schbul/sbp006 . ПМЦ 2669582 . ПМИД 19325164 .
- ^ Jump up to: а б Могаддам Б., Джавитт Д. (январь 2012 г.). «От революции к эволюции: глутаматная гипотеза шизофрении и ее значение для лечения» . Нейропсихофармакология . 37 (1): 4–15. дои : 10.1038/нпп.2011.181 . ПМК 3238069 . ПМИД 21956446 .
- ^ Jump up to: а б с д и ж Россини Гайшак Л., Вогринц Ж., Челич Ружич М., Бошняк Кухарич Д., Бошкович М., Коричанчич Макар А. и др. (февраль 2021 г.). «Реакция кортизола в слюне на психосоциальный стресс у пациентов с первым эпизодом психоза» . Хорватский медицинский журнал . 62 (1): 80–89. дои : 10.3325/cmj.2021.62.80 . ПМЦ 7976886 . ПМИД 33660964 .
- ^ Jump up to: а б с д Корацца Д.И., Себастьян Э, Педросо Р.В., Андреатто К.А., де Мело Коэльо Ф.Г., Гобби С. и др. (апрель 2014 г.). «Влияние хронических физических упражнений на уровень кортизола в сыворотке крови у пожилых людей» . Европейский обзор старения и физической активности . 11 (1): 25–34. дои : 10.1007/s11556-013-0126-8 . ISSN 1861-6909 . S2CID 8850941 .