Гистоновая деацетилаза
| Гистоновая деацетилаза | |||
|---|---|---|---|
 Каталитический домен гистондеацетилазы 4 человека со связанным ингибитором. Рендеринг PDB на основе 2vqj . [ 1 ] | |||
| Идентификаторы | |||
| Номер ЕС. | 3.5.1.98 | ||
| Номер CAS. | 9076-57-7 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Суперсемейство гистонов деацетилаз | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Hist_deacetyl | ||
| Пфам | PF00850 | ||
| ИнтерПро | IPR000286 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1с3с / СКОПе / СУПФАМ | ||
| |||
Гистоновые деацетилазы ( EC 3.5.1.98 , HDAC ) представляют собой класс ферментов , которые удаляют ацетильные группы (O=C-CH 3 ε-N-ацетиллизина как ) из аминокислоты на гистоновых , так и на негистоновых белках . [ 2 ] HDAC позволяют гистонам плотнее обволакивать ДНК. [ 3 ] Это важно, поскольку ДНК обернута вокруг гистонов, а экспрессия ДНК регулируется посредством ацетилирования и деацетилирования. Действие HDAC противоположно действию гистон-ацетилтрансферазы . Белки HDAC теперь также называют лизиндеацетилазами (KDAC), чтобы описать их функцию, а не их мишень, которая также включает негистоновые белки . [ 4 ] В целом они подавляют экспрессию генов. [ 5 ]
Суперсемейство HDAC
[ редактировать ]Вместе с ацетилполиаминамидогидролазами и белками, утилизирующими ацетоин , деацетилазы гистонов образуют древнее суперсемейство белков, известное как суперсемейство деацетилаз гистонов. [ 6 ]
Классы HDAC у высших эукариот
[ редактировать ]HDAC подразделяются на четыре класса в зависимости от гомологии последовательностей исходных ферментов дрожжей и организации домена: [ 7 ]
| Сорт | Члены | Каталитические сайты | Субклеточная локализация | Распределение тканей | Субстраты | Обязательные партнеры | Нокаутный фенотип |
|---|---|---|---|---|---|---|---|
| я | HDAC1 | 1 | Ядро | Вездесущий | Андрогенный рецептор , SHP , p53 , MyoD , E2F1 , STAT3 | – | Эмбриональная летальность, повышенное ацетилирование гистонов, увеличение p21 и p27. |
| HDAC2 | 1 | Ядро | Вездесущий | Глюкокортикоидный рецептор , YY1 , BCL6 , STAT3 | – | Порок сердца | |
| HDAC3 | 1 | Ядро | Вездесущий | ШП , ГГ1 , ГАТА1 , РЕЛА , СТАТ3 , МЕФ2Д | НКОР1 [ 8 ] | – | |
| HDAC8 | 1 | Ядро/цитоплазма | Вездесущий? | – | EST1B | – | |
| ИМА | HDAC4 | 1 | Ядро/цитоплазма | сердце, скелетные мышцы, мозг | ГХМА , ГАТА1 , HP1 | RFXANK | Дефекты хондроцитов дифференцировки |
| HDAC5 | 1 | Ядро/цитоплазма | сердце, скелетные мышцы, мозг | ГХМА , СМАД7 , HP1 | REA , рецептор эстрогена | Порок сердца | |
| HDAC7 | 1 | Ядро/цитоплазма/митохондрии | сердце, скелетные мышцы, поджелудочная железа, плацента | PLAG1 , PLAG2 | HIF1A , BCL6 , рецептор эндотелина , ACTN1 , ACTN4 , рецептор андрогена , Tip60 | Поддержание целостности сосудов, увеличение MMP10 | |
| HDAC9 | 1 | Ядро/цитоплазма | мозг, скелетные мышцы | – | ФОКС3 | Порок сердца | |
| МИБ | HDAC6 | 2 | Преимущественно цитоплазма | сердце, печень, почки, плацента | α-Тубулин , HSP90 , SHP , SMAD7 | РУНКС2 | – |
| HDAC10 | 1 | Преимущественно цитоплазма | печень, селезенка, почки | – | – | – | |
| III | сиртуины млекопитающих ( SIRT1 , SIRT2 , SIRT3 , SIRT4 , SIRT5 , SIRT6 , SIRT7 ) | – | – | – | – | – | – |
| Sir2 в дрожжах S. cerevisiae | – | – | – | – | – | – | |
| IV | HDAC11 | 2 | Ядро/цитоплазма | мозг, сердце, скелетные мышцы, почки | – | – | – |
HDAC (кроме класса III) содержат цинк и известны как Zn. 2+ -зависимые гистондеацетилазы. [ 9 ] Они имеют классическую аргиназную складку и структурно и механически отличаются от сиртуинов (класс III), которые складываются в архитектуру Россмана и представляют собой НАД. + зависимый. [ 10 ]
Подтипы
[ редактировать ]Белки HDAC сгруппированы в четыре класса (см. Выше) на основе сходства функций и последовательностей ДНК. Классы I, II и IV считаются «классическими» HDAC, активность которых ингибируется трихостатином А (TSA) и имеют цинк-зависимый активный центр, тогда как ферменты класса III представляют собой семейство НАД. + -зависимые белки, известные как сиртуины , на которые не влияет TSA. [ 11 ] Гомологи этих трех групп обнаружены у дрожжей, имеющих названия: пониженная зависимость от калия 3 (Rpd3), что соответствует классу I; гистондеацетилаза 1 (hda1), соответствующая классу II; и регулятор молчаливой информации 2 ( Sir2 ), соответствующий классу III. Класс IV содержит только одну изоформу (HDAC11), которая не очень гомологична дрожжевым ферментам Rpd3 или hda1. [ 12 ] и поэтому HDAC11 отнесен к собственному классу. Ферменты класса III считаются отдельным типом ферментов и имеют другой механизм действия; эти ферменты НАД + -зависимый, тогда как HDAC других классов требуют Zn 2+ в качестве кофактора. [ 13 ]
Эволюция
[ редактировать ]HDACs консервативны в ходе эволюции, обнаруживая ортологи у всех эукариот и даже у архей . Все высшие эукариоты, включая позвоночных, растения и членистоногих, обладают по крайней мере одним HDAC в каждом классе, в то время как большинство позвоночных несут 11 канонических HDAC, за исключением костных рыб, у которых отсутствует HDAC2, но, по-видимому, имеется дополнительная копия HDAC11, получившая название HDAC12. . Растения несут дополнительные HDAC по сравнению с животными, предположительно для осуществления более сложной регуляции транскрипции, необходимой этим сидячим организмам. HDAC, по-видимому, происходят из предкового ацетилсвязывающего домена, поскольку гомологи HDAC были обнаружены у бактерий в форме белков, утилизирующих ацетоин (AcuC). [ 3 ]

Субклеточное распределение
[ редактировать ]В HDAC класса I HDAC1, 2 и 3 обнаруживаются преимущественно в ядре, тогда как HDAC8 обнаруживается как в ядре, так и в цитоплазме, а также связан с мембраной. HDAC класса II (HDAC4, 5, 6, 7, 9 и 10) способны перемещаться в ядро и из него в зависимости от различных сигналов. [ 14 ] [ 15 ]
HDAC6 представляет собой цитоплазматический фермент, связанный с микротрубочками. HDAC6 деацетилирует тубулин , Hsp90 и кортактин , образует комплексы с другими белками-партнерами и, следовательно, участвует во множестве биологических процессов. [ 16 ]
Функция
[ редактировать ]Модификация гистонов
[ редактировать ]Гистоновые хвосты обычно заряжены положительно благодаря аминогруппам , присутствующим в их лизине и аргинине аминокислотах . Эти положительные заряды помогают хвостам гистонов взаимодействовать и связываться с отрицательно заряженными фосфатными группами на остове ДНК. Ацетилирование , которое обычно происходит в клетке, нейтрализует положительные заряды гистонов путем превращения аминов в амиды и снижает способность гистонов связываться с ДНК. Это снижение связывания позволяет расширять хроматин , обеспечивая генетической транскрипции возможность . Деацетилазы гистонов удаляют эти ацетильные группы, увеличивая положительный заряд хвостов гистонов и способствуя высокоаффинному связыванию между гистонами и основной цепью ДНК. Повышенное связывание ДНК уплотняет структуру ДНК, предотвращая транскрипцию.
Гистоновая деацетилаза участвует в ряде путей внутри живой системы. Согласно Киотской энциклопедии генов и геномов ( KEGG ), это:
- Обработка экологической информации; передача сигнала ; сигнальный путь notch PATH:ko04330
- Клеточные процессы; рост и смерть клеток; клеточный цикл PATH:ko04110
- Болезни человека; раковые заболевания; хронический миелолейкоз PATH:ko05220
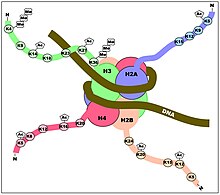

Ацетилирование гистонов играет важную роль в регуляции экспрессии генов. Гиперацетилированный хроматин транскрипционно активен, а гипоацетилированный хроматин «молчит». Исследование на мышах показало, что определенная подгруппа мышиных генов (7%) нарушалась в отсутствие HDAC1. [ 17 ] Их исследование также выявило регуляторные перекрестные помехи между HDAC1 и HDAC2 и предполагает новую функцию HDAC1 в качестве коактиватора транскрипции. Было обнаружено, что экспрессия HDAC1 повышена в префронтальной коре больных шизофренией. [ 18 ] отрицательно коррелирует с экспрессией мРНК GAD67 .
Негистоновые эффекты
[ редактировать ]Ошибочно рассматривать HDACs исключительно в контексте регуляции транскрипции генов путем модификации гистонов и структуры хроматина, хотя это, по-видимому, является преобладающей функцией. Функцию, активность и стабильность белков можно контролировать с помощью посттрансляционных модификаций . белков Фосфорилирование , пожалуй, наиболее широко изученная и понятная модификация, при которой определенные аминокислотные остатки фосфорилируются под действием протеинкиназ или дефосфорилируются под действием фосфатаз . Ацетилирование остатков лизина представляет собой аналогичный механизм , при котором негистоновые белки подвергаются воздействию ацетилаз и деацетилаз. [ 19 ] Именно в этом контексте обнаружено, что HDACs взаимодействуют с множеством негистоновых белков — некоторые из них являются факторами транскрипции и корегуляторами , некоторые — нет. Обратите внимание на следующие четыре примера:
- HDAC6 связан с агресомами . Неправильно свернутые белковые агрегаты помечаются путем убиквитинирования и удаляются из цитоплазмы динеиновыми моторами через сеть микротрубочек в органеллу, называемую агресомой. HDAC 6 связывает полиубиквитинированные неправильно свернутые белки и связывается с динеиновыми моторами, тем самым позволяя физически транспортировать неправильно свернутый белковый груз к шаперонам и протеасомам для последующего разрушения. [ 20 ] HDAC6 является важным регулятором функции HSP90 и его ингибитором, предложенным для лечения метаболических нарушений. [ 21 ]
- PTEN является важной фосфатазой, участвующей в передаче сигналов в клетках через фосфоинозитолы и путь AKT / киназный PI3 . PTEN подвергается сложному регуляторному контролю посредством фосфорилирования, убиквитинирования, окисления и ацетилирования. Ацетилирование PTEN фактором, ассоциированным с гистон-ацетилтрансферазой p300/CBP ( PCAF ), может подавлять его активность; наоборот, деацетилирование PTEN деацетилазой SIRT1 и HDAC1 может стимулировать его активность. [ 22 ] [ 23 ]
- APE1/Ref-1 ( APEX1 ) представляет собой многофункциональный белок, обладающий как активностью репарации ДНК (на сайтах абазовых и одноцепочечных разрывов), так и транскрипционной регуляторной активностью, связанной с окислительным стрессом . APE1/Ref-1 ацетилируется PCAF; наоборот, он стабильно связывается с HDAC класса I и деацетилируется ими. Состояние ацетилирования APE1/Ref-1, по-видимому, не влияет на его активность по репарации ДНК , но регулирует его транскрипционную активность, такую как его способность связываться с промотором ПТГ и инициировать транскрипцию гена паратиреоидного гормона . [ 24 ] [ 25 ]
- NF-κB является ключевым фактором транскрипции и эффекторной молекулой, участвующей в ответах на клеточный стресс, и состоит из гетеродимера p50/p65. Субъединица p65 контролируется ацетилированием через PCAF и деацетилированием через HDAC3 и HDAC6. [ 26 ]
Это лишь некоторые примеры постоянно появляющихся негистоновых и нехроматиновых ролей HDACs.
Ингибиторы HDAC
[ редактировать ]Ингибиторы гистондеацетилазы (ИГД) уже давно используются в психиатрии и неврологии в качестве стабилизаторов настроения и противоэпилептических средств, например вальпроевая кислота . В последнее время ИЧР изучаются в качестве средства смягчения или лечения нейродегенеративных заболеваний . [ 27 ] [ 28 ] [ 29 ] Также в последние годы предпринимались попытки разработать ИЧР для лечения рака. [ 30 ] [ 31 ] Вориностат (SAHA) был одобрен FDA в 2006 году для лечения кожных проявлений у пациентов с кожной Т-клеточной лимфомой (CTCL), у которых предыдущее лечение оказалось неэффективным. Второй ИГД, Истодакс ( ромидепсин ), был одобрен в 2009 году для пациентов с CTCL. Точные механизмы действия этих соединений неясны, но эпигенетические пути. предполагаются [ 32 ] Кроме того, в ходе клинических испытаний изучается влияние вальпроевой кислоты на латентные пулы ВИЧ у инфицированных людей. [ 33 ] ИГД в настоящее время исследуются в качестве химиосенсибилизаторов для цитотоксической химиотерапии или лучевой терапии или в сочетании с ингибиторами метилирования ДНК на основе синергизма in vitro. [ 34 ] Были разработаны селективные по изоформам HDI, которые могут помочь в выяснении роли отдельных изоформ HDAC. [ 35 ] [ 36 ] [ 37 ] [ 29 ]
Ингибиторы HDAC оказывают воздействие на негистоновые белки, связанные с ацетилированием. HDI могут изменять степень ацетилирования этих молекул и, следовательно, увеличивать или подавлять их активность. В четырех примерах, приведенных выше (см. « Функция ») действия HDAC на негистоновые белки, в каждом из этих случаев ингибитор HDAC трихостатин А (TSA) блокирует эффект. Было показано, что HDI изменяют активность многих факторов транскрипции, включая ACTR , cMyb , E2F1, EKLF , FEN1 , GATA, HNF-4 , HSP90, Ku70 , NFκB, PCNA , p53, RB , Runx, SF1 Sp3, STAT, TFIIE , TCF и YY1. [ 38 ] [ 39 ]
экспрессию гена FOXO3a На мышах было показано, что кетоновые тела β-гидроксибутират увеличивают за счет ингибирования деацетилазы гистонов. [ 40 ]
Ингибиторы гистондеацетилазы могут модулировать латентный период некоторых вирусов, что приводит к реактивации. [ 41 ] Было показано, что это происходит, например, при латентной инфекции вируса герпеса-6 человека .
Ингибиторы гистондеацетилазы продемонстрировали активность против определенных видов и стадий Plasmodium , что может указывать на их потенциал в лечении малярии. Было показано, что HDI накапливают ацетилированный гистон H3K9/H3K14, нижестоящую мишень HDAC класса I. [ 42 ]
См. также
[ редактировать ]- Гистонацетилтрансфераза (HAT)
- Ингибитор гистондеацетилазы
- Гистон-метилтрансфераза (HMT)
- Ферменты, модифицирующие гистоны
- Контроль РНК-полимеразы структурой хроматина
Ссылки
[ редактировать ]- ^ Боттомли М.Дж., Ло Сурдо П., Ди Джовин П., Чирилло А., Скарпелли Р., Ферриньо Ф. и др. (сентябрь 2008 г.). «Структурный и функциональный анализ каталитического домена HDAC4 человека выявил регуляторный структурный цинксвязывающий домен» . Журнал биологической химии . 283 (39): 26694–26704. дои : 10.1074/jbc.M803514200 . ПМЦ 3258910 . ПМИД 18614528 .
- ^ Сето, Эдвард; Ёсида, Минору (01 апреля 2014 г.). «Ластики ацетилирования гистонов: ферменты деацетилазы гистонов» . Перспективы Колд-Спринг-Харбор в биологии . 6 (4): а018713. doi : 10.1101/cshperspect.a018713 . ISSN 1943-0264 . ПМК 3970420 . ПМИД 24691964 .
- ^ Jump up to: а б с Милаццо Дж., Меркателли Д., Ди Муцио Дж., Триболи Л., Де Роза П., Перини Дж., Джорджи Ф.М. (май 2020 г.). «Гистоновые деацетилазы (HDAC): эволюция, специфичность, роль в транскрипционных комплексах и фармакологическая эффективность» . Гены . 11 (5): 556–604. дои : 10.3390/genes11050556 . ПМЦ 7288346 . ПМИД 32429325 .
- ^ Чоудхари С., Кумар С., Гнад Ф., Нильсен М.Л., Рехман М., Вальтер Т.С. и др. (август 2009 г.). «Ацетилирование лизина нацелено на белковые комплексы и совместно регулирует основные клеточные функции» . Наука . 325 (5942): 834–840. Бибкод : 2009Sci...325..834C . дои : 10.1126/science.1175371 . ПМИД 19608861 . S2CID 206520776 .
- ^ Чен, Хун Пин; Чжао, Ю Тина; Чжао, Тин С (2015). «Гистондеацетилазы и механизмы регуляции экспрессии генов (гистондеацетилазы при раке)» . Крит Рев Онког . 20 (1–2): 35–47. дои : 10.1615/critrevoncog.2015012997 . ПМЦ 4809735 . ПМИД 25746103 .
- ^ Лейпе Д.Д., Ландсман Д. (сентябрь 1997 г.). «Деацетилазы гистонов, белки, утилизирующие ацетоин, и ацетилполиаминоамидогидролазы являются членами древнего суперсемейства белков» . Исследования нуклеиновых кислот . 25 (18): 3693–3697. дои : 10.1093/нар/25.18.3693 . ПМК 146955 . ПМИД 9278492 .
- ^ Докманович М., Кларк С., Маркс П.А. (октябрь 2007 г.). «Ингибиторы гистондеацетилазы: обзор и перспективы». Молекулярные исследования рака . 5 (10): 981–989. дои : 10.1158/1541-7786.MCR-07-0324 . ПМИД 17951399 .
- ^ Ю Ш., Лим Х.В., Сан З., Броуч М., Вон К.Дж., Лазар М.А. (февраль 2013 г.). «Корепрессоры ядерных рецепторов необходимы для гистон-деацетилазной активности HDAC3 in vivo» . Структурная и молекулярная биология природы . 20 (2): 182–187. дои : 10.1038/nsmb.2476 . ПМК 3565028 . ПМИД 23292142 .
- ^ Маркс П.А., Сюй В.С. (июль 2009 г.). «Ингибиторы гистондеацетилазы: потенциал в терапии рака» . Журнал клеточной биохимии . 107 (4): 600–608. дои : 10.1002/jcb.22185 . ПМЦ 2766855 . ПМИД 19459166 .
- ^ Бюргер М., Чори Дж. (2018). «Структурная и химическая биология деацетилаз углеводов, белков, малых молекул и гистонов» . Коммуникационная биология . 1 : 217. дои : 10.1038/s42003-018-0214-4 . ПМК 6281622 . ПМИД 30534609 .
- ^ Имаи С., Армстронг К.М., Каберлейн М., Гуаренте Л. (февраль 2000 г.). «Белок молчания транскрипции и долголетия Sir2 представляет собой НАД-зависимую гистондеацетилазу». Природа . 403 (6771): 795–800. Бибкод : 2000Natur.403..795I . дои : 10.1038/35001622 . ПМИД 10693811 . S2CID 2967911 .
- ^ Ян XJ, Сето Э (март 2008 г.). «Семейство лизиндеацетилаз Rpd3/Hda1: от бактерий и дрожжей до мышей и людей» . Обзоры природы. Молекулярно-клеточная биология . 9 (3): 206–218. дои : 10.1038/nrm2346 . ПМЦ 2667380 . ПМИД 18292778 .
- ^ Барнеда-Захонеро Б., Парра М. (декабрь 2012 г.). «Гистоновые деацетилазы и рак» . Молекулярная онкология . 6 (6): 579–589. дои : 10.1016/j.molonc.2012.07.003 . ПМЦ 5528343 . ПМИД 22963873 .
- ^ де Рюйтер А.Дж., ван Геннип А.Х., Кэрон Х.Н., Кемп С., ван Куиленбург А.Б. (март 2003 г.). «Гистоновые деацетилазы (HDAC): характеристика классического семейства HDAC» . Биохимический журнал . 370 (Часть 3): 737–749. дои : 10.1042/BJ20021321 . ПМЦ 1223209 . ПМИД 12429021 .
- ^ Лонгворт М.С., Лайминс Л.А. (июль 2006 г.). «Гистондеацетилаза 3 локализуется на плазматической мембране и является субстратом Src». Онкоген . 25 (32): 4495–4500. дои : 10.1038/sj.onc.1209473 . ПМИД 16532030 .
- ^ Валенсуэла-Фернандес А., Кабреро-младший, Серрадор Х.М., Санчес-Мадрид Ф (июнь 2008 г.). «HDAC6: ключевой регулятор цитоскелета, миграции клеток и межклеточных взаимодействий». Тенденции в клеточной биологии . 18 (6): 291–297. дои : 10.1016/j.tcb.2008.04.003 . ПМИД 18472263 .
- ^ Зупковиц Г., Тишлер Дж., Пош М., Садзак И., Рамзауэр К., Эггер Г. и др. (ноябрь 2006 г.). «Отрицательная и положительная регуляция экспрессии генов деацетилазой гистонов 1 мыши» . Молекулярная и клеточная биология . 26 (21): 7913–7928. дои : 10.1128/MCB.01220-06 . ПМЦ 1636735 . ПМИД 16940178 .
- ^ Шарма Р.П., Грейсон Д.Р., Гэвин Д.П. (январь 2008 г.). «Экспрессия гистондеактилазы 1 увеличивается в префронтальной коре больных шизофренией: анализ коллекции микрочипов Национального банка данных мозга» . Исследования шизофрении . 98 (1–3): 111–117. doi : 10.1016/j.schres.2007.09.020 . ПМК 2254186 . ПМИД 17961987 .
- ^ Глозак М.А., Сенгупта Н., Чжан Х, Сето Э (декабрь 2005 г.). «Ацетилирование и деацетилирование негистоновых белков». Джин . 363 : 15–23. дои : 10.1016/j.gene.2005.09.010 . ПМИД 16289629 .
- ^ Родригес-Гонсалес А., Лин Т., Икеда А.К., Симмс-Уолдрип Т., Фу С., Сакамото К.М. (апрель 2008 г.). «Роль агресомного пути при раке: воздействие на деградацию белка, зависимую от гистондеацетилазы 6» . Исследования рака . 68 (8): 2557–2560. дои : 10.1158/0008-5472.CAN-07-5989 . ПМИД 18413721 .
- ^ Махла РС (июль 2012 г.). «Комментарий к: Винклер и др. Деацетилаза гистонов 6 (HDAC6) является важным модификатором глюкокортикоид-индуцированного печеночного глюконеогенеза. Диабет 2012;61:513-523» . Диабет . 61 (7): e10, ответ автора e11. дои : 10.2337/db12-0323 . ПМЦ 3379673 . ПМИД 22723278 .
- ^ Икеноуэ Т., Иноки К., Чжао Б., Гуань К.Л. (сентябрь 2008 г.). «Ацетилирование PTEN модулирует его взаимодействие с доменом PDZ» . Исследования рака . 68 (17): 6908–6912. дои : 10.1158/0008-5472.CAN-08-1107 . ПМИД 18757404 .
- ^ Яо XH, Ньомба Б.Л. (июнь 2008 г.). «Инсулинорезистентность печени, вызванная пренатальным воздействием алкоголя, связана со снижением ацетилирования PTEN и TRB3 у потомства взрослых крыс». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология . 294 (6): R1797–R1806. дои : 10.1152/ajpregu.00804.2007 . ПМИД 18385463 .
- ^ Бхакат К.К., Изуми Т., Ян Ш., Хазра Т.К., Митра С. (декабрь 2003 г.). «Роль ацетилированной AP-эндонуклеазы человека (APE1/Ref-1) в регуляции гена паратиреоидного гормона» . Журнал ЭМБО . 22 (23): 6299–6309. дои : 10.1093/emboj/cdg595 . ПМК 291836 . ПМИД 14633989 .
- ^ Фантини Д., Васкотто С., Дегануто М., Биви Н., Густинчич С., Маркон Г. и др. (январь 2008 г.). «APE1/Ref-1 регулирует экспрессию PTEN, опосредованную Egr-1» . Свободные радикальные исследования . 42 (1): 20–29. дои : 10.1080/10715760701765616 . ПМК 2677450 . ПМИД 18324520 .
- ^ Хассельгрен П.О. (декабрь 2007 г.). «Убиквитинирование, фосфорилирование и ацетилирование — тройная угроза атрофии мышц» . Журнал клеточной физиологии . 213 (3): 679–689. дои : 10.1002/jcp.21190 . ПМИД 17657723 .
- ^ Ханен Э., Хауке Дж., Транкле С., Эйюпоглу И.Ю., Вирт Б., Блюмке И. (февраль 2008 г.). «Ингибиторы гистондеацетилазы: возможные последствия нейродегенеративных заболеваний». Экспертное мнение об исследуемых препаратах . 17 (2): 169–184. дои : 10.1517/13543784.17.2.169 . ПМИД 18230051 . S2CID 14344174 .
- ^ «Ученые «обратили» потерю памяти» . Новости Би-би-си . 29 апреля 2007 г. Проверено 8 июля 2007 г.
- ^ Jump up to: а б Герс С., Кларисса Д., Бэле Ф., Франсеус Дж., Десмет Т., Де Босшер К., Д'Хуг М. (май 2022 г.). «Идентификация ингибиторов HDAC6 на основе меркаптоацетамида с помощью стратегии экономичного ингибитора: скрининг, синтез и биологическая оценка» . Химические коммуникации . 58 (42): 6239–6242. дои : 10.1039/D2CC01550A . hdl : 1854/LU-8752799 . ПМИД 35510683 . S2CID 248527466 .
- ^ Мваквари С.К., Патил В., Геррант В., Ойелере А.К. (2010). «Макроциклические ингибиторы гистондеацетилазы» . Актуальные темы медицинской химии . 10 (14): 1423–1440. дои : 10.2174/156802610792232079 . ПМК 3144151 . ПМИД 20536416 .
- ^ Миллер Т.А., Виттер DJ, Belvedere S (ноябрь 2003 г.). «Ингибиторы гистондеацетилазы». Журнал медицинской химии . 46 (24): 5097–5116. дои : 10.1021/jm0303094 . ПМИД 14613312 .
- ^ Моннере С (апрель 2007 г.). «Ингибиторы гистондеацетилазы для эпигенетической терапии рака». Противораковые препараты . 18 (4): 363–370. дои : 10.1097/CAD.0b013e328012a5db . ПМИД 17351388 . S2CID 39017666 .
- ^ Истощение латентного ВИЧ в клетках CD4 - полнотекстовый просмотр - ClinicalTrials.gov
- ^ Бэтти Н., Малуф Г.Г., Исса Дж.П. (август 2009 г.). «Ингибиторы гистондеацетилазы как противоопухолевые средства». Письма о раке . 280 (2): 192–200. дои : 10.1016/j.canlet.2009.03.013 . ПМИД 19345475 .
- ^ Патил В., Соджи К.Х., Корнаки-младший, Мркшич М., Ойелере А.К. (май 2013 г.). «3-Гидроксипиридин-2-тион как новая цинксвязывающая группа для селективного ингибирования деацетилазы гистонов» . Журнал медицинской химии . 56 (9): 3492–3506. дои : 10.1021/jm301769u . ПМЦ 3657749 . ПМИД 23547652 .
- ^ Мваквари С.К., Геррант В., Патил В., Хан С.И., Теквани Б.Л., Гурард-Левин З.А. и др. (август 2010 г.). «Непептидные макроциклические ингибиторы деацетилазы гистонов, полученные из скелета трициклических кетолидов» . Журнал медицинской химии . 53 (16): 6100–6111. дои : 10.1021/jm100507q . ПМЦ 2924451 . ПМИД 20669972 .
- ^ Батлер К.В., Калин Дж., Брошер С., Вистоли Г., Лэнгли Б., Козиковски А.П. (август 2010 г.). «Рациональный дизайн и простая химия позволили получить превосходный нейропротекторный ингибитор HDAC6 — тубастатин А» . Журнал Американского химического общества . 132 (31): 10842–10846. дои : 10.1021/ja102758v . ПМК 2916045 . ПМИД 20614936 .
- ^ Драммонд, округ Колумбия, Нобл, Ко, Кирпотин Д.Б., Го З, Скотт Г.К., Бенц CC (2005). «Клиническая разработка ингибиторов гистондеацетилазы в качестве противораковых средств». Ежегодный обзор фармакологии и токсикологии . 45 : 495–528. doi : 10.1146/annurev.pharmtox.45.120403.095825 . ПМИД 15822187 .
- ^ Ян XJ, Сето Э (август 2007 г.). «HAT и HDAC: от структуры, функции и регуляции к новым стратегиям терапии и профилактики» . Онкоген . 26 (37): 5310–5318. дои : 10.1038/sj.onc.1210599 . ПМИД 17694074 .
- ^ Симадзу Т., Хирши М.Д., Ньюман Дж., Хе В., Сиракава К., Ле Моан Н. и др. (январь 2013 г.). «Подавление окислительного стресса β-гидроксибутиратом, эндогенным ингибитором деацетилазы гистонов» . Наука . 339 (6116): 211–214. Бибкод : 2013Sci...339..211S . дои : 10.1126/science.1227166 . ПМЦ 3735349 . ПМИД 23223453 .
- ^ Арбакл Дж. Х., Медвечки П. Г. (август 2011 г.). «Молекулярная биология латентного периода вируса герпеса-6 человека и интеграции теломер» . Микробы и инфекции . 13 (8–9): 731–741. дои : 10.1016/j.micinf.2011.03.006 . ПМК 3130849 . ПМИД 21458587 .
- ^ Беус М., Раич З., Майсингер Д., Млинарич З., Антунович М., Марианович И. и др. (август 2018 г.). «SAHAquines, новые гибриды на основе мотивов SAHA и примахина, как потенциальные цитостатические и антиплазмодические агенты» . ХимияОткрыть . 7 (8): 624–638. дои : 10.1002/open.201800117 . ПМК 6104433 . ПМИД 30151334 .
Внешние ссылки
[ редактировать ]- Гистон + деацетилаза Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Анимация в Merck